このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
師部ふるい要素に電気信号を取得し、測定するための電気浸透グラフ(EPG)の新しいアプリケーション
要約
Electrical Penetration Graph (EPG) is a well-established technique for studying the feeding behavior of stylet-bearing insects. Here we show a new application of EPG as a non-invasive tool for the acquisition of intracellular electrophysiology recordings of sieve elements (SEs), the cells that form the phloem vasculature in plants.
要約
細胞の電気生理学的特性は、多くの場合、それらの天然の環境からそれらを解離した後、in vitroで検討されています。しかし、生体内の離れた細胞間の電気伝送の研究は、 生体内でそれらの天然の環境内に埋め込 まれた細胞のアーチファクトのない録音が必要です。工場で無傷の領域に負傷からの電気信号の伝送が長いので、植物学者の興味をそそりました。師部、植物全体に広がっている植物の血管系の住んでいる部分は、植物内の電気伝送における主要な組織として仮定されています。適切な電気生理学的方法の欠如は、in vivoでの師部細胞の電気的特性の研究のための多くの課題を提起します。ここでは、電気浸透GRAで統合された、生きているアブラムシを使用してふるい要素(SES)の細胞内電気生理学、または他の師部送り半翅目昆虫のための新しいアプローチを提示pH値(EPG)回路。この方法の汎用性、堅牢性、および精度により、記録し、モデル植物のシロイヌナズナ 1の中心静脈からのSEに詳細に傷誘導性の電気信号を調べるために行きました。ここでは、EPG電極を容易に限界静脈内のSEの細胞内電気生理学的記録のために実施することができるだけでなく、いくつかの外部刺激に電気信号に応答するのSEの能力を研究することを示しています。 EPGのアプローチは、細胞内のSEの電気生理学に適用植物/昆虫組み合わせの多数であり、多くの研究目的のために、植物種の多種多様に実施することができます。
概要
長距離電気信号を生成する能力は、外部刺激に対する効率的な応答を可能にする多細胞生物の有利な特性です。この特性は、植物および動物において独立して進化し、したがって、収束進化の場合を示しています。電気信号は、例えば、神経伝達や筋肉の収縮、分子的基礎、変速機の機構、および動物における刺激によって誘発される電気信号の関数として、動物で重要な機能に結合されていることを考えると、集中的な研究の対象です。これとは対照的に、植物中の刺激によって誘発される電気信号は、ほとんどの研究が注目されています。植物には神経や筋肉を持っていないが、植物中の刺激によって誘発される電気信号は、環境因子への応答に重要な役割を果たしていることを前提とするのに十分な証拠があるように思われます。
師部、植物の血管系の生体成分は、主要なサブように仮定されています刺激によって誘発される電気信号を伝送するためのstrateは、刺激から/非刺激/非損傷領域2に損傷を受けました。師部の主な細胞は、篩エレメント(SES)、比較的単純な、細長い細胞です。のSEの端部は、植物全体に広がっている連続的な、低抵抗、篩管系を形成する、他のSEに接続されています。これらの高度に特殊化した細胞の電気的特性に非常に少数の研究は、しかし、があります。これらの以前の研究では、研究者は、ガラス微小電極3またはstylectomy(切断)4の後に、アブラムシの植物挿入スタイレットに結合させたガラス電極とのいずれかでのSEにアクセスしました。ガラス微小電極は、直径1μm未満の微細な先端に熱と一端で引っ張り、その後、KCl溶液で満たされたガラス毛細管から作製されます。のKCl充填ガラス電極に挿入されたAg / AgClの又は白金線、次にアンプの入力に接続されており、参照先電極は、回路を完成する、目的の細胞を囲む浴中に挿入されます。このセットアップでは、細胞外の参照先電極および細胞内測定電極、 すなわち、セル5の膜電位との電位差を記録します。この方法では、Umrathは藻類フラスコモ 6,7を用いて、植物細胞からの第1の細胞内記録を作った。 フラスコモは、比較的単純な大きな細胞と生物、および細胞内電気生理学実験することが適しています。対照的に、多細胞、三次元陸生植物の細胞への細胞内小ガラス電極の挿入は、技術的に要求が厳しい、高度に熟練した研究者だけでなく、高度な可視化、マイクロマニピュレーション、および防振装置を必要とします。ガラス電極は、根の表皮細胞8などの植物における表層細胞から記録するのに適しているが、細胞内recordinこのようなSEが、結果を混乱可能性が高い原因の損傷によって誘発される応答として深く植物の組織に埋め込まれた細胞からGS、。 1989年に、フロムとEschrichガラス電極をstylectomy 4後アブラムシのスタイレットに結合されている「アブラムシ法」と呼ばれる別の方法を使用することを、報告しました。ガラス電極がそうであるように柔軟なスタイレットは、組織または細胞の損傷を引き起こすことはありませんので、アブラムシの方法は、低侵襲性です。アブラムシのスタイレットは、植物の浸透のため、自然の偉大な発明であり、アブラムシがかなりのSEを見つけることで、人間よりも熟練しています。残念ながら、このアブラムシ方法は、技術的な専門知識と設備の面で非常に厳しいです。 stylectomy時、安定SEに挿入スタイレットと - また、この技術を実装し、各実験の成功は、給電モードであるアブラムシに完全に依存します。遡及的に考えて、一つは、この技術の成功の確率は私だったかもしれないことがわかります実験にstylectomyを適用する場合アブラムシスタイレットがSEであるか否かを識別することができる機器を追加することによってmproved。
1964年に、マクリーンとキンゼイはリアルタイム9,10にアブラムシの摂食行動の研究のための「電子監視システム」を記載しました。このシステムでは、アブラムシ及びスタイレット-浸透プラントは、電気回路に集積されました。その後、1978年に、Tjallingiiは、システムの修正版を考案した「電気浸透グラフ」(EPG)システム11,12と呼ばれます。オリジナルの電子監視システムは、EPGシステムと、起電力(EMF)が電位を発し、抵抗のみ由来の電位に対して感受性であった、すなわち、植物または昆虫で生成から生じる電位に加えて記録することができたのに対し昆虫の抵抗(R)。両方の信号成分、起電力及びRので、これは重要な改善を示し、アブラムシによる植物への浸透中にイベントの生物学的な関連情報を提供。何R-コンポーネントへのEPGプリアンプが敏感になることは、植物/アブラムシ抵抗の平均値の近くに位置しています1GΩ、その比較的低い入力抵抗です。小さ なオフセット電圧( 図1には 、V)は、約+100 mVのでは、1つの側に、植物と昆虫に分割されている植物、および他の入力抵抗に印加されます。電圧及びその変化は、昆虫および入力抵抗との間の点( 図1A、B)で測定されます。 EMF-成分が昆虫に起因する植物スタイレット先端の電位と電位の一定の割合であるのに対し、このため、R-コンポーネントは、オフセット電圧の植物アブラムシ抵抗変調を表します。ここで最も関連性 - - 植物の電位は、アブラムシのスタイレットを穿刺植物細胞の主に膜電位です。昆虫電位が主であると思われます2スタイレット運河内の流体の動きによって引き起こされるストリーミング電位、 すなわち、食品や唾液運河。は内部の神経や筋肉の電位は、EPGに記録されていません。実際には、電極先端としてスタイレット先端機能します。すべての植物細胞は負電池の正外側に対して内側に充電されます。電流( すなわち、水溶液中の荷電イオンの移動)内側から外側に流れ、 その逆が原因細胞膜の高抵抗に非常に限られています。通常、静止電位が一定に保たれます。しかし、マイナスイオンが出て移動したり、正イオンが細胞膜を通って移動し、膜電位が低下すると、 すなわち、それは「脱分極します」。脱分極は、セルの励起の場合に発生します。イオンは、膜中の特定のイオンチャネルが開いているか、膜が損傷した場合やイオンが内外に漏れるときにアウトに移動したり。すべての細胞は、T中のイオンチャネルおよびポンプを持っています彼は細胞内の種々のイオンの最初の濃度を復元することによってその静止レベルに膜電位を持った膜をプラズマ。静止電位とその変化が起電力成分であり、従って、EPGの技術は、それらを測定するのに適しています。
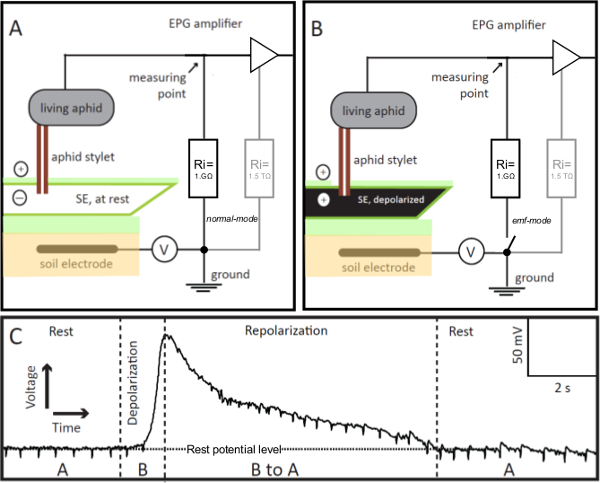
1. EPG電極図 。 EPG電極は、その安定したスタイレット給電モードで篩エレメント(SE)に挿入された電気浸透グラフ(EPG)回路に組み込ま生きアブラムシあります。スタイレット-刺しSEが残り(パネルA)である場合には、EPGによって記録された回路の電圧は、安定しており、静止電位レベル(パネルC、REST)です。 SEが励起される場合、電圧が徐々に増加する(パネルC、脱分極)のように、EPGで可視化され、その膜の脱分極(パネルB)、。 SE中のイオンバランスを休まに戻るように、 すなわち、それrepolar化し、EPGにより記録された電圧は徐々に静止電位レベル(パネルC、再分極)に減少します。パネルCは、「A」及び「B」は、それぞれパネルAおよびBに示されたシナリオを参照します。 V =可変オフセット電圧源。 riは=入力抵抗。 1GΩ外付け抵抗と並行して、アンプが(灰色で、パネルAおよびB)高1.5TΩ抵抗(オペアンプ)で内部があります。スイッチのリモコンでのEPGプリアンプは、高精度の電圧値を得ることができ、モードをEMFために、通常から変更することができます。 この図の拡大版を表示するには、こちらをクリックしてください。
次のセクションでは、両方の集束昆虫や植物に焦点を当てた研究のために有効であるEPG実験を行うための基本的なプロトコルを読者に提供します。
プロトコル
1.アブラムシ飼育
注:EPGの録音のための植物とアブラムシ種の選択は、研究目的に応じて異なります。 シロイヌナズナの研究のために、アブラムシBrevicoryneのアブラナ科が適切です。
- リアB.キャベツの温室でアブラナ科アブラムシ 。他の植物を汚染しないために、ケージにアブラムシの飼育に使用される植物を保管してください。アブラムシを用いた実験植物の汚染を避けるために、別々の部屋に(私たちのケースBのキャベツとシロイヌナズナにおける)アブラムシ飼育植物と実験プラントをしてください。
- 重要な植物の損傷を引き起こす、または人口過剰に到達する前に、2週間毎に約新鮮な植物にアブラムシを転送します。新しい植民地を開始するために、新鮮な飼育所に10-20大人のアブラムシを転送します。
- 不要なアブラムシ種、他の昆虫草食動物、アブラムシの寄生、およびフォンによる汚染のために定期的に植物を飼育監視アブラムシのコロニーの健康に影響を与える可能性がある私。
- EPG録画のための彼らの最終脱皮後の一週間に成人、無翅アブラムシアップを収集します。
- 彼らは多くの場合、誤って他の植物を汚染する可能性の記録、中に生成されたいくつかの子孫を持っているように実験の後、成長室に使用されなかった実験プラントを返します。
EPG録画用2昆虫の配線
- 昆虫の電極を作製するために、真鍮のコネクタピン(釘、Ø1.2ミリメートル)、細い銅線(Ø0.2ミリメートル)、非常に細い金線(Ø約20ミクロン)、水ベースの銀接着剤、と単純な小さなはんだ付けボルトを得ますはんだ液と樹脂入りはんだ線、倍率10倍、小さなハサミやメス、2細かい鉗子、および発泡スチロールのシートやボックスと実体顕微鏡。注:ボルテックスミキサーが便利かもしれません。注記:電極を作るためのステップバイステップのプロトコルは、 図2に示されています。
- アブラムシのための取扱い及びグルーアプリケーションは、取得:小とソフト水彩ラクダの毛のブラシ(サイズ2以下)や、昆虫のコレクションのために使用されるもののような昆虫のピンを、細かい縫い針や爪楊枝は、同様に動作することがあります。ステップ4は、EPG録画を開始する方法を示しています。
- ステップ1。
注:1と2は、以下の昆虫電極マイナスアブラムシを調製する方法を示し、手順。ステップ3は、電極にアブラムシを接続する方法を示します。アブラムシの真空固定は、配線時にお勧めしますが、常に動きの遅い種( 例えば、B。アブラナ科 )のために必要とされていません。- はんだ付けボルトに切り替えて、その先端( 図2A)で、いくつかのはんだ付け、ワイヤを溶融します。いくつかのはんだ液( 図2B)と真鍮のコネクタピンの頭を少し湿らせ、溶融はんだ金属( 図2C)にそれを浸し。
- 細い銅線1〜2cmの長尺片の一端に溶融したはんだ金属の被覆を適用します( 図2D)。その後、ホットボルト( 図2E)に対して一緒にピンと銅線を持参し、( 図2F)を冷却して凝固離れて、それらを一緒に移動します。
- ステップ2。
- 滑らかなエマルジョンが表示されるまで徹底的に数分間銀接着剤でバイアルを振る(またはボルテックス)。カット(はさみまたはメス)実体顕微鏡( 図2G)のオブジェクト板上の金ワイヤ(長さの約1.5センチ)のいくつかの作品。
- (セクション2.3で行った)はんだ付け銅線と真鍮のピンを取ると( 図2H)、それを開いた後、バイアルの蓋の内側に集まっているであろう小さな銀の接着剤溜まりに銅線の自由端を浸し。注:唯一の小さな滴が必要とされています。
- 実体顕微鏡オブジェクト板上に接着剤を塗りつけ避けるために、一方の端を持ち上げながら、金ワイヤの一部に銅線の接着剤に浸した端を移動します。 coppeに重なるようにしてください2本のワイヤの重なりに沿って接着剤を配布数mm( 図2I)、のためのrと金線。
- 接着剤が団結ワイヤを維持するのに十分乾燥されるまで待ちます。乾燥後の接着剤の接触を確認し、参加ワイヤの一部が接着剤を含まない部分を表示する場合には、小さいピンまたは銅線の他の作品にいくつかの新鮮な接着剤を追加します。
- 昆虫電極の準備ができた後、発泡スチロールの作品に挿入し、例えば、それを格納します。
注:金ワイヤの長さは、アブラムシの移動の自由を決定します:それは(5mm未満)が短すぎる場合にアブラムシが制約を感じることがあり、正常に動作しません。それは(> 2のCM)長すぎる場合、アブラムシが自由に移動します。アブラムシはに許可されている場合、葉の向軸側に移動する傾向があります。金線が葉に触れると、信号が短絡されます。
- ステップ3。
- アブラムシは、真空を用いて、光吸引によって所定の位置に保持することができます。この場合には、Tを取り付け彼は実体顕微鏡下でデバイスを吸引します。視野の中心に吸引口を配置します。
- 完全に滑らかなエマルションが形成されるまで、数分(またはボルテックス)のための銀接着剤でバイアルを振ります。小さなブラシでアブラムシを収集します。
- 腹部の背面に、吸引装置のスイッチをオンにし、吸込口( 図2J)のアブラムシをマウントするには、実験者になりました。細かいブラシで、腹部(キャベツのアブラムシに豊富)から任意の表面ワックスを削除します。
- 接着剤バイアルを開き、銀接着剤( 図2K)の非常に小さな液滴でピンを濡らします。アブラムシの腹部( 図2L-M)の背面に銀接着剤の液滴を適用します。激しく再び接着剤バイアルを振ると、最初の上に銀接着剤の第二の液滴を追加し、数分の間に、この液滴が完全に乾燥してみましょう。注:銀接着剤は、電気伝導体であるが、それは重要なことはありません昆虫のキューティクルの損傷。
- 接着剤バイアルを閉じた後、湿った液滴に金ワイヤの自由端を挿入します( 図2N)接着剤が完全に乾燥させながら、まだ線を保ちます。脚や触角上に接着剤を塗りつけ避けるため、これが起こった場合にアブラムシを破棄します。
- 吸引固定装置のスイッチをオフにし、慎重に昆虫( 図2O)を持ち上げます。必要に応じて、吸引装置からのアブラムシの持ち上げを支援するために、微細なブラシを使用しています。
注意:配線Bを彼らは、その腹部にウェットグルーのドロップを適用した後に解除されないように、十分なグリップとアブラムシを提供して粗い表面が精密実験室の組織片、上に配線することができるようにアブラナ科は 、真空を必要としません。接着剤乾燥後一つは細かいブラシの助けを借りて、組織からアブラムシを持ち上げることができます。 - 発泡スチロールに有線昆虫と真鍮のピンを挿入し、必要に応じて、継続EPGの記録セッションのために使用される他のすべての昆虫配線。
注:配線アブラムシのためのこれらのプロトコルは、私たちのためにうまく機能します。ユーザーは、アブラムシを配線するために彼/彼女の自身の方法を見つけることができます。
- ステップ4。
- 非導電性支持体上にファラデーケージ( 図2P)に植物を置く:ペトリ皿やガラスやプラスチックの板を使用しています。
- 各ポットの土壌に植物の電極を挿入します。 EPGプリアンプ( 図2Q)の入力コネクタに有線昆虫の真鍮のピンを挿入します。注:土壌電極は、他の電気生理学的手法で使用される接地電極に対応していません。これは、調整および電極分極電圧を補償するために必要とされるオフセット電圧を有します。
- 取得ソフトスタイレットの+のインターフェイス上で、100ヘルツの固定のサンプル周波数で、ファイル名を入力し、記録時間を指定し、実験(治療、プラント/ inseの詳細を指定するためのテキストを書き込みますコメント行2及び3におけるCT種など )。
- 植物の適切なランディング領域に昆虫を下げて、取得ソフトウェア(スタイレット+)インターフェイスの[スタート]ボタンをクリックすることで、記録セッションを開始します。
注1:8チャネルの最大を設定EPGで同時に使用することができます。工場ごとにEPG電極またはいくつかのEPG電極を使用することができます。
注2:研究の焦点は、アブラムシの行動である場合、第1工場の普及活動を見逃さないためにアブラムシの植物へのアクセスの前に録画を開始。 - 刺激に対するSESの電気生理学的応答を研究するため、アブラムシはアブラムシが持続師部摂取段階にあることを確実にするために、師部相に入った後、少なくとも10分待ってから、信号のベースラインが安定していること。だけにして、任意の植物の刺激実験を開始します。
tp_upload / 52826 / 52826fig2.jpg "/>
図2。電気浸透グラフ(EPG)記録のためのアブラムシや他の半翅目昆虫でEPG電極を作る。 この図の拡大版を表示するには、こちらをクリックしてください。
パネルは、AI、必要な手順は、EPG電極マイナスアブラムシを作製しました。まず、はんだ付けボルト(A)の先端にハンダ付け金属片を溶かします。そして、はんだ付け流体(B)のドロップに真鍮ピンの頭を浸し、はんだ付けボルトチップ(C)で溶融金属とそれをご連絡ください。すぐにこのステップの後、真鍮ピン(EF)の頭部にそれを接着するために、はんだ付けボルトの先端に銅ワイヤの端部に連絡してください。メスまたは刃で、金ワイヤ(G)の一部をカット。ディップ銅線の自由端銀が枯渇する前に、(I)を銀接着剤(H)の(真鍮ピンにもう一方の端で結合)、そしてすぐにそれに金ワイヤに参加します。金ワイヤは、優れた導体であり、かつ偏光することができます。実際には、ほとんどの場合、偏光を検出するには小さすぎる、そしてもしそうなら、それは、オフセット電圧(V)を用いて補償することができます。
パネルJO、電極にアブラムシ(または他の半翅目昆虫)を接続するために必要な手順。まず、慎重に微細な水彩ブラシでアブラムシを持ち上げて、真空吸引装置(J)の開口部の上に置きます。真空ポンプの電源を入れ、吸引を適用するために一枚の紙とエアーバルブの穴をカバーしています。銀接着剤(K)に虫ピンの先端を浸して、実体顕微鏡(LM)の下で、アブラムシの腹部の上に小さな接着剤滴を置きます。以内次〜20秒は、アブラムシが乾燥上の銀接着剤滴前に、銀接着剤の湿潤液滴に昆虫電極の金ワイヤの端部を挿入し、銀接着剤が有するようになるまで、1〜3分間の場所に保管してください完全に空気乾燥した(N)。この時点で、吸引装置から、吸引装置の空気弁孔を覆い、慎重にアブラムシを除去枚の紙を除去することにより、吸引を無効にします。配線後にアブラムシを持ち上げることは、多くの場合、微細なブラシ(O)によっていくつかの助けを必要とします。
パネルPは、全体EPGの概要は、ファラデーケージの内部設定を示しており、パネルQは、EPGのための植物アブラムシの組み合わせの概要を示します。このプロセスのより詳細な説明については、上記のセクション2を参照してください。
:小さな文字は1つが、EPG電極を作るために必要な項目を参照ラベルであるはんだ付けボルトと、b:はんだ付け金属を溶融させ、C:はんだ液; D:真鍮コネクタピン(爪); E:銅線、F:Øの18μmの金ワイヤ; G:吸引装置; H:アブラムシ; I:水ベースの銀接着剤; J:ファラデーケージ; kは :植物電極; L:EPGプリアンプの入力コネクタ(BNC)。
結果
以前の研究では、キャタピラ攻撃1の間にmidveinのSEの中で生成された電気信号を特徴付ける目的で、EPG電極技術を実装しました。 midveinは、これらの技術を実施するために必要な固定に適し、したがって、それはSE-緻密であるため、従来のガラス電極用、並びにガラス、スタイレットの電極のための好ましい挿入部位であり、比較的堅牢。ここでは、特に、葉の辺縁静脈のものとのSEに...
ディスカッション
この記事では、電気浸透グラフ(EPG)の記録を作成するための詳細なプロトコルを提供します。 EPG技術はよく、世界中の100〜200のアクティブユーザーと、確立され、それは、例えば、さまざまなトピックに関する多くの研究のために実装されました:アブラムシや他のスタイレット保有昆虫13 a)の宿主植物の抵抗性を、 B)植物ウイルスおよび病原体伝達機構14と 、アクシ?...
開示事項
WFT launched EPG Systems as a retirement activity, and is affiliated with it financially.
謝辞
VSRは、IIFマリー·キュリー·グラント(: シロイヌナズナで電気信号を誘導した創傷EARTHにおける創傷の略)によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Brass connector pins | EPG Systems/hardw.shop | Φ 1.2 mm | |
| Thin copper wire | EPG Systems/hardw.shop | approx. Φ 0.2 mm | |
| Thin gold wire | EPG Systems | Φ 18 µm | |
| Soldering fluid | hardware shop | matching the soldering wire | |
| Resin-cored soldering wire | hardware shop | ||
| Styrofoam | any | ||
| Water-based silver glue | EPG Systems | recipe in: www.epgsystems.eu | |
| Paper wipes | Kimberly-Clark | 5511 | |
| Soldering bolt | any | ||
| Stereomicroscope | Hund Wetzlar | minimum magnification is 10X | |
| Small scissors | Fine Science Tools | 14088-10 | |
| Scalpel | Fine Science Tools | 10050-00 | |
| Fine forceps | Fine Science Tools | 11231-20 | |
| Vortex | A. Hartenstein | L46 | |
| Watercolor brushes | any | Number 1 or 2 | |
| Air suction device | see description in: www.epgsystems.eu | ||
| Insect pins | any | No. 1 or 2 | |
| Solid table | |||
| Faraday cage | Hand made | ||
| Computer | Fujitsu Siemens | ||
| Data acquisition software | EPG Systems | Stylet+d | |
| Giga-4 (-8) Complete System | EPG Systems | ||
| includes the following: | |||
| Main control box with USB output | Di155/Di710 | 12/14 bit, rate 100 Hz (softw. fixed) | |
| EPG probes 4 (8) | 50x DC pre-amplifier | ||
| Swivel clamps on rod | |||
| DC power adaptor | bipolar, 230/115 VAC to -/+8 VDC | ||
| Plant electrodes and cables | |||
| Additional test and ground cables |
参考文献
- Salvador-Recatalà, V., Tjallingii, W. F., Farmer, E. E. Real-time, in vivo. intracellular recordings of caterpillar-induced depolarization waves in sieve elements using aphid electrodes. New Phytologist. 203 (2), 674-684 (2014).
- Van Bel, A. J., Knoblauch, M., Furch, A. C., Hafke, J. B. (Questions)n on phloem biology. 1. Electropotential waves, Ca2+ fluxes and cellular cascades along the propagation pathway. Plant Science. 181 (3), 210-218 (2011).
- Rhodes, J. D., Thain, J. F., Wildon, D. C. The pathway for electrical signal conduction in the wounded tomato plant. Planta. 200, 50-57 (1996).
- Fromm, J., Eschrich, W. Correlation of ionic movements with phloem unloading and loading in barley leaves. Plant Physiology and Biochemistry. 27, 577-585 (1989).
- Brette, R., Destexhe, A., Brette, R., Destexhe, A. Intracellular Recordings. Handbook of Neural Activity Measurement. , 44-91 (2012).
- Umrath, K. Untersuchungen über Plasma und Plasamstromung an Characeen. IV. Potentialmessungen an Nitella mucronata. mit besonderer Berücksichtingung der Erregungserscheinungen. Protoplasma. 9, 576-597 (1930).
- Umrath, K. Der Erregungsvorgang bei Nitella mucronata. Protoplasma. 17, 258-300 (1932).
- Carden, D. E., Walker, D. J., Flowers, T. J., Miller, A. J. Single-cell measurements of the contribution of cytosolic Na+ and K+ to salt tolerance. Plant Physiology. 131 (2), 676-683 (2003).
- Miles, P. W., McLean, D. L., Kinsey, M. G. Evidence that two species of aphid ingest food through an open stylet sheath. Experientia. 20 (10), 582 (1964).
- McLean, D. L., Kinsey, M. G. A technique for electronically recording aphid feeding and salivation. Nature. 202, 1358-1359 (1965).
- Tjallingii, W. F. Electronic recording of penetration behaviour by aphids. Entomologia Experimentalis et Applicata. 24, 721-730 (1978).
- Tjallingii, W. F. Membrane potentials as an indication for plant cell penetration by aphid stylets. Entomologia Experimentalis et Applicata. 38, 187-193 (1985).
- Alvarez, E. E., et al. Comparative analysis of Solanum stoloniferum. responses to probing by the green peach aphid Myzus persicae. and the potato aphid Macrosiphum euphorbiae. Insect Science. 20 (2), 207-227 (2013).
- Carmo-Sousa, M., Moreno, A., Garzo, E., Fereres, A. A non-persistently transmitted virus induces a pull-push strategy in its aphid vector to optimize transmission and spread. Virus Research. 186, 38-46 (2014).
- Jacobson, A. L., Kennedy, G. G. Electrical Penetration Graph studies to investigate the effects of cyantraniliprole on feeding behavior of Myzus persicae. (Hemiptera: Aphididae) on Capsicum annuum. Pest Management Science. 70 (5), 836-840 (2014).
- Morris, G., Foster, W. A. Duelling aphids: electrical penetration graphs reveal the value of fighting for a feeding site. Journal of Experimental Biology. 211 (9), 1490-1494 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved