Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine neue Anwendung der Electrical Penetration Graph (EPG) zur Erfassung und Messung elektrischer Signale in Phloem Siebelemente
In diesem Artikel
Zusammenfassung
Electrical Penetration Graph (EPG) is a well-established technique for studying the feeding behavior of stylet-bearing insects. Here we show a new application of EPG as a non-invasive tool for the acquisition of intracellular electrophysiology recordings of sieve elements (SEs), the cells that form the phloem vasculature in plants.
Zusammenfassung
Elektrophysiologischen Eigenschaften von Zellen werden häufig in vitro untersucht, nachdem distanziert sie aus ihrer natürlichen Umgebung. Die Untersuchung der elektrischen Übertragung zwischen entfernten Zellen in einem Organismus erfordert jedoch in vivo, artefaktfreie Aufzeichnungen von Zellen in ihrer natürlichen Umgebung eingebettet. Die Übertragung der elektrischen Signale von bis unverwundete Bereiche in einer Pflanze verwundet ist seit langer Fantasie der Botaniker. Das Phloem, das lebende Teil der Pflanze, die Gefäßsystem in der gesamten Anlage verteilt wird, hat als Hauptgewebe in elektrischen Übertragung in Pflanzen postuliert. Der Mangel an geeigneten elektrophysiologischen Methoden mit zahlreichen Herausforderungen für die Untersuchung der elektrischen Eigenschaften der Phloem-Zellen in vivo. Hier einen neuen Ansatz für die intrazelluläre Elektrophysiologie der Siebelemente (SE), die lebenden Blattläuse oder andere Phloem-Fütterung hemipteran Insekten verwendet, in der elektrischen Eindringen gra integrierten präsentieren wirph (EPG) Schaltung. Die Vielseitigkeit, Robustheit und Genauigkeit dieser Methode war es möglich, zu erfassen und zu untersuchen im Detail die wundinduzierten elektrischen Signale in SEs der zentralen Venen der Modellpflanze Arabidopsis thaliana 1. Hier zeigen wir, dass EPG-Elektroden können leicht für die intrazelluläre elektrophysiologischen Ableitungen von SEs in Rand Venen eingeführt werden, sowie um die Kapazität der SE, mit elektrischen Signalen an mehrere externe Stimuli reagieren zu studieren. Die EPG Ansatz zur intrazellulären Elektrophysiologie des SEs angewendet werden, um eine Vielzahl von Pflanzenarten für viele Forschungsziele umgesetzt werden, in einer Vielzahl von Pflanzen / Insekt Kombinationen und.
Einleitung
Die Fähigkeit, Fern elektrische Signale zu erzeugen ist ein vorteilhaftes Merkmal der mehrzelligen Organismen, die für effiziente Reaktionen auf externe Reize ermöglicht. Diese Eigenschaft wurde unabhängig in Pflanzen und Tieren entwickelt, und stellt somit einen Fall konvergente Evolution. Da die elektrischen Signale werden mit wichtigen Funktionen bei Tieren wie neuronale Übertragung und Muskelkontraktion, die molekulare Basis, Mechanismus der Übertragung, und die Funktion der Stimulus-induzierten elektrischen Signale bei Tieren verbunden sind Gegenstand intensiver Forschung. Im Gegensatz dazu hat reizinduzierte elektrische Anzeige in Pflanzen wenig Forschung Aufmerksamkeit erhalten. Obwohl Pflanzen haben keine Nerven oder Muskeln, scheint es genügend Beweise, um davon ausgehen, dass Stimulus-induzierten elektrischen Signale in Pflanzen spielen eine Schlüsselrolle in ihren Reaktionen auf Umweltfaktoren sein.
Das Phloem, das lebendige Komponente der Anlage Gefäßsystem, hat als Hauptunter postuliertstrate für die Übertragung von Stimulus-induzierten elektrischen Signalen aus angeregt / zu nicht-stimulierten / unbeschädigten Bereiche 2 beschädigt. Die wichtigsten Zellen im Phloem sind die Siebelemente (SE), relativ einfach, länglichen Zellen. Die Enden der SE sind an anderen SEs verbunden ist, die eine durchgehende, mit niedrigem Widerstand, Sieb Rohrsystem, das in der gesamten Anlage verteilt wird. Es gibt jedoch nur sehr wenige Untersuchungen über die elektrischen Eigenschaften dieser hochspezialisierten Zellen. In diesen früheren Studien zugegriffen Forscher SEs entweder mit Glasmikroelektroden 3 oder mit Glaselektroden, die verbunden wurden, um zu pflanzen eingefügt Stilette von Blattläusen, nachdem stylectomy (Schneiden) 4. Glasmikroelektroden aus Glaskapillaren, die an einem Ende mit Wärme in einer feinen Spitze von weniger als 1 um im Durchmesser gezogen, und dann mit einer KCl-Lösung gefüllt ist. Eine Ag / AgCl oder Platindraht, in die KCl gefüllte Glaselektrode eingeführt wird dann an den Eingang des Verstärkers verbunden ist und ein BezugspunktElektrode in das Bad um die Zelle von Interesse eingeführt wird, den Stromkreis. Dieser Aufbau wird der Unterschied im Potential zwischen der extrazellulären Referenten Elektrode und der intrazellulären Meßelektrode, dh das Membranpotential der Zelle 5. Mit diesem Verfahren hergestellt Umrath die erste intrazelluläre Aufnahme von einer Pflanzenzelle, wobei die Algen Nitella 6,7. Nitella ist eine relativ einfache Organismen mit großen Zellen, und damit zugänglich für die intrazelluläre Elektrophysiologieexperimente. Im Gegensatz dazu ist das Einfügen von intrazellulärem Glaselektroden in die kleinen Zellen von mehrzelligen, dreidimensionalen Landpflanzen technisch anspruchsvoll, erfordert hochqualifiziertes Forscher, sowie ausgefeilte Visualisierung, Mikromanipulation, und Vibrationsmaschinen. Obwohl Glaselektroden geeignet, von oberflächlichen Zellen in Pflanzen wie Wurzelhautzellen 8 aufzuzeichnen sind, intrazelluläre recordings von Zellen tief in der Pflanze Gewebe, wie SEs, sehr wahrscheinlich zu Schäden induzierten Reaktionen eingebettet, verwirrend die Ergebnisse. 1989, Fromm und Eschrich berichteten über die Verwendung eines alternativen Verfahrens, die so genannte "Blattlaus Methode", bei der Glaselektroden an Blattläusen Stiletts nach stylectomy 4 gekoppelt. Die Blattlaus Verfahren ist minimal-invasiv, weil flexible Stilette verursachen keine Gewebe oder Zellschäden, Glaselektroden zu tun. Aphid Stilette sind der Natur tolle Erfindung für Pflanzen Penetration, und Blattläuse sind deutlich mehr qualifizierte als Menschen bei der Suche nach SEs. Leider ist dieses Verfahren auch Blattlaus anspruchsvolle in Bezug auf technisches Know-how und Ausrüstung. Zusätzlich hängt der Erfolg eines jeden Experiments, die diese Technik umsetzt ganz auf die Blattlaus wobei in Vorschubbetrieb - mit dem Stilett stabil in einer SE eingesetzt, bei der stylectomy. Das Denken in Retrospektive, kann man sehen, dass die Chancen für den Erfolg dieser Technik könnte ich gewesen seinindem dem Versuchsaufbau ein Instrument, das angibt, ob oder ob nicht die Blattlaus Stilett in der SE bei Anwendung stylectomy ermöglicht mproved.
1964, McLean und Kinsey beschrieben ein "elektronisches Überwachungssystem" für die Untersuchung des Fressverhaltens von Blattläusen in Echtzeit 9,10. In diesem System wurden die Blattlaus und das Stilett penetrierten Pflanze in eine elektrische Schaltung integriert ist. Später, im Jahr 1978, entwickelt Tjallingii eine modifizierte Version des Systems, die so genannte 'Electrical Penetration Graph "(EPG) System 11,12. Während der ursprüngliche elektronische Überwachungssystem empfindlich gegenüber den Widerstand-Ursprung Potentiale werden, wobei der EPG-Systems, die elektromotorische Kraft (emf) entstand Potentialen, dh, in der Pflanze oder in das Insekt erzeugt, könnte zusätzlich zu Potenziale aus der aufzuzeichnenden Widerstand (R) in der Insekten. Dies stellt eine wichtige Verbesserung, da beide Signalkomponenten, emf und R,liefern biologische relevante Informationen über Ereignisse während Pflanzen Eindringen von Blattläusen. Was die EPG Vorverstärker empfindlich für die R-Komponenten ist seine relativ niedrigen Eingangswiderstand von 1 G & Omega, die in etwa dem Durchschnitt der Pflanze / Blattlausresistenz ist. Eine geringe Offsetspannung (1, V) von etwa +100 mV wird der Anlage, die dann in Pflanzen und Insekten auf einer Seite unterteilt ist, und der Eingangswiderstand auf der anderen aufgetragen. Die Spannungen und ihre Änderungen an einem Punkt (1A, B) zwischen der Insekten und dem Eingangswiderstand gemessen. Daher werden die R-Komponenten stellen anlagen Blattlausresistenz Modulationen der Offset-Spannung, während die EMK-Komponenten sind ein gewisser Anteil von Pflanzenpotentiale an der Stilettspitze und Potentiale im Insekt verursacht wird. Die Pflanzenpotenziale - relevanteste hier - sind vor allem Membranpotentiale der Pflanzenzellen durch die Blattlaus Stilette punktiert. Die Insekten Potentiale offensichtlich in erster LinieStrömungspotentiale durch Flüssigkeitsbewegungen innerhalb der beiden Stilett Kanälen verursacht, dh, das Essen und die Speichelgänge; keine internen Nerven- oder Muskelpotentiale sind in der EPG aufgezeichnet. In der Praxis sind die Stilettspitze dient als Elektrodenspitze. Alle Pflanzenzellen negativ innen relativ zur positiven Außenseite der Zelle geladen. Der elektrische Strom (dh die Bewegung geladener Ionen in wässriger Lösung) von innen nach außen und umgekehrt fließt, sehr durch die hohe Beständigkeit der Zellmembran beschränkt. Normalerweise wird das Ruhepotential konstant gehalten wird. Allerdings, wenn negative Ionen ausziehen oder positiven Ionen bewegen sich in die Zellmembran, wird das Membranpotential reduziert, dh, es depolarisiert. Depolarisation bei Zellanregung. Ionen treffen dann in oder aus zu bewegen, wenn bestimmte Ionenkanäle in der Membran geöffnet werden, oder wenn die Membran beschädigt und Ionen austreten und aus. Alle Zellen haben Ionenkanäle und Pumpen in tHe-Plasmamembran, die das Membranpotential in seine Ruheniveau zu bringen, indem die ursprüngliche Konzentration der verschiedenen Ionen innerhalb der Zelle. Das Ruhepotential und seine Veränderungen EMK-Komponenten, und daher ist die EPG geeignete Technik, um sie zu messen.
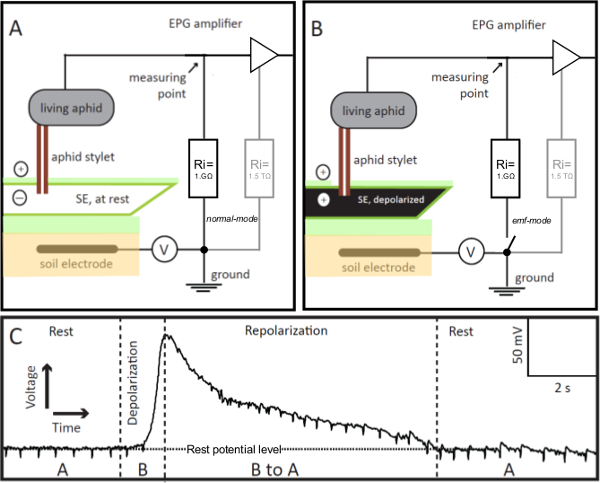
Abbildung 1. EPG-Elektroden. Die EPG-Elektrode ist ein lebendiges Blattlaus in die Elektrik Penetration Graph (EPG) Schaltkreis, dessen Führungsstab wird in ein Sieb Element (SE) in Stallfütterung Modus eingefügt integriert. Wenn das Stilett-aufgespießt SE in Ruhe ist (Feld A), wird die Spannung in der Schaltung von EPG aufgezeichnet wird, ist stabil und in der Ruhepotentialpegel (Tafel C, Rest). Wenn das SE angeregt wird, dessen Membran depolarisiert (Feld B), die in der EPG als eine allmähliche Zunahme der Spannung (Panel C Depolarisation) sichtbar gemacht wird. Da das Ionengleichgewicht in der SE kehrt zur Ruhe, das heißt es repolarIZES, die Spannung von EPG aufgezeichnet allmählich auf den Rest Potentialpegel (Tafel C, Repolarisation). In Panel C, "A" und "B" beziehen sich auf die in den Feldern A und B, gezeigt Szenarien. V = einstellbare Offset-Spannungsquelle. Ri = Eingangswiderstand. Parallel zum 1 GOhm externen Widerstand besitzt der Verstärker eine interne (in der OpAmp) hoch 1,5 Tw Widerstand (Platten A und B, in grau). Durch die Fernsteuerung des Schalters die EPG Vorverstärker kann von normal bis Forschungszentrum für Elektro-Modus, der ermöglicht den Erhalt hochgenaue Spannungswerte geändert werden. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Im nächsten Abschnitt stellen wir die Leser mit einem Basisprotokoll für die Durchführung EPG Experimente, die für beide Insekten konzentriert und Pflanzenstudien konzentriert ist.
Protokoll
1. Blattlaus Aufzucht
Hinweis: Die Auswahl der Anlagen und Blattlaus-Arten für EPG Aufnahmen hängt von der Forschungsziel. Für Untersuchungen an Arabidopsis thaliana ist die Blattlaus Brevicoryne brassicae angemessen.
- Rück B. brassicae Blattläuse in einem Gewächshaus auf Brassica oleracea. Halten Sie die für die Blattlaus Aufzucht in Käfigen verwendeten Pflanzen, um zu vermeiden, verunreinigen anderen Pflanzen. Halten Sie Blattlaus Erziehung Pflanzen und Versuchsanlagen (in unserem Fall B. oleracea und A. thaliana) in getrennten Räumen, um eine Verunreinigung der experimentellen Anlagen mit Blattläusen zu vermeiden.
- Blattläuse übertragen an die frische Pflanzen etwa alle 2 Wochen, bevor verursacht erhebliche Schäden an der Anlage oder das Erreichen der Überbevölkerung. Übertragen 10-20 erwachsene Blattläuse auf eine frische Aufzuchtanlage, um eine neue Kolonie zu initiieren.
- Überwachen Sie die Aufzucht Pflanzen regelmäßig auf Kontamination durch unerwünschte Blattlaus-Arten, andere Insektenfresser, Blattlaus Parasitoide und Fungich, dass die Gesundheit der Blattlauskolonie auswirken können.
- Sammeln Erwachsenen, flügellose Blattläuse bis zu einer Woche nach ihrer endgültigen molt für EPG Aufnahme.
- Nach Abschluß der Versuche, geben die Versuchspflanzen, die nicht an der Wachstumskammer verwendet wurden, da sie oftmals eine Nachkommenschaft, die während der Aufzeichnung, die versehentlich kontaminieren könnten andere Pflanzen hergestellt wurde.
2. Insect Verdrahtung für EPG-Aufnahme
- Insekten Elektroden zu machen, erhalten Messing Steckerstifte (Nägel, Ø 1,2 mm), dünne Kupferdraht (Ø 0,2 mm), sehr dünnen Golddraht (Ø ca. 20 & mgr; m), Wasser-basierte Silber Leim, eine einfache kleine Lötkolben mit Lötwasser und Harzkern-Schweißdraht, Stereomikroskop mit 10-facher Vergrößerung, kleine Schere oder Skalpell, zwei feinen Pinzette und einem Styropor-Platte oder Box. Hinweis: Ein Wirbelmischer könnte nützlich sein. Anmerkung: Die Schritt-für-Schritt-Protokoll mit den Elektroden bilden, ist in Fig. 2 angedeutet
- Für BlattlausHandhabung und Klebstoffauftrag, zu erhalten: eine kleine und weiche Aquarellkamelhaarbürste (Größe 2 oder kleiner) und Insekten Stifte, wie sie für die Insektensammlungen verwendet, obwohl eine feine Nähnadel oder Zahnstocher kann auch funktionieren. Schritt 4 zeigt, wie EPG Aufnahme zu starten.
- Schritt 1.
Hinweis: Die Schritte 1 und 2 zeigen, wie Insekten Elektroden minus die Blattlaus vorzubereiten. Schritt 3 zeigt, wie eine Blattlaus an die Elektrode anzuschließen. Vakuum Fixierung der Blattläuse wird bei der Verdrahtung zu empfehlen, aber nicht immer für langsam fahrende Spezies (z, B. brassicae) erforderlich.- Schalten Sie den Lötkolben und Lötzinn schmilzt etwas an seiner Spitze (Abbildung 2A). Befeuchten Sie den Kopf des Messing Steckerstift mit etwas Lötwasser (2B) und tauchen sie in die geschmolzene Lötmetall (2C).
- Anwenden einer Hülle aus geschmolzenen Lötmetalls auf ein Ende eines 1-2 cm langes Stück der dünnen Kupferdraht (Abbildung2D). Dann zusammen zu bringen Sie den Stift und Kupferdraht gegen die heiße Bolzen (2E) und bewegen Sie sie zusammen weg abkühlen und sich verfestigen (2F).
- Schritt 2.
- Gründlich schütteln (oder Wirbel) das Fläschchen mit Silberkleber für mehrere Minuten, bis eine glatte Emulsion gezeigt. Cut (Schere oder Skalpell) ein paar Stücke der Golddraht (von ca. 1,5 cm lang) auf der Objektplatte des Stereomikroskops (2G).
- Werfen Sie einen Messingstift mit gelöteten Kupferdraht (in Abschnitt 2.3 gemacht) und tauchen Sie das freie Ende der Kupferdraht in die kleine silberne Leimreservoir, die an der Innenseite des Deckels der Ampulle nach dem Öffnen (Abbildung 2 H) gesammelt haben wird. Hinweis: Nur ein kleiner Tropfen ist erforderlich.
- Bewegen Sie den Kleber getauchten Ende der Kupferdraht, um das Stück Golddraht, beim Heben ein Ende zu vermeiden, Verschmieren der Kleber auf dem Stereomikroskop Objektplatte. Versuchen Sie, coppe lappenr und Golddraht für wenige mm (2I), die Verteilung des Leims entlang der Überlappung der beiden Drähte.
- Warten Sie, bis der Kleber wurde genug, um die Drähte zusammenzuhalten getrocknet. Überprüfen Sie die Kontaktkleber nach dem Trocknen und fügen Sie einige frische Kleber mit einem kleinen Stift oder ein anderes Stück Kupferdraht, wenn einige Teile der verbundenen Drähte zeigen klebstofffreien Teilen.
- Nachdem das Insekt Elektrode bereit ist, lagern Sie ihn zum Beispiel in ein Stück Styropor eingesetzt.
Hinweis: Die Länge der Golddraht wird die Bewegungsfreiheit der Blattläuse festzustellen: Wenn es zu kurz (weniger als 5 mm) ist die Blattlaus kann eingeschränkt fühlen und nicht normal zu verhalten; wenn er zu lang ist (> 2 cm) wird der Blattlaus frei bewegen. Blattläuse sind in der Regel auf die oberseits von Blättern zu bewegen, wenn zu dürfen. Wenn der Golddraht das Blatt berührt, wird das Signal kurzgeschlossen werden.
- Schritt 3.
- Blattlaus kann anstelle mittels Licht Ansaugen gehalten werden, unter Verwendung eines Vakuums; in diesem Fall installieren Sie ter Absaugvorrichtung unter dem Stereomikroskop. Legen Sie die Ansaugöffnung in der Mitte des Feldes.
- Gründlich schütteln Sie das Fläschchen mit Silberkleber für einige Minuten (oder Wirbel), bis eine glatte Emulsion gebildet. Sammeln Sie eine Blattlaus mit der kleinen Bürste.
- Einschalten der Saugeinrichtung und Mount Blattlaus auf der Ansaugöffnung (2J), mit der Rückseite des Bauches wandte sich dem Experimentator. Mit dem feinen Pinsel, entfernen Sie das Wachs-Oberfläche aus dem Bauch (reichlich in Kohl Blattläuse).
- Öffnen Sie das Fläschchen und Klebstoff benetzt einen Stift mit einem sehr kleinen Tröpfchen aus Silber Leim (Abbildung 2K). Übernehmen Sie die Tropfen der Silber Kleber auf der Rückseite des Blattlaus Bauch (2L-M). Lassen Sie diese Tröpfchen während mehreren Minuten vollständig trocken, kräftig schütteln den Leim Fläschchen wieder und fügen Sie einen zweiten Tropfen der Silber Kleber auf der Oberseite der ersten. Anmerkung: Während der Silberkleber ein elektrischer Leiter ist, verursacht es keine signifikantenBeschädigung des Insekts Nagelhaut.
- Nach dem Schließen der Klebe Fläschchen, legen Sie die freien Ende der Golddraht in die nasse Tröpfchen und halten den Draht noch während es dem Kleber vollständig trocknen (Abbildung 2 N). Vermeiden verschmiert Leim auf Beinen oder Antennen und entsorgen Sie eine Blattlaus, wenn dies geschehen ist.
- Schalten Sie die Absaugung Fixierungsvorrichtung und heben das Insekt (Abbildung 2 O). Verwenden Sie bei Bedarf einen feinen Pinsel, um in der Aufhebung des Blattlaus von der Absaugvorrichtung zu unterstützen.
Hinweis: Verdrahtung B. brassicae erfordert kein Vakuum, da sie auf einem Stück eines Präzisionslaborgewebe, wobei die rauhe Oberfläche liefert die Blattlaus mit genügend Halt, so daß es nicht nach dem Aufbringen eines Tropfens Nassleim seinen Bauch angehoben verdrahten. Nach dem Trocknen Kleber kann man die Blattlaus aus dem Gewebe mit Hilfe einer feinen Bürste anzuheben. - Setzen Sie die Messingstift mit dem drahtgebundenen Insekt in das Styropor und, wenn nötig, weiterVerdrahtung alle anderen Insekten, um die EPG-Aufnahme-Session verwendet werden.
Hinweis: Diese Protokolle für die Verdrahtung Blattläuse funktionieren gut für uns. Der Benutzer kann seine / ihre eigene Methode für die Verdrahtung Blattläuse finden.
- Schritt 4.
- Gesetzt Pflanzen im Faradayschen Käfig (Abbildung 2P) auf einem nicht-leitenden Träger: Verwenden Petrischalen oder eine Platte aus Glas oder Kunststoff.
- Legen Sie eine Anlage Elektrode in den Boden jedes Topfes. Setzen Sie die Messingstift der verdrahteten Insekt in den Eingangsanschluss des EPG Vorverstärker (Abbildung 2Q). Anmerkung: der Bodenelektrode nicht mit der Masseelektrode in anderen elektrophysiologische Techniken verwendet werden, entsprechen. Es hat die Offsetspannung erforderlich Einstellen und Kompensieren von Elektrodenpolarisationsspannungen.
- An der Schnittstelle der Erfassungssoftware Stilett +, mit fester Sample-Frequenz von 100 Hz, geben Sie einen Dateinamen ein, geben Sie die Aufzeichnungszeit, und schreiben Sie Text, um Details des Experiments festlegen (Behandlungsanlagen / inse ct Arten, etc.) in Kommentarzeilen 2 und 3.
- Senken Sie die Insekten auf einem geeigneten Landebereich der Anlage und starten Sie die Aufnahme-Session, indem Sie auf die Schaltfläche Start der Erfassungssoftware (Stylet +) Schnittstelle.
Anmerkung 1: maximal 8 Kanäle können gleichzeitig in einem EPG einrichten verwendet werden. Einen EPG-Elektrode oder mehrere EPG-Elektroden pro Pflanze verwendet werden.
Anmerkung 2: wenn der Schwerpunkt der Studie ist die Blattlaus Verhalten, starten Sie die Aufnahme vor Pflanzen Zugang der Blattläuse zu vermeiden, fehlt die erste Anlage Eindringen Aktivitäten. - Zum Studium der elektrophysiologischen Reaktionen der SE auf Reize, immer mindestens 10 min nach der Blattläuse wurde in Phloem Phase in Reihenfolge eingegeben, um sicherzustellen, dass die Blattlaus ist nachhaltig Phloem Einnahmephase und daß der Signalbasislinie ist stabil. Erst dann beginnen jede Pflanze Stimulation Experiment.
tp_upload / 52826 / 52826fig2.jpg "/>
2. Erstellen Sie EPG-Elektroden mit Blattläusen oder andere hemipteran Insekten für elektrische Penetration Graph (EPG) Aufnahmen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Panels AI, Schritte erforderlich, um EPG-Elektroden minus die Blattlaus vorzubereiten. Zuerst schmilzt ein Stück Lötmetall auf der Spitze eines Lötkolben (A). Dann tauchen Sie den Kopf des Messingstift in einen Tropfen Lötwasser (B), und wenden Sie es mit dem geschmolzenen Metall am Löten Bolzenspitze (C). Sofort nach diesem Schritt an das Ende einer Kupferdraht an der Spitze der Lötkolben, um sie auf den Kopf des Messingstift (EF) zu kleben. Mit einem Skalpell oder einem Messer, schneiden Sie ein Stück der Golddraht (G). Tauchendas freie Ende des Kupferdrahtes auf dem silbernen Kleber (H) (am anderen Ende an den Messingstift verbunden), und schnell kommen die Golddraht, um sie (I), bevor der Silber austrocknet. Der Golddraht ist ein ausgezeichneter Leiter und kann polarisiert werden. In Wirklichkeit in der Mehrzahl der Fälle die Polarisation zu klein, um erkannt werden, und wenn ja, kann er für die Offset-Spannung (V) kompensiert werden.
Panels JO, Schritte erforderlich, um eine Blattlaus (oder andere hemipteran Insekten) an die Elektrode anzuschließen. Zunächst heben eine Blattlaus mit einem feinen Aquarellpinsel und auf die Öffnung der Vakuumsauger (J). Schalten Sie die Vakuumpumpe und die Abdeckung des Luftventils Loch mit einem Stück Papier, um Unterdruck anwenden. Tauchen Sie die Spitze des Insekts Stift in die Silber Kleber (K), und legte einen kleinen Klebetropfen auf der Oberseite des Blattlaus Bauch, unter einem Stereomikroskop (LM). Innerhalb dernächste ~ 20 sec vor der Silberkleber Tröpfchen auf die Blattlaus trocknet, setzen Sie das Ende der Golddraht des Insekts Elektrode in die nasse Tröpfchen aus Silber Leim, und halten Sie es in Platz für 1-3 min, bis das Silber Leim vollständig luftgetrocknet (N). An dieser Stelle deaktivieren Absaugung durch Entfernen des Stück Papier, das den Luftventilöffnung der Absaugvorrichtung umfasst und entfernen Sie vorsichtig die Blattlaus, von der Absaugvorrichtung: Anheben der Blattlaus nach der Verdrahtung erfordert oft etwas Hilfe von einem feinen Pinsel (O).
P Panel zeigt eine Übersicht über die gesamte EPG einzurichten innerhalb des Faraday-Käfig, und Panel Q zeigt eine Übersicht der Anlage-Blattlaus-Kombination für EPG. Siehe Abschnitt 2 für eine ausführlichere Erklärung dieses Prozesses.
Kleinbuchstaben sind Etiketten, die sich auf die Elemente, die man braucht, um EPG-Elektroden machen: ein: Löten Bolzen; b: geschmolzene Lötmetall;c: Lötwasser; d: Messing Steckerstift (Nagel); e: Kupferdraht; f: Ø 18 um Golddraht; g: Absaugvorrichtung; h: Blattlaus; i: auf Wasserbasis Silber Kleber; j: Faraday-Käfig; k: Pflanzen Elektrode; l: Eingangsbuchse (BNC) des EPG Vorverstärker.
Ergebnisse
In einer früheren Studie haben wir die EPG-Elektrodentechnik mit dem Zweck der Charakterisierung der elektrischen Signale in SEs des Mittelader während Raupe Angriff 1 hergestellt implementiert. Die Mittelader ist eine bevorzugte Insertionsstelle für konventionellen Glaselektroden, sowie für Glas Mandrin Elektroden, weil es SE-dichten und relativ robust, damit zugänglich für die Fixierung für die Implementierung dieser Techniken benötigt. Dabei nutzten wir die Vielseitigkeit des EPG-Elektrode mit dem ...
Diskussion
Dieser Artikel enthält ein detailliertes Protokoll zur elektrischen Penetration Graph (EPG) Aufnahmen. Die EPG-Technik ist gut etabliert, mit 100-200 aktive Nutzer weltweit, und es hat für viele Studien zu verschiedenen Themen, zum Beispiel implementiert: a) Resistenz von Wirtspflanzen auf Blattläuse und andere Stilett tragenden Insekten 13; b) Pflanzenvirus und Erreger Übertragungsmechanismen 14; c) Insektizid Wirkungsweise (Toxizität und Verhaltensänderungen) 15; d) EPGs wurden s...
Offenlegungen
WFT launched EPG Systems as a retirement activity, and is affiliated with it financially.
Danksagungen
VSR wurde durch ein Marie-Curie-Finanzhilfe IIF unterstützt (Wunde in EARTH, Akronym für: Wound induzierte elektrische Signale in Arabidopsis thaliana).
Materialien
| Name | Company | Catalog Number | Comments |
| Brass connector pins | EPG Systems/hardw.shop | Φ 1.2 mm | |
| Thin copper wire | EPG Systems/hardw.shop | approx. Φ 0.2 mm | |
| Thin gold wire | EPG Systems | Φ 18 µm | |
| Soldering fluid | hardware shop | matching the soldering wire | |
| Resin-cored soldering wire | hardware shop | ||
| Styrofoam | any | ||
| Water-based silver glue | EPG Systems | recipe in: www.epgsystems.eu | |
| Paper wipes | Kimberly-Clark | 5511 | |
| Soldering bolt | any | ||
| Stereomicroscope | Hund Wetzlar | minimum magnification is 10X | |
| Small scissors | Fine Science Tools | 14088-10 | |
| Scalpel | Fine Science Tools | 10050-00 | |
| Fine forceps | Fine Science Tools | 11231-20 | |
| Vortex | A. Hartenstein | L46 | |
| Watercolor brushes | any | Number 1 or 2 | |
| Air suction device | see description in: www.epgsystems.eu | ||
| Insect pins | any | No. 1 or 2 | |
| Solid table | |||
| Faraday cage | Hand made | ||
| Computer | Fujitsu Siemens | ||
| Data acquisition software | EPG Systems | Stylet+d | |
| Giga-4 (-8) Complete System | EPG Systems | ||
| includes the following: | |||
| Main control box with USB output | Di155/Di710 | 12/14 bit, rate 100 Hz (softw. fixed) | |
| EPG probes 4 (8) | 50x DC pre-amplifier | ||
| Swivel clamps on rod | |||
| DC power adaptor | bipolar, 230/115 VAC to -/+8 VDC | ||
| Plant electrodes and cables | |||
| Additional test and ground cables |
Referenzen
- Salvador-Recatalà, V., Tjallingii, W. F., Farmer, E. E. Real-time, in vivo. intracellular recordings of caterpillar-induced depolarization waves in sieve elements using aphid electrodes. New Phytologist. 203 (2), 674-684 (2014).
- Van Bel, A. J., Knoblauch, M., Furch, A. C., Hafke, J. B. (Questions)n on phloem biology. 1. Electropotential waves, Ca2+ fluxes and cellular cascades along the propagation pathway. Plant Science. 181 (3), 210-218 (2011).
- Rhodes, J. D., Thain, J. F., Wildon, D. C. The pathway for electrical signal conduction in the wounded tomato plant. Planta. 200, 50-57 (1996).
- Fromm, J., Eschrich, W. Correlation of ionic movements with phloem unloading and loading in barley leaves. Plant Physiology and Biochemistry. 27, 577-585 (1989).
- Brette, R., Destexhe, A., Brette, R., Destexhe, A. Intracellular Recordings. Handbook of Neural Activity Measurement. , 44-91 (2012).
- Umrath, K. Untersuchungen über Plasma und Plasamstromung an Characeen. IV. Potentialmessungen an Nitella mucronata. mit besonderer Berücksichtingung der Erregungserscheinungen. Protoplasma. 9, 576-597 (1930).
- Umrath, K. Der Erregungsvorgang bei Nitella mucronata. Protoplasma. 17, 258-300 (1932).
- Carden, D. E., Walker, D. J., Flowers, T. J., Miller, A. J. Single-cell measurements of the contribution of cytosolic Na+ and K+ to salt tolerance. Plant Physiology. 131 (2), 676-683 (2003).
- Miles, P. W., McLean, D. L., Kinsey, M. G. Evidence that two species of aphid ingest food through an open stylet sheath. Experientia. 20 (10), 582 (1964).
- McLean, D. L., Kinsey, M. G. A technique for electronically recording aphid feeding and salivation. Nature. 202, 1358-1359 (1965).
- Tjallingii, W. F. Electronic recording of penetration behaviour by aphids. Entomologia Experimentalis et Applicata. 24, 721-730 (1978).
- Tjallingii, W. F. Membrane potentials as an indication for plant cell penetration by aphid stylets. Entomologia Experimentalis et Applicata. 38, 187-193 (1985).
- Alvarez, E. E., et al. Comparative analysis of Solanum stoloniferum. responses to probing by the green peach aphid Myzus persicae. and the potato aphid Macrosiphum euphorbiae. Insect Science. 20 (2), 207-227 (2013).
- Carmo-Sousa, M., Moreno, A., Garzo, E., Fereres, A. A non-persistently transmitted virus induces a pull-push strategy in its aphid vector to optimize transmission and spread. Virus Research. 186, 38-46 (2014).
- Jacobson, A. L., Kennedy, G. G. Electrical Penetration Graph studies to investigate the effects of cyantraniliprole on feeding behavior of Myzus persicae. (Hemiptera: Aphididae) on Capsicum annuum. Pest Management Science. 70 (5), 836-840 (2014).
- Morris, G., Foster, W. A. Duelling aphids: electrical penetration graphs reveal the value of fighting for a feeding site. Journal of Experimental Biology. 211 (9), 1490-1494 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten