JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
체관부 체 요소에 전기 신호를 획득 및 측정을위한 전기 침투 그래프 (EPG)의 새로운 응용 프로그램
요약
Electrical Penetration Graph (EPG) is a well-established technique for studying the feeding behavior of stylet-bearing insects. Here we show a new application of EPG as a non-invasive tool for the acquisition of intracellular electrophysiology recordings of sieve elements (SEs), the cells that form the phloem vasculature in plants.
초록
세포의 전기 생리 특성은 종종 자신의 네이티브 환경에서 그들을 해리 후, 시험관에서 공부하고 있습니다. 그러나 유기체 먼 세포 사이의 전기 전송의 연구는 생체 내에서 자신의 네이티브 환경에 내장 세포의 유물이없는 기록을 필요로한다. 공장에서 unwounded 지역으로 부상에서 전기 신호의 전송은 긴 있기 때문에 식물 학자의 관심을 감정을 상하게했다. 사부, 공장 전반에 걸쳐 확산되는 식물 혈관의 살아있는 부분은, 식물에서 전기 전송의 주요 조직으로 가정하고있다. 적합한 전기 생리 학적 방법의 부족은 생체 내에서 체관부 세포의 전기적 특성의 연구에 많은 문제를 야기. 여기에서 우리는 전기 침투 감에 통합 사는 진딧물, 또는 다른 사부 공급 hemipteran 곤충을 사용 체 요소의 세포 내 전기 생리학 (SES)에 대한 새로운 접근 방식을 제시산도 (EPG) 회로. 이 방법의 다양성, 안정성 및 정확성은 가능한 기록 모델 식물 애기 장대 (1)의 중심 정맥의 SE들에 상세히 상처 유발하는 전기 신호를 연구했다. 여기서 우리는 EPG 전극 용이 한계 정맥 세포의 전기 생리 SE를 레코딩을 위해 구현 될 수 있으며,뿐만 아니라, 여러 외부 자극을 전기 신호로 응답 SE의 용량을 연구하는 것을 보여준다. SE의 세포 내 전기 생리학에인가 EPG 방식은 식물 / 곤충 조합의 다수의 식물 종의 다양한 구현에 많은 연구가 목적이 될 수있다.
서문
장거리 전기 신호를 생성하는 기능은 외부 자극에 대한 반응을 효율적으로 허용 다세포 생물의 유리한 특성이다. 이 특성은 식물과 동물에 독립적으로 진화, 따라서 수렴 진화의 경우를 나타내고있다. 집중적 인 연구의 주제는 전기 신호가 이러한 동물에서 자극 유발 된 전기 신호의 송신 및 신경 근육 수축, 분자 단위로, 전송 메커니즘, 및 함수 등의 동물에서 중요한 기능과 결합되는 것을 감안할. 대조적으로, 식물에서 자극 유도 전기 신호는 거의 연구 주목 받고있다. 식물이 더 신경이나 근육이 없지만, 식물이 환경 적 요인에 대한 그들의 반응에 중요한 역할을에서 그 자극에 의한 전기 신호를 가정 할 수있는 충분한 증거가있을 것 같습니다.
체관부, 식물 맥관계의 생활 성분은 주요 서브으로 가정 한자극 유발 된 전기 신호의 전송을위한 strate는 자극으로부터 / 비 자극 / 손상되지 않은 부분이 손상. 체관부의 주요 세포는 체 요소 (SES), 비교적 간단한, 가늘고 긴 세포이다. SE들 중 단이 공장으로 확산되는 연속적인 저 저항, 관 자체 시스템을 형성하는 다른 SE들에 접속된다. 이러한 고도로 전문화 된 세포의 전기적 특성에 대한 연구는 거의 그러나있다. 이러한 이전의 연구에서 연구자와 함께 SE를 액세스하거나 유리 미세 전극 stylectomy (절단) 후 진딧물의 3에 결합 된 유리 전극을 심고 삽입 stylets, 4. 유리 마이크로 전극은 직경이 1 ㎛ 미만의 미세한 팁으로 열에 일단 당겨 다음의 KCl 수용액으로 채워진다 유리 모세관으로부터 만들어진다. KCl을 채워진 유리 전극 삽입 자세 / AgCl로 또는 백금 와이어는 다음 증폭기의 입력에 접속하고있다 리파전극은 회로를 완성 관심 셀을 둘러싸 욕에 삽입된다. 이 설정은 지시 대상 외 전극 및 세포 측정 전극, 즉, 셀 (5)의 막 전위 사이의 전위차를 기록한다. 이 방법은 Umrath 조류 Nitella 6,7을 사용하여, 식물 세포에서 세포 내 첫번째 기록했다. Nitella은 비교적 간단한 많은 세포와 유기체, 세포 내 전기 생리학 실험하는 것이 의무이다. 대조적으로, 다중 - 셀룰러, 입체 육상 식물의 작은 세포에 세포 내 유리 전극의 삽입은, 기술적으로 요구하고 고도로 숙련 된 연구자뿐만 아니라 복잡한 시각화, 미세 조작 및 진동 방지 장치를 필요로한다. 유리 전극은 뿌리 표피 세포 (8)과 같은 식물의 표면 세포에서 기록하기에 적합하지만, 세포 내 recordin세포에서 GS 깊이 결과를 혼란, 같은 SE를, 아주 큰 원인 손상에 의한 반응으로 식물의 조직에 포함. 1989 년 프롬과 Eschrich는 다른 방법의 사용을보고 유리 전극 stylectomy 후 4 진딧물 stylets에 결합 된 '진딧물 법'이라고. 유리 전극처럼가요 stylets은 조직 또는 세포 손상을 유발하지 않기 때문에 진딧물 방법은 침습적이다. 진딧물의 stylets 식물 침투에 대한 자연의 위대한 발명이며, 진딧물은 상당히 SE들을 찾는 인간보다 더 숙련 된입니다. 불행하게도,이 진딧물 방법은 전문 기술 및 장비의 측면에서 매우 요구하고있다. stylectomy시에 안정적으로 삽입 SE와 탐침 - 또한,이 기술을 구현하는 각 실험의 성공은 급송 모드 인 진딧물에 전적으로 의존한다. 회고전의 생각, 하나는이 기술의 성공의 확률이 난을 수 있었던 것을 알 수있다실험 장치에 적용시 stylectomy 진딧물 탐침은 SE인지 여부를 식별 허용기구를 추가하여 mproved.
1964 년과 클린 킨제이 실시간 9,10에서 진딧물의 급전 동작의 연구 '전자 모니터링 시스템'바와. 이 시스템에서, 진딧물과 탐침 - 관통 공장 전기 회로에 통합 하였다. 그 후, 1978 년, Tjallingii, 시스템의 수정 된 버전을 고안 한 '전기 침투 그래프'(EPG) 시스템 (11, 12)를 불렀다. 원시 전자 감시 시스템은 저항 유래 전위에 민감한 반면 단, EPG 시스템, 기전력 (EMF)의 전위, 즉, 식물 또는 곤충의 발생에서 발생하는 전위에 부가하여 기록 할 수 유래 곤충에 저항 (R). 이것은, 중요한 개선을 나타내는 두 신호 성분, EMF 및 R 때문에,진딧물에 의해 식물의 침투 동안 이벤트에 대한 생물학적 관련 정보를 제공합니다. 무엇 R-구성 요소에 EPG의 프리 앰프는 민감한 만드는 것은 공장 / 진딧물 저항의 평균에 가까운 1 GΩ의 상대적으로 낮은 입력 저항이다. 작은 오프셋 전압 (도 1은, V)의 대략 +100 MV는 한쪽면에 식물 및 곤충에 걸쳐 분할된다 식물, 및 기타의 입력 저항에인가된다. 전압 및 변경 사항은 곤충과 입력 저항 사이의 점 (그림 1A, B)로 측정하고 있습니다. EMF-구성 요소가 곤충에 의한 식물 탐침 끝에서 전위와 전위의 특정 부분 반면 따라서, R-구성 요소는 오프셋 전압의 식물 진딧물 저항 변조를 나타냅니다. 공장 전위 - 여기에 가장 관련성이 - 진딧물 stylets에 의해 구멍이 식물 세포의 주로 막 잠재력이다. 곤충 잠재력은 주로 것으로 보인다두 개의 탐침 운하 내에서 유체의 움직임에 의한 스트리밍 전위, 즉, 음식과 타액 운하; 더 내부의 신경 또는 근육 잠재력은 EPG에 기록되지 않습니다. 실제로, 전극의 끝 부분으로 탐침 팁 기능. 모든 식물 세포에 부정적인 셀의 양극 외부에 대하여 내부에 충전된다. 전기 전류는 (즉, 묽은 용액으로 하전 된 이온의 이동) 외부 그 반대로 내부에서 흐르는 매우 인해 세포막의 높은 저항으로 제한된다. 일반적으로 휴식 잠재력은 일정하게 유지된다. 음이온 퇴실이나 양이온은 세포막을 통해 이동할 때, 막 전위가 '탈분극', 즉 감소된다. 세포 탈분극 자극시 발생. 멤브레인이 손상 및 이온과 누출 될 때 막에서 특정 이온 채널을 열 때 또는 이온은 또는 밖으로 이동합니다. 모든 세포는 T에서 이온 채널과 펌프가그는 셀 안에 다양 이온의 원래 농도를 복원하여 휴면 레벨로 막 전위를 가지고 막을 플라즈마. 휴지 전위와 그 변화는 EMF 요소이며, 따라서, EPG 기법들을 측정하는데 적합하다.
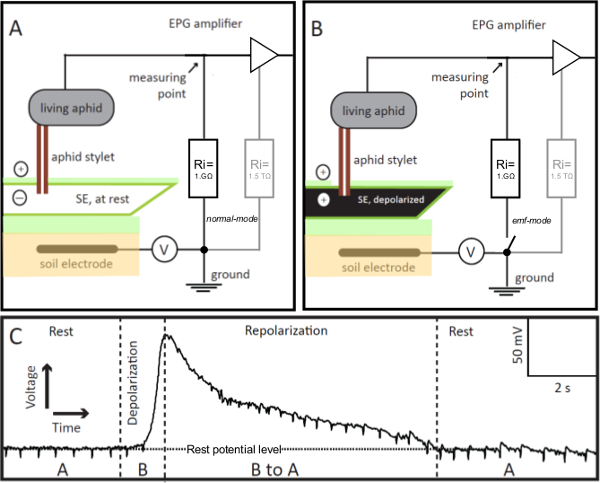
1. EPG 전극 그림. EPG 전극 누구 탐침 안정된 급송 모드 체 요소 (SE)에 삽입되어 전기 침투 그래프 (EPG) 회로에 통합 거실 진딧물이다. 탐침 - 찔려 죽은 SE는 나머지 (패널)에있는 경우, EPG에 의해 기록 된 회로의 전압은 안정과 휴식 전위 레벨 (패널 C, 나머지)에 있습니다. SE 흥분 경우, 전압의 점진적 증가 (패널 C, 탈분극)로 EPG 시각화 자사의 막 탈분극 (패널 B). SE의 이온 균형 즉, 그것은 repolar, 휴식을 반환으로izes, EPG에 의해 기록 된 전압이 점차적으로 나머지 전위 (패널 C, 재분극)로 감소. 패널 C에서, "A"와 "B"는 각각 패널 A 및 B에 도시 된 시나리오를 참조. V = 가변 오프셋 전압원. 리는 입력 저항 =. 1 GΩ 외부 저항에 병행하여, 앰프 (회색, 패널 A와 B) 높은 1.5 TΩ 저항 (OPAMP의) 내부 있습니다. 스위치의 원격 제어에 의해 EPG 프리 앰프는 매우 정확한 전압 값을 얻을 수있게, 모드를 EMF 보통에서 변경 될 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
다음 섹션에서, 우리는 모두 집중 곤충과 식물에 초점을 맞춘 연구를위한 유효 EPG 실험을 수행하기위한 기본 프로토콜 리더를 제공합니다.
프로토콜
1. 진딧물 양육
참고 : EPG 녹화 용 식물과 진딧물 종의 선택은 연구 목적에 따라 달라집니다. 애기 장대에 대한 연구를 들어, 진딧물 Brevicoryne의 brassicae 적합합니다.
- 후면 B. 브라 시카 올레 라 케아에 온실 brassicae 진딧물. 다른 식물 오염을 방지하기 위해, 케이지에서 사육 진딧물 사용 식물 유지. 진딧물과 실험 식물의 오염을 방지하기 위해, 진딧물 양육 식물과 별도의 방에서 (우리의 경우 B의 올레 라 케아와 A. 장대에서) 실험 설비를 유지.
- 중요한 식물의 손상을 초래하거나, 인구 과잉에 도달하기 전에, 2 주마다에 대한 신선한 식물에 진딧물을 전송합니다. 새로운 식민지를 시작하는 신선한 양육 공장에 10 ~ 20 성인 진딧물을 전송합니다.
- 원치 않는 진딧물 종, 기타 곤충 초식 동물, 진딧물 포식 기생자 및 봉에 의한 오염 정기적으로 식물을 양육 모니터나는 진딧물 식민지의 건강에 영향을 미칠 수.
- EPG 녹화에 대한 최종 탈피 후 1 주일 성인, 날개없는 진딧물을 수집합니다.
- 그들은 종종 실수로 다른 식물을 오염시킬 수 기록, 동안 생산 된 일부 자손을 가지고 실험 한 후, 성장 챔버에 사용되지 않은 실험 식물을 반환합니다.
EPG 녹화 2. 곤충 배선
- 황동 커넥터 핀 (손톱, Ø 1.2 mm), 얇은 구리 와이어 (Ø 0.2 mm), 매우 얇은 골드 와이어 (O의 약 20 μm의), 수성은 접착제, 간단한 작은 납땜 볼트를 얻을, 곤충 전극을 만들려면 납땜 유체 및 수지 코어 납땜 와이어, 10 배 배율, 작은 가위 또는 메스,이 미세 집게 및 스티로폼 시트 또는 상자 실체. 참고 : 와류 믹서 유용 할 수 있습니다. 주 : 전극을 만드는 단계별 프로토콜은도 2에 표시된다.
- 진딧물의 경우취급 및 접착제 응용 프로그램은, 구하십시오 작고 부드러운 수채화 camelhair 브러쉬 (크기 2 이하)와 같은 곤충 컬렉션에 사용되는 것과 같은 곤충 핀, 미세 재봉 바늘이나 이쑤시개가 잘 작동 수도있다. 4 단계의 EPG 녹화를 시작하는 방법을 보여줍니다.
- 1 단계.
주 : 1과 2는 아래 곤충 전극을 뺀 진딧물을 준비하는 방법을 보여 단계. 3 단계는 전극에 진딧물을 연결하는 방법을 보여줍니다. 진딧물의 진공 고정 배선시 권장하지만 항상 느린 이동 종 (예를 들면, B를 brassicae) 필요하지 않습니다.- 납땜 볼트에 전환 및 팁 (그림 2A)에서 일부 납땜 와이어 용융. 일부 납땜 유체 (그림 2B)와 황동 커넥터 핀의 머리를 적셔 녹아 납땜 금속 (그림 2C)로 찍어.
- 얇은 구리 와이어의 1-2 ㎝ 길이 부재의 일단 부에 용융 땜납의 금속 피복을 적용 (도2D). 그런 다음 뜨거운 볼트 (그림 2E)에 대해 함께 핀과 구리 와이어를 가져오고 냉각 (그림 2 층)을 응고 멀리 함께 이동합니다.
- 2 단계.
- 부드러운 에멀젼이 표시 될 때까지 철저하게 몇 분 동안은 접착제와 유리 병을 흔들어 (또는 소용돌이). 컷 (가위 또는 메스) 실체 현미경 (그림 2G)의 객체 접시에 골드 와이어 (길이 약 1.5 cm)의 몇 가지.
- (2.3 절 제) 납땜 구리 와이어 황동 핀을 가지고 (그림 2H)를 연 후 유리 병의 뚜껑 내부에서 수집 한 것입니다 작은 은색 접착제 용기에 구리 와이어의 끝을 찍어. 참고 : 작은 물방울이 필요하다.
- 실체 객체 판에 접착제 번지지 않도록 한쪽 끝을 들어올 리면서, 골드 와이어의 조각에 구리 와이어의 접착제 담근 끝을 이동합니다. coppe 겹쳐보십시오두 전선의 중복을 따라 접착제를 배포하는 몇 mm (그림 2I)에 대한 R과 골드 와이어.
- 접착제가 연합 전선을 유지하기에 충분히 건조 될 때까지 기다립니다. 건조 후 접착제의 연락처를 확인하고 가입 전선의 일부는 접착제가없는 부분을 보여 주면 작은 핀 또는 구리 와이어의 다른 조각으로 신선한 풀을 추가 할 수 있습니다.
- 곤충 전극이 준비되면, 스티로폼 조각 삽입 예를 들면, 보관.
주 : 골드 와이어의 길이는 진딧물의 이동의 자유를 결정할 것이다 : 그것은 (5mm 이하) 너무 짧으면 진딧물이 구속 느낄 수 있고, 정상적으로 작동하지 않을 것이다; 그것은 (> 2cm)가 너무 긴 경우, 진딧물 자유롭게 이동한다. 진딧물이 허용하는 경우, 잎의 향축 측면으로 이동하는 경향이있다. 골드 와이어는 잎에 닿으면 신호가 단락 될 것입니다.
- 3 단계.
- 진딧물이 진공을 이용하여, 광 흡수에 의해 제자리에 유지 될 수있다; 이 경우, t를 설치그는 실체 현미경 장치를 빨아. 필드의 중앙에 흡인 개구를 놓는다.
- 철저히 부드러운 에멀젼이 형성 될 때까지 몇 분 (또는 소용돌이) 실버 접착제와 유리 병을 흔들어. 작은 브러시와 진딧물를 수집합니다.
- 복부의 뒤쪽에, 흡인 장치를 켜고 흡입구 (도 2J)에 진딧물 마운트는 실험자에게 돌렸다. 미세 브러시, (양배추 진딧물이 풍부) 복부에서 어떤 표면의 왁스를 제거합니다.
- 접착제 병을 열고 실버 접착제의 아주 작은 물방울 (그림 2K)와 핀 젖은. 진딧물의 복부 (그림 2L-M)의 뒷면에 실버 접착제의 방울을 적용합니다. 적극적으로 다시 접착제 병을 흔들 첫 위에 실버 접착제의 두 번째 방울을 추가, 몇 분 동안 완전히 건조이 방울을 보자. 주 : 실버 접착제 전기 전도체이지만, 그것은 상당한 일으키지 않는다곤충의 표피에 손상.
- 접착제 병을 닫은 후, 젖은 방울에 골드 와이어의 끝을 삽입하고 접착제가 완전히 (그림 2N)을 건조 할 수 있도록하면서 여전히 선을 유지. 다리 또는 안테나에 접착제를 바르는 피하고 이런 일 경우 진딧물을 폐기합니다.
- 흡입 고정 장치를 끄고 조심스럽게 곤충 (그림 2 O)를 들어 올립니다. 필요한 경우, 상기 흡입 장치로부터 진딧물의 리프팅을 돕기 위해 잘 브러쉬를 사용한다.
참고 : 배선 B를 그들은 그것 복부 습식 접착제의 방울을 도포 한 후에 해제되지 않도록 충분한 그립 진딧물을 제공 거친 표면이 정밀 실험실 조직편에 배선 될 수 brassicae는 진공을 필요로하지 않는다. 접착제 건조 후 하나는 미세 브러시의 도움으로 조직의 진딧물을 올릴 수있다. - 스티로폼으로 유선 곤충 황동 핀을 삽입하고 필요한 경우, 계속모든 다른 곤충을 배선하는 EPG 기록 세션을 위해 사용된다.
참고 : 진딧물 배선에 대한 이러한 프로토콜은 우리를 위해 잘 작동합니다. 사용자는 진딧물을 배선 그 / 그녀의 자신의 방법을 찾을 수 있습니다.
- 4 단계.
- 비전 도성 지원에 패러데이 케이지 (그림 2P)에 식물을 넣어 : 페트리 접시 또는 유리 또는 플라스틱 접시를 사용합니다.
- 각 포트의 토양에 식물 전극을 삽입합니다. EPG 프리 앰프 (그림 2 분기)의 입력 커넥터에 유선 곤충의 황동 핀을 삽입합니다. 주 : 토양 전극은 다른 전기 생리 학적 기술에서 사용되는 접지 전극에 대응하지 않는다. 그것은 조정 전극 분극 전압을 보상하기 위해 필요한 전압 오프셋을 갖는다.
- 100 Hz에서의 고정 된 샘플 주파수와 수집 소프트웨어 탐침의 +의 인터페이스에서, 파일 이름을 입력 녹화 시간을 지정하고, 실험의 세부 사항을 지정하는 텍스트를 작성 (처리, 공장 / INSE 주석 행 2 및 3 종의 CT 등)를 포함한다.
- 식물의 적절한 착륙 지점에 곤충을 내리고 수집 소프트웨어 (탐침 +) 인터페이스의 시작 버튼을 클릭하여 레코딩 세션을 시작합니다.
주 1 : 8 채널의 최대가 설정 EPG에서 동시에 사용할 수 있습니다. 한 EPG 전극 또는 식물 당 여러 EPG 전극이 사용될 수있다.
주 2 :이 연구의 초점은 진딧물 문제가있을 때, 제 식물 침투 활동 누락 방지하기 진딧물의 식물 액세스하기 전에 녹화를 시작한다. - 자극에 SE들의 전기 생리 학적 반응을 연구, 진딧물는 진딧물이 지속 체관부 섭취 상에 있는지 확인하기 위해, 사부 상에 입력 된 후 적어도 10 분간 기다린 신호 기준선은 안정된다. 그런 다음에야, 모든 식물 자극 실험을 시작합니다.
tp_upload / 52826 / 52826fig2.jpg "/>
그림 2. 전기 침투 그래프 (EPG) 레코딩을위한 진딧물이나 다른 hemipteran 곤충과 EPG 전극을 만들기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
패널 AI, 공정을 EPG 전극 마이너스 진딧물을 제조 하였다. 먼저, 납땜 볼트 (A)의 선단부에 납땜 금속 조각을 용융. 그리고, 납땜 유체 (B)의 저하에 황동 핀의 헤드를 담그고, 및 인두 팁 볼트 (C)에 용융 금속으로 문의. 이 단계 후에 즉시, 황동 핀 (EF)의 헤드에 접착제를 위해, 납땜 볼트의 선단에 구리 와이어의 단부에 문의. 메스 또는 블레이드, 골드 와이어 (G)의 조각을 잘라. 딥실버가 건조하기 전에 프리 실버 접착제 (H)에 대한 (황동 핀 타단에 결합) 구리 와이어의 단부, 신속는 (I)에 금선 가입. 금선이 우수한 도체이고, 편파 될 수있다. 실제로, 대부분의 경우에, 편광을 검출하기에는 너무 작고, 그래서 경우, 오프셋 전압 (V)로 보상 될 수있다.
패널 조, 전극에 진딧물 (또는 다른 hemipteran 곤충)를 연결하는 데 필요한 단계. 첫째, 신중하게 잘 수채화 브러시와 진딧물을 들어 올려 진공 흡입 장치 (J)의 개통에 놓습니다. 진공 펌프를 켜고 흡입을 적용 할 종이와 공기 밸브 구멍을 커버합니다. 실버 접착제 (K)에 곤충 핀의 끝을 찍어, 및 실체 현미경 (LM)에서, 진딧물의 복부 위에 작은 접착제 방울을 넣어. 내실버 접착제가 될 때까지 다음 ~ 20 초, 진딧물 마를에 실버 접착제 방울 전에, 실버 접착제의 젖은 방울에 곤충 전극의 골드 와이어의 끝을 넣고 1-3 분 동안 장소에 보관 완전히 공기 건조 (N). 이때, 흡인 장치에서, 흡입 장치의 공기 밸브 구멍을 덮는 신중 진딧물 제거 종이 조각을 제거하여 흡인을 해제 : 배선 후 진딧물 리프팅 종종 미세 브러쉬에 의해 도움을 필요 (O).
패널 P는 전체 EPG의 개요는 패러데이 케이지 내부 설정을 보여줍니다, 그리고 패널 Q는 EPG의 식물 진딧물 조합의 개요를 보여줍니다. 이 과정에 대한 자세한 설명은 위의 3 항을 참조 할 것.
: : 작은 글자 하나 EPG 전극을 만들 필요가있는 항목을 참조하는 레이블 납땜 볼트를, B : 납땜 금속을 용융;C : 납땜 유체를, D : 황동 커넥터 핀 (못) E : 구리 와이어, F : 오 18μm 골드 와이어; G : 흡입 장치, H : 진딧물, I : 수성은 접착제를, J : 패러데이 케이지, K : 식물 전극; L : EPG 프리 앰프의 입력 커넥터 (BNC).
결과
이전의 연구에서는 발작 애벌레 일 동안 midvein의 SE들에서 생성 된 전기 신호의 특성의 목적 EPG 전극 기술을 구현 하였다. 그것은 이러한 기술을 구현하기 위해 필요에 따라서 고정 의무, SE-조밀하고 비교적 견고하므로 midvein는, 종래의 유리 전극 용뿐만 아니라, 유리 탐침 전극 용 바람직한 삽입 부위이다. 여기, 우리는 잎의 가장자리 정맥에 그 특히, SE들에 액세스하는 것이 더 어려운에?...
토론
이 문서에서는 전기 침투 그래프 (EPG) 녹음을 만들기위한 상세한 프로토콜을 제공합니다. EPG 기술은 물론 전 세계적으로 100 ~ 200 활성 사용자와, 설립하고, 예를 들어 서로 다른 주제에 대한 많은 연구, 구현되었습니다) 진딧물과 다른 탐침 베어링 곤충 (13)에 대한 호스트 공장 저항; b)는 식물 바이러스 및 병원균 전송 메커니즘 (14); 행동의 C) 살충제 모드 (독성과 행동의 변화) (...
공개
WFT launched EPG Systems as a retirement activity, and is affiliated with it financially.
감사의 말
VSR은 IIF 마리 퀴리 그랜트에 의해 지원되었다 (지구 상처, 약어에 대한 : 상처 애기 장대에서 전기 신호를 유도).
자료
| Name | Company | Catalog Number | Comments |
| Brass connector pins | EPG Systems/hardw.shop | Φ 1.2 mm | |
| Thin copper wire | EPG Systems/hardw.shop | approx. Φ 0.2 mm | |
| Thin gold wire | EPG Systems | Φ 18 µm | |
| Soldering fluid | hardware shop | matching the soldering wire | |
| Resin-cored soldering wire | hardware shop | ||
| Styrofoam | any | ||
| Water-based silver glue | EPG Systems | recipe in: www.epgsystems.eu | |
| Paper wipes | Kimberly-Clark | 5511 | |
| Soldering bolt | any | ||
| Stereomicroscope | Hund Wetzlar | minimum magnification is 10X | |
| Small scissors | Fine Science Tools | 14088-10 | |
| Scalpel | Fine Science Tools | 10050-00 | |
| Fine forceps | Fine Science Tools | 11231-20 | |
| Vortex | A. Hartenstein | L46 | |
| Watercolor brushes | any | Number 1 or 2 | |
| Air suction device | see description in: www.epgsystems.eu | ||
| Insect pins | any | No. 1 or 2 | |
| Solid table | |||
| Faraday cage | Hand made | ||
| Computer | Fujitsu Siemens | ||
| Data acquisition software | EPG Systems | Stylet+d | |
| Giga-4 (-8) Complete System | EPG Systems | ||
| includes the following: | |||
| Main control box with USB output | Di155/Di710 | 12/14 bit, rate 100 Hz (softw. fixed) | |
| EPG probes 4 (8) | 50x DC pre-amplifier | ||
| Swivel clamps on rod | |||
| DC power adaptor | bipolar, 230/115 VAC to -/+8 VDC | ||
| Plant electrodes and cables | |||
| Additional test and ground cables |
참고문헌
- Salvador-Recatalà, V., Tjallingii, W. F., Farmer, E. E. Real-time, in vivo. intracellular recordings of caterpillar-induced depolarization waves in sieve elements using aphid electrodes. New Phytologist. 203 (2), 674-684 (2014).
- Van Bel, A. J., Knoblauch, M., Furch, A. C., Hafke, J. B. (Questions)n on phloem biology. 1. Electropotential waves, Ca2+ fluxes and cellular cascades along the propagation pathway. Plant Science. 181 (3), 210-218 (2011).
- Rhodes, J. D., Thain, J. F., Wildon, D. C. The pathway for electrical signal conduction in the wounded tomato plant. Planta. 200, 50-57 (1996).
- Fromm, J., Eschrich, W. Correlation of ionic movements with phloem unloading and loading in barley leaves. Plant Physiology and Biochemistry. 27, 577-585 (1989).
- Brette, R., Destexhe, A., Brette, R., Destexhe, A. Intracellular Recordings. Handbook of Neural Activity Measurement. , 44-91 (2012).
- Umrath, K. Untersuchungen über Plasma und Plasamstromung an Characeen. IV. Potentialmessungen an Nitella mucronata. mit besonderer Berücksichtingung der Erregungserscheinungen. Protoplasma. 9, 576-597 (1930).
- Umrath, K. Der Erregungsvorgang bei Nitella mucronata. Protoplasma. 17, 258-300 (1932).
- Carden, D. E., Walker, D. J., Flowers, T. J., Miller, A. J. Single-cell measurements of the contribution of cytosolic Na+ and K+ to salt tolerance. Plant Physiology. 131 (2), 676-683 (2003).
- Miles, P. W., McLean, D. L., Kinsey, M. G. Evidence that two species of aphid ingest food through an open stylet sheath. Experientia. 20 (10), 582 (1964).
- McLean, D. L., Kinsey, M. G. A technique for electronically recording aphid feeding and salivation. Nature. 202, 1358-1359 (1965).
- Tjallingii, W. F. Electronic recording of penetration behaviour by aphids. Entomologia Experimentalis et Applicata. 24, 721-730 (1978).
- Tjallingii, W. F. Membrane potentials as an indication for plant cell penetration by aphid stylets. Entomologia Experimentalis et Applicata. 38, 187-193 (1985).
- Alvarez, E. E., et al. Comparative analysis of Solanum stoloniferum. responses to probing by the green peach aphid Myzus persicae. and the potato aphid Macrosiphum euphorbiae. Insect Science. 20 (2), 207-227 (2013).
- Carmo-Sousa, M., Moreno, A., Garzo, E., Fereres, A. A non-persistently transmitted virus induces a pull-push strategy in its aphid vector to optimize transmission and spread. Virus Research. 186, 38-46 (2014).
- Jacobson, A. L., Kennedy, G. G. Electrical Penetration Graph studies to investigate the effects of cyantraniliprole on feeding behavior of Myzus persicae. (Hemiptera: Aphididae) on Capsicum annuum. Pest Management Science. 70 (5), 836-840 (2014).
- Morris, G., Foster, W. A. Duelling aphids: electrical penetration graphs reveal the value of fighting for a feeding site. Journal of Experimental Biology. 211 (9), 1490-1494 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유