Method Article
健康と負傷ゼブラフィッシュ脳の大規模な走査型透過電子顕微鏡(Nanotomy)
要約
Large-scale 2D electron microscopy (EM), or nanotomy, is the tissue-wide application of nanoscale resolution EM. Here we describe a universal method for nanotomy applied to investigate the zebrafish larval brain in health and upon non-invasive brain injury.
要約
大規模な二次元電子顕微鏡(EM)、又はnanotomy、ナノスケールの分解能電子顕微鏡の組織全体のアプリケーションです。その他、我々は以前にヒトの皮膚膵島、組織培養および全ゼブラフィッシュ幼生1-7に、大規模なEMを適用します。ここでは、サブ細胞および分子機能の公正な検出のための組織規模スキャンEMのための普遍的に適用する方法について説明します。 Nanotomyは健康および神経変性ゼブラフィッシュ脳を調査するために適用されました。我々の方法は、標準化されたEM試料調製プロトコルに基づいています:固定グルタルアルデヒドとオスミウムと、エポキシ樹脂の埋め込みに続いて切片とウラニルとリード付きポスト染色に続いて1ホールのグリッド上の超薄切片、の実装極薄。大規模な2D EMモザイク画像は、走査透過EM(STEM)を用いて、外部の大面積スキャン発生器に接続された走査EMを使用して取得されます。 50 G画素I - 大規模EM画像は、典型的には〜5ですn個のサイズ、最高のオンライン地理的なHTMLマップに似た任意のWebブラウザで開くことができるズーム可能なHTMLファイルを、使用して表示。この方法は、(ヒト)の組織、動物全体の断面、ならびに組織培養1-5に適用することができます。ここでは、ゼブラフィッシュ脳を非侵襲的神経切除モデルで分析しました。私たちは、1つのデータセットの組織、ニューロンおよびミクログリアを含む種々の細胞型に定量することができる細胞および細胞内の変化、脳のマクロファージ内で可視化します。大きな表面積は、以前に蛍光顕微鏡を用いて画像化されるように加えて、nanotomyは同じ組織で8(クレム)光学顕微鏡を用いてEMの相関関係を容易に、その後ナノ解剖(nanotomy)、その結果、大面積EMに供することができるの組織。すべてでは、nanotomyは、組織全体の定量化可能な方法でのEMレベルでの機能の公正な検出を可能にします。
概要
最近の技術開発は、超微細構造解析の復活につながる、EMの汎用性、適用性および定量的性質を改善しています。進歩はEMレベル8-10に直接顕微鏡分析の他のモードを比較するために3D EM、大規模な2D EMと相関光学顕微鏡および電子顕微鏡のための改良された方法および試薬(CLEM)が挙げられます。大規模な2D EMは、定量化またはヒト病理のための(新規の)疾患の特徴を識別し、疾患および組織培養モデルの動物モデルを研究するために特に適しています。ビューの一般的に小さなフィールドには、組織全体の規模に高倍率での変化を相関させるだけでなく、unbiasedlyかつ定量的超微細構造の特徴を解析することは困難です。
ヒト組織または動物モデルにおいて病状の評価、ヘマトキシリンおよびエオシン(H&E)着色包埋ホルマリン固定パラフィン切片(FFPE)TISの病理学的分析のためにスーは標準です。単純なH&E染色の免疫標識の他にも、病的異常を識別するために行われます。このような組織は、EMレベルで特定の細胞型を分析することができ、細胞内変化を同定することができる。場合大規模EMの公平な性質は、病気の予期しないと新規な特徴を見つけることができます。大規模EMによって平方ミリメートルまでの領域を可視化することができます。我々と他の人は、以前膵島4、細胞培養2、ラット脳3、皮膚や粘膜7と全体ゼブラフィッシュ幼生1,5(www.nanotomy.org)をラットにするnanotomyを適用しました。ゼブラフィッシュ特に脳免疫細胞11を含めた哺乳動物の組織中のアクセスが困難な細胞タイプを可視化するために、 インビボイメージングのために非常に適しています。ここでnanotomy手順は、ニューロンによってメトロニダゾールの変換によって条件神経切除を受けているゼブラフィッシュヘッドの冠状切片に適用され、詳細に記載されていますニトロレダクターゼ(www.nanotomy.org)5,12-14を表明しました 。すべての生データは、組織規模の変化の分子可視化、ズーム可能なHTMLファイルとして表示されます。生データの提示は、世界中の専門家による他の角度からのデータセットの公平な分析を可能にします。
プロトコル
ゼブラフィッシュの幼虫を持つすべての実験は、国内およびEUのガイドラインに従ってフローニンゲン大学の動物実験委員会によって承認されました。
1.試料の調製
- 固定と埋め込 み
- 固定
- トリカイン(0.003%)で稚魚をAnaesthetizeを静かに突っついによってE3(5のNaCl、0.17のKCl、0.33mMのCaCl 2を、0.33 mMのMgSO 4を、10mMのHEPES、pHは7.6)、麻酔の深さのためのゼブラフィッシュの水とテストに追加しました解剖顕微鏡下で200μlのピペットチップを用いて動きはもはや( 図1A)が検出されなくなるまで。
- 説明したようにアガロース1.8%で共焦点または2光子イメージングを使用してインビボ撮像データに取得した後に相関EMのためにサンプルを処理する場合、アガロースで5,15修正幼虫は、トリトンX-100(0.05%)を含有するPBS中4%PFAを用いました。
- アガロースおよびプロセスのための幼虫をカット大規模なEM 5。
- プラスチックチューブで、室温で2時間、トリトンX-100を含むPBS中で新鮮な4%パラホルムアルデヒド(0.05%)で幼虫を修正しました。
注:次のステップ(1.1.1.5)で説明したように( インビトロで )培養物中で増殖させた細胞は、直接、グルタルアルデヒドで固定することができます。 - 溶液を除去し、100μlの0.5%PFA、2%グルタルアルデヒド(GA)、および0.1 Mカコジル酸ナトリウム(pH7.4)に追加します。 4℃で一晩保管してください。 0.1 Mカコジル酸ナトリウム中で二回サンプルを洗浄します。
- オスミウムの浸透を容易にするために、後脳に吻方幼虫の頭をカットします。細かいシリンジ/鉗子を使用してください。
- 2時間氷上で0.1Mのカコジル酸ナトリウム中の1%四酸化オスミウム(OsO 4)/1.5%フェロシアン化カリウムの、Postfixの幼虫(K 4 [Fe(CN)6]を)および二重蒸留H 2 Oで3×5分間のすすぎ
- エタノール濃度の増加で20分間のインキュベーション(50%、70%、3回、100%)をエタノール中で脱水します。
- 埋め込 み
- EMラボで使用される標準的なレシピに応じて、エポキシ樹脂を準備します。
注:次のように私たちは、エポキシ樹脂を使用する:19.8グラムのglycidエーテル100、磁気撹拌機を用いて、9.6グラムの2-ドデセニルコハク酸無水物及び11.4グラム化メチル無水物を混ぜます。 0.5グラムDMP-30(トリス - (ジメチルアミノメチル)フェノール)を追加し、再び混ぜます。 - (RT)を回転させながら(v / v)エタノール中の50%のエポキシ樹脂中に幼虫一晩インキュベートします。
- 純粋な樹脂で希釈したエポキシ樹脂を交換してください。 、30分間インキュベートし、再度新たな樹脂を添加し、さらに30分間インキュベートします。再び樹脂をリフレッシュした後、58℃で15分間、低圧(200ミリバール)下、室温でさらに1時間、続いて室温で3時間を、インキュベートします。
- オリエント針を使用して、解剖顕微鏡の下で市販されているシリコンフラット埋め込み金型で頭や金型の側を向い前方にまたは必要に応じて爪楊枝します ( 図1B)。
- エポキシ解像度を重合58℃で一晩インチエポキシ樹脂である場合は、まだ柔らかすぎ別の日が重合し、58℃で硬化することができます。ピンセットを使用して圧力を印加することにより、試験剛性。これは簡単にインデントを残す場合は別の日には重合し、58℃で硬化することができます。試料が完全に硬化されると、トリミングし、切片に進みます。
- ( 図1B)かみそりの刃を使用して、スタブから余分な樹脂を切り落とします。
- EMラボで使用される標準的なレシピに応じて、エポキシ樹脂を準備します。
- 固定
- 、セクショニング対照的な、および取り付け
- セクショニング
- ウルトラミクロトームを用いて、セクションエポキシ樹脂ブロック。
- ガラスナイフやトルイジンブルー/塩基性フクシンのための半薄切片(500 nm)をカットするダイヤモンドhistoknifeを使用します( 図1D)右の位置を検出するために染色します。
- その先端火炎中で溶融して閉じられたガラスパスツールピペットでそれらをピックアップして、顕微鏡スライド上の半薄切片を転送します。ホットプレートuの上にドライntilに水が残っていません。ホットプレート上で、そして水ですすいだ後、水に1%トルイジンブルー、1%の四ホウ酸ナトリウムで0.05%塩基性フクシンで10秒間染色で10秒間染色。 40Xに10Xで通常の光学顕微鏡で調べます。
- 脳内の適切な部位/配向に到達すると、超薄切片を切断するためにダイヤモンドナイフを用いてエポキシ樹脂ブロックを区画続ける(〜70nmで、 図1E)
- 超薄切片中に関心領域を識別するために、サンプルを傾けると切片の角度を調整するために、嗅覚ピット、目、グレー白質の境界を含め、中および脳の周りに容易に識別できる解剖学的構造を使用してください。
- シングルスロットL2×1銅グリッド( 図1F)、上のマウント部は、格子バーによって中断されることなく、取得を可能にします。セクションをサポートするためにホルムバールコーティングされたグリッドを使用してください。
- 対照的な
- グリッド上のステイン超薄切片別の2分16レイノルズクエン酸鉛、続いてメタノール中の2%酢酸ウラニルで2分間秒。
- セクショニング
2.画像取得
- 大規模STEM
注:私たちは、STEM検出を用いた高解像度3,5,7,17 で、ビューの複数の大規模なフィールドを取得することができる外部スキャン発生器をスキャンEMを使用しています。典型的に、一つの画像は、この方法はかなりのステッチの量を減少させる、〜100透過型電子顕微鏡(TEM)画像の視野に相当する生成されました。- 顕微鏡でサンプルをマウントします
- 複数のグリッドサンプルホルダ内のセクションにグリッドを配置し、SEMのチャンバーに移します。
- STEM検出器のアライメント
- ビームの下でサンプルとグリッドを入れて、それは約になりますので、それを上に移動。レンズポールから5ミリメートル。使用して20 kVので画像を取得レンズ内検出器。
- グリッドのエッジに集中し、4.0ミリメートルに作動距離を調整します。
- 安全な位置に試料ホルダーを移動し、STEM検出器をもたらします。
- インレンズ検出器を用いて、最大速度で撮像しながら調整ネジを回すことで、画像フィールドにSTEM検出器の穴を中央に配置します。
- 慎重にちょうどレンズの極と検出器との間に収まるように試料ホルダーを戻します。
- 断面積になるようにしてくださいするには、レンズ検出器を用いて画像を取得します。
- スイッチは検出(利得媒質と「マイナス」に設定されているすべての象限)をSTEMと画像を取得し、スキャンする領域を選択します。
- 21 kVのに加速電圧を上げて(再び安定した画像)ビームの安定化を待ってから、2 kVのステップで29 kVのに行きます。
- 画像を取得します
- サンプルを予め照射ズーミングによって、(電子ビームによる輝度の変化を防止するため)スキャンする完全な領域ので、外画像ウィンドウにフィットします。
- (検出器利得が1ステップを小さくする必要があり、適切なダイナミックレンジを維持するために)120μmの開口部を変更します。
- デフォーカス画像がぼやけるようにします。
- 小面積のスキャンオプションを使用して、可能な限りタイトな走査領域を作成します。
- フレームは、約に走査されるように設定されたスキャン速度。 1から2秒。
注意:サイズや組織に応じこれは、一般的に取る½時間(100×100μmのFOV)を最大3時間(千×500ミクロン)に。 - 少なくとも100Xでのズームと10秒間小さな領域をスキャンします。
注:この領域は、その周囲の、照射前に比べて明るさを変更しない場合には、十分なものです。 - 30μmの開口部を連れ戻す(とメディア益をSTEM)
- サンプルを集中します。
- ワブラー(〜40,000Xの倍率で)を使用して、開口部の位置を合わせます。
- 焦点で最も明るいエリア/機能を選択しながら、スキャン速度を設定するような詳細こと表示されています。
- 顕微鏡ソフトウェアで慎重にダイナミックレンジ内のすべてのピクセルを維持するためにヒストグラムを見ながら明るさとコントラストを調整します。最も暗いエリア/機能についても同じ操作を行います。
- 明るい領域に戻り、もう一度確認してください。ヒストグラムの両側にいくつかのスペースがあるので、安全側にあります。
- スキャンする完全な領域が撮像窓に合うようにズームアウト、および大面積取得プログラムを起動します。
- 画面からエリアを選択して、モザイクを設定するためのウィザードオプションを使用します。詳細は必要であるかに応じて、5 nmの - ピクセルサイズ2を使用してください。 STEMのための滞留時間を3マイクロ秒を使用してください。
- オプションを選択 "前のタイル上のオートフォーカス」、「実行前に設定を確認します」とどこにデータを保存するために定義する]チェックボックスをオンにし、デフォルトの会社の設定で大規模な収集ソフトウェアのオートフォーカスを使用しています。
- 押して、顕微鏡の設定を確認するために「最適化」。
注:今必要な時間は、SHになります自分の。これは、1×0.5ミリメートルの領域の場合は最大72時間であるかもしれません。 - ウィンドウ「最大タイル解像度」タイプ20,000ので、個々のタイルは鈍いエッジ効果を防止することで、x 20K 20Kよりも大きくなりません。押して「実行」。
- フォーカス、明るさ/コントラスト(B / C)をチェックするように求められたときは、外部スキャン発電機のスイッチをオフにし、慎重に顕微鏡ソフトウェアにフォーカスし、非点収差を調整します。 B / Cを変更しないでください。
注:ステージを移動することができ、倍率が変更されたが、倍率はバック所望の画素サイズに設定する必要があります。 - 再び外部スキャン発生器のスイッチを押し、「継続」。
- 顕微鏡でサンプルをマウントします
3.データ解析
- 大規模EMファイルビューアプログラムを開き、ファイル "モザイク情報」を開きます。これは、すべてのタイル張りのTIF-ファイルを開きます。これは、好ましくは、新たな取得を妨げないように、別のワークステーション上で実行されます。
- オプション 'AUを選択してください(パラメータは、ズーム、場合ステッチ基準は満たすことができない。閾値0.90、自動ノイズリダクションをステッチ、半分にモードをオーバーラップし、手動位置にタイルを配置し、「そのまま続ける」をクリックしてください)全体モザイクをステッチします。
- htmlファイルとして書き出すか、あるいは単一TIFなど。
TIFのための縮小が必要となる可能性があるエクスポートすることに注意してください。後で測定を可能にする、ファイル名の最後のピクセルサイズを含めます。 - 画像編集プログラムでそれを開くことにより、TIFファイルに注釈を実行します。並行して、最適な分解能観察用のWebブラウザでズーム可能なhtmlファイルを開きます。
結果
1週齢のゼブラフィッシュの幼虫の頭部の冠状断面の大規模EMデータセットは、単一の大規模な画像(www.nanotomy.org)で、多くの組織および細胞の特徴を示しています。
コントロール脳切片のNanotomyは、嗅覚繊維束、ニューロン核とシナプスを含む神経細胞のサブコンパートメント( 図2A、www.nanotomy.org)を含む吻側前脳の神経組織の典型的な超微細構造の特徴を明らかにする。区別することができる頭の中で細胞型は下顎の大きな液胞、嗅神経細胞のオスミウム親和性のミエリン、小血管の内皮細胞と軟骨細胞を含む、構造体は髄膜(髄膜のゼブラフィッシュの対応、膜状層の収容を含みます哺乳類の脳)。細胞内構造は、異なるセルにおける表皮の糖衣、異なる核形態および病巣を含みますゴルジ体、小胞体(ER)、ミトコンドリアおよびシナプス小胞とシナプス後密度を含むリットルタイプと細胞小器官。
予想外に心室の内側を覆う細胞の核は、脳内のより横方向に分散させ、他の細胞と比較して非常に高電子密度です。さらに、これらの心室の核は、脳内の他の細胞に存在しない暗い病巣を示し、貪食ミクログリアの核で発見されたヘテロクロマチン、( 図2)から大きさや構造に異なる表示されます。ゼブラフィッシュの開発に心室の内側を覆う細胞は、より分化した細胞よりも変化したクロマチンの状態を反映している可能性がある、主に放射状グリア細胞や神経前駆細胞が含まれます。組織中の幹細胞は、一般的に非常に稀であるので、組織スケールEMで幹細胞マーカーのための組織の標識を相関させるnanotomyしたがって、幹細胞の超微細構造の特徴を識別するために使用することができます。
ve_content:神経切除を受けたゼブラフィッシュ幼生における冠状断面の「FOキープtogether.withinページ= "1">大規模EMは(www.nanotomy.org)見られない多くの特定の組織、および細胞および分子の特徴を明らかに対照動物に。携帯電話の機能が貪食ミクログリアを含み、おそらく死細胞( 図2B、www.nanotomy.org)を表す、細胞の大きさを液胞。以前EM研究は、脊椎動物18,19にミクログリアを同定した。ミクログリアの特徴は、細長い核を含みます、核膜の隣に斑状のクロマチン塊、著名なゴルジ装置、無料のポリリボソーム、粒状の小胞体(ER)細長い嚢、比較的暗い/高密度の細胞質、及びそのような食細胞、脂肪滴およびリソソームなどの多数の介在物、と。これらのすべての哺乳動物組織におけるミクログリアに起因する顕著な特徴は、また、ゼブラフィッシュ脳( 図2B、www.nanotomy.org)にこれらの細胞で発見されました。 <キープtogether.withinページ= "1">:FO Pクラス= "jove_content"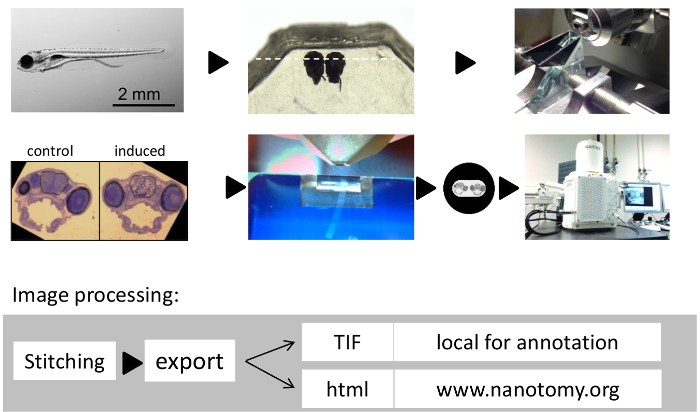
図1:ゼブラフィッシュの脳に大規模な組織電子顕微鏡のワークフロー。 (A)7日齢のゼブラフィッシュ幼虫。(B)エポキシ樹脂に並んで埋め込 まれたゼブラフィッシュ幼虫の頭。半切片標本を配向-thinための(C)ガラスナイフ。(D)2を示す代表的半薄トルイジンブルー染色したセクションサイド・バイ・サイド組み込みゼブラフィッシュの幼虫。極薄(70 nm)のセクションをカットする(E)ダイヤモンドナイフ。(F)編集した画像位置を示すために、1穴グリッド上の全体のゼブラフィッシュの幼虫の脳切片の(D)。(G)で本研究では、大規模な2D EMのために使用される顕微鏡システム。画像処理の(H)の流れ。 こちらをクリックしてくださいこの図の拡大版を表示します。
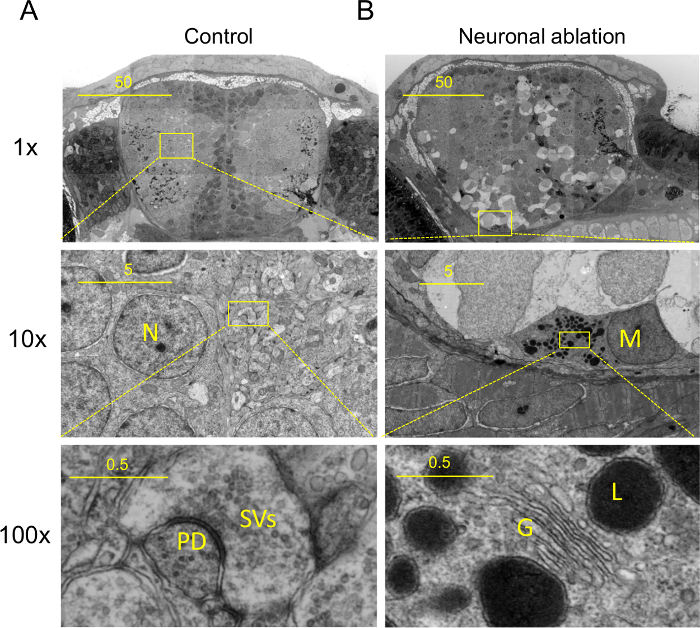
。 図2:Nanotomy 結果:高分子由来の組織に処理された7日後の受精制御および(B)の脳の(A)Nanotomy(神経アブレーション; 図1)、神経細胞に特有の特徴を示すが、脳変性をアブレーション(B)これらの細胞死および神経組織((A)及び(B))のスポンジ状の外観を受ける食ミクログリア、暗い細胞が含まれます。 (5から適応)アッパーパネル:中央のパネルに示された領域の10X拡大図。中央のパネル:下のパネルに示された領域の10X拡大図。 (A、下パネル)、シナプス小胞(SVの)にシナプスを示す神経網の(A、中央のパネル)高倍率ビューとシナプス後密度(PD)。 (B、中央のパネル)高倍率アメーバミクログリアのビューまたはおそらく著名なゴルジ装置(G)、リソソーム液胞(L)を含む介在物を含む典型的なアメーバミクログリアの機能(下のパネル)を示すマクロファージ(中央のパネル、M)。スケールバー:50μmの(上)、5ミクロン(中央)と0.5ミクロン(下)。この図は、5から変更されている。 この図の拡大版を表示するには、こちらをクリックしてください 、または完全なデータをオンライン(nanotomy.org)をご覧ください。
ディスカッション
EMは、生物学的状況における巨大分子の高分解能イメージングと細胞の状況の分析を可能にします。しかし、これは、典型的には、視野を制限します。大規模3D EMは、複雑なデータ処理10を必要とする 、ナノスケールの分解能を3次元再構成を作成することによって、神経接続をマッピングするのに特に適しています。対照的に、2D大規模EMは、画像データの単一の部分とステッチを必要とし、データの評価は、インターネットブラウザへのアクセスを誰でも可能です。我々と他の人は、以前の組織および動物全体を分析するために大規模なEMを使用します。ほとんどのアプローチとしては、TEMおよびSEMベースのステッチは、独自の利点を持っています。ここで、走査透過EM(STEM)は、高解像度で大きな視野の生成を可能にしました。典型的には、1つのSTEM像は、大規模な金融商品取引法を撮像する際に著しくステッチの量を減少させる、約100 TEM画像の視野に相当します高解像度でのビューのDS。より高い解像度が必要な場合は、TEMは、有利であり得ます。 STEMは、非対照試料は、良好な超コントラスト6を使用することができることを、TEMを上回る利点を有します。
さらに、ここに記載された方法は、単にセクションの後方散乱電子検出器(BSD)で使用するために調整することができる複数の顕微鏡システムに使用を広げ、シリカウェーハ上に取り付けられています。 HTML-ズーム可能な組織EMファイルには、患者のデータを分析するために、科学的研究にLMとEMデータ(CLEM)8、プレゼンテーションの目的を組み合わせ、その完全なコンテンツに分析されていない可能性があり、データを共有し、教育のために、定量化のために非常に有用です。 BSDを使用することができる、より一般的に検出ステムよりも走査型電子顕微鏡で使用可能である。代替的に、SEMの大規模EMではなく、TEMで、シリカウェーハは、2つの主な利点を有し、使用することができます。第二に、大規模なセクション(> 1mmの2分野の取り付け関心は)簡単です。シングルスロットグリッド上にマウントすると、労働集約的で技術的に困難です。 TEM、SEMおよびSTEMの間の詳細な比較は、他の場所で6詳述されています。 BSDイメージングの欠点はSTEMに比べて、画像にノイズが増加している、ということです。これは、部分的にはるかに長い取得時間をもたらす、ピクセル滞留時間を増加させることによって補償することができます。
サンプル調製比較的標準EM処理(固定、包埋および切片)のための5-7を必要とされるが、アーティファクトを完全に欠い大超薄切片をカットすることは技術的に困難です。セクションは、非常に脆弱であり、容易に破損、折ったり、典型的には、データセットごとに複数の時間を要するイメージング、中に破壊されています。しかし、生の公平なデータのオンライン共有のために、それが公表されたデータに、より容易に比較することが可能になるはずであり、コントロールとしてオープンドメインで公開されたデータセットを使用します。現在、ラすることのできる、いくつかのEMデバイスRGE規模解析に使用されている、最もイメージングセンターは共同の努力を歓迎するものの、したがって、この技術へのアクセスは、やや限られています。
大規模なセクションのために組織を適切にサンプル全体に固定されなければなりません。それは高速だが、中程度の固定剤PFAの混合物は遅いが強力な固定液GAとの組み合わせで使用されている理由です。アーティファクトなしで大規模なセクションを切断し、ピックアップすることは困難です。 BSDとの組み合わせでウェハを操作する単一の穴グリッド上のセクションを集めるに比べて容易です。ヘビーメタルポスト染色は、古典的なEMに比べてより重要です。セクション全体が撮像されているので、すべてのアーティファクトが表示されます。 TEMのユーザーは、典型的には、それが困難なため、顕微鏡操作の違いにより、SEMへの切り替えを見つけます。
定量化とデータ共有 -細胞内の機能を定量化は、単一のEM画像では困難です。大規模のでズームイン、ズームアウトする可能性画像は容易に細胞内でナノスケールの測定を続けることができ、目的の細胞の同定を可能にします。これらのデータセットは、特定の細胞型が急速に異なるスケールで検出可能な特徴に基づいて、これらの大規模な組織切片における公平な方法で識別し、定量化することができることを示しています。例えば、ミクログリアは、その形態と密な細胞質に基づいて同定することができます。我々は以前に大規模なEM組織培養セット2内のERの幅のために示したように続いて、個々の細胞上でのズーミングに際して、これらの細胞のナノスケールの細胞内および分子的特徴は、同じデータセット内で測定することができます。 nanotomyのさらなる利点は、オンライン、大規模なデータセットのホスティングをするかもしれない他の機能のために、他の人がデータを検査することを可能にし、新たな仮説に彼らの結論を引き出すことです。
CLEMは -定量的なEMを容易にすることに加えて、大規模なEMは、それが簡単に光microscoを相関させることができますEMレベル8にPIC標識。本実施例ではゼブラフィッシュ切除モデルにおける貪食ミクログリアの存在が示されています。神経科学の主要な質問は、個々の機能と貢献は、ミクログリアおよび貪食細胞および免疫細胞の潜在的な他の源であるものです。初期のEM研究は、病気18ミクログリアの特徴的な細胞内の特徴を示しています。残念ながら、それは、遺伝子発現、形態および機能における他の免疫細胞との大きな重なりを示すように、病理学的設定において特にミクログリアを選択的に標識することが困難です。したがって、それは不明であるかどうか、および超微細構造レベルでのミクログリアは、マクロファージ浸潤単球由来を含む他のソースからの免疫細胞と異なるとき。これらの細胞間の超微細構造の違いがあるかどうかを理解することは、機能の違いを分析するための出発点を提供します。選択的遺伝子導入または発現マーカーを組み合わせるとCLEMはDETを許可します特定の集団に対して選択的超微細構造の特徴のection。
診断&プレゼンテーションと教育 - 1つのデータセットEMデータ内にマイクロナノスケールを可視化することで大幅に広い聴衆に促進されます。相関と大規模なEMのための増加の可能性とツールにより、私たちは基本と医学研究におけるEMの復活を期待しています。ここで示される手法は、ゼブラフィッシュ脳損傷モデル5に適用されるが、糖尿病4のための細胞培養2のラットモデルにおいて、ヒト組織7、ラット脳3で使用されており、また、TEMと組み合わせて使用することができますこの方法の汎用性を示すベースのアプローチ1。顕微鏡のオペレータは、もはや高度に選択されていない、ので、バイアスされた画像が、すべての多数の超微細構造の特徴を記録し、世界的な分析のために開いている記録されています。
開示事項
著者らは、開示することは何もありません。
謝辞
仕事の大半はNWO 175-010-2009-023とZonMW 91111006が主催してUMCG顕微鏡およびイメージングセンター(UMIC)で実施されています。 BNGGへSTW「顕微鏡バレー12718」。この作品はTJvHにZonMW VENIの助成金、(瀕死ニューロンを保存)マリー・キュリーのキャリアの統合助成金およびアルツハイマーオランダの交わりが主催しました。
資料
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| low melting point agarose | VWR | 444152G | |
| tricaine | Sigma | E10521 | |
| triton-X-100 | Sigma | X100 | |
| glutaraldehyde | Polysciences | 1909 | |
| sodium cacodylate | Sigma | C0250 | |
| osmium tetroxide | Electron Microscopy Sciences | 19114 | |
| potassium ferrocyanide (K4[Fe(CN)]6) | Merck | 4984 | |
| ethanol | VWR | 20821.365 | |
| uranyl acetate | Merck | 8473 | |
| sodium tetraborate | Merck | 1063808 | |
| toluidene blue | Merck | 1273 | |
| basic fuchsin | BDH | 340324 | |
| lead citrate | BDH | discontinued | |
| EPON | |||
| 2-dodecenylsuccinicacid anhydride | Serva | 20755 | |
| methylnadic anhydride | Serva | 29452 | |
| glycid ether 100 | Serva | 21045 | |
| DMP-30 | Polysciences | 553 | |
| standard flat embedding mold | Electron Microscopy Sciences | 70901 | |
| diamond knife | Diatome Inc. | ||
| copper grids | Electron Microscopy Sciences | ||
| double sided carbon tape | Electron Microscopy Sciences | ||
| scanning EM Zeiss Supra55 | Zeiss | ||
| ultramicrotome Leica EM UC7 | Leica | ||
| atlas external scan generator | Fibics |
参考文献
- Faas, F. G., et al. Virtual nanoscopy: generation of ultra-large high resolution electron microscopy maps. J Cell Biol. 198, 457-469 (2012).
- Kuipers, J., et al. FLIPPER, a combinatorial probe for correlated live imaging and electron microscopy, allows identification and quantitative analysis of various cells and organelles. Cell Tissue Res. 360, 61-70 (2015).
- Kuwajima, M., Mendenhall, J. M., Lindsey, L. F., Harris, K. M. Automated transmission-mode scanning electron microscopy (tSEM) for large volume analysis at nanoscale resolution. PLoS One. 8, e59573(2013).
- Ravelli, R. B., et al. Destruction of tissue, cells and organelles in type 1 diabetic rats presented at macromolecular resolution. Sci Rep. 3, 1804(2013).
- van Ham, T. J., et al. Intravital correlated microscopy reveals differential macrophage and microglial dynamics during resolution of neuroinflammation. Dis Model Mech. 7, 857-869 (2014).
- Kuipers, J., de Boer, P., Giepmans, B. N. Scanning EM of non-heavy metal stained biosamples: Large-field of view, high contrast and highly efficient immunolabeling. Exp Cell Res. 15477, 202-207 (2015).
- Sokol, E., et al. Large-Scale Electron Microscopy Maps of Patient Skin and Mucosa Provide Insight into Pathogenesis of Blistering Diseases. J Invest Dermatol. 135, 1763-1770 (2015).
- de Boer, P., Hoogenboom, J. P., Giepmans, B. N. Correlated light and electron microscopy: Ultrastructure lights up! Nat Methods. Nat Methods. 12, 503-513 (2015).
- Lam, S. S., et al. Directed evolution of APEX2 for electron microscopy and proximity labeling. Nat Methods. 12, 51-54 (2015).
- Helmstaedter, M., et al. Connectomic reconstruction of the inner plexiform layer in the mouse retina. Nature. 500, 168-174 (2013).
- Oosterhof, N., Boddeke, E., van Ham, T. J. Immune cell dynamics in the CNS: Learning from the zebrafish. Glia. 63, 719-735 (2015).
- van Ham, T. J., Kokel, D., Peterson, R. T. Apoptotic cells are cleared by directional migration and elmo1- dependent macrophage engulfment. Curr Biol. 22, 830-836 (2012).
- Davison, J. M., et al. Transactivation from Gal4-VP16 transgenic insertions for tissue-specific cell labeling and ablation in zebrafish. Dev Biol. 304, 811-824 (2007).
- Distel, M., Wullimann, M. F., Koster, R. W. Optimized Gal4 genetics for permanent gene expression mapping in zebrafish. Proc Natl Acad Sci U S A. 106, 13365-13370 (2009).
- van Ham, T. J., Mapes, J., Kokel, D., Peterson, R. T. Live imaging of apoptotic cells in zebrafish. FASEB J. 24, 4336-4342 (2010).
- Reynolds, E. S. The use of lead citrate at high pH as an electron-opaque stain in electron microscopy. J Cell Biol. 17, 208-212 (1963).
- Kuwajima, M., Mendenhall, J. M., Harris, K. M. Large-volume reconstruction of brain tissue from high-resolution serial section images acquired by SEM-based scanning transmission electron microscopy. Methods Mol Biol. 950, 253-273 (2013).
- Stensaas, L. J., Reichert, W. H. Round and amoeboid microglial cells in the neonatal rabbit brain. Z Zellforsch Mikrosk Anat. 119, 147-163 (1971).
- Mori, S., Leblond, C. P. Identification of microglia in light and electron microscopy. J Comp Neurol. 135, 57-80 (1969).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved