Method Article
건강 및 부상 Zebrafish의 두뇌의 대규모 스캐닝 투과 전자 현미경 (Nanotomy)
요약
Large-scale 2D electron microscopy (EM), or nanotomy, is the tissue-wide application of nanoscale resolution EM. Here we describe a universal method for nanotomy applied to investigate the zebrafish larval brain in health and upon non-invasive brain injury.
초록
대형 2 차원 전자 현미경 (EM) 또는 nanotomy 나노 스케일 해상도 전자 현미경의 조직 전반의 애플리케이션이다. 기타 우리는 이전에 인간의 피부 췌장 섬, 조직 배양 및 전체 제브라 피쉬 애벌레 1-7로 대규모 EM을 적용했다. 여기에서 우리는 서브 세포 및 분자 기능의 편견 검출을위한 조직 규모 주사 EM에 대해 보편적으로 적용 할 수있는 방법을 설명합니다. Nanotomy는 건강하고 신경 퇴행성 제브라 피쉬의 뇌를 조사하기 위해 적용되었다. 우리의 방법은 표준화 된 EM 샘플 준비 프로토콜을 기반으로합니다 : 고정 글루 타르 알데히드와 오스뮴와, 에폭시 수지 삽입 한 다음 절편과 우라 닐 리드 포스트 염색 한 다음 하나의 홀 그리드에 얇은 섹션, 장착 초박형. 대규모 2D EM 모자이크 이미지 EM 스캔 전송 EM (STEM)를 이용하여 외부의 큰 영역 스캔 발생기에 접속 된 주사를 이용하여 취득한다. 50 G 화소 난 - 대규모 EM 이미지는 일반적으로 5 ~이다n 개의 크기, 최고의 온라인 지리적 HTML지도와 유사한 웹 브라우저에서 열 수있는 줌 가능 HTML 파일을 사용하여 볼. 이 방법은 (인간)의 조직, 간 전체 동물의 부분뿐만 아니라, 조직 배양 1-5에 적용될 수있다. 여기서, 피쉬 뇌 비 침습적 신경 절제 모델에서 분석 하였다. 우리는 신경 세포와 미세 아교 세포, 뇌의 대식 세포 등 다양한 세포 유형으로 정량화 할 수있는 세포 하나의 데이터 집합 조직 및 세포 내 변화에서 시각화. 큰 표면 영역은 이전에 이미징으로 또한 nanotomy 형광 현미경을 사용하여 동일한 조직의 광학 현미경 (클레멘 타인)와 EM의 상관 8 용이이어서 나노 해부학 (nanotomy)의 결과, 대 면적 EM을 실시 할 수있다 조직. 모두에서는, nanotomy는 조직 전체의 정량화 방식으로 EM 수준에서 기능의 편견 검출 할 수있다.
서문
최근의 기술 개발은 미세 구조 분석의 부흥을 선도, EM의 다양성, 적용 및 양적 특성을 개선했다. 진보는 직접 EM 레벨 8-10에 현미경 분석의 다른 모드를 비교하는 3D EM, 대규모 2D EM과 상관 광학 현미경과 전자 현미경 (클레멘 타인)에 대한 개선 된 방법 및 시약을 포함한다. 대규모 2D EM은 계량 또는 인간의 병리에 대한 (소설) 질병 기능을 식별, 질병 및 조직 배양 모델 동물 모델을 연구하기에 적합하다. 때문에보기의 통상적 작은 필드는 조직 대규모로 높은 배율 변화의 상관 관계뿐만 아니라 unbiasedly 정량적 미세 특징을 분석하는 것이 어렵다.
인체 조직 또는 동물 모델에서 병리학의 평가, 헤 마톡 실린 및 에오신 (H & E) 컬러 포함 된 포름 알데히드 고정 파라핀 섹션 (FFPE) TIS의 병리학 적 분석을 위해고소는 표준입니다. 간단한 외에 H & E 염색 immunolabeling는 병리학 적 이상을 식별하기 위해 수행된다. 이러한 조직은 EM 수준, 특정 세포 유형에서 분석 될 수 있다면 세포 내 변화가 확인 될 수있다. 대규모 EM의 편견 특성은 질병의 예상치 못한 새로운 특징을 발견 할 수 있습니다. 대규모으로 평방 밀리미터 EM 영역까지를 시각화 할 수 있습니다. 우리와 다른 이전에 췌장 섬 4 쥐 위해 nanotomy, 세포 배양 2, 쥐의 뇌 (3), 피부 및 점막 7 및 전체 제브라 피쉬 애벌레 1.5을 (www.nanotomy.org) 적용. 제브라 피쉬의 뇌 면역 세포 (11)을 포함한 포유 동물 조직에서 접근하기 어려운 세포 유형을 시각화 특히에서, 생체 내 이미징에 매우 적합하다. 여기 nanotomy 절차에 의한 신경 메트로니다졸 변환하여 조건부 신경 절제술을받은 제브라 헤드의 관상 부에인가 상세히 설명표현 nitroreductase (www.nanotomy.org) 5,12-14. 모든 원시 데이터는 조직의 규모 변화에 분자 시각화, 줌 가능 HTML 파일로 제공됩니다. 원시 데이터의 발표는 전 세계적으로 전문가에 의해 다른 각도에서 데이터 세트의 편견 분석을 할 수 있습니다.
프로토콜
제브라 피쉬 애벌레 모든 실험은 국가 및 EU 지침에 따라 흐로 닝언 대학의 동물 실험위원회에 의해 승인되었다.
1. 샘플 준비
- 고정 및 포함
- 정착
- tricaine (0.003 %) 물고기 애벌레를 마취 부드럽게 파고에 의해 E3 (5 mM의 염화나트륨, 0.17 밀리미터의 KCl, 0.33 mM의 CaCl2를, 0.33 mM의 황산, 10 mM의 HEPES, pH를 7.6) 마취의 깊이 제브라 피쉬의 물과 테스트에 추가 해부 현미경 하에서 200 μL 피펫 팁의 움직임이 더 이상 (도 1a)을 검출되지 않을 때까지.
- 기술 된 바와 같이 아가 1.8 %에 촛점 2 광자 영상화를 이용하여 생체 내 이미징 데이터를 획득 한 후 상호 EM 용 샘플을 처리하는 경우, 아가로 오스 5,15 수정 유충 트리톤 X-100 (0.05 %)을 함유하는 PBS로 4 % PFA를 사용.
- 아가로 오스와 프로세스에서 유충을 잘라대규모 EM 5.
- 플라스틱 튜브를 실온에서 2 시간 동안 트리톤 X-100 (0.05 %)를 함유하는 PBS에 신선한 4 % 파라 포름 알데히드에서 유충을 수정.
주 : 배양에서 배양 세포를 다음 단계 (1.1.1.5)에서 설명한 바와 같이 (시험 관내)가 직접, 글루 타르 알데히드로 고정 될 수있다. - 솔루션을 제거하고 100 μl를 0.5 % PFA, 2 % 글루 타르 알데히드 (GA), 0.1 M 나트륨 cacodylate (산도 7.4)를 추가합니다. 4 ℃에서 하룻밤 저장합니다. 린스 샘플을 두 번 0.1 M 나트륨 cacodylate있다.
- 오스뮴의 침투를 용이하게하기 위해 후뇌에 rostrally 애벌레 머리를 잘라. 미세 주사기 / 집게를 사용합니다.
- 1 % 산화 오스뮴의 후위 유충 (OSO 4) 2 시간 동안 페로 시안화 칼륨 (K 4의 Fe (CN) 6]) 얼음에 0.1 M 나트륨 cacodylate의를 /1.5% 두 번 증류수 H 2 O 3 × 5 분을 씻어
- 에탄올 농도가 증가하는 20 분간 인큐베이션 (50 %, 70 %, 3 회, 100 %), 에탄올로 탈수.
- 퍼가기
- EM 실험실에서 사용되는 표준 조리법에 따라 에폭시 수지를 준비합니다.
주 : 우리는 다음과 같은 에폭시 수지를 사용 믹스 19.8 g glycid 에테르 (100), 자석 교반기를 사용하여 9.6 g 2- 도데 세닐 산 무수물 11.4 g, 무수 메틸 나. 0.5 g DMP-30 (트리스 (디메틸 아미노 메틸) 페놀)를 추가하고 다시 섞는다. - 에탄올 중의 50 % 에폭시 수지 유충 밤새 인큐베이션 (V / V) (RT)으로 회전시키면서.
- 순수한 수지와 희석 된 에폭시 수지를 교체합니다. 30 분 동안 인큐베이션 다시 신선한 수지를 추가로 30 분 동안 배양한다. 다시 수지를 새로 고침 한 후 58 ° C에서 15 분 및 저압 (200 밀리바)에서 RT 또 다른 1 시간 뒤에 실온에서 3 시간을 품어.
- 바늘을 사용하여 해부 현미경으로 시판되는 실리콘 평탄한 매립 몰드의 헤드의 방향이나 금형의 필요에 따라 측면에 대향하는 전방으로 이쑤시개 (그림 1B).
- 에폭시 입술을 중합58 ° C에서 하룻밤한다. 에폭시 수지 인 경우에는 여전히 너무 부드러운 하루가 중합하고 58 ℃에서 경화 할 수있다. 집게를 사용하여 압력을가함으로써 테스트 강성. 이것은 쉽게 들여 쓰기가 다른 날은 중합 및 58 ° C에서 경화 할 수 있도록 나뭇잎합니다. 시료가 완전히 경화 될 때 트리밍 및 단면 처리를 진행합니다.
- 스텁 사용하여 면도날 (그림 1B)에서 초과 수지를 얻어 낸다.
- EM 실험실에서 사용되는 표준 조리법에 따라 에폭시 수지를 준비합니다.
- 정착
- , 단면 대조 및 설치
- 단면
- 을 Ultramicrotome를 사용하여 섹션 에폭시 수지 블록.
- 유리 칼 또는 톨루이딘 블루 / 기본 푹신에 대한 semithin 섹션 (500 나노 미터)를 절단하는 다이아몬드 histoknife를 사용하여 (그림 1D) 오른쪽 위치를 감지하는 염색.
- 선단 화염에 녹아에 의해 폐쇄 된 유리 파스퇴르 피펫으로 그들을 데리러하여 현미경 슬라이드에 전송 세미 얇은 부분. 핫 플레이트 U에 드라이ntil 물이 남아 있지 않습니다. 핫 플레이트에 물에 1 % 톨루이딘 블루 10 초 동안 1 %의 붕산 나트륨 0.05 % 기본 푹신으로 10 초 동안 물 얼룩 세척 한 후 얼룩. 40 배 10 배에서 일반 광학 현미경으로 검사합니다.
- 뇌 내의 적절한 위치 / 방향에 도달하면, 얇은 부분을 절단하는 다이아몬드 칼 에폭시 수지 블록을 계속 절편 (~ 70 내지도 1E)
- 절편 초박형 동안 관심의 영역을 확인하고 샘플을 기울 때 단면 각도를 조정, 후각 피트, 눈, 회색 - 흰색 물질의 경계를 포함, 및 뇌 주위에 쉽게 식별 해부학 적 구조를 사용합니다.
- 단일 슬롯 L2 × 1 구리 그리드 (그림 1 층)에 마운트 부분은 그리드 막대에 의해 방해받지 인수를 허용합니다. 섹션을 지원하기 위해 Formvar에게 코팅 그리드를 사용합니다.
- 대조
- 그리드에 얼룩 얇은 섹션레이놀즈 다음 메탄올 2 % 우라 닐 아세테이트 2 분의 또 다른 2 분 16 구연산을지도한다.
- 단면
2. 이미지 인식
- 대규모 STEM
참고 : 우리는 STEM 감지를 사용하여 높은 해상도 3,5,7,17에서보기의 여러 큰 분야를 획득 할 수있는 외부 스캔 발생기 스캔 EM을 사용합니다. 통상적으로, 하나의 이미지는 이러한 방식으로 크게 접의 양을 감소 ~ 100 투과 전자 현미경 (TEM) 이미지 뷰 필드에 해당 생성.- 현미경에서 샘플을 장착
- 여러 그리드 샘플 홀더에 섹션 그리드를 놓고 SEM의 챔버로 전송합니다.
- 줄기 감지기의 정렬
- 빔 아래 샘플 그리드를 넣고이 약 수 있도록 그것을 이동합니다. 렌즈 극에서 5mm. 사용하여 20 kV로에서 화상을 취득인 - 렌즈 검출기.
- 그리드 가장자리에 초점 및 4.0 mm 거리에 작업을 조정합니다.
- 안전한 위치로 샘플 홀더를 이동하고 STEM 검출기에 가져.
- 인 - 렌즈 검출기를 최대 속도로 조정 나사 동안 영상을 돌려 이미지 필드에서 STEM 검출기의 구멍을 중앙에.
- 조심스럽게 바로 렌즈 극과 검출기 사이에 맞는 샘플 홀더를 다시 가져.
- 섹션 영역에있을해야하는 인 - 렌즈 검출기로 이미지를 획득.
- 스위치 검출 (이득 매체와 '마이너스'에 설정된 모든 사분면)를 줄기와 이미지를 획득하고 스캔 할 영역을 선택합니다.
- 21 kV의에 가속 전압을 올리고 (다시 안정된 이미지) 빔의 안정화 기다린 후 2 kV의 단계에서 29 kV로 이동합니다.
- 이미지 획득
- 샘플을 미리 조사하여 줌 (전자 빔에 의한 휘도 변화를 방지하기 위해)스캔의 전체 영역 밖이므로 이미지 창을 맞는다.
- 120 μm의 개구 수를 변경 (검출기 이득이 한 단계 감소 할 수있는 적절한 동적 범위를 유지하기 위해).
- 데 초점 이미지가 흐려되도록.
- 감소 된 지역 검색 옵션을 사용하여 가능한 한 꽉 스캔 영역을 확인합니다.
- 프레임이 약으로 주사되도록 설정 스캔 속도. 1-2 초.
참고 : 크기와 조직에 따라이 일반적으로 소요 ½ 시간 (100 × 100 μm의의 FOV)를 3 시간 (1000 X 500 μm의) 최대로. - 적어도 100 배에 확대하고 10 초 동안 작은 영역을 스캔합니다.
참고 :이 지역은 그 주변, 사전 조사가 충분에 비해 밝기를 변경하지 않는 경우. - 30 μm의 구멍을 다시 가져 오기 (중간에 이득을 STEM)
- 샘플을 초점을 맞 춥니 다.
- 비틀 비틀 (~ 40,000의 배율)를 사용하여 조리개를 맞 춥니 다.
- 초점 가장 밝은 영역 / 기능을 선택하는 동안, 스캔 속도를 설정 같은 세부 사항이볼 수 있습니다.
- 현미경 소프트웨어에서 조심스럽게 동적 범위 내의 모든 픽셀을 유지하기 위해 히스토그램을 보면서 밝기와 대비를 조정합니다. 가장 어두운 영역 / 기능에 대해 동일한 작업을 수행합니다.
- 다시 밝은 영역으로 이동하고 다시 확인합니다. 히스토그램의 양쪽에 약간의 공간이 있으므로 안전면에 올려.
- 스캔의 전체 영역이 촬상 창 맞도록 축소하고, 대 면적의 수집 프로그램을 시작한다.
- 화면에서 영역을 선택하여 모자이크를 설정 마법사 옵션을 사용합니다. 사용 픽셀 크기는 2 - 세부 사항이 필요한 내용에 따라 5 나노 미터. STEM에 대한 체류 시간 3 μs의를 사용합니다.
- 옵션을 선택 "이전 타일에 자동 초점은"확인란을 기본 회사 설정으로 대규모 수집 소프트웨어 자동 초점을 사용하여 "실행 전에 설정을 확인"어디에 데이터를 저장하는 방법을 정의합니다.
- 를 눌러 현미경 설정을 확인하기 위해 "최적화".
참고 : 이제 필요한 시간이 쉬 될 것입니다개인적인. 이것은 최대 1 × 0.5 mm 영역에 대한 72 시간에 수 있습니다. - 창 "최대 타일 해상도"유형에서 20,000 그래서 각각의 타일은 무딘 가장자리 효과를 방지보다 더 큰 20K X 20K되지 않습니다. 보도는 "실행".
- 초점과 밝기 / 명암 대비 (의 b / C)를 확인하기 위해 물었을 때, 외부 검사 발전기의 전원을 끄고 조심스럽게 현미경 소프트웨어에 초점과 난시를 조정합니다. B / C를 변경하지 마십시오.
주 : 스테이지 이동 배율 변경되었지만 배율 다시 원하는 픽셀 크기로 설정되어야 할 수있다. - 다시 외부 스캔 발전기에 스위치를 누르십시오 "계속".
- 현미경에서 샘플을 장착
3. 데이터 분석
- 대규모 EM 파일 뷰어 프로그램을 열고 파일을 "모자이크 정보"를 엽니 다. 이 모든 타일 TIF-파일을 엽니 다. 이것은 바람직 새 인수를 막지 다른 워크 스테이션에서 실행된다.
- 옵션 '노소를 선택전체 모자이크 스티치 (매개 변수가 임계 값 0.90, 자동 노이즈 감소 바느질, 절반 모드를 중복. 경우 스티치 기준으로는에, 줌을 충족 수동 위치에 타일을 배치하고 '그대로 계속'을 클릭 할 수 없습니다).
- HTML 파일로 내보내기, 또는 다른 하나의 TIF있다.
TIF의 다운 스케일링이 필요할 수 있습니다 내보낼 수 있습니다. 이후의 측정을 가능하게하는 파일 이름의 마지막 픽셀 크기를 포함한다. - 이미지 편집 프로그램을 열어서 TIF 파일에 주석을 수행한다. 병행하여, 최적 해상도 관찰하는 웹 브라우저의 줌 가능한 HTML 파일을 연다.
결과
1 주 된 제브라 피쉬 유충의 머리의 관상 섹션의 대규모 EM 데이터 세트는 하나의 큰 스케일 이미지의 많은 조직과 세포의 기능을 보여줍니다 (www.nanotomy.org).
제어 뇌 부분의 Nanotomy는 후각 섬유 다발, 신경 세포의 핵 및 시냅스를 포함한 신경 하위 구획 (그림 2A, www.nanotomy.org)를 포함하여 주동이의 전뇌의 신경 조직의 전형적인 미세 특징을 보여준다. 구별 할 수있는 헤드의 세포 유형은 아래턱 큰 액포, 후각 신경 세포 osmiophilic 미엘린 작은 혈관 내피 세포 구조가 meninx (수막의 제브라 대응, 멤브레인 층 감싸는 포함와 연골을 포함 포유류의 뇌). 세포 내 구조는 다른 CEL의 표피의 글리코 칼 릭스, 다른 핵 형태학 및 초점을 포함 골지체, 소포체 (ER), 미토콘드리아와 시냅스 소포 및 사후 시냅스 밀도를 포함한 리터 유형 및 세포 소기관.
예기치 않게 심실을 안감 세포의 핵은 뇌에 더 많은 측면으로 분산 다른 세포에 비해 매우 전자 밀도가 있습니다. 또한 이러한 심실 핵은 뇌의 다른 세포에 존재하며 식세포 미세 아교 세포 (그림 2)의 핵에서 발견되는 이질 염색질에서 크기와 구조가 다르게 나타날 어두운 초점을 보여줍니다. 제브라 피쉬를 개발 심실을 안감 세포들은 분화 세포보다 변경 염색질 상태를 반영 주로 방사형 신경 교세포 및 신경 전구 세포를 포함한다. 조직 줄기 세포는 일반적으로 매우 드물다 같이 nanotomy는 EM 그러므로 줄기 세포의 미세 구조의 기능을 식별하기 위해 사용될 수있는 조직 규모 줄기 세포 마커의 조직 표지를 상관한다.
ve_content : 신경 절제를 겪는 제브라 피쉬 애벌레의 코로나 섹션의 "FO 유지-together.within 페이지 ="1 "> 대규모 EM은 (www.nanotomy.org) 찾을 수 없습니다 많은 특정 조직, 세포 및 분자 기능을 보여줍니다 셀룰러 기능 식세포 미세 아교 세포를 포함 할 가능성 죽어가는 세포 (도 2B, www.nanotomy.org)을 나타내는 세포의 크기를 액포 대조군이다.. 이전 EM 연구는 척추 (18, 19)의 미세 아교 세포를 확인 하였다. 미세 아교 세포의 특징적인 기능을 연장 핵 포함 다음 좁고 긴 cisternae, 상대적으로 어두운 / 밀도 세포질 및 phagosomes, 지질 방울과 리소좀 수많은 흠와 핵 봉투, 눈에 띄는 골지체, 무료 polyribosomes, 세분화 된 소포체 (ER)에 누덕 누덕 기운 염색질의 덩어리.이 모든 포유 동물 조직에서 미세 아교 세포에 의한 특징은 또한 이러한 제브라 뇌 세포 (도 2B, www.nanotomy.org)에서 발견되었다. <유지-together.within 페이지 = "1"> : FO P 클래스 = "jove_content"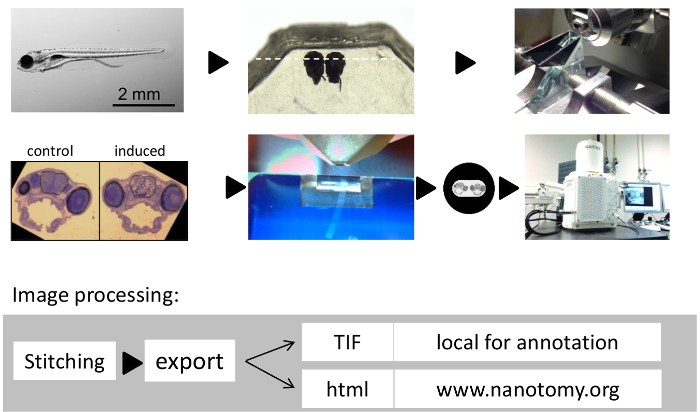
그림 1 : Zebrafish의 두뇌에 큰 규모의 조직 전자 현미경의 워크 플로우. (A) 칠일 된 제브라 피쉬 애벌레. (B) 에폭시 수지에 나란히 임베디드 Zebrafish의 애벌레 머리. 반 절편과 시편을 배향를 엷게에 대한 (C) 유리 칼. (D) 두 가지를 보여주는 대표적인 semithin 톨루이딘 블루 스테인드 섹션 사이드 바이 사이드 (F).. 초박형 (70 ㎚) 섹션을 잘라 (E) 다이아몬드 칼을 제브라 피쉬 애벌레를 삽입 위치를 표시하기 위해 한 구멍 격자에 전체 제브라 피쉬 애벌레 뇌 섹션의 (D)에서 이미지를 편집. (G) 이 연구에서 대규모 2D EM에 사용되는 현미경 시스템. 이미지 처리 (H) 흐름. 여기를 클릭하십시오이 그림의 더 큰 버전을 볼 수 있습니다.
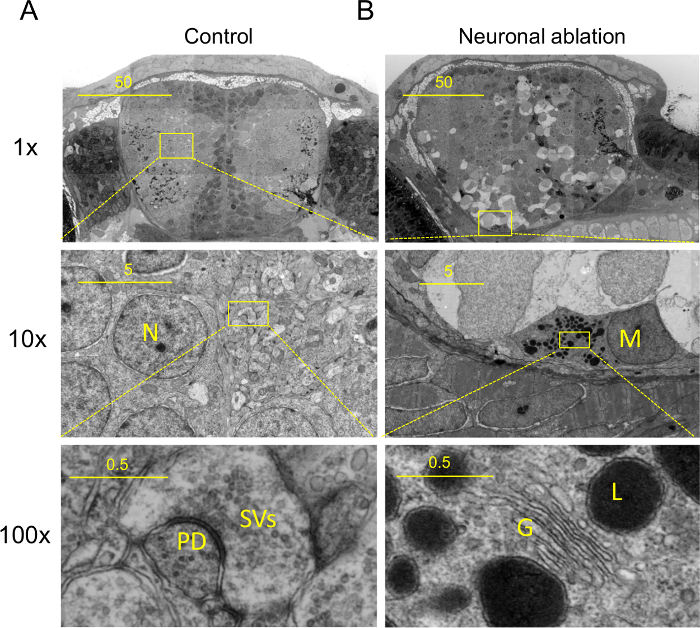
. 그림 2 : Nanotomy 결과 :. 고분자에서 조직에 처리 칠일 후 시비 제어 및 (B)의 뇌 (A) Nanotomy (신경 절제도 1), 신경에 특정 기능을 보여주는이 퇴행성 뇌를 절제 (B)이 세포 사멸 및 신경 조직 ((A)와 (B))의 해면 모양을 겪고 식세포 미세 아교 어두운 세포를 포함한다. (5 개조) 상단 패널 : 지역의 10X 확대보기 중간 패널에 표시. 중간 패널 : 지역의 10X 확대보기 낮은 패널에 표시. (A, 가운데 패널) (A, 낮은 패널)에서 neuropil 보여주는 시냅스의 높은 배율의 뷰, 시냅스 소포 (SV들)과시냅스 밀도 (PD). (B, 중앙 패널) 눈에 띄는 골지체 (G)를 포함하는 전형적인 아메바 소교 기능 (하단 패널) 표시 가능 아메바 미세 아교 세포 나 대 식세포 (가운데 패널, M)의 높은 배율의 뷰, 리소좀 액포 (L)를 포함 흠. 스케일 바 : 50 μm의 (위), 5 μm의 (중간)와 0.5 μm의 (아래). 이 그림 5에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오 , 또는 전체 데이터를 온라인으로 방문 (nanotomy.org).
토론
EM은 생물 학적 맥락에서 거대 분자의 고해상도 이미지와 휴대 맥락의 분석을 할 수 있습니다. 그러나, 이것은 통상적으로 시야를 제한한다. 대규모 3D EM 복잡한 데이터 처리를 요구하는 10 나노 스케일 해상도 3 차원 재구성을 만들어 매핑 신경 연결에 특히 적합하다. 대조적으로, 2D 대규모 EM는 촬상 데이터의 하나의 부분과 스티치를 요구하고, 상기 데이터의 평가는 인터넷 브라우저에 대한 액세스를 누구라도 가능하다. 우리와 다른 이전에 조직과 전체 동물을 분석하기 위해 대규모 EM을 사용했다. 가장 접근, TEM 및 SEM 기반 바느질에 관해서는 자신의 장점을 가지고 않습니다. 여기서, 스캔 전송 EM (STEM)은 높은 해상도로 넓은 시야의 생성을 허용하는 사용되었다. 큰 한 느낌을 묘화 할 때 일반적으로 하나의 STEM 이미지는 대략 100 TEM 이미지를 크게 스티치의 양을 감소시키는 관점 분야에 해당높은 해상도에서보기 DS. 높은 해상도가 필요한 경우, TEM 유리할 수있다. STEM 비 대조 샘플이 좋은 미세 콘트라스트 6 사용될 수 TEM 이상의 장점을 갖는다.
또한, 여기에 기재된 방법은 단순히 여러 섹션 현미경 시스템의 사용을 확대 실리카 웨이퍼 상에 장착 다시 산란 전자 검출 (BSD)에 사용하기 위해 조정될 수있다. HTML-줌 가능 조직 EM 파일은 환자 데이터를 분석, 과학 연구 LM 및 EM 데이터 (클레멘 타인) 8, 프리젠 테이션 목적을 결합, 그 전체 내용 분석되지 않았을 수 있습니다 데이터를 공유하고, 교육, 정량 매우 유용하다. BSD가 사용될 수 있고, 더 일반적으로 검출 줄기보다 사형 전자 현미경에 사용 가능하다 : 대안 적으로, SEM 대규모 EM에 있지만 아닌 TEM에 실리카 웨이퍼는 두 가지 장점을 갖고 이용 될 수있다. 둘째, 대형 섹션 (>의 1mm 2 영역으로 설치관심이) 간단합니다. 하나의 슬롯 그리드에 설치하는 것은 노동 집약적 기술적 도전이다. TEM, SEM 및 STEM 사이의 상세 비교는 다른 곳에서 6 자세히 설명되어 있습니다. BSD 영상의 단점은 이미지 잡음 증가 줄기 비교한다는 것이다. 이것은 부분적으로 더 긴 획득 시간의 결과, 화소 체류 시간을 증가시킴으로써 보상 될 수있다.
샘플 준비 상대적으로 표준 EM 처리 (고정, 삽입 및 절편)에 대한 5-7을 필요로하지만,이 유물의 완전히없는 큰 얇은 부분을 잘라 기술적 도전이다. 섹션은 쉽게 깰 매우 연약 접거나 일반적으로 데이터 세트에 따라 여러 시간이 소요 영상 중에 파괴된다. 그러나, 원시 바이어스 데이터의 온라인 공유, 그것은 문서 데이터를 쉽게 비교하고, 컨트롤과 같은 개방 도메인 문서 셋을 사용하는 것이 가능해질 것이다. 현재 할 수있는 라 몇 EM 장치RGE 규모 분석을 사용하고, 대부분의 이미징 센터가 공동 노력을 환영하지만, 따라서이 기술에 대한 접근성은 다소 제한됩니다.
대규모 섹션의 조직이 제대로 샘플은 고정되어야한다. 즉 빠르지 만 적당한 정착 PFA의 혼합물이 느리지 만 강한 정착액 GA와 병용되는 이유이다. 절단과 유물없이 큰 부분을 따기 것은 어려운 일이다. BSD와 함께 웨이퍼 작업은 하나의 구멍 격자에 섹션을 수집에 비해 쉽다. 중금속 후 염색 고전 EM에 비해 더 중요하다. 전체 부분이 몇 군데 있기 때문에 모든 이슈가 표시됩니다. TEM 사용자가 일반적으로 어려운 때문에 현미경 동작의 차이 중, SEM으로 전환 발견.
정량 및 데이터 공유 - 세포 내 기능을 정량화하는 단일 EM 이미지에 어렵다. 가능성과 대규모의 축소이미지는 쉽게 세포 내부의 나노 측정에 의해 올 수 있습니다 관심의 세포를 식별 할 수 있습니다. 이 데이터 세트는 특정 세포 유형이 빠르게 다른 규모에서 검출 기능에 따라, 식별하고 이러한 큰 조직 섹션에 공정한 방식으로 정량화 될 수 있음을 나타냅니다. 예를 들어, 미세 아교 세포들은 형태와 치밀한 세포질에 기초하여 식별 될 수있다. 우리는 이전에 대규모 EM 조직 배양 데이터 세트 (2) 내에 ER의 폭 켰을 때, 계속해서, 각 셀의 확대에 따라, 이들 세포의 세포 내 분자 나노 기능은 동일한 세트 내에서 측정 할 수있다. nanotomy의 또 다른 장점은 온라인 대규모 데이터 세트의 호스팅하는 다른 사람이 어쩌면 다른 기능에 대한 데이터를 검사 할 수 있도록, 새로운 가설에 자신의 결론을 도출하는 것입니다.
클레멘 타인은 - 정량적 EM 촉진뿐만 아니라, 대규모 EM보다 쉽게 광 microsco를 상관하게EM 레벨 8 그림 라벨링. 본 예에서 제브라 절제 모델 식세포 미세 아교 세포의 존재를 나타낸다. 신경 과학에서 중요한 문제는 각각의 기능과 기여가 미세 아교 세포와 대 식세포와 면역 세포의 잠재적 인 다른 소스의 무엇이다. 초기 EM 연구는 질병 (18)에 미세 아교 세포의 독특한 세포 내 기능을 보여 주었다. 그들은 유전자 발현 형태와 기능의 다른 면역 세포와 큰 오버랩을 나타낸다 불행히도, 선택적으로 병리 적 환경에서 특히 미세 아교 라벨 어렵다. 따라서, 불분명 여부와 미세 수준에서 미세 아교 세포는 대 식세포에 침투 유래 단핵구를 포함하여 다른 소스에서 면역 세포와 다를 경우. 기능 차이의 분석을위한 시작점을 제공 이러한 미세 셀 사이의 차이가 있는지 이해. 선택적 형질 전환 또는 식 마커를 조합과 클레멘 타인은 DET 수 있습니다미세 기능 ection 특정 집단에 선택적.
진단 및 프리젠 테이션과 교육 - 하나의 데이터 세트 EM 데이터 내에서 마이크로에 나노를 시각화함으로써 크게 폭 넓은 관객들에게 용이하게된다. 상관 대규모 EM의 증가 가능성과 도구를 우리는 기본 및 의학 연구에 EM의 부흥을 기대하고 있습니다. 여기에 표시되는 우리의 방법은 제브라 뇌 손상 모델 (5)에인가되지만, 당뇨병 4 및 세포 배양 2의 쥐 모델에서 인체 조직 7, 래트 뇌 (3)에 사용되고, 또한 TEM과 조합하여 사용될 수있다 이 방법의 다양성을 보여주는 기반 접근 방식 1. 현미경 연산자는 더 이상 높은 선택하지, 따라서 바이어스 이미지,하지만 모든 다수의 미세 기능은 기록 및 전 세계 분석을위한 오픈되어 녹음됩니다.
공개
저자는 공개 아무것도 없어.
감사의 말
작품의 대부분은 NWO 175-010-2009-023 및 ZonMW 91111006 후원하는 UMCG 현미경 및 이미징 센터 (UMIC)에서 수행되었다; BNGG에 STW "현미경 밸리 12718". 이 작품은하는 마리 퀴리 경력 통합 보조금 (신경 세포 죽어 저장)를 ZonMW VENI 부여 및 TJvH에 알츠하이머 네덜란드의 교제에 의해 후원
자료
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| low melting point agarose | VWR | 444152G | |
| tricaine | Sigma | E10521 | |
| triton-X-100 | Sigma | X100 | |
| glutaraldehyde | Polysciences | 1909 | |
| sodium cacodylate | Sigma | C0250 | |
| osmium tetroxide | Electron Microscopy Sciences | 19114 | |
| potassium ferrocyanide (K4[Fe(CN)]6) | Merck | 4984 | |
| ethanol | VWR | 20821.365 | |
| uranyl acetate | Merck | 8473 | |
| sodium tetraborate | Merck | 1063808 | |
| toluidene blue | Merck | 1273 | |
| basic fuchsin | BDH | 340324 | |
| lead citrate | BDH | discontinued | |
| EPON | |||
| 2-dodecenylsuccinicacid anhydride | Serva | 20755 | |
| methylnadic anhydride | Serva | 29452 | |
| glycid ether 100 | Serva | 21045 | |
| DMP-30 | Polysciences | 553 | |
| standard flat embedding mold | Electron Microscopy Sciences | 70901 | |
| diamond knife | Diatome Inc. | ||
| copper grids | Electron Microscopy Sciences | ||
| double sided carbon tape | Electron Microscopy Sciences | ||
| scanning EM Zeiss Supra55 | Zeiss | ||
| ultramicrotome Leica EM UC7 | Leica | ||
| atlas external scan generator | Fibics |
참고문헌
- Faas, F. G., et al. Virtual nanoscopy: generation of ultra-large high resolution electron microscopy maps. J Cell Biol. 198, 457-469 (2012).
- Kuipers, J., et al. FLIPPER, a combinatorial probe for correlated live imaging and electron microscopy, allows identification and quantitative analysis of various cells and organelles. Cell Tissue Res. 360, 61-70 (2015).
- Kuwajima, M., Mendenhall, J. M., Lindsey, L. F., Harris, K. M. Automated transmission-mode scanning electron microscopy (tSEM) for large volume analysis at nanoscale resolution. PLoS One. 8, e59573(2013).
- Ravelli, R. B., et al. Destruction of tissue, cells and organelles in type 1 diabetic rats presented at macromolecular resolution. Sci Rep. 3, 1804(2013).
- van Ham, T. J., et al. Intravital correlated microscopy reveals differential macrophage and microglial dynamics during resolution of neuroinflammation. Dis Model Mech. 7, 857-869 (2014).
- Kuipers, J., de Boer, P., Giepmans, B. N. Scanning EM of non-heavy metal stained biosamples: Large-field of view, high contrast and highly efficient immunolabeling. Exp Cell Res. 15477, 202-207 (2015).
- Sokol, E., et al. Large-Scale Electron Microscopy Maps of Patient Skin and Mucosa Provide Insight into Pathogenesis of Blistering Diseases. J Invest Dermatol. 135, 1763-1770 (2015).
- de Boer, P., Hoogenboom, J. P., Giepmans, B. N. Correlated light and electron microscopy: Ultrastructure lights up! Nat Methods. Nat Methods. 12, 503-513 (2015).
- Lam, S. S., et al. Directed evolution of APEX2 for electron microscopy and proximity labeling. Nat Methods. 12, 51-54 (2015).
- Helmstaedter, M., et al. Connectomic reconstruction of the inner plexiform layer in the mouse retina. Nature. 500, 168-174 (2013).
- Oosterhof, N., Boddeke, E., van Ham, T. J. Immune cell dynamics in the CNS: Learning from the zebrafish. Glia. 63, 719-735 (2015).
- van Ham, T. J., Kokel, D., Peterson, R. T. Apoptotic cells are cleared by directional migration and elmo1- dependent macrophage engulfment. Curr Biol. 22, 830-836 (2012).
- Davison, J. M., et al. Transactivation from Gal4-VP16 transgenic insertions for tissue-specific cell labeling and ablation in zebrafish. Dev Biol. 304, 811-824 (2007).
- Distel, M., Wullimann, M. F., Koster, R. W. Optimized Gal4 genetics for permanent gene expression mapping in zebrafish. Proc Natl Acad Sci U S A. 106, 13365-13370 (2009).
- van Ham, T. J., Mapes, J., Kokel, D., Peterson, R. T. Live imaging of apoptotic cells in zebrafish. FASEB J. 24, 4336-4342 (2010).
- Reynolds, E. S. The use of lead citrate at high pH as an electron-opaque stain in electron microscopy. J Cell Biol. 17, 208-212 (1963).
- Kuwajima, M., Mendenhall, J. M., Harris, K. M. Large-volume reconstruction of brain tissue from high-resolution serial section images acquired by SEM-based scanning transmission electron microscopy. Methods Mol Biol. 950, 253-273 (2013).
- Stensaas, L. J., Reichert, W. H. Round and amoeboid microglial cells in the neonatal rabbit brain. Z Zellforsch Mikrosk Anat. 119, 147-163 (1971).
- Mori, S., Leblond, C. P. Identification of microglia in light and electron microscopy. J Comp Neurol. 135, 57-80 (1969).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유