Method Article
シングルプローブの応用:周囲条件下での質量分析イメージングと単一細胞解析
要約
Here, we present protocols to perform both ambient mass spectrometry imaging (MSI) of tissues and in-situ live single cell MS (SCMS) analysis using the single-probe, which is a miniaturized multifunctional device for MS analysis.
要約
Mass spectrometry imaging (MSI) and in-situ single cell mass spectrometry (SCMS) analysis under ambient conditions are two emerging fields with great potential for the detailed mass spectrometry (MS) analysis of biomolecules from biological samples. The single-probe, a miniaturized device with integrated sampling and ionization capabilities, is capable of performing both ambient MSI and in-situ SCMS analysis. For ambient MSI, the single-probe uses surface micro-extraction to continually conduct MS analysis of the sample, and this technique allows the creation of MS images with high spatial resolution (8.5 µm) from biological samples such as mouse brain and kidney sections. Ambient MSI has the advantage that little to no sample preparation is needed before the analysis, which reduces the amount of potential artifacts present in data acquisition and allows a more representative analysis of the sample to be acquired. For in-situ SCMS, the single-probe tip can be directly inserted into live eukaryotic cells such as HeLa cells, due to the small sampling tip size (< 10 µm), and this technique is capable of detecting a wide range of metabolites inside individual cells at near real-time. SCMS enables a greater sensitivity and accuracy of chemical information to be acquired at the single cell level, which could improve our understanding of biological processes at a more fundamental level than previously possible. The single-probe device can be potentially coupled with a variety of mass spectrometers for broad ranges of MSI and SCMS studies.
概要
Mass spectrometry imaging (MSI) is a relatively new molecular imaging technique to provide the spatial distribution of the compounds of interest on surfaces. During the MSI analysis, mass spectrometry (MS) measurements are recorded across the surface on an individual pixel basis to create a 2D image of the species of interest 1. MSI techniques have the ability to provide a spatially resolved feature distribution for a large range of metabolites, allowing a much greater amount of information to be obtained from a sample than from using traditional molecular imaging techniques, and they have the potential to greatly improve the analysis of biological samples for biological and pharmacology studies 2. MSI can be broadly separated into non-ambient and ambient approaches. The non-ambient MSI analysis techniques, such as matrix assisted laser desorption ionization (MALDI) MS 3 and time of flight secondary ion MS (ToF SIMS) 4, are capable of high spatial resolution (around 5 µm and 100 nm, respectively) and high sensitivity. However, these methods require extensive sample preparation, such as the application of matrix molecules to the sample surface, and a vacuum sampling environment, which could introduce artifacts to the data obtained. Ambient techniques such as desorption electrospray ionization (DESI) MS 5, laser ablation electrospray ionization (LAESI) MS 6, and nano-DESI MS 7 are capable of MSI of samples with little to no prior preparation under the ambient environment, which is able to produce MS images that potentially reflect the sample in its most native state. However, most of these techniques generally lack the high spatial resolution and detection sensitivity compared with the non-ambient techniques, with experiments typically conducted at around 150 µm per pixel 8.
Single cell analysis (SCA) is a growing field that has the ability to characterize the chemical composition of biological samples at the cellular level. SCA enables the analysis of biological systems at a more fundamental level than traditional cell analysis techniques, which produce an averaged result of a population of cells, potentially providing insights that are previously intractable 9. MS techniques have recently been applied to SCA (termed single cell mass spectrometry or SCMS) using non-ambient techniques such as MALDI MS 10 and ToF SIMS 11 in which cells are pretreated before analysis, and with ambient techniques such as LAESI MS 12 and direct extraction methods, such as live single-cell video-MS 13, 14, to analyze a wide variety of cell types such as egg, plant, and cancer. Ambient techniques have the advantage of being applied to live cells, which again minimizes the artifacts, leading to a better representation of the metabolites in the live cells. The direct extraction based methods described above, however, perform the sample extraction and analysis process at two different steps, which result in a time gap during the analysis that could potentially alter the metabolites present within the sample.
The single-probe, a miniaturized multifunctional device that is capable of conducting high spatial resolution ambient MSI on biological tissue sections 15 and near real-time in-situ SCMS on live single cells 16. The single-probe has an integrated construction that is made up of a pulled dual-bore quartz capillary coupled with a solvent providing inlet and a nano-ESI emitter made from fused silica capillaries, enabling solvent delivery and analyte extraction to be performed from a single device. In the ambient MSI mode, the single-probe is placed over the sample tissue and surface micro-extraction occurs, allowing a rastered MS image to be made at high spatial resolution. Particularly, the tapered tip of the single-probe is small enough to be inserted into live eukaryotic cells for in-situ SCMS analysis, where the metabolite detection takes less than two seconds between probe insertion and MS detection, allowing chemical information to be taken in near real-time. Here are the protocols to fabricate the single-probe device and to conduct both the ambient MSI and SCMS modes using the single-probe MS techniques.
プロトコル
動物の使用と福祉は、施設内動物管理使用委員会(IACUC)によってレビューされ、承認されたプロトコル以下の実験動物の管理と使用に関するNIHガイドに準拠する必要があります。マウス組織サンプルを、協力者博士Chuanbinマオによって提供されました。
1.マウス組織セクションの準備
- 十分小さなプラスチック( 例えば 、12ウェル細胞培養プレート)の中心に目的の全マウスの臓器(脳、腎臓、肝臓など)を配置し 、そして約10mmの高さに化合物を包埋組織に沈めます。組織包埋化合物および器官が所望の向き( すなわち 、矢状、冠状、 など )に置かれていることを、泡が形成されなくことを確認してください。
- すぐに瞬間冷凍用の液体窒素中に組織を配置します。長期保存の場合、-80℃の冷凍庫で凍結したサンプルを格納。
- temperatuに-15℃に凍結したマウスの臓器および解凍してください制御クライオミクロトームを再度。
- 組織包埋化合物の約500μlのとでスチールベースにセキュアな組織が希望する切片の向きがナイフに提示されるようにマウント切片ミクロトーム上に配置します。
- セクション12ミクロンの厚さに組織。ポリカーボネート顕微鏡スライド上に切片組織切片を置き、室温で30分間乾燥させるために残します。長期保存の場合、-80℃の冷凍庫で凍結されたスライドを保存します。
2.細胞培養
注:細胞培養は、無菌条件下で、生物学的安全キャビネット(バイオセーフティレベルII)で行いました。 HeLa細胞ラインは、モデル系として使用し、そして細胞を、以下の従来のプロトコルを完全培地中で培養しました。
- 暖かい試薬( 例えば 、トリプシン、リン酸緩衝生理食塩水(PBS)、および細胞培養培地)37℃です。
注:細胞培養培地は、無機SAが含まれLTS、アミノ酸、ビタミン、および他のもの。成分の完全なリストについては、メーカーからの製剤を参照してください。 - 細胞試料( 例えば 、1ミリリットルのHeLa細胞懸濁液)を入手し、標準的な10cmの細胞培養プレート中の完全な細胞培養培地の9ミリリットルにそれを追加します。初期の細胞数は、約0.5×10 6細胞/ mlです。成長表面は、細胞培養プレート上で70〜80%で覆われるまで2~3日間、5%CO 2で37℃で培養細胞を維持します。連続する各ラウンドのレコードの細胞継代数。
- 細胞培養プレート中の細胞継代( すなわち 、細胞分裂)を行います。
- 吸引増殖培地は、細胞をリンスし、1×PBSの5ミリリットルを使用します。無菌吸引チップを用いてPBSを削除し、培養プレートから細胞を分離するために、37℃で〜5分間トリプシンの2.5ミリリットル(0.25%)で細胞を培養します。
注:実際のトリプシン処理時間は、特定のトリプシンのproduに応じて最適化する必要がありますctがメーカーから購入しました。過剰な治療は、細胞死に至るのに対し不十分な処理時間は、プレートに付着した細胞を残します。 - 完全な細胞培養培地7.5 mlで添加することによりトリプシン活性を停止し、その後均一に細胞(総体積10ml)に再懸濁します。 SCMSサンプル(ステップ2.4)の文化(ステップ2.2)、または製造のための細胞懸濁液を使用してください。
- 吸引増殖培地は、細胞をリンスし、1×PBSの5ミリリットルを使用します。無菌吸引チップを用いてPBSを削除し、培養プレートから細胞を分離するために、37℃で〜5分間トリプシンの2.5ミリリットル(0.25%)で細胞を培養します。
- SCMS実験のために細胞サンプルを準備します。
- 12ウェルプレートの個々のマイクロカバースライドを配置し、1.8 mlのCell培地を追加し、ウェルに細胞懸濁液0.2 mlです。
- 静かにプレートの穏やかな撹拌で細胞を混合し、24時間〜37℃で5%CO 2環境下でインキュベートします。培養細胞に薬物治療を行うために、12ウェル細胞培養プレートに薬剤化合物の溶液( 例えば 、DMSO中(ジメチルスルホキシド))を加えます。
注:最終薬物濃度( 例えば 、10 nMで、100 nMの、1μM、および10μM)およびtreatment時間( 例えば 、4時間)が研究の特定の目的に応じて変更されています。細胞は、マイクロカバースライドに取り付けられ、CSMS実験(ステップ6)のために準備されています。
3.シングルプローブの作製
- レーザーマイクロピペットプラーにデュアルボア石英管(内径(ID)127ミクロン、外径(OD)500μm)を配置し、デュアルボア石英針を引っ張ります。 (すべてのユニットが製造元の単位である)熱= 400、フィル= 3、ヴェル= 80、デル= 150、およびPUL = 250:出発点として、以下のパラメータを使用します。確認引っ張らデュアルボア石英針が最適なプローブのプロパティのテーパーチップを持っています。 〜もう一方の端に左unpulledデュアルボア石英キャピラリーの5ミリメートルの長があるように引っ張られ、先端をカットします。
注意:レーザープラーの実際のパラメータは、機器の特定の条件に応じて最適化する必要があります。 - 溶融シリカキャピラリー(ID 40ミクロン、ODの〜80ミリメートルのセクションをカット。毛細血管を提供する溶媒として105ミクロン)、およびデュアルボア石英針の平らな終わりに1穴に挿入します。
- 溶融シリカキャピラリー(ID 40ミクロン、OD 105ミクロン)の〜40ミリメートルの部分をカットし、中間点からポリイミドコーティングの〜5ミリメートルを剃るためにかみそりを使用しています。素早く加熱し、微細なテーパを有するナノエレクトロスプレーイオン化(ESI)エミッタに融合キャピラリーを引っ張ってプロパン炎を使用してください。ナノESIエミッター(〜7〜10ミリメートル長い)を切り取り、およびデュアルボア石英針の平らな終わりに他の穴に挿入します。また、微細なテーパを生成するためにレーザープラーを使用します。
- デュアルボア石英針の平らな端に(〜1-2μl)をUV硬化樹脂の最小量を適用し、毛細血管やナノの溶剤を確保する〜のために20秒をLED UVランプを使用して提供する樹脂を固めますESIエミッタ。単一プローブに個々の部品を組み立てる手順は、 図1aに示されています。
- 標準的な顕微鏡のGLをカットお尻のスライド縦に半分に(1 "×3")。ナノESIエミッターが外側に指摘されるように、スライドガラスの一端に単一のプローブを配置します。それはスライドガラス( 図1b)上に固定となるように、単一のプローブの本体に、通常のエポキシ樹脂を適用します。硬化のために一晩おきます。いくつ図1Dに示すように、質量分析計に結合している集積シングルプローブ設定( 図1c)で製造された単一のプローブ。
4.統合されたシングルプローブMSのセットアップを構築
- 質量分析計のイオン源インターフェイスフランジを変更し、デジタルステレオスコープ( 図1Eおよび1F)の(調整可能な位置と高さ)、スタンドを製作。
- アルミ光板の取り付けを可能にする二つの穴にイオン源インターフェイスのフランジを開けます。スライドレール装置に取り付けられ、高さ調整棒を(作りますデジタルステレオスコープシステムはアルミ光板( 図1eのに添付することができるように、微細な位置調整用XYステージ)、)。
- 質量分析計のカスタマイズされたイオン源インターフェイスのフランジに装着されているアルミ光板に修正されたデジタルステレオ顕微鏡、USBデジタル顕微鏡、柔軟なクランプホルダー付ミニチュア手動XYZ移動ステージ、電動XYZ翻訳ステージシステムを取り付け( 図1Cおよび1F)。単一のプローブを取り付けたスライドガラスを固定するために柔軟なクランプホルダを使用してください。
- 質量分析計( 図1F)に、単一のプローブの設定を取り付けます。質量分析計の入口の前に単一のプローブのエミッタを配置するために柔軟なクランプホルダとミニチュアXYZステージを調整します。単Pのズームイン画像を提供するために単一のプローブの側に(調整視野角)USBデジタル顕微鏡を使用してシングルプローブ上記のローブの先端またはナノESIエミッター、および(高さ調節付き)デジタルステレオスコープは、細胞およびプローブチップを表示します。
注:対応するイオン源フランジを使用して、この統合された単一プローブシステムは、周囲のイオン化源を備えた質量分析計の任意の他のタイプに結合することができます。
5.周囲MSI
- 室温でのサンプルセクションを解凍し、シングルプローブの下に、電動XYZ移動ステージシステム上に置きます。制御ソフトウェアの座標を変更することにより、サンプル位置を調整します。
- 適切な速度( 例えば 、0.2マイクロリットル/分)でサンプリング溶剤ポンプ、およびイオン化電圧( 例えば 、5キロボルト)を適用する注射器を使用しました。サンプリング溶媒の選択が柔軟であり、そして一般的なものは、メタノールを含む:水(9:1)アセトニトリル。ナノESIエミッタのデッドボリュームは3 NL、およびプローブsurfa間の時間〜であると推定されましたCEコンタクトとイオン信号観察は、通常1秒未満である15。
注:カスタマイズされたイオン源インターフェイスのフランジは、イオン化電圧はワニ口クリップを介して導電組合に質量分析計から配信されることを可能にします。イオン化電圧は、次いで、キャピラリー内部の溶媒とシングルプローブチャネルに導電性のユニオンを介して送信し、サンプリングされた検体をイオン化するために、ナノESIエミッタに印加されます。導電組合とワニ口クリップを接続する際に、イオン化電圧がオフになっていることを確認してください。 - それだけで試料の表面上に休んおよび代謝物の表面抽出を行うことが可能となるように、単一のプローブの高さを調整します。慎重にZステージを持ち上げ、その後単一のプローブ先端と組織表面との間の距離変化を監視するために(単一のプローブの側に)USBデジタル顕微鏡を使用。この高さ調整時の質量スペクトルの変化を監視し、リフトを停止組織の代謝物への溶媒のバックグラウンドからのイオン信号の変化が観察されたときに、Zステージる。
- 繰り返しステップ5.3 3回は、自動化された表面平坦化調整用ステージ制御プログラム内の異なる3点を設定します。離間約10mmの距離で、試料表面上の3点のシングルプローブの先端を置き。アップを押して、アイコンの下の高さ調整を実行し、「計画法」の下の位置に3点をロックします。
- このプログラムを使用して、サンプル内の関心のセクションを横切ってラスタのための他のパラメータを設定します。ここで紹介するマウスの腎臓切片については、10.0ミクロン/秒のラスタ速度と線の間の20μmの距離を使用します。電動ステージシステムは、0.1μmの最小増分運動を有します。単一のプローブ先端部と組織との間の距離は、ステップ5.3から得られます。
- 質量分析計からのMSスペクトルの自動取得のための方法を設定します。フォー質量分解能60,000(メートル/Δmの)、〜5 kVのポジティブモード、1マイクロスキャン、150ミリ秒の最大噴射時間、およびAGC上:次のパラメータを使用し、マウスの腎臓サンプル上の高質量分解能MSI rを。 MS画像の個々の行を表すすべての取得MSスペクトルは、生成された画像のピクセルサイズが均一に分布していることを示し、それぞれのスキャンの間に一様な時間間隔でのスキャンの数が同じでした。
- MSIのデータ収集を開始します。質量分析のためのMS収集シーケンスを開始し、その後、XYZ制御プログラムのラスタ・シーケンスを開始します。
- 例えば、ここで利用されるMSデータ取得プログラムでは、「新シーケンス」を選択し、「シーケンスの設定」に進み、Xがために使用される行数はXに01から番号の新しいシーケンスのファイルのセットを生成希望のMS画像を撮影し、「実行順序」を押します。
- ソフトウェアはコンタを生成できるようにするために自家製の電子デバイスを使用質量分析のためのCT閉鎖信号は、データを収集します。回路図は、基準として補足図( 図S1)に示されています。
- 適切なMSIの可視化ソフトウェアを使用して、生MSファイルからMSのイメージを構築します。 PNNL 17でラスキンのグループによって開発されたソフトウェアパッケージを使用している場合たとえば、次の手順を実行します。
- 「眉ファイル」をクリックします。 MSI実験から得られた最初のファイルを選択します。下のどこにファイルが起動し、終了を指定する」行の数。 " 「MZ範囲を入力してください」の下のMS画像範囲のm / z値の範囲を選択します。
- 画像作成プロセスを開始する「スタート」ボタンを押してください。 MS画像が行われると、コンピュータに画像を保存するために「ツールバー」の「画像を保存」をクリックします。
6. その場ライブSCMS
- セットアップに指示に従って、単一プローブシステムMSIのためのイオン。流量の溶媒( 例えば、メタノール/ H 2 O又はアセトニトリル)を調整する( 例えば 、〜25 NL /分)。
- 文化的なメディアおよび細胞外薬物成分を除去するためにPBSで、マイクロカバーガラススライド上に付着された培養細胞を洗浄します。実験用の電動XYZ移動ステージシステム上にスライドガラスを含むセルを配置します。
注:別の方法として、培養細胞をリンスし(ウシ胎児血清を含まない)新鮮な細胞培養培地を使用します。以下イオン抑制が観察されています。さらに、細胞は、周囲温度(〜20℃)培養温度(37℃)よりも有意に低い実験中に長時間生存することができます。薬物の種類、溶液濃度、処理時間は、別の研究で異なります。 - 分析中に、細胞侵入を監視するために、単一のプローブの先端に(サンプル上)デジタルステレオ顕微鏡の焦点を合わせます。複数のUSBデジタル顕微鏡(使用シングルプローブ上のナノESIエミッタの労働条件を監視するための単一のプローブのIDE)。
- 電動XYZステージ制御プログラムと(セル上)デジタルステレオ顕微鏡は、目的の細胞を見つけ、正確にサンプルの上に単一プローブチップを配置するために使用します。単一プローブ先端が細胞内に挿入する前に、MSデータ収集を開始します。
- 質量分解能10万(メートル/Δmの)、〜3 kVの正および負モード、1マイクロスキャン、150ミリ秒の最大噴射時間、AGCモード上:高分解能質量分析計を用いてMS分析のための基準として、以下のパラメータを使用します。 MSスペクトルの自動取得は、MSデータ取得プログラムで「スタート」をクリックすることで行われます。
- 細胞膜を貫通し、細胞から生成されたMS信号を記録しておくためにアイコンをクリックすることで、電動式Zステージを持ち上げます。 1~2秒の時間遅延は、通常、プローブ挿入及びMSシグナル検出の間に観察されます。の他の確認として細胞透過、MSシグナルの劇的な変化は、細胞膜の浸透時に観察することができます。著しく低下する前に、細胞内の化合物のMS信号は、通常〜15-20秒間続くことができます。
- 細胞からのシングルプローブ先端を引き出すためにプレートを含むセルダウン低いです。これは通常ノイズレベルに近づくように、セルラ化合物のイオン信号の<15秒を要します。完全に単一のプローブをフラッシュするために〜3分間、溶媒の流れをみましょう。一方、分析されるべき次のセルを検索するために、電動XYZステージシステムを配置。各セルの実験は、2〜3分を達成する必要があります。
結果
単一プローブが正常に区分さマウスの腎組織15の周囲MSI分析に使用しました。デバイスは、MSI結果の豊富なイオン信号強度につながる、小さな領域から高効率の検体抽出を提供し、表面液体マイクロ抽出( 図1a)、のメカニズムを使用しています。例えば、10以上7の信号強度は、いくつかの豊富な代謝産物( 図2A)のために達成されました。 +(725.5575 のm / z)[PC(32:代謝産物の多くはスフィンゴミエリンの数(SM)およびホスファチジルコリン(PC)などの種[+ナSM(1 34)]を含む、このようにして検出しました。 0)+ H] +(734.5700 のm / z)[PC(34:1)+のNa] +(782.5696 のm / z)、および[PC(38:5 + NA)] +(814.5726 のm / z)。トンを結合したときにこれらの化合物は、高い質量分解能と質量精度で同定されましたOA高分解能質量分析計。例えば、識別は4ppm未満のm / z質量精度、ここで提示された結果の各代謝物( 図2b)のため(の観測と理論値との間すなわち 、差)で達成されました。また、タンデムMS( すなわち 、MS / MS)はまた、目的の種のより多くの自信を持って識別するために実施した解析を行う。15
小領域の効率的な液マイクロ抽出を実行する能力を、単一のプローブ装置は、周囲条件の下で15の高空間分解能MSI実験を行うために使用することができます。例えば、マウスの腎切片の詳細MS画像は、選択された代謝産物( 図2c)の空間分布を示す得られました。 MS画像の空間分解能はtransitiを有する広く使用されているメトリック以下、8.5ミクロンであると決定されました。MS信号の百分の20から80の強度変化内で決定鋭い特徴の点18リン脂質の場合の[PC(38:5 +のNa)] +マウスの腎臓部、内部髄質間の特徴の遷移で及び外側髄質超える20〜80%の範囲の強度変化を示すクロノグラムで一つの走査周期にわたって行われます。スピード(10.0ミクロン/秒)およびMSデータ取得率(0.85秒/スペクトル)を移動させるサンプルに基づいて、1 MSスキャン周期(8.5ミクロン)、 すなわち 、距離を移動するサンプルは、MSI空間分解能は、計算することができます( 図図2d)。この空間分解能はまだ生物学的サンプルに行っ周囲MSI技術のために達成された最高の間です。
SCMSのための単一のプローブは、個々の生きたHeLa細胞16の分析を達成することができました。単一プローブの先端の大きさは、典型的には10μm( 図未満であります十分に小さいUREの3a)は、直接それらの直径は、抽出およびMS分析のために、約10ミクロンであり、真核細胞の多くのタイプの中に挿入されます。細胞への単一のプローブ先端の挿入プロセスは、視覚的にデジタル実体顕微鏡を用いてモニターすることができる( 図3b)、および細胞膜浸透はPBS(又は新鮮な細胞培養物からの質量スペクトルの急速かつ著しい変化を介して確認することができます細胞内の化合物( 図3cと3dの )中〜)。実験は、分子種の広範な種類を検出するために正と負の両方のイオンモードで実施することができます。アデノシンリン酸(AMP、ADPおよびATP)が負イオンモード( 図3C及びD)で検出されたのに対し、例えば、18の異なる脂質種は、スフィンゴミエリン(SM)およびホスファチジルコリン(PC)を含む、ポジティブモードで同定されました。単一プローブ挿入Iとの間の時間遅延細胞及び信号検出NTO細胞代謝産物のほぼリアルタイムの検出を可能にする、典型的には2秒未満でした。 SCMSは、細胞は、抗癌剤( 例えば 、OSW-1、パクリタキセル及びドキソルビシン)19]で処理した実験に適用しました。対応する薬物は、未処理細胞の(DMSOのみを追加使用して、DMSO(ジメチルスルホキシド)中で一連の濃度( すなわち 、10 nMで、100 nMの、1μM、及び10μM)で4時間処理後のHeLa細胞内で検出することができます)コントロールとして。薬物のMS信号は、細胞外PBSまたは対照( 図3E)内に存在しなかったが、(のみ100nMの処理結果は、図3Fに示されている)は、単一のプローブMS技術を用いて単一細胞内で検出されました。細胞をPBS(または新鮮な細胞培養培地)でリンスしたので、内因性代謝物( 例えば 、細胞の脂質の検出を細胞外化合物および汚染物質を除去するためにDアデノシンリン酸)および外因性化合物( 例えば 、抗癌剤)は、シングルプローブMS技術は、細胞内の化合物を分析するために使用され得ることを示しています。
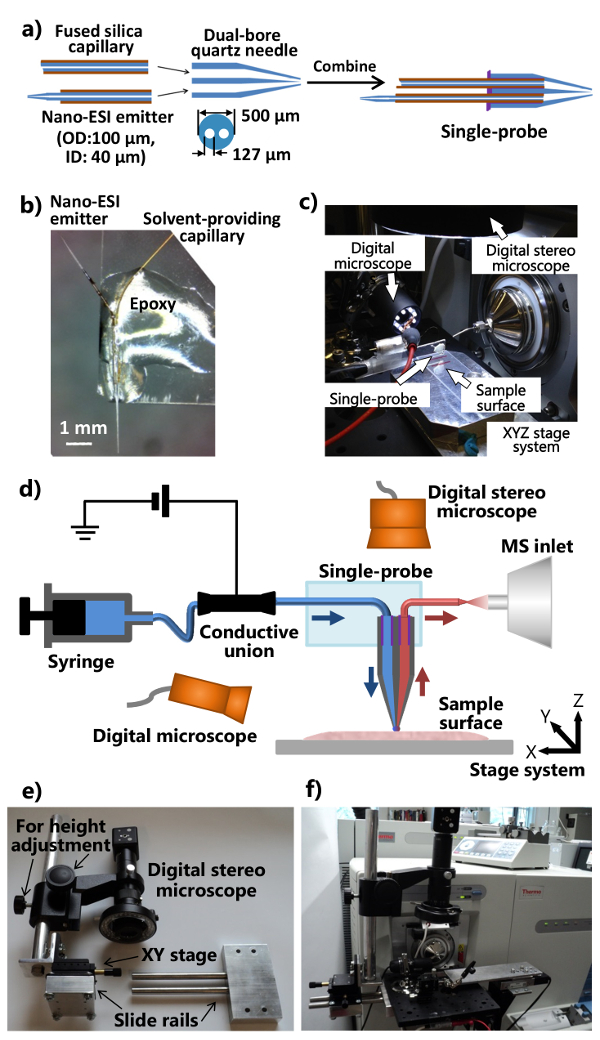
図1作製と周囲MSIとSCMS分析のための単一のプローブのセットアップ。a) の単一のプローブの作製手順。b)のガラススライドするc)単一の写真に添付作製し、単一のプローブの写真質量分析計に取り付けられたプローブの設定。D)質量分析計で結合されたシングルプローブのセットアップの図。実験中、サンプリング溶媒を連続的にシリンジから提供され、イオン化電圧は、質量分析計からの導電性組合に適用され、2つのデジタル顕微鏡は、サンプルの配置を監視するために使用され、電動XYZステージシステムサンプルモーションを制御するために使用され、質量分析計を分析のために使用されます。カスタマイズされたデジタルステレオスコープシステムのe)の写真。f)の光学基板を介してイオン源インターフェイスのフランジに取り付けられたデジタルステレオスコープを示す写真。 にはこちらをクリックしてくださいこの図の拡大版を表示します。
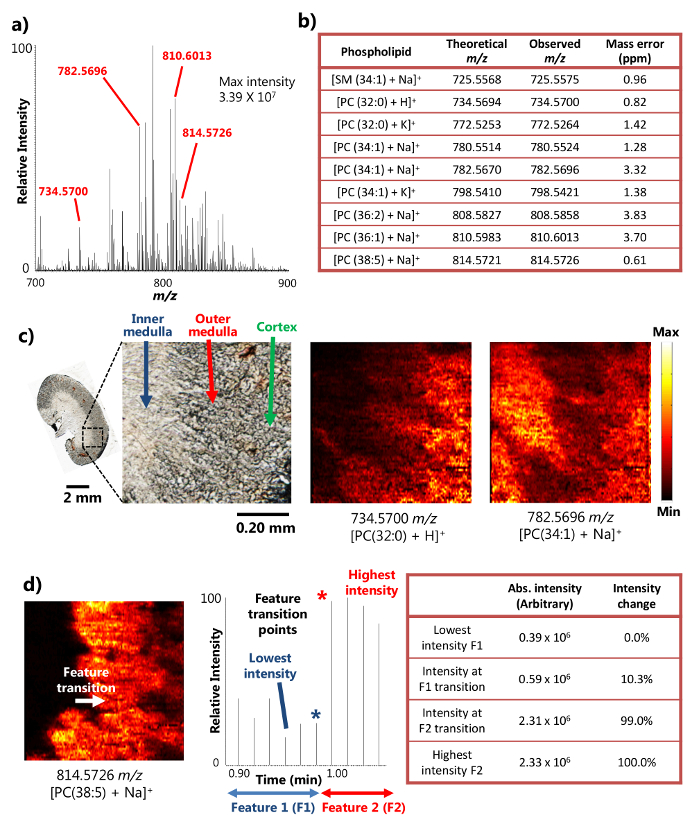
高い空間と質量分解能を有するマウス腎臓部の周囲MSIの研究から、図2の結果。シングルプローブMSIからa)の代表的な質量スペクトル。検出された代謝物の最大強度は、3.39×10 7(任意の単位)に到達することができます。彼らの質量精度を提示検出代謝物のb)に選択するc)MSの画像[PC(32:0)+ H] +および[PC(34:1)+のNa] + 8.5μmの空間分解能でマウスの腎臓切片から取りました。 PC:ホスファチジルコリン。スケールバー:2ミリメートル; 0.20ミリメートル(挿入図)d)の空間のためのMS画像の解像度の決意。[PC(38:5)+のNa] +(参照15から許可を得て適応)。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図は、高質量分解能を有する薬剤処理したHeLa細胞の周囲SCMS解析から3.結果は。a) のズームアップ直径<10μmの典型的な大きさを示す単一プローブ先端の写真。b)の写真の時点で採取されましたHeLa細胞へのシングルプローブ挿入。スケールバー:50μmです。C)PC(ホスファチジルコリン)種。D)HeLa細胞の正と負イオンモードインチEFの両方)のための質量スペクトルのSCMS分析から検出された代謝物の代表的なリストの数の識別情報を持つ典型的な陽イオンモードの質量スペクトル対照および処理(100 nMのOSW-1)細胞(参照16から許可を得て適応)。 この図の拡大版をご覧になるにはこちらをクリックしてください。
図S1。データを収集するために質量分析計のための接点信号を生成するために使用される電子機器の回路図である。 この図を表示またはダウンロードするにはこちらをクリックしてください。
ディスカッション
単一プローブはMSIとSCMS両方の実験のために使用することができる多機能装置です。 (並進ステージシステム、顕微鏡、イオン源インタフェースフランジ、 等を含む)単一のプローブの設定を柔軟に既存の質量分析計に適合させることができるアドオンコンポーネントとして設計されています。単一プローブセットアップと従来のESIイオン源間の迅速な交換は、1分以内に達成することができます。原理的には、適切なイオン源インタフェースフランジを使用して、単一のプローブの設定は、他の質量分析計に適合させることができます。さらに、種々の試薬を含むサンプリング溶媒が大きく生体分子のより広い範囲の検出を増強反応MSI及びSCMS実験のために単一のプローブの設定で使用することができます。動物組織および細胞株に加えて、単一のプローブはまた、植物などの他の生物学的システムを分析することが可能です。そのため、同じ実験のセットアップとと同様のユーザのトレーニングは、研究の様々な単一機器を使用して行うことができ、同一のユーザが、最小のトレーニング時間及び計装コストで実現することが効率的で多用途の実験を可能にします。
シングルプローブMS技術の重要な要素は、プローブそのものです。シングルプローブの品質が大幅に両方のMSIとSCMS実験の品質を決定し、その性能、に大きな影響を与えています。単一のプローブを作製する場合、デュアルボアチューブの内側の毛細血管が確実に実験中の溶剤漏れの可能性を排除するために接着されていることを確認します。オリフィスおよび毛細血管をプローブ製造中に目詰まりしないように、UV硬化性エポキシ樹脂の最小量を使用することが重要です。
単一プローブを生体試料15の高空間分解能質量周囲MSIを実施するために使用されています。周囲MSIの上の主な利点非周囲方法サンプル調製は、サンプルが近く天然状態8で分析することを可能にする真空サンプリング環境を必要とせず、最小に保たれることです。他のほとんどの周囲MSI技術のための主要な障害の1つは、空間分解能1の欠如となっています。 (このようなDESIとLAESIなど)脱着ベースMSI技術と比較して、単一のプローブの小さなチップサイズは、高空間分解能につながる、小領域の上、実行するより堅牢かつ効率的な表面の液マイクロ抽出を可能にします周囲MSI技術15を使用して達成された最高のものの中で8.5μmで、。また、サンプリング溶媒の成分を調整する実験を行うために余分な柔軟性を提供します。例えば、試薬( 例えば 、ジカチオン性化合物)を含有する溶媒をサンプリングすると、識別された代謝物のPEの数の大幅な増加を可能にする、反応性MSI実験を行うために使用されていますrの実験20。単一プローブの他の利点は、全データの取得処理時の動作の容易さを提供する統合された設計です。先端と組織表面との間の距離は、イオン信号強度と安定性のために非常に敏感であるので、平坦な組織切片を取得し、距離の分散を最小にするように表面平坦化調整を実施することは、高品質MSI実験のためのキーです。単一のプローブMSI技術が凹凸面の高空間MS画像を得るのに適していないということになります。
高品質のプローブを作製することに加えて、慎重に機器のチューニングが成功MSI実験のために不可欠です。すべてのチューニング・ステップの中で、組織切片表面上の単一プローブ先端の高さを調整することは最も重要なものです。プローブの高さを調整する場合、サンプリング溶媒ポンプおよび溶媒のみ背景イオン信号をobservできるように、イオン化電圧をオンにしますエド。慎重に組織切片からの強力かつ安定したイオンシグナルが観察されるまで電動Zステージを持ち上げてプローブ表面の距離を低減しつつ、その後の質量スペクトルの変化を監視します。このプローブの高さは、実験中にMSIのデータ収集のために使用されます。また、最適化された溶媒の流量は、MSIの実験のために不可欠です。最適化されたプローブの高さで流量を調整します。ナノESIエミッタの内部には、溶剤組織表面上のスプレッド( すなわち 、流量が高すぎる)または気泡形成( すなわち 、流量が低すぎる)がないことを確認してください。
シングルプローブは、生物分析のための多機能デバイスです。 MSIの実験に加えて、SCMSは、MALDI 10やSIMSなどの他の真空ベースのSCMS技術(と比べて大きな利点である、生きた真核細胞16から詳細な化学情報を解明するために、その場でリアルタイムに近く行うことができ、 21 )。プローブ先端のサイズが小さい生真核細胞に挿入されると即座MS分析のための細胞内化合物を抽出し、イオン化する能力を提供します。同様に、試薬( 例えば 、ジカチオン性化合物)を含有するサンプル溶媒はSCMS実験に使用することができ、細胞成分のより広い範囲がこれまで以上にライブ単一細胞で検出することができる(進行中の研究は、データは示していません)。リアルタイム分析は、膜と細胞内容の抽出の細胞透過に、生きた単一細胞の化学的特性を提供しますが、調査中の細胞は、単一のプローブSCMS技術はまだであることを暗示している、実験後に殺されます破壊的な方法。また、単一のプローブでプローブチップとナノESIエミッターを容易に不慣れなユーザのために目詰まりすることができます。セルにシングルプローブ先端を挿入するときに、デバイスの目詰まりの可能性を減らすために、核を触れないように確認してくださいリットル。目詰まりが発生した場合、デバイスは、手製の加熱コイル16を用いて、詰まったプローブチップまたはナノESIエミッタを加熱することによって再生することができます。単一プローブSCMS技術の他の制限は、接着性細胞( すなわち 、細胞が表面に付着している)現在の設定を使用して分析することができることです。しかしながら、単一プローブMS装置に細胞操作システムを組み込むことにより、細胞の広範な種類が将来的に研究することができます。
MSIの実験と同様に、高品質のプローブと最適化された溶媒の流量を得ることがSCMS研究にとって重要です。溶媒の流量を調整するときは、シングルプローブ先端( すなわち 、細胞または培養培地と接触無し)サンプルの上に配置され、ナノESI内部のプローブ・チップやバブル形成からの溶剤滴下がないことを確認され、エミッタ。
開示事項
We have no conflict of interest to declare with the work presented here.
謝辞
The authors would like to thank Dr. Laskin (the Pacific Northwest National Laboratory) for sharing the motorized stage control software and MSI visualization program. We also thank Dr. Mao (the University of Oklahoma) for providing mouse organ samples and Mr. Chad E. Cunningham (the University of Oklahoma) for the assistance in machining and electronics work. This research was supported by grants from the Research Council of the University of Oklahoma Norman Campus, the American Society for Mass Spectrometry Research Award (sponsored by Waters Corporation), Oklahoma Center for the Advancement of Science and Technology (Grant HR 14-152), and National Institutes of Health (R01GM116116).
資料
| Name | Company | Catalog Number | Comments |
| Single-probe fabrication | |||
| Dual bore quartz tubing, 1.120’’ × 0.005” × 12” | Friedrich & Dimmock, Inc, Millville, NJ | MBT-005-020-2Q | |
| Micropipette laser puller | Sutter Instrument Co., Novato, CA | Model P-2000 | |
| Fused silica capillary, ID: 40 µm, OD: 110 µm | Molex, Lisle, IL | TSP040105 | |
| UV curing resin | Prime Dental, Prime-Dent, Chicago, IL, USA | Item No. 006.030 | |
| LED UV lamp | Foshan Liang Ya Dental Equipment, Guangdong, China | LY-C240 | |
| Epoxy resin | Devcon, Danvers, MA | Part No. 20945 | |
| Inline MicroFilter | IDEX Health & Science LLC, Lake Forest, IL | M-520 | |
| Microunion | IDEX Health & Science LLC, Lake Forest, IL | M-539 | |
| Microscope slide (glass) | C & A Scientific - Premiere, Manassas, VA | 9105 | |
| Syringe | Hamilton, Reno, NV | 1725LTN 250UL | |
| Mass spectrometer | |||
| LTQ Orbitrap Mass sprectrometer | Thermo Fisher Scientific, Inc., Waltham, MA | LTQ Orbitrap XL | |
| Xcalibur 2.1 Software | Thermo Fisher Scientific, Inc., Waltham, MA | XCALIBUR21 | |
| Fance Stage Control | Pacific Northwest National Laboratory, Richland, WA | ||
| MSI QuickView | Pacific Northwest National Laboratory, Richland, WA | ||
| Contact closure device | |||
| USB-6009 Multifunction DAQ | National Instruments, Austin, TX | 779026-01 | |
| DR-5V SDS Relay | Panasonic, Kadoma, Japan | DR-SDS-5 | |
| Logic Gates 50 Ohm Line Driver | Texas Instruments, Dallas, TX | SN74128N | |
| Single-probe setup | |||
| Motorized linear stage and controller (3 sets) | Newport, Irvine, CA | Conex-MFACC | |
| Miniature XYZ stage | Newport, Irvine, CA | MT-XYZ | |
| Translation XY stage | ThorLab, Newton, NJ | PT1 and PT102 | |
| Thermo LTQ XL ion source interface flange | New Objective, Woburn, MA | PV5500 | |
| Digital stereo microscope, 250X - 2,000X | Shenzhen D&F Co., Shenzhen, China | Supereyes T004 | |
| USB Digital Photography Microscope | DX.com, HongKong, China | S02 25~500X | |
| Syringe pump | Chemyx Inc., Stafford, TX | Nexus 3000 | |
| Solid Aluminum Optical Breadboard, 8" x 8" x 1/2" | Thorlabs, Newton, NJ | MB810 | |
| Flexible clamp holder | Siskiyou, Grants Pass, OR | MXB-3h | |
| Solvents | |||
| Methol | Sigma-Aldrich, St. Louis, MO | 34860 Chromasolv | |
| Water | Sigma-Aldrich, St. Louis, MO | W4502 | |
| Acetonitrile | Sigma-Aldrich, St. Louis, MO | 34967 Chromasolv | |
| Cell culture | |||
| Dulbecco’s Modified Eagle’s Medium (DMEM) | Cellgro, Manasas, VA | 10-013-CV | |
| 10% heat-inactivated fetal bovine serum (FBS) | Gibco/Life Technologies, Long Island, NY | 10100-139 | |
| Penicillin/Streptomycin | Cellgro, Manasas, VA | 30-002-CI | |
| 10 mM HEPES (pH 7.4) | Cellgro, Manasas, VA | 25-060-CI | |
| Phosphate Buffered Saline (PBS) | Cellgro, Manasas, VA | 46-013-CM | |
| TrypLE Express | Thermo Fisher Scientific, Waltham, MA | 12604-013 | |
| 12-well plates | Corning Inc., Corning, NY | Falcon 351143 | |
| T25 flask | Corning Inc., Corning, NY | Falcon 3055 | |
| Micro Cover Glasses, Round, No. 1 | VWR International, Radnor, PA | 48380-046 | |
| DMSO (Dimethyl Sulfoxide) | VWR International, Radnor, PA | BDH1115-1LP | |
| Tissue imaging | |||
| Cyro-Cut Microtome | American Optical Coporation | ||
| Tissue-Tek, Optimum cutting temperature (OCT) | Sakura Finetek Inc., Torrance, CA | 4583 | |
| Microscope slide (polycarbonate) | Science Supply Solutions, Elk Grove Village, IL | P11011P | |
参考文献
- Vickerman, J. C. Molecular imaging and depth profiling by mass spectrometry-SIMS, MALDI or DESI?. Analyst. 136 (11), 2199-2217 (2011).
- Schwamborn, K. Imaging mass spectrometry in biomarker discovery and validation. J. Proteomics. 75 (16), 4990-4998 (2012).
- Schwamborn, K., Caprioli, R. M. MALDI Imaging Mass Spectrometry - Painting Molecular Pictures. Mol Oncol. 4 (6), 529-538 (2010).
- Kraft, M. L., Klitzing, H. A. Imaging lipids with secondary ion mass spectrometry. Biochim. Biophys. Acta. 1841 (8), 1108-1119 (2014).
- Wiseman, J. M., et al. Desorption electrospray ionization mass spectrometry: Imaging drugs and metabolites in tissues. Proc Natl Acad Sci U S A. 105 (47), 18120-18125 (2008).
- Nemes, P., Woods, A. S., Vertes, A. Simultaneous imaging of small metabolites and lipids in rat brain tissues at atmospheric pressure by laser ablation electrospray ionization mass spectrometry. Anal. Chem. 82 (3), 982-988 (2010).
- Laskin, J., Heath, B. S., Roach, P. J., Cazares, L., Semmes, O. J. Tissue Imaging Using Nanospray Desorption Electrospray Ionization Mass Spectrometry. Anal. Chem. 84 (1), 141-148 (2012).
- Wu, C., Dill, A. L., Eberlin, L. S., Cooks, R. G., Ifa, D. R. Mass spectrometry imaging under ambient conditions. Mass. Spectrom. Rev. 32 (3), 218-243 (2013).
- Altschuler, S. J., Wu, L. F. Cellular heterogeneity: do differences make a difference?. Cell. 141 (4), 559-563 (2010).
- Amantonico, A., Urban, P. L., Fagerer, S. R., Balabin, R. M., Zenobi, R. Single-Cell MALDI-MS as an Analytical Tool for Studying Intrapopulation Metabolic Heterogeneity of Unicellular Organisms. Anal. Chem. 82 (17), 7394-7400 (2010).
- Passarelli, M. K., Ewing, A. G., Winograd, N. Single-cell lipidomics: characterizing and imaging lipids on the surface of individual Aplysia californica neurons with cluster secondary ion mass spectrometry. Anal. Chem. 85 (4), 2231-2238 (2013).
- Shrestha, B., et al. Subcellular metabolite and lipid analysis of Xenopus laevis eggs by LAESI mass spectrometry. PLoS One. 9 (12), e115173 (2014).
- Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. Live single-cell video-mass spectrometry for cellular and subcellular molecular detection and cell classification. J. Mass. Spectrom. 43 (12), 1692-1700 (2008).
- Zhang, L., et al. In Situ metabolic analysis of single plant cells by capillary microsampling and electrospray ionization mass spectrometry with ion mobility separation. Analyst. 139 (20), 5079-5085 (2014).
- Rao, W., Pan, N., Yang, Z. High Resolution Tissue Imaging Using the Single-probe Mass Spectrometry under Ambient Conditions. J. Am. Soc. Mass. Spectrom. 26 (6), 986-993 (2015).
- Pan, N., et al. The single-probe: a miniaturized multifunctional device for single cell mass spectrometry analysis. Anal. Chem. 86 (19), 9376-9380 (2014).
- Thomas, M., et al. Visualization of High Resolution Spatial Mass Spectrometric Data during Acquisition. 2012 Annual International Conference of the Ieee Engineering in Medicine and Biology Society (Embc). , 5545-5548 (2012).
- Luxembourg, S. L., Mize, T. H., McDonnell, L. A., Heeren, R. M. High-spatial resolution mass spectrometric imaging of peptide and protein distributions on a surface. Anal. Chem. 76 (18), 5339-5344 (2004).
- Zhou, Y., et al. OSW-1: a natural compound with potent anticancer activity and a novel mechanism of action. J Natl Cancer Inst. 97 (23), 1781-1785 (2005).
- Rao, W., Pan, N., Tian, X., Yang, Z. High-Resolution Ambient MS Imaging of Negative Ions in Positive Ion Mode: Using Dicationic Reagents with the Single-Probe. J. Am. Soc. Mass. Spectrom. 27 (1), 124-134 (2016).
- Ostrowski, S. G., Kurczy, M. E., Roddy, T. P., Winograd, N., Ewing, A. G. Secondary ion MS imaging to relatively quantify cholesterol in the membranes of individual cells from differentially treated populations. Anal. Chem. 79 (10), 3554-3560 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved