Method Article
Applicazioni del singolo-probe: Mass Spectrometry Imaging e analisi singola cella in condizioni ambientali
In questo articolo
Riepilogo
Here, we present protocols to perform both ambient mass spectrometry imaging (MSI) of tissues and in-situ live single cell MS (SCMS) analysis using the single-probe, which is a miniaturized multifunctional device for MS analysis.
Abstract
Mass spectrometry imaging (MSI) and in-situ single cell mass spectrometry (SCMS) analysis under ambient conditions are two emerging fields with great potential for the detailed mass spectrometry (MS) analysis of biomolecules from biological samples. The single-probe, a miniaturized device with integrated sampling and ionization capabilities, is capable of performing both ambient MSI and in-situ SCMS analysis. For ambient MSI, the single-probe uses surface micro-extraction to continually conduct MS analysis of the sample, and this technique allows the creation of MS images with high spatial resolution (8.5 µm) from biological samples such as mouse brain and kidney sections. Ambient MSI has the advantage that little to no sample preparation is needed before the analysis, which reduces the amount of potential artifacts present in data acquisition and allows a more representative analysis of the sample to be acquired. For in-situ SCMS, the single-probe tip can be directly inserted into live eukaryotic cells such as HeLa cells, due to the small sampling tip size (< 10 µm), and this technique is capable of detecting a wide range of metabolites inside individual cells at near real-time. SCMS enables a greater sensitivity and accuracy of chemical information to be acquired at the single cell level, which could improve our understanding of biological processes at a more fundamental level than previously possible. The single-probe device can be potentially coupled with a variety of mass spectrometers for broad ranges of MSI and SCMS studies.
Introduzione
Mass spectrometry imaging (MSI) is a relatively new molecular imaging technique to provide the spatial distribution of the compounds of interest on surfaces. During the MSI analysis, mass spectrometry (MS) measurements are recorded across the surface on an individual pixel basis to create a 2D image of the species of interest 1. MSI techniques have the ability to provide a spatially resolved feature distribution for a large range of metabolites, allowing a much greater amount of information to be obtained from a sample than from using traditional molecular imaging techniques, and they have the potential to greatly improve the analysis of biological samples for biological and pharmacology studies 2. MSI can be broadly separated into non-ambient and ambient approaches. The non-ambient MSI analysis techniques, such as matrix assisted laser desorption ionization (MALDI) MS 3 and time of flight secondary ion MS (ToF SIMS) 4, are capable of high spatial resolution (around 5 µm and 100 nm, respectively) and high sensitivity. However, these methods require extensive sample preparation, such as the application of matrix molecules to the sample surface, and a vacuum sampling environment, which could introduce artifacts to the data obtained. Ambient techniques such as desorption electrospray ionization (DESI) MS 5, laser ablation electrospray ionization (LAESI) MS 6, and nano-DESI MS 7 are capable of MSI of samples with little to no prior preparation under the ambient environment, which is able to produce MS images that potentially reflect the sample in its most native state. However, most of these techniques generally lack the high spatial resolution and detection sensitivity compared with the non-ambient techniques, with experiments typically conducted at around 150 µm per pixel 8.
Single cell analysis (SCA) is a growing field that has the ability to characterize the chemical composition of biological samples at the cellular level. SCA enables the analysis of biological systems at a more fundamental level than traditional cell analysis techniques, which produce an averaged result of a population of cells, potentially providing insights that are previously intractable 9. MS techniques have recently been applied to SCA (termed single cell mass spectrometry or SCMS) using non-ambient techniques such as MALDI MS 10 and ToF SIMS 11 in which cells are pretreated before analysis, and with ambient techniques such as LAESI MS 12 and direct extraction methods, such as live single-cell video-MS 13, 14, to analyze a wide variety of cell types such as egg, plant, and cancer. Ambient techniques have the advantage of being applied to live cells, which again minimizes the artifacts, leading to a better representation of the metabolites in the live cells. The direct extraction based methods described above, however, perform the sample extraction and analysis process at two different steps, which result in a time gap during the analysis that could potentially alter the metabolites present within the sample.
The single-probe, a miniaturized multifunctional device that is capable of conducting high spatial resolution ambient MSI on biological tissue sections 15 and near real-time in-situ SCMS on live single cells 16. The single-probe has an integrated construction that is made up of a pulled dual-bore quartz capillary coupled with a solvent providing inlet and a nano-ESI emitter made from fused silica capillaries, enabling solvent delivery and analyte extraction to be performed from a single device. In the ambient MSI mode, the single-probe is placed over the sample tissue and surface micro-extraction occurs, allowing a rastered MS image to be made at high spatial resolution. Particularly, the tapered tip of the single-probe is small enough to be inserted into live eukaryotic cells for in-situ SCMS analysis, where the metabolite detection takes less than two seconds between probe insertion and MS detection, allowing chemical information to be taken in near real-time. Here are the protocols to fabricate the single-probe device and to conduct both the ambient MSI and SCMS modes using the single-probe MS techniques.
Protocollo
uso e benessere degli animali devono aderire alla guida NIH per la cura e l'uso di animali da laboratorio seguendo protocolli esaminato e approvato dal Comitato Istituzionale Animal Care e Usa (IACUC). campioni di tessuto del mouse sono stati forniti dal collaboratore Dr. Chuanbin Mao.
1. Tessuto mouse sezione Preparazione
- Collocare un intero organo topo di interesse (cervello, rene, fegato, ecc) nel centro di un piccolo plastica pozzetto (es, 12-pozzetti di coltura cellulare), e immergere nel tessuto incorporamento composto fino a circa 10 mm di altezza. Assicurarsi che non vi è alcuna bolla formata nel composto incorporamento dei tessuti, e l'organo è collocata in posizione desiderata (cioè, sagittale, coronale, etc.).
- Immediatamente posto tessuti in azoto liquido per il flash di congelamento. Per la conservazione a lungo termine, conservare i campioni congelati in un freezer -80 ° C.
- Prendere l'organo congelati mouse e scongelare a -15 ° C in una temperi criomicrotomo controllata.
- tessuto sicura su base in acciaio con circa 500 ml di tessuto composto incorporamento e posto su un criomicrotomo sezionamento supporto in modo che l'orientamento sezionamento desiderati viene presentato al coltello.
- Sezione tessuto ad uno spessore 12 micron. Mettere le fette di tessuto sezionati su vetrini da microscopio in policarbonato e lasciare asciugare per 30 minuti a temperatura ambiente. Per la conservazione a lungo termine, conservare il vetrino congelato in un -80 ° C freezer.
Culture 2. cellulare
Nota: La coltura cellulare è stata eseguita in cappa di sicurezza biologica (Biosafety livello II) in condizioni sterili. linea cellulare HeLa è stata utilizzata come sistema modello, e le cellule sono state coltivate in mezzo completo di coltura con i seguenti protocolli convenzionali:
- Reagenti caldi (ad esempio, tripsina, tampone fosfato salino (PBS), e coltura cellulare medie) a 37 ° C.
Nota: Il terreno di coltura cellulare contenente sa inorganicoLTS, aminoacidi, vitamine, e altri. Per un elenco completo dei componenti, fare riferimento alla formulazione dal produttore. - Ottenere campione cellulare (ad esempio, 1 ml di sospensione di cellule HeLa) ed inserirlo in 9 ml di mezzo completo di coltura cellulare in una piastra di coltura cellulare standard 10-cm. Il numero di cellule iniziale è intorno a 0,5 x 10 6 cellule / ml. Mantenere cellule in coltura a 37 ° C con 5% di CO 2 per 2-3 giorni finché la superficie è coperta crescente a 70-80% sulla piastra di coltura cellulare. numero di cellulare di passaggio record per ogni turno successivo.
- Eseguire passaging cellule (cioè, splitting cella) nella piastra di coltura cellulare.
- Aspirare mezzo di crescita, e usare 5 ml di PBS 1x per sciacquare le cellule. Rimuovere PBS utilizzando una punta di aspirazione sterile e incubare le cellule con 2,5 ml di tripsina (0,25%) per ~ 5 min a 37 ° C per staccare le cellule dalla piastra di coltura.
Nota: è necessario il tempo effettivo trattamento tripsina essere ottimizzata in base alla specifica produ tripsinact ha acquistato dal produttore. tempo di trattamento inadeguata lascia le cellule attaccate alla piastra, mentre il trattamento eccessivo porta alla morte cellulare. - Interrompere l'attività tripsina aggiungendo 7,5 ml completa mezzo di coltura cellulare, e quindi risospendere uniformemente le cellule (volume totale 10 ml). Utilizzare la sospensione cellulare per la cultura (passo 2.2) o nella preparazione di campioni SCMS (passo 2,4).
- Aspirare mezzo di crescita, e usare 5 ml di PBS 1x per sciacquare le cellule. Rimuovere PBS utilizzando una punta di aspirazione sterile e incubare le cellule con 2,5 ml di tripsina (0,25%) per ~ 5 min a 37 ° C per staccare le cellule dalla piastra di coltura.
- Preparare i campioni di cellule per gli esperimenti SCMS.
- Mettere diapositive singole micro copertura in un 12-pozzetti e aggiungere terreno di coltura 1,8 ml di cellule e 0,2 ml di sospensione cellulare nel pozzo.
- Mescolare delicatamente le cellule con leggera agitazione della piastra e incubare in un ambiente 5% di CO 2 a 37 ° C per ~ 24 ore. Per eseguire il trattamento farmacologico alle cellule in coltura, aggiungere una soluzione composto medicinale (ad esempio, in DMSO (dimetilsolfossido)) nella piastra di coltura cellulare 12 pozzetti.
Nota: La concentrazione di farmaco finale (ad esempio, 10 nM, 100 nM, 1 mM e 10 mM) e ttempo RATTAMENTO (ad esempio, 4 ore) sono varie a seconda dello scopo specifico degli studi. Le cellule sono attaccati alle diapositive micro copertura e pronto per gli esperimenti CSMS (passo 6).
3. Single-sonda Fabrication
- Posizionare il dual-bore tubo di quarzo (diametro interno (ID) 127 micron, diametro esterno (OD) a 500 micron) in una micropipetta estrattore laser e tirare un ago al quarzo dual-bore. Utilizzare i seguenti parametri come punti di partenza: Calore = 400, Fil = 3, Vel = 80, Del = 150, e Pul = 250 (tutte le unità sono unità del produttore). Assicurarsi che l'ago doppio foro di quarzo tirato ha una punta rastremata per le proprietà ottimali sonda. Tagliare la punta tirata in modo che ci sia di ~ 5 mm lungo di unpulled dual-bore capillare quarzo sinistra all'altra estremità.
Nota: I parametri attuali del tenditore laser devono essere ottimizzati in funzione delle condizioni specifiche dello strumento. - Tagliare una sezione ~ 80 mm capillare di silice fusa (ID 40 micron, OD. 105 micron) come solvente fornire capillare, e inserirla in un foro all'estremità piatto dell'ago quarzo dual-bore.
- Tagliare una sezione ~ 40 mm capillare di silice fusa (ID 40 micron, OD 105 micron) e usare un rasoio per radere ~ 5 mm dal rivestimento in poliimmide dal punto centrale. Utilizzare una fiamma di propano per riscaldare e tirare la capillare fusi in un emettitore nano-elettrospray ionizzazione (ESI) con un bel cono in fretta. Tagliare un emettitore nano-ESI (~ lungo 7-10 mm), e inserirlo nel l'altro foro alla fine piatto dell'ago al quarzo dual-bore. In alternativa, utilizzare l'estrattore laser per produrre un bel cono.
- Applicare una quantità minima di (~ 1-2 microlitri) UV resina indurimento sull'estremità piatto dell'ago quarzo dual-bore e solidificare la resina utilizzando una lampada UV a LED per ~ 20 sec per fissare il solvente fornendo capillare e nano ESI emettitore. Le procedure per assemblare le singole parti in un unico sonda sono mostrati in figura 1a.
- Tagliare un gl microscopio di seriescivolo ass (1 "x 3") nella metà per il lungo. Posizionare la singola sonda sul un'estremità del vetrino in modo che l'emettitore nano-ESI è puntato verso l'esterno. Applicare la resina epossidica regolare al corpo della singola sonda in modo che diventi fissato sul vetrino (Figura 1b). Lasciar riposare per l'indurimento. Coppia il fabbricato single-sonda con la messa a punto integrato single-sonda (Figura 1c), che è attaccato ad uno spettrometro di massa, come illustrato nella figura 1d.
4. Costruire il programma di installazione di MS integrato Single-sonda
- Modificare la flangia interfaccia sorgente ionica dello spettrometro di massa e fabbricare il supporto (con posizione regolabile e altezza) dello stereoscopio digitale (figure 1e e 1f).
- Praticare una flangia di interfaccia sorgente ionica con due fori che consentono il collegamento di una scheda ottica in alluminio. Fare un dispositivo di guida di scorrimento e un asta di regolazione in altezza (allegato aluno stadio XY per controllo fine della posizione), tale che il sistema stereoscopio digitale può essere collegato alla scheda ottica di alluminio (Figura 1e).
- Attaccare il microscopio modificato stereo digitale, un microscopio digitale USB, un XYZ fase traslazione manuale miniatura con un supporto morsetto flessibile, il motorizzata sistema fase di traduzione XYZ alla scheda ottica di alluminio, che è montato sull'interfaccia flangia sorgente ionica misura dello spettrometro di massa (figure 1c e 1f). Utilizzare il supporto morsetto flessibile per riparare il vetrino fissato con un single-sonda.
- Fissare la configurazione single-sonda al spettrometro di massa (Figura 1F). Regolare il supporto morsetto flessibile e la fase XYZ miniatura per posizionare l'emettitore del singolo sonda di fronte alla entrata dello spettrometro di massa. Utilizzare il microscopio digitale USB (con angolo di vista registrabile) sul lato della singola sonda per fornire un'immagine zoomata del singolo-ppunta accappatoio o l'emettitore nano-ESI, e lo stereoscopio digitale (regolabile in altezza) al di sopra del singolo-sonda per visualizzare le cellule e la punta della sonda.
Nota: Utilizzando la flangia sorgente ionica corrispondente, questo sistema a singolo sonda integrata può essere accoppiato ad altri tipi di spettrometri di massa con sorgente di ionizzazione ambiente.
5. ambiente MSI
- Scongelare la sezione campione a temperatura ambiente e posizionarlo sulla motorizzata sistema fase di traduzione XYZ sotto il singolo-sonda. Regolare la posizione del campione cambiando le coordinate nel software di controllo.
- Usando la siringa per pompare il solvente di campionamento ad un tasso adeguato (ad esempio, 0,2 ml / min), e applicare la tensione di ionizzazione (ad esempio, 5 kV). La scelta del solvente campionamento è flessibile, e quelli comuni includono MeOH: acqua (9: 1) e acetonitrile. Il volume morto del emettitore nano-ESI è stata stimata essere ~ 3 nl, e il tempo tra la sonda-surfacontatto ce e l'osservazione del segnale di ioni è di solito meno di 1 sec 15.
Nota: La flangia di interfaccia sorgente ionica personalizzata permette la tensione di ionizzazione da consegnare dal spettrometro di massa ad una unione conduttivo attraverso un coccodrillo. La tensione di ionizzazione viene poi trasmesso attraverso una unione conduttivo al solvente all'interno del capillare e canali singola sonda, e applicata sulla emettitore nano-ESI per ionizzare gli analiti nel campione. Assicurarsi che la tensione di ionizzazione viene spento quando si collega la clip coccodrillo con l'unione conduttivo. - Regolare l'altezza della singola sonda in modo che sia appoggiata appena sopra la superficie del campione e in grado di eseguire superficie estrazione di metaboliti. Sollevare attentamente la Z-fase, e quindi utilizzare il microscopio digitale USB (sul lato della singola sonda) per monitorare la variazione della distanza tra la punta singola sonda e superficie del tessuto. Monitorare i cambiamenti nello spettro di massa durante questa regolazione in altezza, e smettere di ascensoreing Z-fase in cui si osserva una variazione del segnale di ioni da sfondo solvente metaboliti tissutali.
- Ripetere il punto 5.3 a tre volte per impostare tre diversi punti all'interno del programma di controllo fase per la regolazione spianatura superficiale automatizzato. Posizionare la punta della singola sonda a tre punti sulla superficie del campione ad una distanza di circa 10 mm l'uno dall'altro. Eseguire la regolazione in altezza premendo su e giù le icone, e bloccare i tre punti in posizione sotto il "metodo Piano".
- Impostare altri parametri per raster attraverso la sezione di interesse all'interno del campione utilizzando questo programma. Per le sezioni di rene di topo qui presentati, utilizzare un / sec di velocità rastering 10,0 micron e 20 micron distanza tra le linee. Il sistema palco motorizzato ha un movimento di 0,1 micron minimo incremento. La distanza tra la punta singola sonda e tessuti è ottenuta dal passaggio 5.3.
- Impostazione di un metodo per l'acquisizione automatica di MS dalla spettrometro di massa. foR risoluzione di massa ad alta MSI su un campione di rene di topo, utilizzare i seguenti parametri: risoluzione di massa 60.000 (m / Δm), ~ modalità positiva 5 kV, 1 Microscan, tempo di iniezione di 150 msec max, e AGC su. Tutti gli spettri MS acquisiti rappresentano singole linee dell'immagine MS avevano lo stesso numero di scansioni con spaziatura temporale uniforme fra ciascuna scansione, indicando che le dimensioni dei pixel per le immagini prodotte sono stati distribuiti uniformemente.
- Avviare l'acquisizione dei dati MSI. Avviare la sequenza di acquisizione MS per lo spettrometro di massa, e quindi avviare la sequenza di rasterizzazione per il programma di controllo XYZ.
- Ad esempio, nel programma di acquisizione dati MS utilizzati qui, andare a "setup Sequence", selezionare "Nuovo sequenza", generare un insieme di file per una nuova sequenza numerata da 01 a X, dove X è il numero di linee utilizzate per la immagine MS desiderato da prendere, e quindi premere "sequenza di esecuzione".
- Utilizzare un dispositivo elettronico in casa per consentire al software di produrre una contasegnale di chiusura ct per lo spettrometro di massa per raccogliere i dati. Lo schema elettrico è mostrato nella figura supplementare (Figura S1) come riferimento.
- Costruire immagini MS da file RAW MS utilizzando appropriati software di visualizzazione MSI. Ad esempio, quando si utilizza il pacchetto software sviluppato dal gruppo di Laskin a PNNL 17, effettuare le seguenti operazioni.
- Fai clic su "File sopracciglia." Selezionare il primo file ottenuto dall'esperimento MSI. Specificare la posizione del file inizia e finisce in "Numero di linee". Selezionare un intervallo di valori m / z per la gamma immagine MS sotto "Enter MZ Range".
- Premere il pulsante "Start" per avviare il processo di creazione dell'immagine. Una volta che l'immagine di MS è fatto, fai clic su "Salva immagine" sotto "Barra degli strumenti" per memorizzare le immagini nel computer.
6. In-situ dal vivo SCMS
- Imposta il sistema single-sonda per istruireioni per MSI. Regolare il solvente (ad esempio, MeOH / H 2 O o acetonitrile) Portata (ad esempio, ~ 25 nl / min).
- Lavare le cellule in coltura, che sono attaccati sugli scivoli micro vetro di copertura, con PBS per rimuovere il supporto culturale e componenti di droga extracellulari. Mettere cella contenente vetrino sul motorizzata sistema fase di traduzione XYZ per l'esperimento.
Nota: In alternativa, utilizzare il mezzo di coltura cellulare fresca (senza contenente siero fetale bovino) per lavare le cellule in coltura. Meno soppressione ionica è stata osservata. Inoltre, la cella può sopravvivere per più tempo durante l'esperimento in cui la temperatura ambiente (~ 20 ° C) è significativamente inferiore alla temperatura cultura (37 ° C). Il tipo di farmaco, concentrazione della soluzione, e tempo di trattamento variano in diversi studi. - Primo microscopio stereo digitale (sopra il campione) sulla punta della singola sonda per verificare la penetrazione cellulare durante l'analisi. Utilizzare il microscopio digitale USB (sul side del singolo-sonda) per monitorare le condizioni di lavoro del emettitore nano-ESI sul singolo-sonda.
- Utilizzare il programma di controllo fase XYZ motorizzato e microscopio stereo digitale (sopra celle) per individuare una cella di interesse, e di posizionare con precisione la punta singola sonda al di sopra del campione. Inizia acquisizione dati MS prima della punta singola sonda viene inserita nella cella.
- Utilizzare i seguenti parametri come riferimento per l'analisi MS con uno spettrometro di massa ad alta risoluzione: risoluzione di massa 100.000 (m / Δm), ~ modalità 3 kV positivo e negativo, 1 Microscan, 150 msec tempo di iniezione massima, la modalità AGC. acquisizione automatica di MS viene fatto clic su "Start" nel programma di acquisizione dati MS.
- Sollevare il motorizzata Z-stage facendo clic sull'icona di penetrare la membrana cellulare e mantenere la registrazione del segnale MS generato dalla cella. Un ritardo di 1-2 secondi è generalmente osservata tra l'inserimento sonda e il rilevamento del segnale MS. Come l'altra confermapenetrazione cellulare, un drastico cambiamento dei segnali MS può essere osservato dopo la penetrazione della membrana cellulare. I segnali MS di composti intracellulari di solito possono durare per ~ 15-20 secondi prima di una significativa diminuzione.
- Più in basso la cella contenente piastra per tirare la punta singola sonda dalla cellula. Richiede solitamente <15 sec per i segnali di ioni dei composti cellulari per avvicinarsi al livello di rumore. Lasciate che il flusso di solvente per ~ 3 min per svuotare completamente il singolo-sonda. Nel frattempo, posizionare il sistema fase XYZ motorizzato per individuare la cella successiva da analizzare. Ogni esperimento cella richiede ~ 3 min per essere realizzato.
Risultati
Il singolo-sonda è stata utilizzata con successo per l'ambiente analisi MSI di topo sezionato tessuto renale 15. Il dispositivo utilizza il meccanismo di liquido superficie micro-estrazione (Figura 1a), che fornisce altamente efficiente estrazione analita da una piccola area, portando ad abbondanti segnali ioni intensità nei risultati MSI. Ad esempio, le intensità di oltre 10 7 segnale siano stati raggiunti per alcuni metaboliti abbondanti (Figura 2a). Un gran numero di metaboliti sono stati rilevati in questo modo, compreso un certo numero di sfingomielina (SM) e fosfatidilcolina (PC) specie come [SM (34: 1) + Na] + (725,5575 m / z), [PC (32: 0) + H] + (734,5700 m / z), [PC (34: 1) + Na] + (782,5696 m / z), e [PC (38: 5 + Na)] + (814,5726 m / z). Questi composti sono stati identificati con alta risoluzione di massa e accuratezza di massa quando accoppiato tspettrometro di massa ad alta risoluzione OA. Per esempio, l'identificazione è stato ottenuto con meno di 4 ppm m / z accuratezza di massa (cioè, la differenza tra i valori osservati e teorici) per ciascun metabolita (Figura 2b) nei risultati qui presentati. Inoltre, tandem MS analisi (ad esempio, MS / MS) sono stati anche condotti per l'identificazione più sicuri di specie di interesse. 15
Grazie alla capacità di eseguire efficiente liquido micro-estrazione in una piccola area, il dispositivo singola sonda può essere utilizzato per eseguire esperimenti elevati risoluzione MSI spaziali in condizioni ambientali 15. Ad esempio, immagini dettagliate MS di sezioni di rene di topo sono stati ottenuti illustrante la distribuzione spaziale dei metaboliti selezionati (figura 2c). La risoluzione spaziale dell'immagine MS è stata determinata da 8,5 micron, seguendo la metrica diffuso di avere il transiti. il punto di un elemento tagliente determinata entro una variazione di intensità 20-80% del segnale MS 18 Nel caso di fosfolipide [PC (38: 5 + Na)] + sulla sezione renale mouse, la transizione tra funzionalità midollare interna e il midollo esterna avviene attraverso un ciclo di scansione nel cronogramma, con un cambiamento di intensità gamma maggiore di 20-80%. Sulla base della velocità di campionamento in movimento (10,0 micron / sec) e MS velocità di acquisizione dati (0,85 sec / spettro), il campione muove distanza in una MS di ciclo (8,5 micron), cioè, la risoluzione spaziale MSI, può essere calcolata (Figura 2d). Questa risoluzione spaziale è tra i più alti ancora raggiunto per le tecniche di MSI ambientali condotte su campioni biologici.
Per SCMS singola sonda era in grado di realizzare l'analisi delle singole cellule vive HeLa 16. La dimensione punta del singolo-sonda è in genere inferiore a 10 micron (Figure 3a), che è abbastanza piccolo da essere inserito direttamente in molti tipi di cellule eucariotiche, il cui diametro è ~ 10 micron, per l'estrazione e l'analisi MS. Il processo di inserimento della punta singola sonda in una cella può essere monitorato visivamente utilizzando un microscopio stereo digitale (Figura 3b), e la penetrazione della membrana cellulare può essere confermata mediante la rapida e significativo cambiamento di spettri di massa da PBS (o coltura cellulare fresca medio) ai composti intracellulari (figure 3C e 3D). Gli esperimenti possono essere condotti in entrambe le modalità di ioni positivi e negativi per rilevare ampi tipi di specie molecolari. Ad esempio, 18 specie diverse di lipidi sono stati identificati in modalità positiva, compresi sphingomyelins (SM) e fosfatidilcolina (PC), considerando fosfati dell'adenosina (AMP, ADP e ATP) sono stati rilevati in modalità ioni negativi (figure 3c e d). Il ritardo di tempo tra l'inserimento i single-sondanto una cella e il rilevamento del segnale era tipicamente meno di due secondi, consentendo un rilevamento quasi in tempo reale di metaboliti cellulari. SCMS è stato applicato anche per esperimenti in cui cellule sono state trattate con farmaci antitumorali (es OSW-1, paclitaxel e doxorubicina) 19]. I farmaci corrispondenti possono essere rilevati nelle cellule HeLa dopo il trattamento di 4 ore ad una serie di concentrazioni (cioè, 10 nM, 100 nM, 1 mM e 10 mM) in DMSO (dimetilsolfossido), utilizzando le cellule non trattate (solo aggiungere DMSO ) come i controlli. I segnali MS di farmaci non erano presenti nella extracellulare PBS o il controllo (figura 3e), ma sono stati individuati all'interno delle singole celle utilizzando la tecnica MS singola sonda (solo 100 risultati di trattamento nM sono mostrati nella Figura 3f). Poiché le cellule sono state lavate con PBS (o terreno di coltura cellulare fresca) per rimuovere composti extracellulari e contaminazioni, la rilevazione di metaboliti endogeni (ad esempio, lipidi cellulari and fosfati dell'adenosina) ei composti esogeni (ad esempio, farmaci antitumorali) indica che la tecnica MS singola sonda può essere utilizzato per analizzare composti intracellulari.
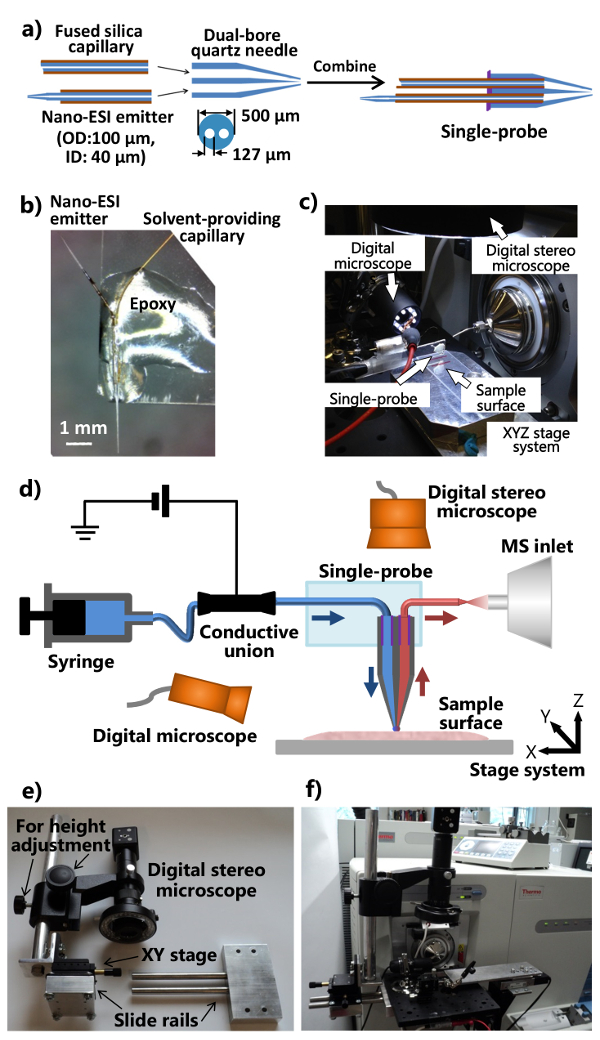
Figura 1. Realizzazione e messa a punto del singolo-sonda per ambiente analisi MSI e SCMS. A) le procedure di fabbricazione del singolo-sonda. B) fotografia di un fabbricato singolo sonda collegata ad un vetrino. C) la fotografia del singolo installazione sonda collegata ad una massa spettrometro. d) Diagramma della configurazione single-probe accoppiato con uno spettrometro di massa. Durante un esperimento, il solvente campionamento viene continuamente fornita dalla siringa, la tensione di ionizzazione viene applicata al raccordo conduttivo dal spettrometro di massa, due microscopi digitali sono utilizzati per monitorare il posizionamento del campione, la fase XYZ motorizzatosistema è utilizzato per controllare il movimento del campione, e uno spettrometro di massa viene usato per l'analisi. e) fotografia del sistema stereoscopio digitale personalizzato. f) fotografia che mostra stereoscopio digitale collegato all'interfaccia flangia sorgente ionica attraverso una scheda ottica. Fare click qui per visualizzare una versione più grande di questa figura.
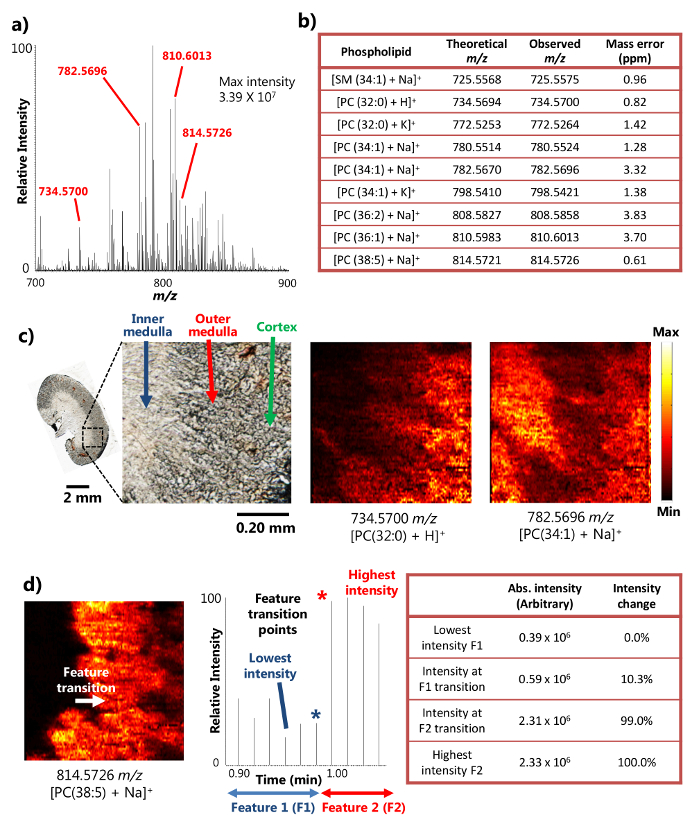
Figura 2. I risultati di uno studio MSI ambiente di una sezione di rene di topo con elevata risoluzione spaziale e la massa. A) Un spettro di massa rappresentante della singola sonda MSI. L'intensità massima di metaboliti rilevati può raggiungere 3,39 x 10 7 (unità arbitrarie). B) Una selezione dei metaboliti rilevati presentati con la loro precisione di massa. C)Immagini MS di [PC (32: 0) + H] + e [PC (34: 1) + Na] + tratti da una sezione di rene di topo a 8.5 micron risoluzione spaziale. PC: fosfatidilcolina. Barra di scala: 2 mm; 0,20 millimetri (nel riquadro) d) Determinazione della risoluzione spaziale dell'immagine MS per. [PC (38: 5) + Na] + (adattato con il permesso di riferimento 15). Si prega di cliccare qui per vedere una versione più grande di questa figura.

Figura 3. I risultati di una analisi ambientale SCMS dei trattati con farmaci cellule HeLa con una risoluzione elevata massa. A) zoom in fotografia della punta single-sonda che mostra una dimensione tipica di <10 micron di diametro. B) Fotografia presa al punto di inserimento di una singola sonda in una cellula HeLa. barra della scala: 50 micron.c) Un tipico spettro positivo massa modalità ioni con le identificazioni di un numero di PC (fosfatidilcolina) specie. d) Un elenco rappresentativo dei metaboliti identificati dall'analisi SCMS di cellule HeLa sia nelle modalità di ioni positivi e negativi. ef) Mass spettri per il controllo e trattati (100 nM OSW-1) cellule (adattato con il permesso di riferimento 16). Si prega di cliccare qui per vedere una versione più grande di questa figura.
Figura S1. Schema elettrico del dispositivo elettronico utilizzato per produrre il segnale di chiusura contatto per spettrometro di massa per raccogliere i dati. Fare clic qui per visualizzare o scaricare questa cifra.
Discussione
Il singolo-sonda è un dispositivo multifunzione che può essere utilizzato per entrambi gli esperimenti MSI e SCMS. La configurazione single-sonda (compresi i sistemi di fase di traduzione, microscopi, flangia interfaccia di origine ionica, ecc) è concepito come un componente aggiuntivo che può essere adattato flessibilmente per lo spettrometro di massa esistente. Un rapido scambio tra la configurazione single-sonda e la fonte di ioni ESI convenzionale può essere eseguita entro un minuto. In linea di principio, con la flangia interfaccia sorgente ionica caso, la configurazione singola sonda può essere adattata alle eventuali altri spettrometri di massa. Inoltre, il solvente campionamento contiene una varietà di reagenti può essere utilizzato con la configurazione single-sonda per esperimenti MSI e SCMS reattivi, che migliora notevolmente il rilevamento di intervalli più ampi di biomolecole. Oltre ai tessuti animali e linee cellulari, la singola sonda è anche in grado di analizzare altri sistemi biologici, come piante. Pertanto, con la stessa configurazione sperimentale eformazione degli utenti simili, diversi studi può essere eseguita utilizzando un unico strumento e dagli utenti stessi, consentendo esperimenti efficiente e versatile da realizzare con il tempo minimo di formazione e di costo strumentazione.
La componente chiave della tecnica MS single-sonda è la sonda stessa. La qualità del singolo-sonda ha una notevole influenza sulle sue prestazioni, che determina in larga misura la qualità di entrambi gli esperimenti MSI e SCMS. Quando fabbricazione di singole sonde, assicurarsi che i capillari all'interno del tubo dual-bore sono incollati saldamente per eliminare il rischio di perdita di solvente durante gli esperimenti. È fondamentale utilizzare una quantità minima di UV epossidica induribile, tale che gli orifizi e capillari non siano ostruiti durante la fabbricazione della sonda.
Il singolo-probe è stato usato per condurre elevata spaziale e massa risoluzione ambiente MSI su campioni biologici 15. Il principale vantaggio di ambiente MSI soprametodi non-ambiente è che la preparazione del campione è mantenuto al minimo, senza necessità di un ambiente di campionamento sotto vuoto, che consente il campione da analizzare in uno stato quasi nativa 8. Uno dei principali ostacoli per la maggior parte degli altri ambienti tecnica MSI è stata una mancanza di risoluzione spaziale 1. Rispetto al desorbimento basato MSI tecniche (come DESI e LAESI), le piccole dimensioni punta della singola sonda permette una più robusta ed efficiente superficie liquido micro-estrazione da eseguire su una piccola area, portando ad una risoluzione spaziale di 8.5 micron, che è tra i più alti quelli ottenuti utilizzando le tecniche ambientali MSI 15. Inoltre, regolando i componenti del solvente campionamento fornisce flessibilità per condurre gli esperimenti. Ad esempio, il campionamento solventi contenenti reagenti (ad esempio, composti dicationic) sono stati utilizzati per effettuare esperimenti MSI reattive, consentendo un aumento significativo nel numero di metaboliti identificati peR esperimento 20. L'altro vantaggio della singola sonda è la progettazione integrata, che fornisce la facilità di funzionamento durante l'intero processo di acquisizione dei dati. Poiché la distanza tra la punta e la superficie del tessuto è molto sensibile per l'intensità del segnale di ioni e stabilità, ottenendo una sezione di tessuto superficie piana e conducendo appiattimento regolazione per minimizzare la varianza distanza è una chiave per esperimenti MSI alta qualità. Ne consegue che i singoli sonda tecniche MSI non sono adatte per ottenere alte immagini spaziali MS su superfici irregolari.
Oltre a fabbricare una sonda di alta qualità, accuratamente accordate lo strumento è essenziale per un esperimento MSI successo. Tra tutti i passi di sintonia, regolando l'altezza della punta singola sonda sopra la superficie della sezione di tessuto è il più critico. Quando si regola l'altezza della sonda, pompare il solvente di campionamento e accendere la tensione di ionizzazione, in modo che solo il solvente sfondo segnali di ioni possono essere osservatied. Poi monitorare la variazione dello spettro di massa, riducendo accuratamente la distanza sonda-superficie sollevando il motorizzata Z-fase fino possono essere osservate forti e stabili segnali ioni da sezione di tessuto; questa altezza della sonda verrà utilizzato per la raccolta dati MSI durante l'esperimento. Inoltre, un tasso di flusso di solvente ottimizzato è essenziale per esperimenti MSI. Regolare la portata con l'altezza della sonda ottimizzato. Assicurarsi che non vi è alcuna diffusione solvente sulla superficie del tessuto (ad esempio, la portata è troppo alto) o la formazione di bolle all'interno del emettitore nano-ESI (vale a dire, portata è troppo bassa).
Il singolo-sonda è un dispositivo multifunzionale per analisi biologiche. Oltre agli esperimenti MSI, è in grado di condurre quasi in tempo reale in-situ SCMS per chiarire informazioni chimiche dettagliate da cellule eucariotiche vivi 16, che è un importante vantaggio rispetto ad altre vuoto tecniche SCMS base (come MALDI 10 e SIMS 21 ). La piccola dimensione della punta della sonda fornisce la possibilità di essere inserito in una cellula eucariotica vivo e per estrarre e ionizza composti intracellulari per un'analisi immediata MS. Analogamente, i solventi campionamento contenenti reagenti (ad esempio, composti dicationic) possono essere utilizzati in esperimenti SCMS, ed una più ampia gamma di costituenti cellulari possono essere rilevati in una cella singola vivo che mai (ricerca in corso, i dati non sono visualizzati). Sebbene l'analisi in tempo reale fornirà i profili chimici delle singole cellule vive, a causa della penetrazione cellulare di membrana ed estrazione dei contenuti cellulari, la cella in esame saranno uccisi dopo l'esperimento, implicando che la tecnica SCMS singola sonda è ancora un metodo distruttivo. Inoltre, la punta della sonda e nano-ESI emettitore nella singola sonda può essere facilmente ostruiti per gli utenti inesperti. Per ridurre il rischio di intasamento dispositivo, assicurarsi di evitare di toccare il nucleo quando si inserisce la punta singola sonda in un cell. In caso di intasamento, il dispositivo può essere rigenerato riscaldando la punta della sonda ostruiti o nano-ESI emettitore utilizzando un autocostruito bobina di riscaldamento 16. Un'altra limitazione della tecnica SCMS singola sonda è che solo le cellule adesive (cioè, le cellule sono attaccate alle superfici) possono essere analizzati utilizzando la configurazione corrente. Tuttavia, incorporando il sistema di manipolazione delle cellule nell'apparecchiatura MS singola sonda, ampi tipi di cellule possono essere studiati in futuro.
Simile al esperimento MSI, l'ottenimento di una sonda di alta qualità e una portata di solvente ottimizzato è fondamentale per gli studi SCMS. Con l'adattamento del tasso di flusso di solvente, la punta singola sonda è posto sopra il campione (cioè, nessun contatto con il mezzo cella o coltura), e verificare che non vi sia gocciolamento solvente dalla punta della sonda o la formazione di bolle all'interno del nano-ESI emettitore.
Divulgazioni
We have no conflict of interest to declare with the work presented here.
Riconoscimenti
The authors would like to thank Dr. Laskin (the Pacific Northwest National Laboratory) for sharing the motorized stage control software and MSI visualization program. We also thank Dr. Mao (the University of Oklahoma) for providing mouse organ samples and Mr. Chad E. Cunningham (the University of Oklahoma) for the assistance in machining and electronics work. This research was supported by grants from the Research Council of the University of Oklahoma Norman Campus, the American Society for Mass Spectrometry Research Award (sponsored by Waters Corporation), Oklahoma Center for the Advancement of Science and Technology (Grant HR 14-152), and National Institutes of Health (R01GM116116).
Materiali
| Name | Company | Catalog Number | Comments |
| Single-probe fabrication | |||
| Dual bore quartz tubing, 1.120’’ × 0.005” × 12” | Friedrich & Dimmock, Inc, Millville, NJ | MBT-005-020-2Q | |
| Micropipette laser puller | Sutter Instrument Co., Novato, CA | Model P-2000 | |
| Fused silica capillary, ID: 40 µm, OD: 110 µm | Molex, Lisle, IL | TSP040105 | |
| UV curing resin | Prime Dental, Prime-Dent, Chicago, IL, USA | Item No. 006.030 | |
| LED UV lamp | Foshan Liang Ya Dental Equipment, Guangdong, China | LY-C240 | |
| Epoxy resin | Devcon, Danvers, MA | Part No. 20945 | |
| Inline MicroFilter | IDEX Health & Science LLC, Lake Forest, IL | M-520 | |
| Microunion | IDEX Health & Science LLC, Lake Forest, IL | M-539 | |
| Microscope slide (glass) | C & A Scientific - Premiere, Manassas, VA | 9105 | |
| Syringe | Hamilton, Reno, NV | 1725LTN 250UL | |
| Mass spectrometer | |||
| LTQ Orbitrap Mass sprectrometer | Thermo Fisher Scientific, Inc., Waltham, MA | LTQ Orbitrap XL | |
| Xcalibur 2.1 Software | Thermo Fisher Scientific, Inc., Waltham, MA | XCALIBUR21 | |
| Fance Stage Control | Pacific Northwest National Laboratory, Richland, WA | ||
| MSI QuickView | Pacific Northwest National Laboratory, Richland, WA | ||
| Contact closure device | |||
| USB-6009 Multifunction DAQ | National Instruments, Austin, TX | 779026-01 | |
| DR-5V SDS Relay | Panasonic, Kadoma, Japan | DR-SDS-5 | |
| Logic Gates 50 Ohm Line Driver | Texas Instruments, Dallas, TX | SN74128N | |
| Single-probe setup | |||
| Motorized linear stage and controller (3 sets) | Newport, Irvine, CA | Conex-MFACC | |
| Miniature XYZ stage | Newport, Irvine, CA | MT-XYZ | |
| Translation XY stage | ThorLab, Newton, NJ | PT1 and PT102 | |
| Thermo LTQ XL ion source interface flange | New Objective, Woburn, MA | PV5500 | |
| Digital stereo microscope, 250X - 2,000X | Shenzhen D&F Co., Shenzhen, China | Supereyes T004 | |
| USB Digital Photography Microscope | DX.com, HongKong, China | S02 25~500X | |
| Syringe pump | Chemyx Inc., Stafford, TX | Nexus 3000 | |
| Solid Aluminum Optical Breadboard, 8" x 8" x 1/2" | Thorlabs, Newton, NJ | MB810 | |
| Flexible clamp holder | Siskiyou, Grants Pass, OR | MXB-3h | |
| Solvents | |||
| Methol | Sigma-Aldrich, St. Louis, MO | 34860 Chromasolv | |
| Water | Sigma-Aldrich, St. Louis, MO | W4502 | |
| Acetonitrile | Sigma-Aldrich, St. Louis, MO | 34967 Chromasolv | |
| Cell culture | |||
| Dulbecco’s Modified Eagle’s Medium (DMEM) | Cellgro, Manasas, VA | 10-013-CV | |
| 10% heat-inactivated fetal bovine serum (FBS) | Gibco/Life Technologies, Long Island, NY | 10100-139 | |
| Penicillin/Streptomycin | Cellgro, Manasas, VA | 30-002-CI | |
| 10 mM HEPES (pH 7.4) | Cellgro, Manasas, VA | 25-060-CI | |
| Phosphate Buffered Saline (PBS) | Cellgro, Manasas, VA | 46-013-CM | |
| TrypLE Express | Thermo Fisher Scientific, Waltham, MA | 12604-013 | |
| 12-well plates | Corning Inc., Corning, NY | Falcon 351143 | |
| T25 flask | Corning Inc., Corning, NY | Falcon 3055 | |
| Micro Cover Glasses, Round, No. 1 | VWR International, Radnor, PA | 48380-046 | |
| DMSO (Dimethyl Sulfoxide) | VWR International, Radnor, PA | BDH1115-1LP | |
| Tissue imaging | |||
| Cyro-Cut Microtome | American Optical Coporation | ||
| Tissue-Tek, Optimum cutting temperature (OCT) | Sakura Finetek Inc., Torrance, CA | 4583 | |
| Microscope slide (polycarbonate) | Science Supply Solutions, Elk Grove Village, IL | P11011P | |
Riferimenti
- Vickerman, J. C. Molecular imaging and depth profiling by mass spectrometry-SIMS, MALDI or DESI?. Analyst. 136 (11), 2199-2217 (2011).
- Schwamborn, K. Imaging mass spectrometry in biomarker discovery and validation. J. Proteomics. 75 (16), 4990-4998 (2012).
- Schwamborn, K., Caprioli, R. M. MALDI Imaging Mass Spectrometry - Painting Molecular Pictures. Mol Oncol. 4 (6), 529-538 (2010).
- Kraft, M. L., Klitzing, H. A. Imaging lipids with secondary ion mass spectrometry. Biochim. Biophys. Acta. 1841 (8), 1108-1119 (2014).
- Wiseman, J. M., et al. Desorption electrospray ionization mass spectrometry: Imaging drugs and metabolites in tissues. Proc Natl Acad Sci U S A. 105 (47), 18120-18125 (2008).
- Nemes, P., Woods, A. S., Vertes, A. Simultaneous imaging of small metabolites and lipids in rat brain tissues at atmospheric pressure by laser ablation electrospray ionization mass spectrometry. Anal. Chem. 82 (3), 982-988 (2010).
- Laskin, J., Heath, B. S., Roach, P. J., Cazares, L., Semmes, O. J. Tissue Imaging Using Nanospray Desorption Electrospray Ionization Mass Spectrometry. Anal. Chem. 84 (1), 141-148 (2012).
- Wu, C., Dill, A. L., Eberlin, L. S., Cooks, R. G., Ifa, D. R. Mass spectrometry imaging under ambient conditions. Mass. Spectrom. Rev. 32 (3), 218-243 (2013).
- Altschuler, S. J., Wu, L. F. Cellular heterogeneity: do differences make a difference?. Cell. 141 (4), 559-563 (2010).
- Amantonico, A., Urban, P. L., Fagerer, S. R., Balabin, R. M., Zenobi, R. Single-Cell MALDI-MS as an Analytical Tool for Studying Intrapopulation Metabolic Heterogeneity of Unicellular Organisms. Anal. Chem. 82 (17), 7394-7400 (2010).
- Passarelli, M. K., Ewing, A. G., Winograd, N. Single-cell lipidomics: characterizing and imaging lipids on the surface of individual Aplysia californica neurons with cluster secondary ion mass spectrometry. Anal. Chem. 85 (4), 2231-2238 (2013).
- Shrestha, B., et al. Subcellular metabolite and lipid analysis of Xenopus laevis eggs by LAESI mass spectrometry. PLoS One. 9 (12), e115173 (2014).
- Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. Live single-cell video-mass spectrometry for cellular and subcellular molecular detection and cell classification. J. Mass. Spectrom. 43 (12), 1692-1700 (2008).
- Zhang, L., et al. In Situ metabolic analysis of single plant cells by capillary microsampling and electrospray ionization mass spectrometry with ion mobility separation. Analyst. 139 (20), 5079-5085 (2014).
- Rao, W., Pan, N., Yang, Z. High Resolution Tissue Imaging Using the Single-probe Mass Spectrometry under Ambient Conditions. J. Am. Soc. Mass. Spectrom. 26 (6), 986-993 (2015).
- Pan, N., et al. The single-probe: a miniaturized multifunctional device for single cell mass spectrometry analysis. Anal. Chem. 86 (19), 9376-9380 (2014).
- Thomas, M., et al. Visualization of High Resolution Spatial Mass Spectrometric Data during Acquisition. 2012 Annual International Conference of the Ieee Engineering in Medicine and Biology Society (Embc). , 5545-5548 (2012).
- Luxembourg, S. L., Mize, T. H., McDonnell, L. A., Heeren, R. M. High-spatial resolution mass spectrometric imaging of peptide and protein distributions on a surface. Anal. Chem. 76 (18), 5339-5344 (2004).
- Zhou, Y., et al. OSW-1: a natural compound with potent anticancer activity and a novel mechanism of action. J Natl Cancer Inst. 97 (23), 1781-1785 (2005).
- Rao, W., Pan, N., Tian, X., Yang, Z. High-Resolution Ambient MS Imaging of Negative Ions in Positive Ion Mode: Using Dicationic Reagents with the Single-Probe. J. Am. Soc. Mass. Spectrom. 27 (1), 124-134 (2016).
- Ostrowski, S. G., Kurczy, M. E., Roddy, T. P., Winograd, N., Ewing, A. G. Secondary ion MS imaging to relatively quantify cholesterol in the membranes of individual cells from differentially treated populations. Anal. Chem. 79 (10), 3554-3560 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon