Method Article
教育実習でラクターゼ酵素活性の測定
要約
ラクターゼの酵素活性は、二糖類の乳糖の分解処理に不可欠です。ここでは、栄養補助食品は、乳糖分解酵素の活性は、比色試金を使用して試金されるが。これは乳糖分解酵素と酵素の活動を理解するため実験プラットフォームを持つ学生を提供します。
要約
酵素が働く仕組みを理解し、実際の生活の例には、この関係は、幅広い生物学的および生物医学科学の学士に不可欠です。このわかりやすいプロトコル 1年生学部薬局用に開発された、酵素分析のため酵素反応と分析的手続入門のエントリー レベルを提供します。好みの酵素はラクターゼは、これは人間の病気/製薬練習に関連する市販酵素の例を表します。乳糖分解酵素は栄養補助食品の錠剤から抽出され、ラクターゼの人工基質の加水分解に基づく比色定量法を用いて評価した (オルト-ニトロフェノール -ベータ-D-ガラクトピラノシド、ONPG)。オルト-ニトロフェノール ラクターゼによって ONPG の加水分解の開裂、次のリリースが 420 で吸光度の変化によって測定される nm、および酵素反応に及ぼす温度は氷、37、常温での反応を行うことにより評価° C.高度な解析は、異なる条件下で酵素活性を評価し、異なる試薬を使用してこのプロトコルを使用して実装できます。
概要
酵素は生物体内の化学反応触媒として機能するタンパク質の一種の生物1。生活、エネルギーを提供する、廃棄物の処理と生物機能を許可するための酵素の働きが欠かせません。したがって、理解酵素は生命の完全な理解のために重大です。そのような知識は、大学レベルの学位プログラム、医科学から生物学に至るまでのさまざまな不可欠です。酵素反応の特性はの実用的な経験の手によって理解最高触媒の原理から酵素活性の理論モデルに至るまで詳細な背景は、生講義を行い、読み物に提供できる、アクションで酵素は前述2を示した。このプロトコルでは、単純な人間の栄養と健康に関連する活動に酵素の例として乳糖分解酵素を用いた実験室条件下での酵素活性を測定する実験パラダイムに従うことを提供します。
グリコシドの加水分解酵素ラクターゼ (EC 3.2.1.23/26) は、哺乳類3の中央の栄養の重要性の酵素です。ラクターゼの活性、進化の過程で保存性が高いと酵素の β-ガラクトシダーゼ家族から派生-家族を大腸菌からホモ ・ サピエンス(図 1、PDB 1JZ8)4に存在します。人間の栄養設定で乳糖分解酵素の重要性はの構成単糖のコンポーネントについては、体内でエネルギーを生成する使用できますに乳糖の分解を許可する役割に由来します。ラクターゼは、二糖類の乳糖は、ガラクトースとグルコース (図 2) 解放のグリコシド結合の加水分解を触媒する5。これらの単糖は、アデノシン三リン酸 (ATP)経由でクエン酸回路、酸化的リン酸化6生成のために主に使用されます。新生児と幼児の開発の段階の乳糖分解酵素を高発現して母乳の乳糖の早い年の間にプライマリ炭水化物組成と栄養の原因の 1 つから受け取った乳糖を分解、人間の消化器系の7. 先天性乳糖分解酵素欠損症 (CLD)、ラクターゼ酵素8符号化 (LCT) ラクターゼ遺伝子で突然変異によって引き起こされるまれな常染色体優性劣性状態によってラクターゼの医療の重要性が強調表示されます。CLD と新しい生まれた赤ちゃん展示非常に少ないラクターゼの活動、したがって母乳、ミルク、または乳糖を含む数式の他のタイプの給紙できません。
小児期にラクターゼ表現が通常減少しました。ただし、この低減離乳は酵素9を表現する大人の世界的な継続のおよそ 35% の地理的に異なります。Lactase と呼ばれるラクターゼの持続的な表現では、情報源の範囲から牛乳や乳製品の製品を消化していく個人ことができます。逆に、ラクターゼ表現の損失は、乳糖不耐症、またとして知られている成人型 hypolactasia (ATH)、腸内の乳糖を分解することができないことに起因する可能性があります。ATH は乳糖乳糖を含む食品の摂取に続くコロンのビルドが特徴です。コロン、蓄積された乳糖を発酵して腸内微生物相、水素、メタン、二酸化炭素などのガスを放出します。腹部膨満、放屁増加、苦痛、悪心、および borborygmi (胃ゴロゴロ)7ラクターゼ酵素欠損を持つ個人でこれらのガスの生産を促進します。乳糖の消化管の増加されたレベルは軟便にもつながります。
LCT遺伝子発現の制御は、近くのMCM6遺伝子のイントロンにある多型による変調されます。ラクターゼの持続的な表現を持つ個人を運ぶ相殺離乳、 LCT転写制御を通常LCT遺伝子発現に強い遠位エンハンサーとして機能する遺伝子多型とその結果成人3ラクターゼ表現を維持します。エンハンサーの多型は、積極的に選択された次の牛と中東地域でのラクダの家畜化五千年以上前に提案されている9,10。
ATH から起きる症状は、たとえばダイエットから酪農製品を削除することによって乳糖の摂取量を減らすことによって管理できます。ATH のための別のアプローチ、CLD、最適なアプローチは、薬局から広く利用可能、乳糖分解酵素サプリメントの使用です。これらのサプリメントは、さまざまなソース、液体または錠剤形式で撮影または乳糖含有食品に追加することができますで酵母や細菌を含むから分離された乳糖分解酵素を提供します。サプリメントは、乳糖をグルコースとガラクトース製品、こうして吸収を許可して、腸内に未消化の乳糖の基質の蓄積を防止する食糧で現在の割合を加水分解されます。
栄養の補助として乳糖分解酵素サプリメントの使用に基づいて、最初年の生物医学の科学または薬局生に適した単純な酵素学研究室実験を開発しました。この実験を活用して市販乳糖分解酵素サプリメントや使用されているオルソ-ニトロフェノール -β-d ガラクトピラノシド ラクターゼ (によってグリコシド結合の開裂を測定する比色終点を提供する (ONPG)図 3)11。ONPG 行為、ラクターゼの人工基質をこの酵素による加水分解生成 D-ガラクトースとオルト-ニトロフェノールを受けるとき。後者の製品は 420 の波長の光を吸収、黄色 nm。吸光度 420 nm 以下の任意の変化を定量化することでラクターゼを ONPG の露出、それはこの酵素の活性を推定することが可能。この実験は酵素の加水分解酵素の活動のデモンストレーションを提供します。追加のレプリケートの建物と異なる条件の試金を遂行、酵素反応速度論、人間の健康に関連する行動における酵素の貴重な実例を提供することのより高度な解析を組み込むことが可能です。
プロトコル
注: 以下のプロトコル (クラスのワークシートの補完を含む) 2 時間にわたって開催される専用教育研究室で開発されました。実験の手順が意図的に酵素反応速度論 (実施モデル データを使用してこのコースのコンテキストで); の詳細な分析を除外に入れてただし、前述の議論-プロトコルは、時間、設備、学生の達成レベルに応じてより高度な分析用のテンプレートを提供します。
安全性: この実用的なべきである良い化学実験室の練習 (GCLP) の規則に従って、個人用保護具、留められた白衣、使い捨て手袋、安全メガネなどに着用するべきすべての回、研究室で.
1. 酵素を抽出
- 乳鉢と乳棒を使用しても粉に酵素の 200 mg を含む 1 つの乳糖分解酵素タブレットをつぶします。
- 「懸濁液」をラベル 15 mL チューブに結果の粉を置き、100 mM リン酸緩衝生理食塩水 (PBS) の 10 mL で再懸濁します。
- 酵素の抽出を最大化するために 1 分の渦。
- 堆積物の固体の粒子に、懸濁液から 1.5 mL 遠心チューブ ・遠心 10,000 × gで 1 分に 1 mL を転送します。
- ラベル「乳糖分解酵素エキス「クリーン 1.5 mL チューブに上清を 500 μ l 添加を転送します。
2. 比色反応の観察
- 1.5 mL チューブに 100 mM PBS の場所 390 μ L はラベル「反応 A」です。
- ボルテックスでよく 5 mM ONPG ソリューションとミックスの 100 μ L を追加します。
注意: この実用的な使用オルト-ニトロフェノール -ベータ-D-ガラクトピラノシド (ONPG) 乳糖の代用として。ONPG フェノール化合物である、ために、注意して処理する必要があります。ONPG が肌に接触した場合露出した皮膚をすぐに洗浄する必要があります。適切な廃棄物の流れに処分するペーパー タオルでこぼれすぐに拭いてください。 - ボルテックスでよく反応がチューブとミックスに抽出液の 10 μ L を追加します。
- 5 分間反応混合物を観察し、ソリューションに比色変更に注意してください。
3. 酵素活性の測定
- 2 つの 1.5 mL チューブを設定:"反応 B"、1 つのラベル「コントロール」のラベルの 1 つ。
- B 管、制御管 100 mM PBS の 400 μ L 反応する 100 mM PBS の 390 μ L を追加し、各管に 5 mM ONPG の 100 μ L を追加します。
- ボルテックスによって内容をミックスします。
- 反応 B 管に乳糖分解酵素抽出液の 10 μ L を追加、ボルテックスでミックス、室温で 1 分進む反応ができます。
- 1 分が経過すると、それによって反応を終了させる、pH を増やすことによってラクターゼの酵素を阻害する両方のチューブに 1 M 炭酸ナトリウム 500 μ L を追加します。
- きれいな分光光度計のキュベットに各チューブから 500 μ L を転送し、420 で吸光度を測定分光光度計を用いた nm。
- ONPG の活性酵素の存在下で加水分解による吸光度の変化を派生させる反応値からコントロールの値を減算し、反応 B、コントロール サンプルの吸光度を注意してください。
4 酵素活性に及ぼす温度の影響
- セクション 3 で説明した 3 つの制御管および 3 つの反応管を設定し、これらのラベル「4 ° C」、「室温」と「37 ° C」.
- 以下の酵素の付加を抽出し、1 つの管、室温で、37 ° c (中古温水バス) での氷を孵化させなさい。
- 1 分進み、各チューブに 1 M 炭酸ナトリウム 500 μ L を追加することによって、反応を終了する反応を許可します。
- 測定吸光度 420 nm のセクション 3 で説明した各チューブ。それぞれのケースで反応値からコントロールの値を減算値を記録します。
結果
プロトコルのセクション 2 の代表的な結果は、図 4 aに表示されます。コントロールの反応は、ラクターゼ酵素の不在で解放 ONPG を加水分解、ラクターゼ タブレットからの抽出物を含む反応溶液が黄色に変わりながら明確に残るオルソ- ニトロフェノール。図 4 bは、定量化のプロトコル、分光光度計を用いた試料の分析を次のセクション 4 から任意の単位を使用してを示しています。オルト-ニトロフェノールの生産は反応は氷、培養するとき最小値と最大 37 ° C で反応を行った場合
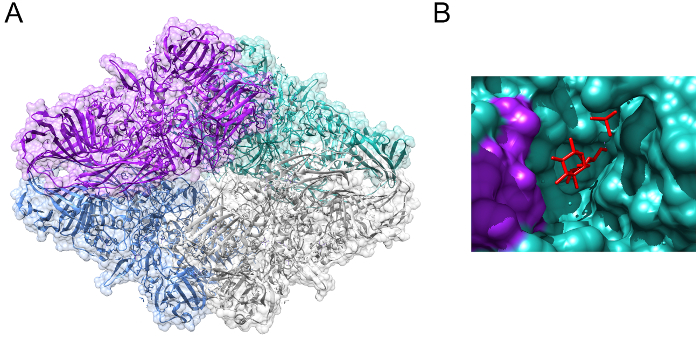
図 1:大腸菌 β-ガラクトシダーゼ。(A)エシェリヒア属大腸菌アクティブの 4 量体構造に複雑な表示から β-ガラクトシダーゼの結晶構造。(B) Allolactose (赤色で表示) は、β-ガラクトシダーゼの活性部位にバインドされます。PDB 1JZ84から生成されたイメージ。この図の拡大版を表示するのにはここをクリックしてください。
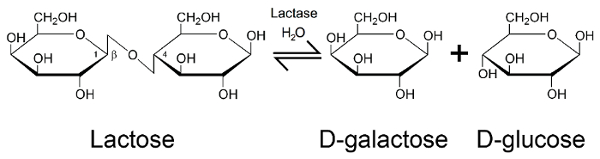
図 2:ラクターゼの酵素作用します。ベータ版 D-ガラクトースと β-グルコースを生成するラクターゼがラクトースの加水分解。この図の拡大版を表示するのにはここをクリックしてください。
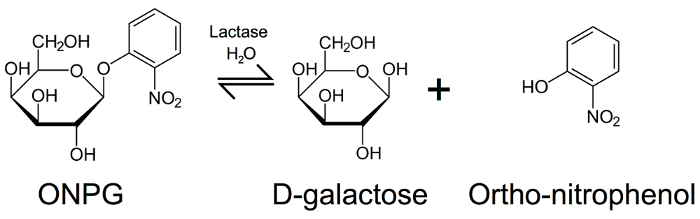
図 3:加水分解オルト-ニトロフェノール -ベータ版-D-ガラクトピラノシド。ベータ版 D-ガラクトースとオルト-ニトロフェノール (黄色の色である)、420 で吸光度の測定によってラクターゼ活性の推定を許可するを生成するラクターゼによって ONPG 分解 nm。この図の拡大版を表示するのにはここをクリックしてください。
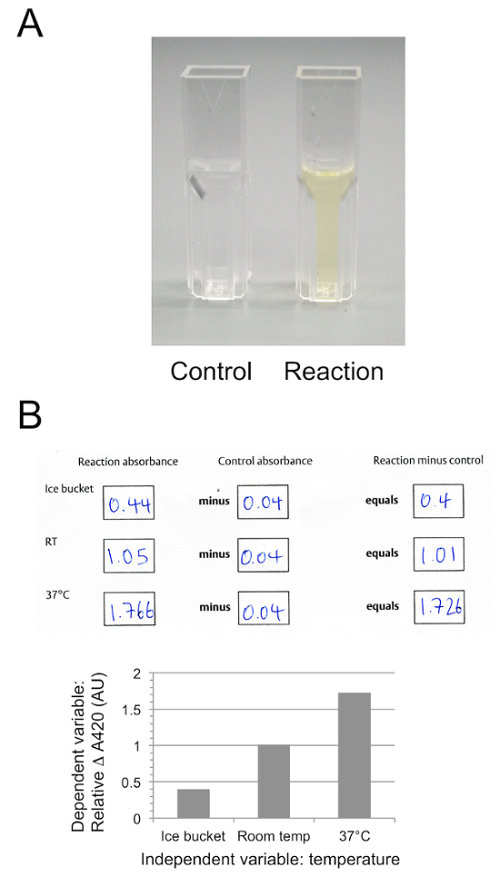
図 4:ONPG 分解します。ONPG 加水分解の代表的な結果は、コントロールと反応管 (A) とプロトコルのセクション 4 から代表的なデータを示す生吸光度を示す 420 で任意の単位でクラスのワークシートに記録された nm、背景の修正と3 種類の温度 (B) でこの図の拡大版を表示するのにはここをクリックしてください。
| 実験条件 | 実験変数 |
| 温度 | 0 の ° C、10 ° C、20 ° C、30 ° C、50 ° C |
| 基質濃度 | 0、1 mM、5 mM、10 mM ONPG |
| 競争阻害 | 5 mM ONPG プラス 0 mM、1 mM、5 mM または 10 mM の乳糖 |
| 時間依存性 | 0 秒、15 秒、30 秒、1 分、5 分、10 分、20 分 |
| 熱変性 | 試金する前に 10 分の 100 ° C に加熱して乳糖分解酵素エキス |
表 1: 潜在的な実験条件を拡張。3 通、乳糖分解酵素の生物学の特定の側面を調査実施の拡張の実験を提案しました。
ディスカッション
詳細な知識と酵素、酵素反応、酵素反応速度論の理解は生物学、生物医学、薬理学にまたがるトピックの広い範囲に必要です。上記プロトコルより高度な実験室の実験で使用することができますキーのスキルを提供する酵素の反応を示すため、人間の健康に関連する酵素の例として乳糖分解酵素を使用します。
このプロトコルは、意図的にできるように、可能な限り生徒の時間の短いスペースで解釈の結果を生成するほとんどあるいは全くのぬれた実験室の経験と堅牢に設計されています。レディング大学薬学院で 2014/2015 年度の延べ 144 名の生徒、3 のグループに分類がラクターゼ タブレットからの酵素の活動のいくつかのレベルを検出することができるすべてのグループで、「乳糖分解酵素を測る」実験を実施抽出します。
このプロトコルの重要なステップの数があります。まず、最初の抽出、効率的で、以降の解析に十分な活性酵素の可溶化を許可することが必須です。私たちの経験では最初の 1 年生これで実現できますプロトコルを次のとおり。しかし研究所デモ参加者からいくつかのガイダンスがこの時点で必要でした。自明のポイントに思えるが、このプロトコルの成功の重要な要因は、慎重に体積測定、正しくチューブにラベルを付けるし、指示に従ってください。多くの学生、入念な監視と彼らがわからない場合に、支援を求める学生のための明確な要求をある程度語学力が想定される場合何をするか次に正常な試金の最大の可能性を提供します。
クラスのワークシート (補足資料として利用できる)、実験、結果、講義資料、背景情報/読書へのリンクにコメント データをメモする学生を求めてより学生の評価を実施することができます。クラス評価試行し評価の速度論的解析を可能にする提供されるモデル データから詳細な。
ここに提示されたプロトコルは教育研究室の条件下で乳糖分解酵素の活性測定法の簡単な例より高度な分析を許可する実験の複雑さを増やす十分な機会があります。特に、提案するプロトコルは酵素反応速度論の概念を紹介しますが、実験データの速度論的解析を許可しません。そのため、特定の目的や実験を行う学生コホートの才能に合わせて適応した精密なディテールとクラスの初期テンプレートとして記述されているプロトコルを表示するをお勧めします。拡張実験の例は含むことができる: 繰り返し異なる温度、異なる基質濃度を使用して統計分析、始まる (生化学の学生/専攻分野に適した)、データの速度論的解析で測定いくつかの異なる錠剤 (コントロールの錠剤、法医学専攻学生に適した添加) それぞれに酵素活性を評価する学生を許可する、熱変性の影響の評価や競争の実施乳糖の添加、またはラクターゼ (表 1) の阻害剤を用いた実験。乳糖分解酵素の速度論的解析のための詳しいプロトコルは、以前公開された12をされて。
このプロトコルの重要な強さは医学における酵素学の現実事例研究、酵素学や酵素反応速度論の基本的な紹介と組み合わせています。これは当研究室を医学、薬学、生物医学科学、関連科目の学生に特に関連の実験。重要なは、深刻な病状と乳糖分解に関連するより広範な食問題があるという事実は、学生では医療と倫理的な問題の広い範囲を高めるための機会を提供します。これは医療の条件のための遺伝学的検査にまつわる問題を含めることができます、遺伝子治療、遺伝相談と同様に使用および医薬品サプリメントの販売に関するディスカッションを関連付けられています。1 つの主要な制限は、抽出用の原料のための酵素濃度の正確な推定のプロトコルができないことです。このため、アカウントへの変更ただし、アッセイ用試薬グレードの酵素を使用するでしょう。重要なは、ラクターゼ酵素の動力学のより正確な計算のためことができます。
試金活動の結論としては、教育実習でラクターゼの環境提供初期段階の酵素学のフィールドに堅牢な魅力的で興味深い紹介大学生。
開示事項
著者はある利益相反を開示します。
謝辞
PAL は、パーキンソン病英国研究員 (グラント F1002) によって資金を供給されました。この仕事は MRC 新しい調査研究助成 (氏/L010933/1) によって支えられた、BBSRC 就労 BB/M017222/1 ジェットに、pal、MRC プログラムによって氏/N026004/1 を付与します。MPharm パート 1 学生のフィードバックと入力この実用的なおよびそれ以降のコホートの最初のイテレーションに参加のための読書の大学の 2014-15 コホートに感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| Lactase tablet | Lamberts | 8511-60 | |
| Phosphate buffered saline (powdered) | Sigma | P3813 | Dissolved in deionized water to a final concentration of 100 mM |
| ONPG | Sigma | N1127 | Dissolved in deionized water to a final concentration of 5 mM |
| Sodium Carbonate | Sigma | 451614 | Dissolved in deionized water to a final concentration of 1 M |
| De-ionized water | NA | NA | |
| Pestle and mortar | VWR | ||
| Spectrophotometer | Jenway 6315 | ||
| Pipettes | Gilson | ||
| 15 mL tubes | VWR | ||
| 1.5 mL tubes | Eppendorf | ||
| Spectrophotometer cuvettes | Jenway | ||
| Vortex | Vortex genie 2 | ||
| Centrifuge | Beckman | ||
| Ice bucket | VWR | ||
| Water bath | Thermo-Scientific | ||
| Weighing scales | Thermo-Scientific |
参考文献
- Berg, J. M., Tymoczko, J. L., Gatto, J. G., Stryer, L. Biochemistry. , 8th, Palgrave Macmillan. (2015).
- Jittam, P., et al. Red seaweed enzyme-catalyzed bromination of bromophenol red: An inquiry-based kinetics laboratory experiment for undergraduates. Biochemistry and Molecular Biology Education. 37, 99-105 (2009).
- Troelsen, J. T. Adult-type hypolactasia and regulation of lactase expression. Biochimica et biophysica acta. 1723, 19-32 (2005).
- Juers, D. H., et al. A structural view of the action of Escherichia coli (lacZ) beta-galactosidase. Biochemistry. 40, 14781-14794 (2001).
- Plimmer, R. H. On the presence of lactase in the intestines of animals and on the adaptation of the intestine to lactose. Journal of Physiology. 35, 20-31 (1906).
- Krebs, H. A., Salvin, E., Johnson, W. A. The formation of citric and alpha-ketoglutaric acids in the mammalian body. The Biochemical journal. 32, 113-117 (1938).
- Vesa, T. H., Marteau, P., Korpela, R. Lactose intolerance. Journal of the American College of Nutrition. 19, 165S-175S (2000).
- Robayo-Torres, C. C., Nichols, B. L. Molecular differentiation of congenital lactase deficiency from adult-type hypolactasia. Nutrition Reviews. 65, 95-98 (2007).
- Swallow, D. M. Genetics of lactase persistence and lactose intolerance. Annual Review of Genetics. 37, 197-219 (2003).
- Enattah, N. S., et al. Independent introduction of two lactase-persistence alleles into human populations reflects different history of adaptation to milk culture. American Journal of Human Genetics. 82, 57-72 (2008).
- Lowe, G. H. The rapid detection of lactose fermentation in paracolon organisms by the demonstration of beta-D-galactosidase. Journal of Medical Laboratory Technology. 19, 21-25 (1962).
- Russo, S. F., Moothart, L. Kinetic study of the Enzyme Lactase. Journal of Chemical Education. 63, 242(1986).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved