このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
多フッ素化された胆汁酸を用いて
要約
ツールが制限されている胆汁酸吸収不良を診断およびインビボで胆汁酸輸送を測定します。生きた動物での革新的なアプローチは、結合プロトン(1 H)とフッ素(19 F)、磁気共鳴イメージングを利用することが記載されています。この新規方法論は、臨床診療における胆汁酸吸収不良をスクリーニングする翻訳可能性を秘めています。
要約
脂肪の吸収を促進する界面活性剤としての伝統的な役割に加えて、新興の文献は、胆汁酸は、複数の臓器に影響を与える強力なシグナル伝達分子であることを示しています。彼らは腸運動性およびホルモン産生を調節し、血管緊張、グルコース代謝、脂質代謝、及びエネルギー利用を変えます。糞便胆汁酸の変化は、腸のmicrobiomeを変更し、cholerrheic下痢および結腸癌を含む大腸病変を促進することができます。糞便胆汁酸組成物の重要な調節因子は、小腸アピカルナトリウム依存性胆汁酸輸送体(ASBT)および線維芽細胞増殖因子19(FGF19)です。 ASBTの発現低下と機能がアップテイク腸の胆汁酸を減少させます。また、in vitroのデータは、いくつかのFDA承認薬はASBTの機能を阻害することを示唆しています。欠損FGF19のリリースでは、肝胆汁酸合成が増加し、ASBTを圧倒するレベルに腸への放出します。 ASBT機能不全またはFGF19欠損症のいずれかがfを増加させECAL胆汁酸および慢性の下痢を引き起こし、結腸腫瘍形成を促進することができます。残念ながら、 インビボでの胆汁酸の吸収不良および胆汁酸輸送に対する薬物の作用を測定するためのツールは限られています。胆汁酸の複雑なアクションを理解するために、技術は、腸および代謝組織における胆汁酸の同時モニタリングを可能にすることが必要です。これは、プロトン(1 H)、フッ素(19 F)、磁気共鳴イメージング(MRI)の組み合わせを使用して、生きた動物中の胆汁酸輸送を測定するための革新的な方法を考えるために、私たちを導きました。フッ素(19 F)のための新規なトレーサーは、 インビトロおよびインビボの両方において 、生きた動物MRIが作成され、試験されたベース。このアプローチの強みは、放射線と臨床研究と実践のための翻訳可能性を電離への曝露の欠如が含まれます。
概要
腸からの脂肪の吸収を促進洗剤としての古典的な役割に加えて、胆汁酸は、それらの腸肝循環1,2に関連したものに加えて、複数の臓器に影響を与える強力なシグナル伝達分子として浮上しています。独自の代謝を制御することに加えて、胆汁酸は、胃腸生理学( 例えば 、腸運動性およびインクレチンホルモン産生、結腸の生理機能、および癌感受性)のいくつかの側面を調節し、血管緊張、グルコース及び脂質代謝、およびエネルギー利用の全身的な効果を有します。これらの効果の一部は、腸内で媒介されているが、肥満患者または胃バイパス手術後のように、他のものは、全身性胆汁酸レベルの食後の変化によるものです。胆汁酸の複雑な代謝作用を解明するために、新しい技術は、胃腸管及びメタにおいて、異なる解剖学的区画における胆汁酸レベルの同時モニタリングを可能にすることが要求されますBolicの組織(肝臓、膵臓、骨格筋および脂肪)。このような時間的および空間情報を取得することは革新的な技術を必要とする- in vivoイメージングに新たな胆汁酸トレーサーを使用して、ここで説明したように、このような新規のアプローチです。
解剖学的区画における胆汁酸組成と分布は、それらの肝臓での合成やダイエット、手術、抗生物質の使用と腸内細菌叢の変化を含む回腸の取り込みを調節因子によって調節されています。彼らの腸肝循環のための腸の胆汁酸取り込みの重要な調節因子3( 図1)は、回腸アピカルナトリウム依存性胆汁酸トランスポーター(; SLC10A2 ASBT)です。受動吸収は腸を通して起こるが、通常は胆汁酸の限定された流出が糞便中に存在するように、ASBTは、腸の胆汁酸の95%の取り込みを媒介します。 ASBT欠損(Slc10a2 - / - )マウスは、糞便胆汁酸および減少胆汁ACIが増加していますDプール4。
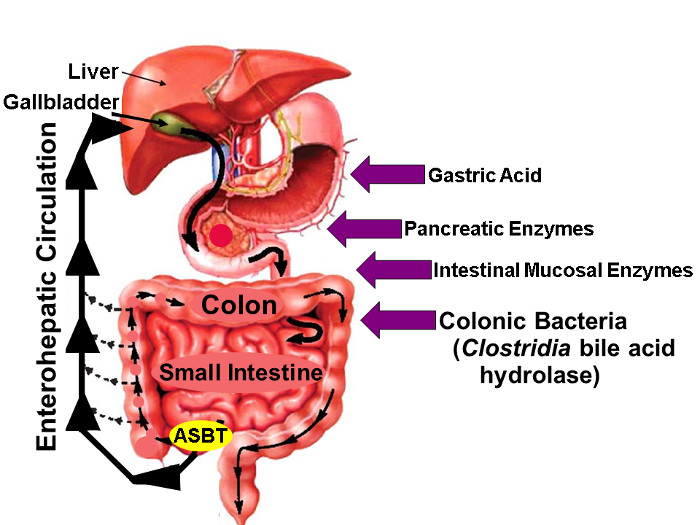
図1:胆汁酸の腸肝循環。
腸肝循環することにより胆汁酸のイラストは、肝臓で合成胆道系に排泄、胆嚢に格納され、食事と近位小腸への排出、および積極的に回腸遠位部にASBT を経由して取り込まれます。胆汁酸の少量腸を通して受動的に吸収され、一方、腸の胆汁酸の約95%は、新しい胆汁酸合成の類似量によって補償される糞便中の最小(約5%)の損失が生じるASBTによって能動的に輸送されます肝臓は、それによって定常胆汁酸のプールを維持します。右側の矢印は、胃酸、膵臓および腸管粘膜酵素を含む天然およびフッ素標識胆汁酸の安定性に影響を与える可能性のある要因、および、最もimportantlを識別します遠位小腸及び結腸にコロニー形成クロストリジウム種によって放出され、Y、加水分解酵素。 (許可16に変更された) この図の拡大版をご覧になるにはこちらをクリックしてください。
胆汁酸の吸収不良により断続的または慢性下痢を引き起こし、糞便ジヒドロキシ胆汁酸を増大各々が3種類に分類することができます。肉眼回腸病理( 例えば、切除、クローン病)5から1の結果を入力します。胆嚢摘出術、迷走神経切断、セリアック病、細菌異常増殖、および膵機能不全から3の結果を入力します。彼らはそのような先行条件を欠いており、回腸における病理の証拠を持っていないので、これとは対照的に、「一次」(タイプ2)胆汁酸吸収不良のある人は手ごわい診断難題をもたらします。したがって、一次胆汁酸吸収不良は、一般的に下痢-pと誤診されますredominant過敏性腸症候群(IBS-D)、消化器関連の外来患者の訪問のため、おそらく最も一般的な理由。 IBS-Dの患者の三分の一は、一次胆汁酸の吸収不良を有することが推定されています。米国では、これは数百万人の5を表すことができます。最近の洞察は、プライマリBAMがない低下した発現またはASBTの機能から、腸の線維芽細胞増殖因子19(FGF19)による肝胆汁酸合成の減損フィードバック阻害に由来することを示しています。
一次胆汁酸吸収不良では、FGF19の低血漿レベルは、肝胆汁酸合成を遮断することができない-腸胆汁酸中の得られた増加は、ASBT含む胆汁酸トランスポーターを、飽和、および糞中への胆汁酸の増強流出は、下痢6を引き起こし ( 図2)。 Fgf15(マウスFGF19)が欠損したマウスは、胆汁酸プールを拡大し、糞便胆汁酸7が増加しています。

図2:腸胆汁酸吸収不良のメカニズム。
パネル Aに示すように、通常は、腸の胆汁酸の約95%は、ASBTを介して、遠位回腸に能動輸送によって吸収されます。 ASBTの発現または活性は、( パネルB)、結腸への胆汁酸の流出における障害腸胆汁酸の取り込み結果を減少するとき。損なわれたFGF19のシグナル伝達( パネルC)、結腸に胆汁酸の流出分のASBTの輸送能力を圧倒する腸胆汁酸の増加濃度の肝胆汁酸合成結果のフィードバック阻害の欠如と。 の拡大版をご覧になるにはこちらをクリックしてください。この図。
糞便胆汁ACIの長期慢性標高DSは、結腸腫瘍形成を促進することができます。結腸新生物は、体細胞遺伝子変異に関連する進行粘膜異形成から生じるが、糞便胆汁酸を増加させる環境要因は、このプロセスを加速し、強化することがあります。げっ歯類では、いずれかの外因性投与またはASBT欠乏の結果として、結腸異形成および腫瘍形成8-10を促進糞便胆汁酸を増加させました。
注目すべきことに、刺激的な知見は、食品医薬品局(FDA)によって承認され、一般的に使用される薬剤は強力インビトロ 11 ASBTによって胆汁酸輸送を阻害することを示しています。これらの薬剤は、in vivoでの小腸胆汁酸輸送を削減し、糞便胆汁酸のレベルを増加した場合、大腸病理学上の潜在的な影響につきましてだろう。そのような薬物の使用に起因する大腸病理学においてさえ、わずかな増加は、主要な健康影響を与える可能性があります。 試験管調査結果と疫学OB でこれらの妥当性を評価することができるツールキットservationsは、市販後安全性研究を含む追加の研究を、拍車をかけるだろう。
必要性にもかかわらず、胆汁酸吸収不良を持つ人々を識別するための実用的なアッセイが不足しています。糞便胆汁酸の直接測定は、面倒で非現実的、および5信頼できないとして年前に拒否されました。別のアプローチは、測定放射性セレン標識コール酸誘導体(75 SeHCAT)の保持および7αヒドロキシ-4-コレステン-3-オン(C4)、または胆汁酸結合剤の治療試験の血漿レベルを含む。75 SeHCAT試験ました診断テストからさらに米国での使用に限定されたヨーロッパで可用性とFDAに承認されていないか、または使用可能な、控えめな放射線被曝(0.26ミリシーベルト/ 75 SeHCATテスト)が懸念され、細菌の異常増殖と高度な肝疾患が75 SeHCAT結果を混乱させてもよいです。 C4のテストは、血漿のみが必要とされているので、潜在的に魅力的ですが、それは低い正の予測のvalを持っていますUEとテストが広く利用可能ではありません。 FGF19の血清レベルを測定することは同様の制限を有します。頻繁に臨床医は、胆汁酸捕捉剤の治療裁判に訴えるが、この方法は、胆汁酸吸収不良5の決定的な診断を提供することはできません。
これらの理由から、新規なMRIアプローチは、革新的な多フッ素化された胆汁酸(MFBA-MRI)を用いて、インビボで胆汁酸の輸送および分布を測定するために考案されました。フッ素(19 F)、100%天然存在の安定同位体の3個の原子を含むMFBAは、天然の胆汁酸12と同様に輸送され、プロトン(1 H)及びフッ素(の組み合わせで胆汁酸輸送を可視化するために使用することができ19 F)MRI、放射線被曝13,14をイオン化することなく、敏感な、安全な方法。
プロトコル
以下のプロトコルは、(2015年6月18日に承認IACUCプロトコル#0415011)医学部のメリーランド大学の大学の施設内動物管理使用委員会(IACUC)によって承認されたガイドラインに準拠しています。
19 F標識胆汁酸と1 Gavagingマウス
- 150 mg / kg体重19 F標識された胆汁酸で強制飼養マウス。 19 F標識胆汁酸の原液[コール酸トリフルオロアセチルリジンと必要なボリュームに1-mlの注射器を埋める(CA-のLys-TFA; 1:1のポリエチレングリコール400:ダルベッコのリン酸緩衝生理食塩水)またはcholylsarcosine-フルオロ-N-メチルアセトアミド(CA-SAR-TFMA; 60%のポリエチレングリコール400および40%ダルベッコのリン酸緩衝生理食塩水]と20ゲージ1.5インチ曲がった電球ひっくり返した胃胃管栄養針を添付してください胃管栄養針を作ります。針のハブに食道までに挿入したときに、マウスの剣状突起軟骨のレベルに到達するのに十分な長さであります
- しっかりグラム親指と人差し指の間に首の後ろでたるんだ皮膚によって動物をやすりと腰と尾の皮膚を把握するために残りの指を使用しています。
- 直立マウスを持ち、側面に沿って強制経口投与針と口の屋根食道へとダウン胃の中を通過します。抵抗は咽頭に遭遇した場合、動物まで、針の位置を変更し、それを「ツバメ」 - 抵抗に抗してプッシュしないでください。
- 麻酔は、胃管栄養法のために必要とされている場合は、イソフルランと近い5ミリリットルを含むベルジャーにマウスを置きます。マウスは、その側に低下すると、マウスを削除し、胃管栄養を行って、7秒を待ちます。麻酔蒸気から作業員を保護するために、唯一のドラフト内でベルジャーを使用しています。
- 数分でイソフルランから回復動物を観察します。
注:イソフルランは肝臓で代謝されるので、無傷の薬物または胆管系に排泄その代謝物および胆嚢から発せられるフッ素信号がFLUOを混乱することができます19 F標識胆汁酸15からrine信号。代替案は、ケタミンプラスキシラジンを(用量について3.1節を参照)を使用することです。
2.収穫胆嚢、液体クロマトグラフィー/質量分析法を用いて胆汁酸の測定のための肝と血
- 臓器を収穫する前に、少なくとも6時間、最大胆嚢充填、高速でマウスを達成するために。リン酸緩衝生理食塩水(100μlのケタミン、62.5μlのキシラジン、840μlのPBS)にケタミンおよびキシラジンを準備します。
- 1-mlの無菌注射器を使用して、ケタミン/キシラジン溶液(150mgのケタミンおよび体重1kgあたり18mgのキシラジン)の15μL/ g体重で前に臓器の収穫にマウスの皮下に1時間を注入。
- ケタミン/キシラジン投与後1時間は、つま先のピンチにより十分な麻酔を確認し、麻酔をかけたマウスの仰臥位を置きます。
- 剣状突起とFiに恥骨から腹部正中皮膚切開を作るために5または6インチのハサミを使用してくださいneのはさみ(4インチ)が腹膜ライニングをカットし、腹部臓器を露出させる - 横隔膜を貫通しないでください。
- 5インチクランプで剣状突起をつかみ、上腹部の空洞を露出するように胸に戻って持ち上げます。胆嚢を露出させ、脇に肝臓を分析し、移動するために鉗子や鈍器を使用してください。
注:肝臓を切るか、以前のように胆嚢を触れないでくださいは、重度の出血の原因となりますし、後者は、胆嚢収縮および排出を刺激することができます。 - 総胆管( 図3、矢印を破線)を横切る4インチクランプを置きます。ダイヤフラムに胆嚢の優れたポールを取り付ける靭帯を切り、静かに腹部の右側に胆嚢を移動します。
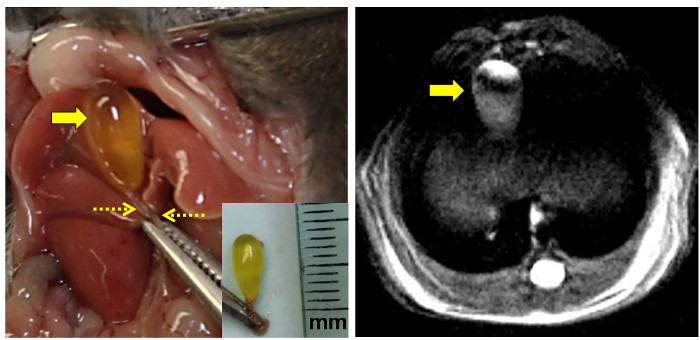
図3:マウス胆嚢の解剖学的およびプロトンMRIビュー。
左側のパネルには、露出した覚書を示しています腹部切開後の正中線の左側に電子胆嚢。クランプは、剣状突起を把握します。胆汁が充填された空腹時胆嚢は、大きな矢印と点線の矢印によってクランプされた総胆管によって示されています。 [ 挿入図:総胆管で切り出し、そのまま胆嚢をクランプ。定規はミリメートル(mm)でマークされている。]右側のパネルには、空腹時のマウス胆嚢(矢印)の高解像度のプロトン密度強調MRI画像を示す。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- 胆嚢を切除する前に、収穫の血液を心臓穿刺を行い、安楽死を確認するために動物を放血。
注:最初の胆嚢を収穫すると、心血管虚脱、十分な血液サンプル(≥200μl)を取得するために障害の原因となって肝臓を切ることができます。 - 左横隔膜の下面を露出させ、心臓の鼓動面を識別します。最大心拍動の時点で1-mlシリンジに取り付けた23ゲージの針でダイヤフラムと心を穿刺。
- 吸引しながら、ゆっくりと注射器を撤回。血液が注射器を埋めるために開始すると、撤退停止し、0.2収集するために吸引を維持 - 0.6ミリリットルの血液を。そっと針を回転させるか、それが停止した場合の流れを再確立することができる少しそれを引き抜きます。
- 15分間、2000×gで1.5 mlのヘパリン処理チューブと遠心分離機に血液を転送します。 10分間、12,000×gで4部品アセトニトリルおよび遠心分離機で血漿を沈殿させます。液体クロマトグラフィー/質量分析法(LC / MS / MS)11-1312-1412-1412-1412-14によって上清を分析します。必要に応じて、分析の前に-80 O Cでプラズマを保存します。
- 鈍的切開を使用して、肝臓から胆嚢を解放します。 、クランプ下の総胆管を離断胆嚢を除去し、計量し、1.5 mlのmicrocenに配置しますtrifugeチューブ。肝臓を収穫。
- 約100肝臓のmgであり、大きさ-21ガラス組織ホモジナイザーで氷上で全体の胆嚢を均質化します。 10分間、12,000×gで75%アセトニトリル、25%水(肝臓のために800μlの、胆嚢のために300μl)を、遠心分離して抽出します。必要に応じて抽出物を希釈し、LC / MS / MS 11-13を使用して胆汁酸含量を定量します。
3.ライブアニマルプロトン(1 H)及びフッ素(19 F)磁気共鳴イメージング
- 撮影前に少なくとも6時間、最大胆嚢充填、高速でマウスを達成するために。ケタミンとキシラジンを使用して、MRIスキャナの動きを防止するために、マウスを麻酔。リン酸緩衝生理食塩水(130μlのケタミン、42.5μlのキシラジン、827μlのPBS)にケタミンプラスキシラジンのストック溶液を準備します。 MRIの前に1時間、この溶液5μl/ g体重(65mgのケタミンおよび4.25ミリグラムxylazでマウスの皮下に注入するために1 mlの滅菌注射器を使用します体重kg当たりINE)。麻酔下で乾燥を防ぐために、動物の目に獣医の軟膏を適用します。
- 上記のようにケタミン/キシラジンで誘導した後、#40または細かい電気バリカンの刃を使用して腹部マウスの左下半分に1.5センチメートル2の領域をクリップ。毛皮を除去した後、8と面積準備を - 12%希釈したヨウ素の外科スクラブソリューションを、70%アルコールですすいでください - 両方のステップを繰り返します。腹腔内に0.75インチの針/カテーテルを皮下トンネルにより24ゲージを挿入します。カテーテルは、プランジャに引き戻すことにより、盲腸または他の腹部の臓器になっていないことを確認 - カテーテル内に血液または糞便があってはなりません。
- 針を外し、腹腔内カテーテルを残します。 MRIスキャナ動物室内の温度制御サーマルパッドの上にマウスを置きます。
- リン酸緩衝生理食塩水(千μlのケタミン、300μlのキシラジンでケタミンおよびキシラジンを含む1 mlの滅菌注射器を準備します、6700μlのPBS)と72インチの滅菌チューブの所望の長さを埋めます。プレフィルド滅菌チューブに腹腔内カテーテルを接続し、MRIスキャナから離れて拡張します。マウスのバイタルサインが安定している場合、麻酔を維持するために20分毎に、この溶液50μlを注入します。
注:イメージングする前に、特定のない金属はMRIスキャナの近くではない作ります。 - 1 H用の300.283 MHzおよび19 F核用の282.524 MHzで無線周波数信号を送受信する19 F / 1 HデュアルチューニングされたリニアボリュームのMRIコイルを使用してください。
- 高速ローアングルショットシーケンス(FLASH)を使用して、3スライス(アキシャル、正中矢状、および冠状)スカウト画像を使用してシステム・キャリブレーション11、13および動物のローカライズを行います。実験を開始するには、ソフトウェアのコンソール上でスキャンコントロールウィンドウの「交通信号」ボタンをクリックします。
- 緩和と迅速な取得を使用してマルチスライス1 H MR画像を収集強化サンプルまたは繰り返し時間2200ミリ秒で動物の身体、エコー時間8.9ミリ秒のクロスビュー内メント(RARE)シーケンス、RARE因子8、ビュー4×4 cm 2のフィールドは、厚さ1.0ミリメートル、マトリクスサイズ266をスライスX 266、面内の解像度150×150μm2で、実験を開始するには平均値6の数、ソフトウェアのコンソール上でスキャンコントロールウィンドウの「交通信号」ボタンをクリックします。
- 繰返し時間で1 H MRIの同じ領域にFLASHシーケンスを使用して、19 F画像を取得220ミリ秒、フリップ角= 30°、エコー時間3.078秒、マトリクスサイズ32×32、面内分解能1.25×1.25ミリメートル2、 「GOP」ソフトウェアのコンソール上の分光計コントロールツールウィンドウで(G O- Oのn P ipeline)ボタンをクリックして、厚さ4.0ミリメートルをスライスし、平均値768の数は、実験を開始します。
- MRI後、腹腔内injectiでマウスを安楽死させます15μL/グラムの体重のケタミン/キシラジンソリューション失血のために心臓穿刺に続いて(体重kg当たり150mgのケタミン/ 18mgのキシラジン)の上。
- 麻酔からマウスを回復するには、腹腔内カテーテルを除去するが、それは胸骨横臥位を維持するのに十分な意識を取り戻すまで、無人の動物を放置しないでください。
- 上記のように臓器の収穫から19 F標識胆汁酸濃度11-13を測定するために、ケタミンプラスキシラジン麻酔を維持します。
結果
リアルタイムで胆汁酸輸送を「見る」ためのin vivoでの MRI用MFBAの使用は、研究および臨床使用の両方のための大きな可能性を秘めています。また、胆嚢の切除し、液体クロマトグラフィーおよび質量分析を使用してその内容の生化学的分析のためにここに記載される方法は、撮像結果を確認する手段を提供します。しかし、これらの方法の有効性は、正確な投?...
ディスカッション
CA-のLys-TFAおよびCA-SAR-TFMAおよびASBTを発現する安定にトランスフェクトされたMadin-Darbyイヌ腎細胞ナトリウム/タウロコール酸共輸送ポリペプチド(NTCP)を発現するヒト胚腎臓細胞を使用して、輸送のインビトロ分析の合成他の場所13,14詳述されています。ここでは、フォーカスがlive-動物MRIによって胆嚢にMFBAを画像化、特に、MFBA含有量の分析のために胆嚢、肝臓、および血液?...
開示事項
著者らは、開示することは何もありません。
謝辞
この作品は、国立衛生研究所、糖尿病および消化器の国立研究所および腎疾患(助成金番号JP.R.にR21 DK093406およびT32 DK067872)及び(JP.R.への助成金番号1BX002129)VAメリット賞によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Duall size-21 all glass tissue grinder | Kimble Chase Life Science, Vineland, NJ | 885351-0022 | |
| Bruker BioSpec 70/30USR Avance III 7T horizontal bore MR Scanner | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Bruker 40 mm 19F/1H dual-tuned linerar volume coil | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Waters Acquity UPLC System with Quadrupole Detector | Waters Corporation, Milford, MA | ||
| Waters Acquity UPLC ethylene bridged hybrid C8 1.7 μm 2.1 x 50 mm column | Waters Corporation, Milford, MA | ||
| Gavage Needle | Braintree Scientific, INC. | N-010 | 20 G-1.5" curved 2.25 mm ball |
| 2 Stainless Steel Hemostats | VWR | 10755-018 | 4 and 5 inch, straight |
| Ketamine | MWI Veterinary Supply | 501090 | Ketamin zetamine 100 mg/ml |
| Xylazine | Akorn, Inc. | 20 mg/ml | |
| Intraperitoneal Catheter | Abbott | AbbocathTM-T.I.V. G720-A01 4535-42 | 24-G x 0.75" |
参考文献
- Thomas, C., Pellicciari, R., Pruzanski, M., Auwerx, J., Schoonjans, K. Targeting bile-acid signalling for metabolic diseases. Nat Rev Drug Discov. 7, 678-693 (2008).
- Vallim, T. Q., Edwards, P. A. Bile acids have the gall to function as hormones. Cell Metab. 10, 162-164 (2009).
- Dawson, P. A., Karpen, S. J. Thematic Review Series: Intestinal Lipid Metabolism: New Developments and Current Insights Intestinal transport and metabolism of bile acids. Journal of Lipid Research. 56, 1085-1099 (2015).
- Dawson, P. A., et al. Targeted deletion of the ileal bile acid transporter eliminates enterohepatic cycling of bile acids in mice. J Biol Chem. 278, 33920-33927 (2003).
- Pattni, S., Walters, J. R. Recent advances in the understanding of bile acid malabsorption. Br Med Bull. 92, 79-93 (2009).
- Walters, J. R., et al. A new mechanism for bile acid diarrhea: defective feedback inhibition of bile acid biosynthesis. Clin Gastroenterol Hepatol. 7, 1189-1194 (2009).
- Hofmann, A. F., Mangelsdorf, D. J., Kliewer, S. A. Chronic diarrhea due to excessive bile acid synthesis and not defective ileal transport: a new syndrome of defective fibroblast growth factor 19 release. Clin Gastroenterol Hepatol. 7, 1151-1154 (2009).
- Flynn, C., et al. Deoxycholic acid promotes the growth of colonic aberrant crypt foci. Mol Carcinog. 46, 60-70 (2007).
- Glinghammar, B., Rafter, J. Carcinogenesis in the colon: interaction between luminal factors and genetic factors. Eur J Cancer Prev. 8, S87-S94 (1999).
- Bernstein, C., et al. Carcinogenicity of deoxycholate, a secondary bile acid. Arch Toxicol. 85, 863-871 (2011).
- Zheng, X., Ekins, S., Raufman, J. P., Polli, J. E. Computational models for drug inhibition of the human apical sodium-dependent bile acid transporter. Mol Pharm. 6, 1591-1603 (2009).
- Vivian, D., et al. Design and characterization of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile Acid transporter activity. Pharm Res. 30, 1240-1251 (2013).
- Vivian, D., et al. Design and evaluation of a novel trifluorinated imaging agent for assessment of bile acid transport using fluorine magnetic resonance imaging. J Pharm Sci. 103, 3782-3792 (2014).
- Vivian, D., et al. In vivo performance of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile acid transport. Mol Pharm. 11, 1575-1582 (2014).
- Raufman, J. P., et al. In Vivo Magnetic Resonance Imaging to Detect Biliary Excretion of 19F-Labeled Drug in Mice. Drug Metab Dispos. 39, 736-739 (2011).
- Ridlon, J. M., Kang, D. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47, 241-259 (2006).
- Frisch, K., et al. N-methyl-11C]cholylsarcosine, a novel bile acid tracer for PET/CT of hepatic excretory function: radiosynthesis and proof-of-concept studies in pigs. J Nucl Med. 53, 772-778 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved