Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mit Multi-fluorierten Bile Acids und
In diesem Artikel
Zusammenfassung
Werkzeuge Gallensäure - Malabsorption zu diagnostizieren und Gallensäuretransport in vivo messen begrenzt sind. Ein innovativer Ansatz in lebenden Tieren beschrieben , das kombinierte Proton (1 H) und Fluor (19 F) Magnetresonanztomographie verwendet; Diese neuartige Methode hat translationale Potenzial für Gallensäure-Malabsorption in der klinischen Praxis zu screenen.
Zusammenfassung
Zusammen mit ihrer traditionellen Rolle als Reinigungsmittel, die Fettaufnahme zu erleichtern, gibt Literatur ab, dass Gallensäuren sind starke Signalmoleküle, die mehrere Organe betreffen; Gefäßtonus, Glukosestoffwechsel, den Fettstoffwechsel und Energieausnutzung sie modulieren Darm-Motilität und die Hormonproduktion und zu verändern. Änderungen in fäkale Gallensäuren können den Darm microbiome verändern und Kolon Pathologie einschließlich cholerrheic Durchfall und Darmkrebs zu fördern. Schlüsselregulatoren der fäkalen Gallensäure Zusammensetzung sind die kleinen Darm-Apikale Natrium-abhängigen Gallensäure-Transporter (ASBT) und Fibroblasten-Wachstumsfaktor-19 (FGF19). Reduzierte Expression und Funktion von ASBT verringert Darm Gallensäure up-nehmen. Darüber hinaus kann in - vitro - Daten deuten darauf hin , dass einige der FDA zugelassene Medikamente ASBT Funktion hemmen. Defizienten FGF19 Freisetzung erhöht Lebergallensäuresynthese und Freisetzung in den Darm zu Ebenen, die ASBT überwältigen. Entweder ASBT Dysfunktion oder FGF19 Mangel erhöht fecal Gallensäuren und können chronische Durchfall verursachen und Kolon Neoplasien fördern. Bedauerlicherweise Werkzeuge Gallensäure - Malabsorption zu messen und die Aktionen von Drogen auf Gallensäuretransport in vivo sind begrenzt. Um die komplexe Aktionen von Gallensäuren zu verstehen, sind Techniken erforderlich, die die gleichzeitige Überwachung von Gallensäuren im Darm und metabolische Geweben ermöglichen. Dies führte uns eine innovative Methode vorstellen Gallensäuretransport in lebenden Tieren zu messen , eine Kombination von Protonen (1 H) und Fluor (19 F) die Kernspintomographie (MRI) verwendet. Neuartigen Tracer für Fluor (19 F) -basierte lebendes Tier MRI wurden erzeugt und getestet, sowohl in vitro als auch in vivo. Stärken dieses Ansatzes gehören die fehlende Belichtungsstrahlung und translationale Potenzial für die klinische Forschung und Praxis zu ionisieren.
Einleitung
Zusammen mit ihren klassischen Rolle als Detergentien , die Fettabsorption aus dem Darm zu erleichtern, Gallensäuren wurden als potente Signalmoleküle beeinflussen mehrere Organe zusätzlich zu den mit den enterohepatischen Kreislauf 1,2 zugeordnet entstanden. Zusätzlich zu ihren eigenen Stoffwechsel steuern, modulieren Gallensäuren mehrere Aspekte der gastrointestinalen Physiologie (zB Darmmotilität und incretin Hormonproduktion, Kolon Physiologie und Krebsanfälligkeit) und haben eine systemische Wirkung auf den vaskulären Tonus, Glukose- und Lipidstoffwechsel, und die Energienutzung. Während einige dieser Wirkungen im Darm vermittelt werden, sind andere aufgrund postprandial Veränderungen in systemische Spiegel Gallensäure, bei adipösen Patienten oder nach Magen-Bypass-Operation nicht anderweitig angegeben. Aufzuklären ist die komplexe metabolischen Wirkungen von Gallensäuren neue Technologie benötigt, die gleichzeitige Überwachung von Gallensäureniveaus in verschiedenen anatomischen Abteilen ermöglicht, im Gastrointestinaltrakt und metabolic Geweben (Leber, Bauchspeicheldrüse, Skelettmuskulatur und Fettgewebe). Erhalten eines solchen zeitlichen und räumlichen Informationen erfordert innovative Technologie - in - vivo - Bildgebung neue Gallensäure - Tracer verwendet , wie hier beschrieben ist so ein neuer Ansatz.
Gallensäure Zusammensetzung und Verteilung in anatomischen Kompartimenten werden durch verschiedene Faktoren reguliert, die ihre hepatische Synthese und Ileum-Aufnahme modulieren, einschließlich Ernährung, Chirurgie, den Einsatz von Antibiotika und Veränderungen in der Darmflora. Ein wichtiger Regulator der intestinalen Gallensäureaufnahme für ihre enterohepatischen Kreislauf 3 (Figur 1) ist die Ileum - Apical natrium-abhängigen Gallensäure - Transporter (ASBT; SLC10A2). Obwohl passive Absorption in den Därmen stattfindet, vermittelt ASBT Aufnahme von 95% der intestinalen Gallensäuren, so dass normalerweise beschränkt Verschütten von Gallensäuren in die Faeces ist. ASBT-defizienten (Slc10a2 - / -) Mäusen haben fäkalen Gallensäuren und Gallen eine verminderte aci erhöhted Pool 4.
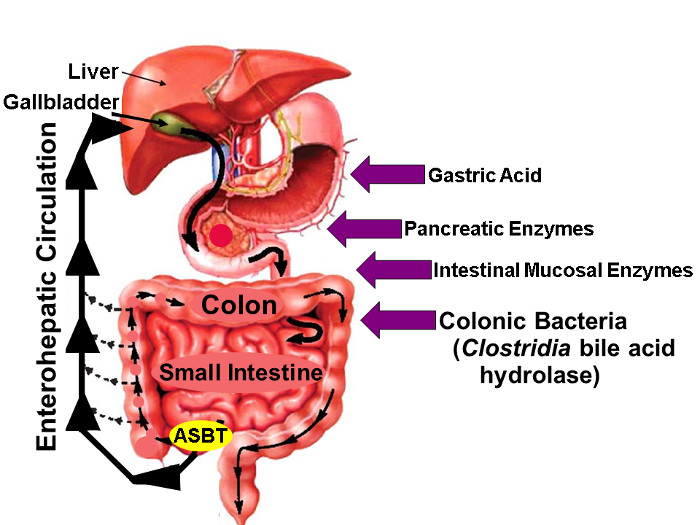
Abbildung 1: enterohepatischen Kreislauf von Gallensäuren.
Illustration von enterohepatischen Kreislauf , wodurch Gallensäuren werden in der Leber gebildet schieden in den biliäre Baum, Stored in der Gallenblase, Veröffentlicht in den Proximal Duenndarm mit Mahlzeiten und aktiv über ASBT in distaler Ileum aufgenommen. Während geringe Mengen an Gallensäuren passiv ganzen Darm absorbiert werden, etwa 95% der intestinalen Gallensäuren resultierende im Stuhl in minimal (etwa 5%) Verlust aktiv durch ASBT transportiert, die durch eine ähnliche Menge an neuen Gallensäuresynthese kompensiert wird in die Leber, die Aufrechterhaltung dadurch eine Steady-State-Gallensäure-Pool. Die Pfeile auf der rechten Seite identifizieren Faktoren, die native und Fluor-markierten Gallensäurestabilität, einschließlich Magensäure, Bauchspeicheldrüsen- und Darmschleimhaut Enzyme auswirken können, und die meisten importantly, hydrolytische von Clostridien - Spezies freigesetzt Enzyme, die den distalen Dünndarm und Dickdarm besiedeln. (Mit Genehmigung 16) Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Gallensäure-Malabsorption können in drei Typen eingeteilt werden, von denen jeder fäkalen dihydroxy Gallensäuren erhöht, wodurch eine intermittierende oder chronischen Durchfall. Typ 1 Ergebnisse von den Brutto - Ileum - Pathologie (zB Resektion, Morbus Crohn) 5. Typ 3 Ergebnisse von Cholezystektomie, Vagotomie, Zöliakie, bakterielle Überwucherung und Pankreasinsuffizienz. Im Gegensatz dazu Personen mit "primären" (Typ 2) Gallensäure-Malabsorption stellen eine gewaltige diagnostische Herausforderung, weil sie solche Vorbedingungen fehlen und haben keine Beweise für Pathologie im Ileum. Daher wird primären Gallensäure-Malabsorption häufig als Durchfall-p falsch diagnostiziertredominant Reizdarmsyndrom (IBS-D), vielleicht der häufigste Grund für Gastroenterologie bezogene ambulante Besuche. Es hat sich gezeigt, dass mit IBS-D haben primäre Gallensäure-Malabsorption ein Drittel der Patienten geschätzt wird; in den USA kann dies mehrere Millionen Personen repräsentieren 5. Neuere Erkenntnisse zeigen, dass die primäre BAM leitet sich von beeinträchtigten Feedback-Hemmung der Lebergallensäuresynthese durch Darm-Fibroblasten-Wachstumsfaktor-19 (FGF19), nicht von einer verminderten Expression oder Funktion von ASBT.
Bei der primären Gallensäure - Malabsorption, versagen niedrige Plasmaspiegel von FGF19 Lebergallensäuresynthese abzusperren - das daraus resultierende Erhöhung der intestinalen Gallensäuren sättigt Gallensäure - Transporter, einschließlich ASBT und das vergrößerte Verschütten von Gallensäuren in den Kot verursacht Durchfall 6 (Abbildung 2). Defiziente Mäuse in Fgf15 (murine FGF19) haben eine Gallensäure Pool erweitert und erhöht fäkale Gallensäuren 7.

Abbildung 2: Die Mechanismen der intestinalen Gallensäure - Malabsorption.
Normalerweise , wie in Tafel A gezeigt ist , etwa 95% der intestinalen Gallensäuren werden durch aktiven Transport im distalen Ileum über ASBT absorbiert. Wenn ASBT Expression oder Aktivität vermindert (Feld B), Beeinträchtigung der Darmgallensäureaufnahme führt Verschütten von Gallensäuren in den Darm. Mit eingeschränkter FGF19 - Signalisierung (Panel C), das Fehlen von Feedback - Hemmung der Lebergallensäuresynthese führt zu einer erhöhten Konzentration von Darmgallensäuren , die ASBT Transportkapazität mit verschütteten Materialien von Gallensäuren in den Darm zu überwältigen. Bitte hier klicken , um eine größere Version zu sehen diese Figur.
Die langfristige, chronische Erhöhung in fäkale Gallen acids kann Kolon Neoplasien fördern. Colon Neoplasie ergibt sich aus progressiven Schleimhaut-Dysplasie mit somatischen Gen-Mutationen assoziiert, aber Umweltfaktoren, die fäkale Gallensäuren erhöhen kann diesen Prozess beschleunigen und zu erweitern. Bei Nagetieren erhöhten fäkalen Gallensäuren entweder als Folge der exogenen Verabreichung oder ASBT Mangel fördern colon Dysplasie und Tumorbildung 8-10.
Bemerkenswert ist , provokativ Ergebnisse zeigen , dass häufig verwendete Medikamente , die von der Food and Drug Administration (FDA) genehmigt Gallensäuretransport durch ASBT in vitro 11 potent inhibieren. Wenn diese Medikamente Dünndarm Gallensäuretransport in vivo und erhöhen fäkale Gallensäurespiegel zu senken, wäre die möglichen Auswirkungen auf die Kolon Pathologie betreffen. Selbst ein kleiner Anstieg der Kolon Pathologie zurückzuführen eines solchen Arzneimittels zu verwenden, könnte eine große Auswirkungen auf die Gesundheit haben. Ein Toolkit, das die Plausibilität dieser in - vitro - Ergebnisse und epidemiologischer ob beurteilenachtungen würde zusätzliche Forschung anspornen, einschließlich Post-Marketing-Studien zur Sicherheit.
Trotz der Notwendigkeit, die praktische Tests identifizieren Menschen mit Gallensäure-Malabsorption fehlen. Eine direkte Messung der fäkalen Gallensäuren wurde Jahre abgelehnt vor als umständlich, unpraktisch und unzuverlässig 5. Alternative Ansätze umfassen die Messung Beibehaltung einer radioaktiven Selen-markiertem Cholsäure - Derivat (75 SeHCAT) und die Plasmaspiegel von 7α-Hydroxy-4-cholesten-3-on (C4) oder einem Therapieversuch von Gallensäurebinder. 75 SeHCAT Tests haben begrenzte Verfügbarkeit in Europa und ist nicht FDA-zugelassen oder für den Einsatz in den USA Außerdem, selbst bescheidene Strahlenexposition (0,26 mSv / 75 SeHCAT Test) von diagnostischen Tests wirft Bedenken, und bakterielle Überwucherung und fortgeschrittener Lebererkrankung kann 75 SeHCAT Ergebnisse durcheinander bringen. C4-Test ist potentiell attraktiv, da nur Plasma erforderlich ist, aber es hat eine geringe positive prädiktive value und Prüfung ist nicht weit verbreitet. Messung der Serumspiegel von FGF19 hat ähnliche Grenzen. Häufig greifen Ärzte auf ein Therapieversuch von Gallensäurebindern, aber dieser Ansatz kann eine endgültige Diagnose von Gallensäure - Malabsorption 5 nicht zur Verfügung stellen.
Aus diesen Gründen wurde ein neuartiges MRI - Ansatz konzipiert Gallensäure Transport und die Verteilung in vivo unter Verwendung von innovativen Multi-fluorierten Gallensäuren (MFBA-MRT) messen. MFBA drei Atome von Fluor (19 F), einem stabilen Isotop von 100% natürlicher Häufigkeit enthält, werden ähnlich zu nativem Gallensäuren 12, transportiert und verwendet werden kann , um Gallensäure - Transport mit einer Kombination von Protonen (1 H) und Fluor visualisieren ( 19 F) MRT, ein sensibles, sicheres Verfahren ohne Strahlenbelastung ionisierender 13,14.
Protokoll
Das folgende Protokoll hält sich an Richtlinien durch die Pflege und Verwendung Committee (IACUC) an der University of Maryland School of Medicine (IACUC Protokoll # 0415011, den 18. Juni genehmigt, 2015) Institutional Animal genehmigt.
1. Gavaging Mäuse , die mit 19 F-markierten Bile Acids
- Gavage Mäuse mit 150 mg / kg Körpergewicht 19 F-markierten Gallensäuren. Füllen einer 1-ml Spritze mit dem erforderlichen Volumen mit 19 F-markierten Gallensäure - Stammlösung [Cholsäure-Trifluor-acetyl Lysin (CA-lys-TFA; in 1: 1 Polyethylenglycol 400: Dulbeccos phosphatgepufferter Kochsalzlösung) oder cholylsarcosine- Trifluor-N-methyl-acetamid (CA-sar-TFMA; in 60% Polyethylenglykol 400 und 40% Dulbecco-Phosphat-gepufferte Saline] und fügen Sie eine 20-Gauge 1,5-Zoll gekrümmten lampen~~POS=TRUNC Magensonde Nadel Achten Sie darauf, die Nadel Schlundsonde. ist lang genug, den Pegel der Maus des Xyphoid Knorpels zu erreichen, wenn sie in die Speiseröhre bis zu der Nabe der Nadel eingeführt
- fest graspeln das Tier durch die lose Haut an der Rückseite des Halses zwischen dem Daumen und Zeigefinger und mit den restlichen Fingern die Haut auf den unteren Rücken und Schwanz zu fassen.
- Halten Sie die Maus aufrecht und die Sondennadel an der Seite vorbei und das Dach der Mund in die Speiseröhre und hinunter in den Magen. Wenn der Widerstand bei den Rachen angetroffen wird, setzen Sie die Nadel, bis das Tier "schluckt" es - nicht schieben gegen einen Widerstand.
- Wenn Anästhesie für eine Sonde erforderlich ist, setzen Sie die Maus in einer Glasglocke, die 5 ml Isofluran und zu schließen. Wenn die Maus auf die Seite fällt, warten 7 Sekunden, die Maus zu entfernen und Schlundsonde durchführen. Um Personal von Narkose- dämpfen, verwenden Sie die Glasglocke nur in einem Abzug schützen.
- Beachten Sie das Tier von Isofluran in wenigen Minuten zu erholen.
Hinweis: Da Isofluran in der Leber metabolisiert wird, ein Fluor Signal von Capecitabin ausgeht oder seiner Metaboliten in die Gallenwege ausgeschieden und Gallenblase kann Fluo vermengenrine Signale von 19 F-markierten Gallensäuren 15. Eine Alternative ist, Ketamin und Xylazin zu verwenden (siehe Abschnitt 3.1 für Dosen sehen).
2. Ernten der Gallenblase, die Leber und das Blut für Gallensäure-Messungen mit Flüssigchromatographie / Massenspektrometrie
- mindestens 6 Stunden für maximale Gallenblase Füllung, schnelle Mäuse Um das zu erreichen, bevor die Organe Ernte. Bereiten Ketamin und Xylazin in phosphatgepufferter Kochsalzlösung (100 ul Ketamin, Xylazin 62,5 & mgr; l, 840 & mgr; l PBS).
- Verwendung einer 1-ml sterile Spritze, injizieren einer Maus subkutan 1 Stunde vor der Organentnahme mit 15 ul / g Körpergewicht Ketamin / Xylazin-Lösung (150 mg Ketamin und 18 mg Xylazin pro kg Körpergewicht).
- Eine Stunde nach der Verabreichung von Ketamin / Xylazin bestätigen ausreichende Anästhesie durch toe Prise und legen Sie den narkotisierten Maus Rücken.
- Verwenden Sie 5 oder 6-Zoll-Schere, um eine Mittellinie Bauchhautschnitt von der pubis machen zum Xyphoid und fine Schere (4 Zoll), um die Peritonealüberzug zu schneiden und Bauchorgane aussetzen - nicht über die Membran zu durchdringen.
- Fassen Sie den Xyphoid Prozess mit einem 5-Zoll-Klemme und heben Sie über die Brust zurück in die obere Bauchhöhle aus. Verwenden einer Pinzette und ein stumpfes Instrument zu sezieren und die Leber zur Seite schieben, Freilegung der Gallenblase.
HINWEIS: Die Leber nicht zerfleischen oder die Gallenblase als ehemaliger berühren zu schweren Blutungen und so kann Kontraktion der Gallenblase und Entleerung stimulieren. - Legen Sie ein 4-Zoll - Klemme über den Gallengang (Abbildung 3, gestrichelte Pfeile). Schneiden Sie das Band den oberen Pol der Gallenblase an der Membran befestigt und sanft die Gallenblase an der rechten Seite des Bauches bewegen.
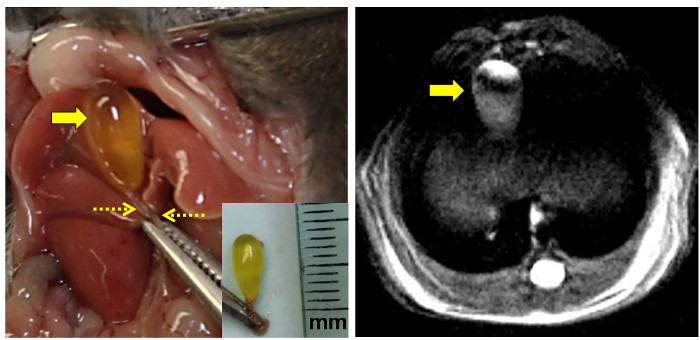
Abbildung 3: Anatomische und Proton MRI Ansichten der Maus Gallenblasenhydrops.
Die linke Tafel zeigt die freiliegende mouse Gallenblase, die links von der Mittellinie nach Bauchschnitt. Die Klammer greift den Xyphoid Prozess. Die Galle gefüllten Fasten Gallenblase wird durch den großen Pfeil und dem geklemmten Choledochus durch die gestrichelten Pfeile angedeutet. [Inset: exzidiert intakte Gallenblase mit dem Gallengang eingespannt. Der Herrscher in Millimeter markiert ist (mm).] Das rechte Bild zeigt eine hochauflösende Protonendichte-gewichteten MRT - Bild des Fastens murine Gallenblase (Pfeil). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
- Vor Excision der Gallenblase Herzpunktur führen, Ernte Blut und exsanguinate das Tier zu Euthanasie überprüfen.
HINWEIS: Ernten der Gallenblase zuerst die Leber zerfleischen können Kreislaufkollaps und Versagen verursacht eine ausreichende Blutprobe (≥ 200 & mgr; l) zu erhalten. - Expose die Unterseite der linken Membran unddas Schlagen Oberfläche des Herzens zu identifizieren. Am Punkt der maximalen Herz Pulsation durchstechen die Membran und das Herz mit einer 23-Gauge-Nadel an einer Spritze 1 ml angebracht.
- Langsam die Spritze zurückziehen, während Absaugen. Wenn das Blut beginnt die Spritze zu füllen, zu stoppen zurückzuziehen und halten Sog 0,2 zu sammeln - 0,6 ml Blut. Sanft Drehen der Nadel oder Fluss wieder herzustellen Abziehen kann es leicht, wenn es aufhört.
- Übertragen, um das Blut in ein 1,5-ml heparinisiertes Rohr und Zentrifuge bei 2.000 xg für 15 min. Man fällt das Plasma mit vier Teilen Acetonitril und Zentrifuge bei 12.000 g für 10 min. Analysieren Sie den Überstand durch Flüssigchromatographie / Massenspektrometrie (LC / MS / MS) 11-1312-1412-1412-1412-14. Bei Bedarf speichern Sie das Plasma bei -80 o C vor der Analyse.
- Mit stumpfen Dissektion, befreien die Gallenblase von der Leber. TRANSECT den Gallengang unterhalb der Klemme, zu entfernen und wiegen um die Gallenblase, und legen Sie sie in einem 1,5-ml MicroCentrifuge Rohr. Ernten Sie die Leber.
- Homogenisieren etwa 100 mg Leber und die gesamte Gallenblase auf Eis in einer Größe-21-Homogenisator Glasgewebe. Extrakt mit 75% Acetonitril und 25% Wasser (800 & mgr; l für Leber, 300 & mgr; l für Gallenblase) und Zentrifuge bei 12.000 g für 10 min. Verdünnte Extrakte nach Bedarf und zu quantifizieren Inhalt Gallensäure unter Verwendung von LC / MS / MS 11-13.
3. Live Animal Proton (1 H) und Fluorine (19 F) Magnetic Resonance Imaging
- maximal Gallenblase Füllung, schnelle Mäuse für mindestens 6 Stunden vor der Bildgebung zu erzielen. Mit Ketamin und Xylazin anästhesiert Mäuse Bewegung in der MRI-Scanner zu verhindern. Bereiten Sie eine Stammlösung von Ketamin und Xylazin in phosphatgepufferter Salzlösung (130 ul Ketamin, 42,5 ul Xylazin, 827 & mgr; l PBS). Eine Stunde vor der MRI, mit einem 1-ml sterile Spritze eine Maus subkutan mit 5 ul / g Körpergewicht dieser Lösung (65 mg Ketamin und 4,25 mg xylaz einzuspritzenine pro kg Körpergewicht). Trockenheit unter Narkose gelten veterinär Salbe auf die Augen des Tieres zu verhindern.
- Wie oben Nach Induktion mit Ketamin / Xylazin, befestigen ein 1,5 cm 2 Fläche auf der linken unteren Hälfte der Maus Bauch # 40 oder feiner elektrische Schermesser verwenden. Nach Fell Entfernung, prep den Bereich mit 8 bis 12% verdünnte Jod chirurgische schrubben und spülen mit 70% Alkohol - beide Schritte wiederholen. Legen Sie eine 24-Gauge von 0,75-Zoll-Nadel / Katheter subkutan und Tunnel in die Bauchhöhle. Stellen Sie sicher, dass der Katheter nicht in den Blinddarm oder andere Bauchorgan durch Ziehen an den Kolben zurück - es sollte in den Katheter kein Blut oder fäkale Material sein.
- Entfernen Sie die Nadel und lassen Sie die intraperitoneale Katheter. Platzieren Sie die Maus auf einem temperaturgesteuerten Thermal-Pad in der MRI-Scanner Tierkammer.
- Bereiten Sie eine 1-ml sterile Spritze mit Ketamin und Xylazin in phosphatgepufferter Salzlösung (1000 ul Ketamin, 300 ul Xylazin, 6700 & mgr; l PBS) und die gewünschte Länge von 72-Zoll-sterile Schläuche zu füllen. Verbinden Sie den intraperitoneale Katheter in die prefilled sterile Schläuche und verlängern sie von der MRI-Scanner entfernt. Zur Aufrechterhaltung der Anästhesie 50 ul dieser Lösung injizieren alle 20 Minuten, wenn die Vitalfunktionen des Maus stabil sind.
HINWEIS: Vor dem Imaging, stellen Sie sicher, keine Metalle sind in der Nähe der MRT-Scanner. - Verwenden , um eine 19 F / 1 H Dual-tuned linear Volumen MRI - Spule zur Übertragung und Hochfrequenzsignale bei 300,283 MHz für 1 H und 282,524 MHz für 19 F - Kerne zu erhalten.
- Führen Sie die Systemkalibrierung 11, 13 und Tier Lokalisierung mit Drei Scheibe (axial, mittsagittale und koronalen) scout Bilder einen schnellen Low-angle shot - Sequenz mit (FLASH). Um das Experiment zu starten, klicken Sie auf die "Ampel" Taste im Fenster Scan Control auf der Software-Konsole.
- Acquire Multislice - 1 H - MR - Bildern schnelle Erfassung mit Entspannung mit verbessernment (RARE) Sequenz in der Queransicht der Probe oder dem Körper des Tieres mit Wiederholungszeit 2200 ms, Echozeit 8,9 ms, RARE Faktor 8, Sichtfeld 4 x 4 cm 2, Schichtdicke 1,0 mm, Matrixgröße 266 in der gleichen Ebene x 266, Auflösung 150 x 150 & mgr; m 2, und die Anzahl der Mittelwerte 6. das Experiment zu starten, klicken Sie auf die "Ampel" Taste im Fenster Scan Control auf der Software - Konsole.
- Erwerben Sie 19 F Bilder eine FLASH - Sequenz in der gleichen Region des 1 H - MRI mit Wiederholungszeit 220 ms, Flipwinkel = 30 °, Echozeit 3,078 ms verwenden, Matrixgröße 32 x 32, Auflösung in der Ebene von 1,25 x 1,25 mm 2, Schichtdicke 4,0 mm und Anzahl der Mitte 768. das Experiment zu starten, klicken Sie auf den "GOP" (G o- O n- P ipeline) Taste im Spectrometer Control Tool - Fenster auf der Software - Konsole.
- Nach MRI, einschläfern die Maus mit intraperitoneale INJEKTIERTauf 15 ul / g Körpergewicht Ketamin / Xylazin-Lösung (150 mg Ketamin / Xylazin 18 mg pro kg Körpergewicht) durch Herzpunktion zum Ausbluten gefolgt.
- Um eine Maus aus der Narkose erholen, entfernen Sie die intraperitoneale Katheter aber nicht verlassen, das Tier unbeaufsichtigt, bis es genügend Bewusstsein wiedererlangt Brustlage zu halten.
- Zur Messung der 19 F-markierten Gallensäure - Konzentrationen von 11 bis 13 aus Organentnahme, halten Anästhesie mit Ketamin und Xylazin wie oben beschrieben.
Ergebnisse
Die Verwendung von MFBA für in vivo - MRT zu "sehen" Gallensäuretransport in Echtzeit hat ein großes Potenzial für die Forschung und die klinische Anwendung. Außerdem beschriebenen Verfahren hier zur Resektion der Gallenblase und biochemische Analyse seines Inhalts unter Verwendung von Flüssigkeitschromatographie und Massenspektrometrie ein Mittel zur Bildergebnisse bestätigt. Jedoch erfordert die Gültigkeit dieser Verfahren eine genaue Dosierung, Timing von As...
Diskussion
Die Synthese von CA-lys-TFA und CA-sar-TFMA und die in - vitro - Analyse der Transport stabil transfizierten Madin-Darby - Hundenierenzellen unter Verwendung von ASBT und humane embryonale Nierenzellen exprimieren , die Expression des Natrium / taurocholate Co-Transport Polypeptid (NTCP) werden an anderer Stelle 13,14 detailliert beschrieben. Hier liegt der Schwerpunkt auf die orale Verabreichung von MFBA mit der Schlundsonde Tiere leben, gefolgt von der Ernte der Gallenblase, Leber und Blut...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde von den National Institutes of Health, National Institute of Diabetes und Magen-Darm-und Nierenerkrankungen (Erteilungsnummern R21 DK093406 und T32 DK067872 zu JP.R.) und ein VA Merit Award (Grantnummer 1BX002129 zu JP.R.) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Duall size-21 all glass tissue grinder | Kimble Chase Life Science, Vineland, NJ | 885351-0022 | |
| Bruker BioSpec 70/30USR Avance III 7T horizontal bore MR Scanner | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Bruker 40 mm 19F/1H dual-tuned linerar volume coil | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Waters Acquity UPLC System with Quadrupole Detector | Waters Corporation, Milford, MA | ||
| Waters Acquity UPLC ethylene bridged hybrid C8 1.7 μm 2.1 x 50 mm column | Waters Corporation, Milford, MA | ||
| Gavage Needle | Braintree Scientific, INC. | N-010 | 20 G-1.5" curved 2.25 mm ball |
| 2 Stainless Steel Hemostats | VWR | 10755-018 | 4 and 5 inch, straight |
| Ketamine | MWI Veterinary Supply | 501090 | Ketamin zetamine 100 mg/ml |
| Xylazine | Akorn, Inc. | 20 mg/ml | |
| Intraperitoneal Catheter | Abbott | AbbocathTM-T.I.V. G720-A01 4535-42 | 24-G x 0.75" |
Referenzen
- Thomas, C., Pellicciari, R., Pruzanski, M., Auwerx, J., Schoonjans, K. Targeting bile-acid signalling for metabolic diseases. Nat Rev Drug Discov. 7, 678-693 (2008).
- Vallim, T. Q., Edwards, P. A. Bile acids have the gall to function as hormones. Cell Metab. 10, 162-164 (2009).
- Dawson, P. A., Karpen, S. J. Thematic Review Series: Intestinal Lipid Metabolism: New Developments and Current Insights Intestinal transport and metabolism of bile acids. Journal of Lipid Research. 56, 1085-1099 (2015).
- Dawson, P. A., et al. Targeted deletion of the ileal bile acid transporter eliminates enterohepatic cycling of bile acids in mice. J Biol Chem. 278, 33920-33927 (2003).
- Pattni, S., Walters, J. R. Recent advances in the understanding of bile acid malabsorption. Br Med Bull. 92, 79-93 (2009).
- Walters, J. R., et al. A new mechanism for bile acid diarrhea: defective feedback inhibition of bile acid biosynthesis. Clin Gastroenterol Hepatol. 7, 1189-1194 (2009).
- Hofmann, A. F., Mangelsdorf, D. J., Kliewer, S. A. Chronic diarrhea due to excessive bile acid synthesis and not defective ileal transport: a new syndrome of defective fibroblast growth factor 19 release. Clin Gastroenterol Hepatol. 7, 1151-1154 (2009).
- Flynn, C., et al. Deoxycholic acid promotes the growth of colonic aberrant crypt foci. Mol Carcinog. 46, 60-70 (2007).
- Glinghammar, B., Rafter, J. Carcinogenesis in the colon: interaction between luminal factors and genetic factors. Eur J Cancer Prev. 8, S87-S94 (1999).
- Bernstein, C., et al. Carcinogenicity of deoxycholate, a secondary bile acid. Arch Toxicol. 85, 863-871 (2011).
- Zheng, X., Ekins, S., Raufman, J. P., Polli, J. E. Computational models for drug inhibition of the human apical sodium-dependent bile acid transporter. Mol Pharm. 6, 1591-1603 (2009).
- Vivian, D., et al. Design and characterization of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile Acid transporter activity. Pharm Res. 30, 1240-1251 (2013).
- Vivian, D., et al. Design and evaluation of a novel trifluorinated imaging agent for assessment of bile acid transport using fluorine magnetic resonance imaging. J Pharm Sci. 103, 3782-3792 (2014).
- Vivian, D., et al. In vivo performance of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile acid transport. Mol Pharm. 11, 1575-1582 (2014).
- Raufman, J. P., et al. In Vivo Magnetic Resonance Imaging to Detect Biliary Excretion of 19F-Labeled Drug in Mice. Drug Metab Dispos. 39, 736-739 (2011).
- Ridlon, J. M., Kang, D. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47, 241-259 (2006).
- Frisch, K., et al. N-methyl-11C]cholylsarcosine, a novel bile acid tracer for PET/CT of hepatic excretory function: radiosynthesis and proof-of-concept studies in pigs. J Nucl Med. 53, 772-778 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten