Method Article
にバインドされた熱安定、発現、精製、およびヒトセロトニントランスポーターの結晶化
要約
本稿では、変異を熱安定をスクリーニングヒトセロトニントランスポーターの精製、高親和性抗体を生成し、抗うつ薬のSの -シタロプラムにバインドされたセロトニントランスポーター-抗体複合体を結晶化する方法について説明します。このプロトコルは、他の挑戦的な膜輸送体、受容体、およびチャネルの研究に適合させることができます。
要約
セロトニントランスポーターは、細胞への細胞外セロトニンの「ポンプ」とナトリウムと塩化結合トランスポーターである。 のS -シタロプラムは、セロトニン再取り込みをブロックする、高い親和性を有するセロトニントランスポーターに結合することによりうつ病および不安を治療するために使用される薬物です。ここでは、効率的な手順と、特急、安定化、精製、 およびS -シタロプラムおよびその他の抗うつ薬に結合されたセロトニントランスポーター-抗体複合体を結晶化するためのツールのセットを報告しています。セロトニントランスポーターの安定化変異は、結合アッセイのS -シタロプラムを用いて同定しました。バキュロウイルス形質導入HEK293SのGnTIで発現セロトニン輸送体-細胞は、プロテオリポソームに再構成し、高親和性抗体を産生するために使用しました。我々は、構造研究に有用な抗体を発見するための戦略を開発しました。 Sf9細胞における抗体断片の発現のための直接的なアプローチは、確立されています。トランス-抗体複合体は、この手順を使用して精製した行儀であり、容易に結晶化、3-4オングストロームの解像度にX線を回折するのS -シタロプラムとの複合体を製造します。ここで開発された戦略は、他の挑戦的な膜タンパク質の構造を決定するために利用することができます。
概要
セロトニントランスポーター(SERT)は、細胞膜を横切る1セロトニンの輸送を促進する内在性膜タンパク質です。 SERTはまた、ドーパミンとノルエピネフリントランスポーター2を備えて神経伝達物質ナトリウムシンポーター(NSSs)のファミリーに属します。 SERTは、競争的セロトニントランスポート3を阻害するように作用広く処方されている抗うつ薬や抗不安薬の分子標的です。 SERTは、シナプス間隙からの神経伝達物質を除去するために、ナトリウムのエネルギー的に有利な共輸送を利用します。セロトニン作動性システムの広範な特徴付けは、セロトニン代謝の変化は、気分、睡眠、痛み、認知を含む実質的にすべての神経学的プロセスに影響を与えるように見えることが示されている、と侵略を4ビヘイビア。 SERT機能は、S -シタロプラムなどの抗うつ薬と選択的セロトニン再取り込み阻害薬(SSRI)の使用により、ならびにpsychostimulaにより変更することができますそのようなアンフェタミンおよび3,4- methylenedioxy- N -methylamphetamineまたは「エクスタシー」1,2として中毒の国税庁と薬。
SSRIには、気分障害の治療のために大いに重要であり、まだそれらの作用の正確な構造的基礎は十分に理解されていません。 WT SERTは、このようにSERT 5,6の3次元(3D)構造に向かって進行を妨げる、界面活性剤ミセル中で不安定です。最近、我々は洗剤の広い範囲でロバスト安定であり、活動6を結合SSRIを保持SERTの変異体を開発しました。これらの耐熱性SERT変異体は、シンチレーション近接ベースの熱安定性アッセイを用いて選択しました。ここでは、抗体とS -シタロプラムとの複合体、SERTを結合することができる高親和性抗体の生成のための手順、および耐熱性SERTの精製及び結晶化について説明します。
このプロトコルは、SERTおよび8B6遺伝子は成功してきたことを前提としていyはそれぞれ、BacMamによって7および昆虫発現ベクターにクローニングしました。抗体を生成するために、WT SERTのcDNAを残基をコードする73から616をC末端のStrep IIタグ(SERT IC)でBacMamによってベクターにクローニングしました。熱安定性の画面では、SERT残基C末端GFPで73から616まで、のStrep II、10-Hisをタグ(SERTのTC)を使用しました。個々の点突然変異は、SERT TCバックグラウンドで生成されました。結晶化プロトコルの場合、SERT-GFP融合タンパク質は、表面システインC554A、C580Aの熱安定性変異体、Y110A、I291A、およびT439Sおよび変異を有する、ツイン連鎖球菌[TrpSerHisProGlnPheGluLys(GlyGlyGlySer)2 GlyGlySerAlaTrpSerHisProGlnPheGluLys]および10-Hisをタグで使用されました、およびC622A(SERTのCC)。トロンビン切断配列(LVPRGS)もまた、N末端およびC末端の除去を可能にするために、Q76及びT618後SERTのCCに挿入しました。 8B6のFabをコードするプラスミドは、重鎖および光の両方を発現するように遺伝子操作されました二つの別個のポリヘドリンプロモーターの制御下でGP67分泌配列を有する抗体の連鎖。 8B6抗体の重鎖のC末端は、8-Hisタグでタグ付けし、トロンビン切断部位は、重鎖およびタグの間に挿入しました。
プロトコル
接着HEK293SのGnTIの1.トランスフェクション-熱安定性スクリーンのための細胞
- ポリ-D-リシン(PDL)は、96ウェルプレートにコーティングを採用準備します。無菌層流フード内のすべての作業を実行します。
- 0.2μmの滅菌フィルターを使用して、25μgの/ mL溶液(PDL)、分子量70,000-150,000ダをフィルタリングします。均一に被覆されている底部を確保し、96ウェル組織培養(TC)をプレートの各ウェルにPDLの50μLを加え、室温で30分間インキュベートします。
- 吸引したPDL液および滅菌水200μLで洗浄します。
- プレートは4℃で保存前に2時間空気乾燥することができます。 PDLコーティングしたプレートを数週間4℃で保存することができます。
- 付着HEK293S細胞のトリプシン処理。
- 8%CO 2で37℃で維持10cmディッシュ中で80%コンフルエントにHEK293Sを成長させます。シングル10cmディッシュは約千万HEK293S細胞を持っている必要があります。 30継代後の細胞を使用しないでください!
- 吸引は、メディアおよびリン酸緩衝生理食塩水(PBS)5mLで洗浄します。細胞をトリプシン-EDTA溶液(0.25%トリプシン、0.02%EDTA)の1 mLを加え、37℃で2分間インキュベートします。
- 繰り返しピペッティング血清学的ピペットを用いて、10%ウシ胎児血清(FBS)を再懸濁細胞を補充したダルベッコ改変イーグル培地(DMEM)の10 mLを加え。
- 細胞のピペット10μLおよびトリパンブルー溶液(0.4%)の10μLと混合。血球計および光学顕微鏡を用いて細胞密度を決定します。彼らは死んでいるとして、青色に染色された細胞をカウントしないでください。細胞生存率は90%以上であることを確認してください。
- 徹底的HEK293SのGnTIをトリプシン処理し再懸濁- DMEM中の細胞は使い捨てピペットリザーバに0.5×10 6細胞/ mLの密度に、10%FBSを補充しました。約500万HEK293S細胞を、各プレートのために必要とされるであろう。 24コンストラクトの合計は、この広報を使用して、各プレートにトランスフェクトすることができますotocol。
- マルチチャンネルピペットを使用して、PDLコートしたプレートの各ウェルに細胞を100μLを追加します。細胞の均一な分布を確実にするために、各プレートを充填した後、ピペットリザーバで細胞を再懸濁します。 8%CO 2で37℃のインキュベーター中で細胞をインキュベートします。 24時間後、細胞を、約80%コンフルエントに達するべきです。
- トランスフェクション前の1時間は、メディアを交換してください。トランスフェクションのためのDNAトランスフェクション試薬複合体を準備します。
- それぞれがスクリーニングされるべきSERTのTCのバックグラウンドで構築するために、無血清DMEMの45μLと450 ngのDNAを混合し、混合します。無血清DMEMの45μLにトランスフェクション試薬の1.6μLを加え、混合します。
- 直ちにDNA溶液と混合する希釈トランスフェクション試薬溶液を加えます。逆の順序でソリューションを混在させないでください。 15分および4ウェルにトランスフェクション試薬/ DNA混合物の20μLを追加 - 10待ちます。
- すべてのウェルがトランスフェクトされた後、静かに戻って揺動することによりプレートを混ぜますND前後と37℃のインキュベーターに戻します。
- 16後 - 24時間DMEMは、血清および10mMの酪酸ナトリウムを含有する培地を交換してください。
- 約48時間後、トランスフェクション培地を除去し、すぐに熱安定性スクリーンを進めるか、後で使用するために-80℃で細胞を凍結するのいずれか。細胞は数週間-80℃で保存することができます。
S -シタロプラム2.シンチレーション近接ベースの熱安定性スクリーン
- 室温で5分間- TBSの25μL(20 mMトリス、pHが8、100mMのNaClトリス緩衝生理食塩水)で200 nMのS -シタロプラムで細胞をインキュベートします。
- 、プロテアーゼ阻害剤カクテルを8ミリモルのn-ドデシルβ-D-マルトピラノシド(C12M)の25μL、1mMのコレステリルhemmisuccinate(CHS)を添加することによって細胞を可溶化(2 mMのは、0.1mg / mlのアプロチニン、を4gフルオリド(PMSF)をフェニルメタン/ mLのペプスタチンA、4 / mlのロイペプチン)TBS中で、そしてRTで1時間インキュベートします。
- TBSのwiの50μLを追加20nMの[3 H]シタロプラム(81.7 CI / mmol)を、0.1%ウシ血清アルブミン、および2 mg / mlでHisタグアフィニティシンチレーション近接アッセイ(SPA)ビーズ番目の各構築物のための3つのウェルに。最後のためによく記載されている同じ溶液を加えるが、非特異的結合を決定するために、100μMのセルトラリンで補います。 96ウェルプレートに追加する際にHisタグの親和性SPAビーズが完全に混合されていることを確認してください。
- ウェルあたり1分間カウント時間でRTで96ウェルシンチレーションカウンターを用いて結合する[3 H]シタロプラムを測定します。総カウント(約36時間後)高原まで、プレートをカウントし続けます。
- 33℃で加熱蓋付き加熱ブロック中で15分間熱板。 2.4で説明したように加熱した後に再び結合[3 H]シタロプラムを測定します。
- 繰り返しステップ2.4から2.5と36℃、39℃、45℃、48℃、および51℃に加熱工程を変更します。見かけの融解温度(Tm)に応じて加熱温度を調整します標的タンパク質と、最も安定した構造物の熱安定性の。すべての構築物は、低い特定のカウントになるまで熱プレートに進みます。
- Tm値を決定するためにデータを分析します。
- 3複製ウェルを平均化することによってセルトラリンを含まないウェルについて各構築物の分当たりの平均総カウント(CPM)を決定します。単板に含む各ウェルセルトラリンのCPMを平均化することにより、非特異的CPMを決定します。
- 総CPMから非特異的CPMを差し引くことにより、特定のCPMを計算します。
- ボルツマンシグモイド関数の非線形フィットによってはTmを計算します。 RTで低比CPM(Tm値を持っていません。最も耐熱性の構築物からの変異が一緒に合わせて、熱安定性添加剤増加についてスクリーニングすることができます。
HEK293SのGnTI中のヒトセロトニントランスポーターの3式 -細胞
- プラスミド1ngので化学的コンピDH10BAC細胞を形質転換します。
- DH10BAC細胞の50μLにプラスミドを加え、氷上で30分間インキュベートします。
- 30秒間42℃で熱ショックDH10BAC細胞。 SOC培地200μLを加え、振とうしながら4時間37℃でインキュベートします。
- 50μg/ mLのカナマイシン、7 / mlのゲンタマイシン、10μgの/ mLのテトラサイクリン、100μg/ mLの5-ブロモ-3-インドリルβ-D-ガラクを含むルリアブロス(LB)プレート上にプレートの細菌の全てを、そして40μgの/ mLのイソプロピルβ-D-1-チオガラクトピラノシド(IPTG)。
- lacZを隔離- LB寒天プレート上で2日間37℃で生育したコロニー(白色コロニー)。
- 抗生物質を含むLB 5mLに37℃で、いくつかのコロニーO / Nを成長し、バクミドDNAを単離します。
- 5分間遠心分離機1,000×gで細菌をスピンダウン。上清を捨てます。ミニプレップrの200μLで再懸濁菌esuspensionバッファ。
- ミニプレップの溶解緩衝液200μLを添加し、穏やかに10回チューブを反転させることにより溶解細菌。中和緩衝液200μLを加えます。
- 遠心機で10分間、14,000×gで回転させることにより不溶性画分を削除してください。 DNAを沈殿させ、20分間-20℃で上清とチルにイソプロパノール1 mLを加え。
- 遠心機で15分間、14,000×gでスピンし、上清を捨てます。
- ウォッシュDNAは70%エタノールでペレット化し、15分間、14,000×gで再びスピン。上清を捨てます。すべてのEtOHまで空気乾燥DNAを蒸発させ、50μLの水で再懸濁しました。
注:バクミドDNAはすぐに最適な結果を得るために、Sf9細胞にトランスフェクトされるべきでなく、数週間-20℃で保存することができます。
- トランスフェクトを6ウェルディッシュ中で27℃の加湿チャンバー中で増殖させたSf9付着の1×10 6個の細胞にDNAをバクミド。無菌層流フード内のすべての細胞培養操作を行います。
- 細胞から培地を除去し、新鮮なのSf9メディアの2ミリリットルを追加します。 Sf9メディアの100μL(溶液A)にバクミドDNA5μgのを追加します。
- Sf9メディアの100μL(溶液B)にカチオン性脂質のSf9トランスフェクション試薬の8μLを追加します。 5分間溶液Bを含むチューブをインキュベートします。
- 溶液Bと溶液Aを含むチューブを混合し、室温で30分間インキュベートし、Sf9細胞にソリューションのすべてを追加します。
- 0.2μmのフィルターを通過することで96時間、収穫上清(P1ウイルス)の後。 P1ウイルスは、暗所で4℃で数ヶ月間保存し、必要に応じて、P2ウイルスを作製するために再使用することができます。
- Sf9細胞培地中1×10 6細胞/ mLの密度で、Sf9細胞を1 Lに100μLP1ウイルスの追加。 100rpmでシェーカー上で27℃で成長し、96時間細胞に感染。
- 15分であり、0.2μmのフィルターを通してウイルス粒子を含むフィルター上清のために4000×gで遠心分離で細胞をスピンダウン。細胞ペレットを捨てます。 Determウイルスのプラークアッセイまたはウイルスカウンタを使用してINEウイルス密度。ウイルス密度はミリリットル当たり> 1×10 8ウイルス粒子であるべきです。 P2ウイルスは、暗所で4℃で保存し、数ヶ月のために使用することができます。
- セル7は、2の感染多重度で2%FBSを補充した293発現培地で130 rpmで振盪機上で8%のCO 2および85%湿度(MOI)で37℃で懸濁液中で成長している- HEK293SのGnTIの10 Lに感染そして3×10 6細胞/ mL、典型的には30の密度- 2 Lバッフル付きフラスコ内の細胞のP2ウイルス800 mLあたり50 mLの。
注:これはHEK293SのGnTIので、P2ウイルスの80以上のミリリットルを使用することが推奨されていない-によるpHの変化に細胞がゆっくり成長すると不利になることがあります。 Sf9メディアは293発現培地よりも酸性です。 - 12 - 感染後16時間は、1 Mストックから10 mMの濃度に酪酸ナトリウムを追加します。 48から60時間感染後、遠心分離により収穫細胞で15分間、4000×gで。上清を取り除きます。
- TBSの150ミリリットルで細胞を再懸濁し、2μMのSの -シタロプラムまたは他のSERT阻害剤、-80℃で保存精製の直前まで。
免疫化および結晶化のためのセロトニントランスポーターの4アフィニティ精製
- 急速に均一になるまで10 mLのピペットを通過することにより温水(約30℃)および再懸濁での培養の10 Lから細胞を解凍します。
- 40 mMのC12M、5 mMのCHS、およびプロテアーゼ阻害剤カクテルを含む80 mMトリス、pHが8、150mMのNaCl:可溶化のための界面活性剤溶液(150ミリリットル)を準備します。
- 撹拌棒をビーカーに細胞のすべてを追加し、攪拌しながら細胞に洗剤溶液のすべてを追加します。撹拌しながら1時間、4℃で可溶化します。
- 4℃で15分間8000×gで溶解液をスピン。ペレットを捨て、きれいな超遠心チューブに上清をデカントします。 ultracentで1時間、100,000×gでスピンrifuge。 0.2μmのフィルターを通してペレットやフィルタ上清を捨てます。
- 1 mMのC12M、0.2 mMのCHS、5%グリセロール、25μMの脂質(1-パルミトイル-2- oleoyl- SN -glycero-:洗浄緩衝液で平衡化し、蠕動ポンプを使用してカラムに充填連鎖球菌親和性樹脂mLの10の上に、溶解物を渡します1のモル比で3ホスホコリン、1-パルミトイル-2- oleoyl- SN -glycero -3-ホスホエタノールアミン、1-パルミトイル-2- oleoyl- SN -glycero -3-ホス:1:1)、1 μMS -シタロプラムまたはTBSでSSRI。
- 高速タンパク質液体クロマトグラフィー(FPLC)システムに連鎖球菌アフィニティーカラムを接続し、洗浄緩衝液の66ミリリットル(6.6カラム体積)にて2mL /分でカラムを洗浄。 5 mMのを補充した同じ緩衝液で溶出精製されたタンパク質は、緩衝液の33ミリリットル(3.3カラム体積)を用いて0.5mL /分でデスチオビオチン。 1 mL画分を収集します。ピーク画分〜10 mLとなります。所望であれば、3次元 - 精製されたタンパク質は、2、4℃で保存してもよいです。
注:総収量は3になります -SERT CCとSERT IC 1mgの4mgの。 280nmで2 AUの吸光度は1mg / mlのSERTに等しいです。
予防接種のためのリポソームへのトランスポーターの5の再構成
- コレステロール:リピドA:脳極性脂質(モル比60:17:3:20)アゾレクチンを含むリポソームを準備します。 1mLのクロロホルム中の脂質を溶解し、示されたモル比で100 mLのガラス製丸底フラスコに総脂質の40ミリグラムを追加します。
- 温水に回転する丸底フラスコを用いて真空下で少なくとも1時間、クロロホルムを蒸発させ、約30°C。
- TBSを10mLを加えることによって脂質を再水和します。 10分間緩衝液中でインキュベートします。
- 液体N 2中にフラスコを置くことによって脂質をフリーズします。
- 解凍。暖かい水で満たされたビーカーにフラスコの球状の底を浸し、約30°C。 5分間浴超音波処理器で超音波処理します。
- 渦と繰り返し手順5.1.3 - 5.1.4 10倍または脂質まで完全に底から再懸濁させ、濁った懸濁液を形成します。
- 200 nmのフィルターを通して二回全体脂質混合物を押し出します。脂質は、押出前に乳白色の懸濁液として表示されます。その後それは半透明になります。それが詰まることができるように、サンプルの損失が生じ、一度押出機に、全脂質混合物を追加しないでください。
- 40mg / mLの濃度でTBSの1ミリリットル - 0.5で20分間再懸濁し、100,000×gで脂質をスピン。
- 2に100kDaのMWCO遠心タンパク質濃縮器を用いて、500μL - - 250に精製されたSERT ICを集中に4mg / mL及び5 mMのC12Mを有するリポソームを飽和。洗剤に精製されたSERTを追加:脂質混合物を1 mLの最終容量で。
- 80 mg / mlで疎水性吸収樹脂の3連続添加によってC12Mを削除します。第2の追加のために、4℃で2時間回転させながら樹脂でインキュベートします。グラスウールを通過することによって樹脂を除去します。樹脂との最終インキュベーションを行います一晩。
- 20分を100,000×gで遠心分離することによってプロテオリポソームを濃縮します。 TBSの500μL - 250で上清と再懸濁ペレットを捨てます。
- 樹脂の最終的な除去後の再構成タンパク質へのS -シタロプラムの最終濃度10μMを追加します。
- SDS-PAGEローディング緩衝液(62.5 mMトリス、pHが6.8、10%グリセロール、2%SDS、0.01%ブロモフェノールブルー、100mMのDTT)中のプロテオリポソームの2.5μLを可溶化し、1、200 VでSDS-PAGEゲル上で泳動そのSERTを確保する時間が正常に再構成されています。プロテオリポソームは、長期貯蔵のためにアリコートで-80℃で保存し、各免疫化の前に氷上で解凍することができます。
3Dエピトープを認識する抗体6.スクリーニング
- ウェスタンブロットによる画面ハイブリドーマ細胞株。ウエスタンブロットによってSERTを認識する抗体は、おそらく線形エピトープに結合し、可能性の高い構造研究のために有用ではありません。
- purifi1μgのミックスED SERT ICまたはSERTのCCと4で実行さ- 1時間、200 Vで15%SDS-PAGEゲル。
- Towbin緩衝液を用いて30分間(25 mMトリス、192 mMグリシン、20%(v / v)のメタノール、0.1%SDS)、200 mAでニトロセルロース膜に移します。膜を乾燥させ、室温で無期限に保存することができます。
- 再湿潤10%のメタノールで膜、及びPBS(10mMリン酸塩、pH7.4中、137mMの塩化ナトリウム、2.7mMの塩化カリウム)で洗浄しました。
- 室温で30分間、PBS中の5%粉乳でブロック。
- PBSで洗浄し、0.1%ミルクを含むPBS中の抗体を1μg/ mLでインキュベートします。
- PBSは、0.1%のTween-20を含有する広範囲に洗浄します。
- 0.1%のTween 20および0.1%ミルクを含むPBS 10,000:1に希釈したIR染料に結合したヤギ抗マウス抗体とインキュベートします。
- 広範囲に洗浄し、イメージングシステムを用いてスキャンします。
- 2(SER:1のモル比を用いて100 nmのSERTのCCタンパク質と西洋負の抗体を含有するハイブリドーマ上清を混ぜますT:モノクローナル抗体)1 mMのC12M、0.2 mMのCHS、および1μMS -シタロプラムと200μLのTBSインチ20分間100,000×gで遠心分離します。 SERT-モノクローナル抗体複合体を含む上清を分析し、蛍光検出サイズ排除クロマトグラフィー(FSEC)8によって分析します。ペレットを捨てます。
- TBS、0.4ミリモルを含むランニングバッファーを用いた蛍光検出器を備えた高速液体クロマトグラフィー(HPLC)システム(510 NM:480nmで、発光励起)を用いて0.5mL /分でのサイズ排除カラムに上清の100μLを実行しますラウリルマルトースネオペンチルグリコール、および1μMS -シタロプラム。複合体を形成する抗体は、GFP融合タンパク質は、サイズ排除カラムからの無料トランスポーターよりも早く溶出するために発生します。
- 1 mMのC12Mと200μLのTBSで10、1、0.1 nMの、0.2 mMのCHS、および1μMのSの -シタロプラムおよび再実行FSECに複合体を希釈します。依然として低ナノモル濃度でトランスピークをシフトすることができる抗体であります高親和性結合体と構造研究のための良い候補。
- 1 mMのセロトニンの存在下でFSECによって結合再テスト。特にSSRIに結合した立体構造を認識する抗体は、基質の存在下で結合しません。コンフォメーションの結果として変化しない3Dエピトープを認識する抗体は関係なく、リガンドの存在のバインドします。
- 抗体およびFSECによって結合試験の対異なる組み合わせを混ぜます。別個のエピトープを認識する抗体は、単一の抗体の結合と比較して、一緒に組み合わされたときSERTは早く溶出します。
- 初期の構造研究のために、3Dエピトープを認識する最も高い親和性の抗体を選択します。
Sf9細胞における抗体フラグメントの7式
- 標準的なプロトコールを用いてSf9細胞での発現のための昆虫発現系にPCRによりクローン変数およびFabの定常ドメイン。
- トランスフェ1×1(セクション3.4に従って)GP67分泌配列と8-Hisタグ8B6のFabの軽鎖および重鎖をコードするバクミドDNA5μgの0 6 Sf9細胞。
- 収穫P1ウイルス96時間トランスフェクション後及びP2ウイルスを作製するために2 Lのフラスコに1×10 6細胞/ mlの密度で、Sf9細胞を1 LにP1ウイルスの500μLを加えます。 27℃で96時間、細胞を感染させます。
- 収穫P2ウイルス(セクション3.6によります)。
- 各2Lフラスコ中Sf9細胞の1 Lのフラスコ当たり50ミリリットル- P2ウイルスと2のMOIで3×10 6細胞/ mL、一般的に40から2の密度でSf9細胞の6 Lに感染します。
- 細胞を回収し、約96時間の感染後。 、リン酸緩衝液50 mLを加え20分間4,000×gで細胞をスピンするの50mMの最終濃度でpHを8。 0.2μmのフィルタータンジェンシャルフローセルを通って細胞ペレットとフィルタ上清を捨てます。必要であれば3日 - 2のために4℃で上清とストアを収集します。
8。 Sf9細胞上清からの抗体フラグメントの精製
- 800ミリリットル - 約400に30kDaの分子量カットオフ(MWCO)タンジェンシャルフローセルを用いたSf9上清を濃縮します。
- イミダゾール、10mMの最終濃度でpHを8とHisタグアフィニティ樹脂の10 mLを加え。 4℃で1時間、ビーカーに撹拌します。
- 5分間2000×gで遠心分離することによりHisタグアフィニティー樹脂を収集します。上清を捨てます。
- 列にHisタグアフィニティー樹脂をパックし、FPLCに接続します。
- 50 mMのリン酸pHが8、150mMのNaCl、25 mMイミダゾールの66ミリリットル(6.6カラム体積)にて2mL /分でHisタグアフィニティー樹脂を洗浄します。
- 50 mMのリン酸pHが8、150mMのNaCl、250mMイミダゾールの33ミリリットルで溶出8B6のFab。 1 mL画分を収集します。
- 氷冷20 mMの酢酸の10倍の容量を有するFab親和性精製し、pHを5に希釈します。
- 1ml /分で蠕動ポンプを使用して、1 mLの陽イオン交換カラムに結合したFab。
- 30 mLの林を使用して独立したのFabFPLCを使用して、20mMの酢酸のpHは5.5で - (500mMの0)のNaClの耳の勾配。 Fabを〜300mMのNaClで単一ピークとして溶出します。
- 100mMのDTTを含む試料緩衝液を用いて12.5%SDS-PAGEゲル上で分析します。 8B6のFabの重鎖および軽鎖は、還元SDS-PAGEゲル上で、それぞれ、27および25kDaのに実行されます。
- 3,000×gで、スイングバケット遠心分離機で30kDaのMWCOタンパク質濃縮器を用いて、15 mg / mlで - のFabを含むプール画分とは、少なくとも10に集中します。
- 4℃での長期のFabを精製し、50mMの、店舗の最終濃度を1 MトリスpHが8を添加することによってpHを8に調整します。 30 mgの - 合計収率は25になります。 280nmで1.4 AUの吸光度を1mg / 8B6のFab mLのに等しいです。
サイズ排除クロマトグラフィーによってトランスポーター - 抗体複合体と分離の9の形成
- 前述したように結晶化のために、(セクション4)C12Mにおける連鎖球菌アフィニティークロマトグラフィーによりSERT CCを浄化します。
- タグを削除するには、トロンビンとのダイジェスト(1:100ワット/ワット)RTでと遠藤(1:10 w / w)のO / N。 10 mg / mlのタンパク質濃度を100 kDaのMWCO遠心タンパク質濃縮を使用して300μL - 250に集中します。
- 未満500μL容積で1.2:ミックス1のモル比でのFabとSERTを濃縮しました。 20分間、4℃で10万×gで遠心分離します。 SERT-のFab複合体を含有する上清を収集します。ペレットを捨てます。
- TBS中で平衡化したサイズ排除カラムでFPLCを用いてサイズ排除クロマトグラフィー(SEC)によって別個の40mM n-オクチルβ-D-マルトシド(C8M)を補充した、0.5mMのCHS、5%グリセロール、同じ25μM脂質(ステップ4.5)、および0.5mL /分で1μMのSの -シタロプラムインチ
- 0.5 mL画分を収集し、4に分析 - 15%SDS-PAGEゲル並びにSECによるトリプトファン蛍光によって。 GFPは、SERTは、SDS-PAGEゲル上で約80kDaで実行されますタグの付きました。末端およびN結合型糖を除去した後、それは、45 kDaのタンパク質として実行されます。
- DETEトリプトファン蛍光SECによる画分の分析(:280、発光:335nmで励起)によって判断されるように、画分が単分散である画分のみをプールすることにより結合するrmine。
- ストアは、最大1週間4℃でSERT-8B6複合体を精製しました。
ドロップハンギングによりトランスポーター - 抗体複合体の結晶化10
- 結晶化の前に、100 kDaのMWCO遠心タンパク質濃縮を使用して2 mg / mlとするSERT-8B6複合体のSEC分離からのピーク画分を濃縮します。 280nmで2 AUの吸光度を1mg / mLに等しいです。
- 0.05複雑な::無料のFab 1の割合で追加のFabを追加します。 10μM無料のS -シタロプラムを追加します。
- 20分間、4℃で10万×gで遠心分離します。 SERT-のFab複合体を含有する上清を収集します。ペレットを捨てます。
- 表1によると、4℃でハンギングドロップ24ウェルの画面を設定する。リザーバーのソリューションに比べて回折品質の結晶を成長させます、100 mMトリスNaOHを、pHが8.5を含む25から125のKCl、32.5から34パーセントのPEG 400、および0.5%の6-アミノヘキサン酸。
注:バッファーとしてpH8.5にNaOHで調整使用トリス。 HClで調整トリス塩基を使用しないでください。画面は2 mLのチューブに調製し、完了するまで使用されてもよいです。それは非常に粘性があるように正確に正の変位ピペットを用いて、PEG 400をピペットに注意してください!- シーラントとロープロファイルの各リザーバー溶液を24ウェルプレートのピペット500μLを各ウェルに適用されます。ピペット1.5、1.75、および18ミリメートルシリコンコートガラスカバースリップ上にSERT-8B6複合体の2μL。タンパク質試料の上にリザーバー溶液のピペット1μL。
注:プレートはすでに井戸の縁に適用されるシーラントで購入しました。 - リザーバー溶液に直面滴で24ウェルにカバースライドを適用し、各ウェルに予め適用シーラント上にカバースリップを押すことで、すぐに密封します。
- 全24ウェルが設定されるまで続けます。
- 4°Cでよく絶縁された部屋で、完成したプレートを残します。少なくとも3日間プレートを邪魔しないでください
注:単結晶は約3日以内に表示され、14日後に100から175ミクロンに成長します。
- シーラントとロープロファイルの各リザーバー溶液を24ウェルプレートのピペット500μLを各ウェルに適用されます。ピペット1.5、1.75、および18ミリメートルシリコンコートガラスカバースリップ上にSERT-8B6複合体の2μL。タンパク質試料の上にリザーバー溶液のピペット1μL。
- 収穫cryoloops中の結晶と直接フラッシュクール液体N 2中の前のX線回折データ収集へ。
- 必要に応じて、懸滴との幅広いスクリーニングによって追加の結晶化条件を見つけます。 2の沈殿剤比:1、1.5:1、1:1のタンパク質と3滴を使用してください。ロボットが利用可能である場合、100から150 nLの96ウェルプレートにリザーバー溶液の70μLをドロップを設定します。大きな3D結晶は、24ウェル中で増殖させることができます。
- ドロップの外観に基づいてスコア:0、明確な。 1、ほこり; 2、顆粒状の沈殿物。 3相分離。 4、微結晶; 5、針。 6、プレート。図7に示すように、3次元結晶。
- 新たに同定されたcondの周りに上記のように24ウェルのドロップ方法をぶら下げによる結晶化を設定しますitions。
結果
SERTのTCのバックグラウンドで単一点突然変異体のライブラリーは、突然変異を熱安定をスクリーニングするために作成されました。個々の変異体は、標準的な変異誘発を用いて作製しました。スクリーニングプロトコルは、 図1(a)に概説されるように結晶化のため急速にアイデンティティ有用変異に一過性にトランスフェクトHEK293S細胞とシンチレーション近接ベースの熱安定性の画面を利用しています。プロットTm値結合した[3 H]シタロプラム対RTで適切な高耐熱性および発現レベルを有する構築物を明らかにタンパク質精製のために( 図1B)。三つの突然変異体(Y110A、I291A、およびT439S)は安定性の高い構築物( 図1C)を生成するために組み合わせました。熱安定性はまた、SERT-のFab複合体の結晶化に必要な短鎖の界面活性剤で安定性の増加と相関します。
バキュロウイルス-TRを用いてヒトSERTの大規模発現ansduced HEK293SのGnTIは-細胞が2週間未満取ることができ、 図2Aに示すように、ミリグラム量を生成することができます。 GFPタグSERTのCCタンパク質の使用は、SERTは便利蛍光( 図2B)による発現および精製の間続くことを可能にします。 ;安定化脂質としてCHSの存在下でC12Mでの細胞-当社の精製戦略は、1)HEK293SのGnTIからのS -シタロプラムにバインドされたSERTの可溶化を関与しました2)連鎖球菌の親和性マトリックスにSERTの結合;徹底的な洗浄によって夾雑タンパク質の3)除去;および4)を含む緩衝液デスチオビオチン( 図2C)との機能SERTの溶出。溶出したタンパク質は、FSEC( 図2D、E)によって判断されるようにクマシーブルー染色し、単分散することにより、他の検出可能なタンパク質の大部分は無料です。
同様の戦略はreconstitutioのために使用されたのStrep IIタグとSERTを精製するために取られましたnおよび免疫( 図3A、B)。プロテオリポソームへのSERTの取り込みは、SERTの血清半減期および安定性を向上させ、高親和性抗体の単離の可能性を向上させます。また、リピドA、細菌細胞壁の構成要素を含めることは、強力なアジュバント9として機能します。多重膜リポソームは、ガラス管中の乾燥した脂質混合物に緩衝液を添加することにより調製し、緩衝液中に再懸濁しました。 200 nmの細孔サイズのフィルターを通してリポソームを押し出し、単分散ユニラメラリポソーム懸濁液を生成します。リポソームは、その後洗剤で精製SERT、続いて界面活性剤で飽和されています。界面活性剤混合物:最後に、界面活性剤は、脂質の疎水性吸着樹脂を添加することによって除去されます。追加のリガンドは、抗うつ薬に結合した立体構造を認識する抗体を選択するために再構成したサンプルに追加する必要があります。プロテオリポソーム内SERTの存在はにより確認すべきですSDS-PAGEローディング色素またはC12Mとの小さなサンプルを可溶化し、SDS-PAGEおよびFSEC( 図3C、D)上で実行されています。
SERTの抗体を発現するハイブリドーマ細胞株は、3次元のエピトープを認識する高親和性結合についてスクリーニングすることができます。抗体がしっかりと均質な、秩序だったドメインの結晶パッキングを促進するための構造化領域に結合したままでなければならないように、これらの特性は、結晶化の最終的な成功に不可欠です。第1のステップでは、構造化されていない領域を認識する抗体が同定されます。 SERTを変性させ、ニトロセルロース膜上にブロット。変性SERTを結合する抗体は、西洋陽性であること、おそらく線形エピトープを認識します。 図4Aに、我々は西洋陽性とcrystallogenesisを促進する可能性が有用ではない抗体の2つの例を示しています。 図4Bでは、残りの西部陰性抗体は、100 nMのSERT-GFPとインキュベートされ、で区切らFSEC。 SERTは、以前の位置にGFP陽性ピークをシフトさせる特異的に結合する抗体。 SERT - 抗体複合体は、それらがFSECによって分析を行っナノモルの親和性で結合することができるかどうかを決定するために界面活性剤でさらに希釈することができます。コンフォメーション輸送の変化、従って、抗体中のセロトニン結果の添加は、それらが特にSSRI結合コンホメーションを認識できるかどうかを決定するために再スクリーニングすることができます。 図4Cにおいて、抗体は、エピトープ(単数または複数)に結合した状態の基板にSSRIから変化しないことを示し、セロトニンの存在下で、SERTに結合することが示されています。最後に、 図4Dに抗体の組み合わせをさらに左方向へのシフトをもたらす、異なるエピトープに結合するそれらの能力について試験します。ここ15B8または8A11抗体は8B6とは異なるエピトープを認識します。
8B6抗体は、パパイントリートメントルームを用いた予備結晶スクリーニングに基づいて、さらなる構造解析のために選択しましたテッドのFab。 8B6のFab遺伝子は、昆虫細胞発現ベクターにクローニングしました。 Fabを発現させ、懸濁液中で成長させたSf9細胞から分泌させることができます。 8B6のFabは、Hisタグの親和性( 図5A、B)およびSDS-PAGEゲル上の汚染物質を含まない現れるタンパク質を生じる陽イオン交換クロマトグラフィー( 図5C、D)でSf9細胞の上清から精製することができます。 図5Eにおいて、組み換え8B6のFabは、SERTを結合することが示され、その後の生化学的および生物物理学的実験に使用されています。
アフィニティー精製されたSERTのCCは、トロンビンと遠藤で消化およびS -シタロプラムの存在下で複合体を形成する8B6のFabと混合します。トランス-抗体複合体は、次いでC8M( 図6A)にSECにより分離し、SDS-PAGE( 図6B)で示されるように、ピーク画分SERTおよびFabの両方を含みます。 C8Mの使用は、おそらく結晶形成のために重要です短鎖洗剤は、結晶格子中の分子の間のより良いパッキングを可能にします。 FSECは、結晶化のためにプールされるべき画分を決定するために採用されている( 図6C)。単分散でないおよび/または遊離SERTまたはFabを大量に含まれている画分を合わせすべきではありません。
角柱状SERT抗体結晶をドロップ蒸気拡散( 図7A)を吊り下げすることによって、このプロトコルを使用してSの -シタロプラムの存在下で増殖させることができます。得られた結晶は3.15Å10( 図7B)の解像度にX線を回折します。
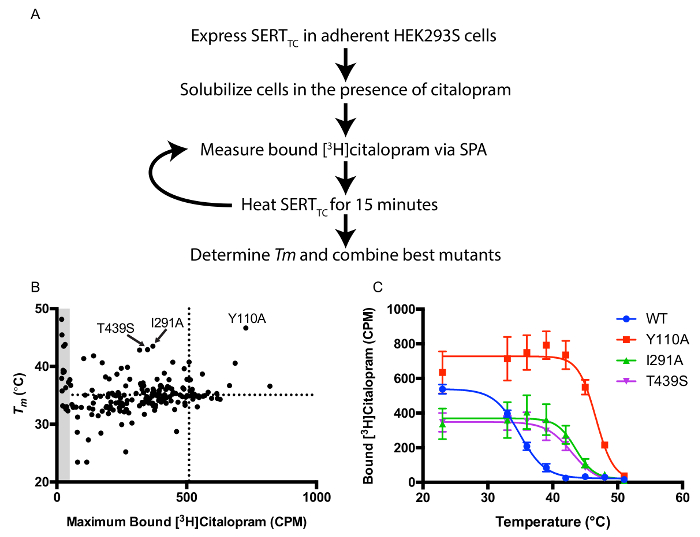
図1:シンチレーション近接ベースの熱安定性アッセイ A。 [3 H]シタロプラムの存在下での熱安定性をスクリーニングするためのプロトコールの概要B。最大バインドされた[3 (Tm)対SUP> H]シタロプラム。点線は、WTの輸送のための値を表します。 3ほとんどの熱安定性の変異体が標識されています。灰色の領域は、低い信号対雑音重量に対して、したがって不正確なTm値を結合する[3 H]シタロプラムの10%未満を有する変異体を表す。C。 WT SERT TCとトップ3の変異体のための熱安定性曲線。エラーバーは標準偏差(SD)を表す。 この図の拡大版をご覧になるにはこちらをクリックしてください。
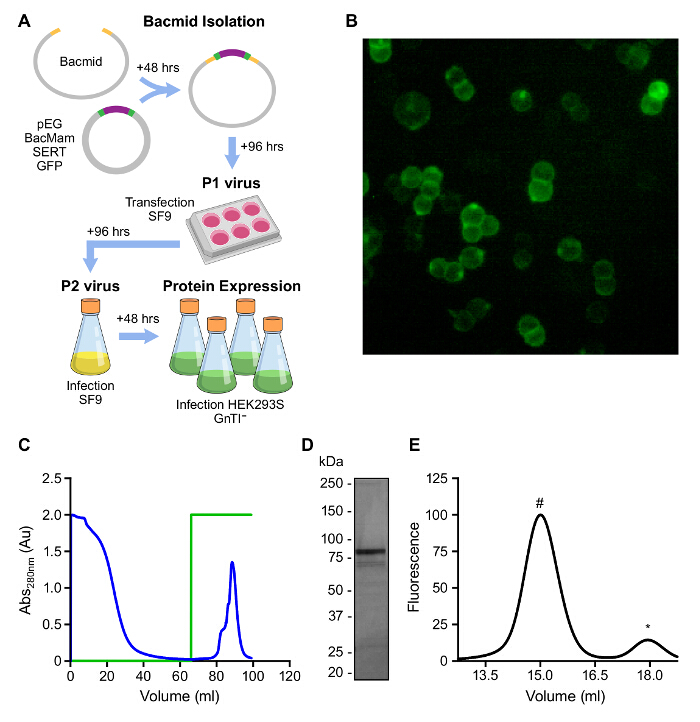
図2:哺乳類の異種タンパク質の発現 A の概要 。 HEK293SのGnTIでBacMamによってウイルスの生成およびSERTの発現の図式概要- 。セルB。彼K293SのGnTI - 。SERTのCC(GFP蛍光)Cを発現する細胞。連鎖球菌親和性樹脂上のSERT CCの溶出プロファイル。 100%(0 - - 5 mM)のD。グリーントレースは、デスチオビオチンの濃度、0を表します。 4のアフィニティー精製SERTのCCの分析- 15%SDS-PAGEゲルE。 GFP蛍光によって検出されたアフィニティー精製SERT CCのFSEC(励起:480nmで、発光:510 nm)を。 15 mLで溶出するピークは、SERT(#)で、18 mLを無料でGFP(*)である。 この図の拡大版をご覧になるにはこちらをクリックしてください。
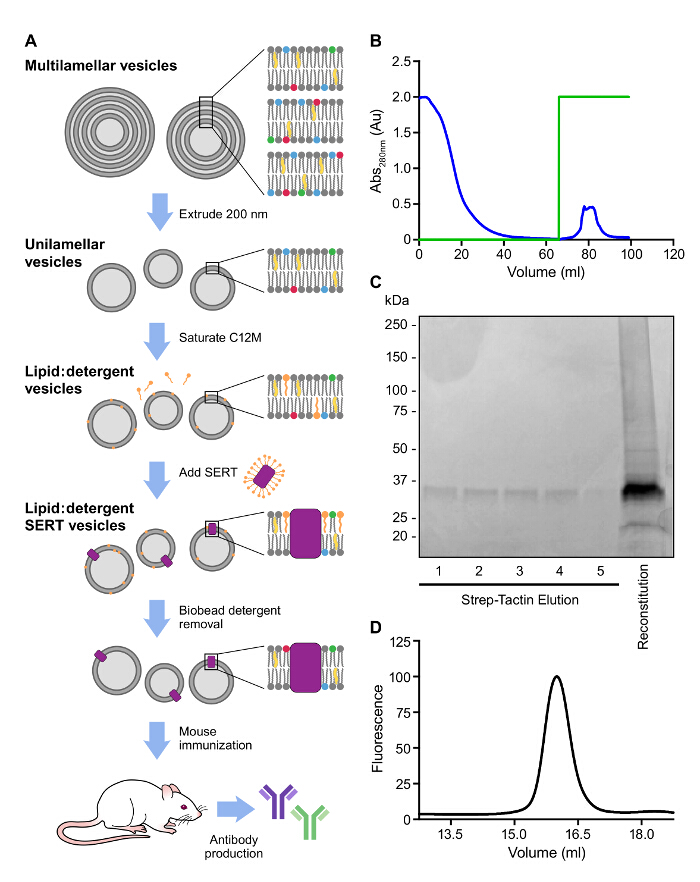
図3:SERT IC A の代表的なアフィニティー精製および再構成 。抗体の生成の概略図。 <強い> B。溶出プロフィールは、連鎖球菌の親和性樹脂上SERT ICのアフィニティー精製の280nmで観察しました。 100% -グリーントレースは0、デスチオビオチンの濃度を表す。(0から5 mM)のC。親和性の分析は、精製し4のSERT再構成- 15%SDS-PAGEゲルD。再構成後の可溶化SERTのFSEC。トリプトファン残基の蛍光はSERT(:280nmで、発光:励起335 nm)を検出するために使用された。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図4:代表SERT抗体の分析 A。ウエスタンブロットによる抗体のスクリーニング。約1μgのGFPの有無にかかわらずSERT CCのは4に適用された- 15%SDS-PAGEゲル、ニトロセルロース膜上にブロットしました。結合は、IR色素にコンジュゲートしたヤギ抗マウス抗体を用いて検出しました。 2G4および10F2は西部陽性である。B。 FSECにより100nMのGFPタグSERTと検出への抗体の結合は、GFP蛍光を用いて検出する。C。 1 mMのセロトニン。Dの存在下で、100nMのGFPタグSERTに選択されたFabの結合。 SERT-8B6のFabに8A11または15B8のFabの結合。 18 mLで溶出する小さなピークは無料GFPである。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図5:Sf9細胞から8B6のFabの代表的な精製A。。 Hisタグアフィニティchromatograpによって8B6のFabの精製の280 nmで観察された溶出プロファイル HY。 50%(0 - - 250 mM)のB。グリーンのトレースは、イミダゾールの濃度、0を表します。 Hisタグアフィニティ精製後の非還元および還元SDS-PAGEゲル。 50kDaの近くで実行されるタンパク質は、非還元のFab(#)とkDaではのFab(*)。Cを減少させる25でマイナーな種です。溶出プロフィールは、直線塩化ナトリウム勾配下で溶出する単一の対称ピークを表示する陽イオン交換によって8B6のFabの精製の280nmで観察しました。 100%。(0 - - 500 mM)のDグリーントレースは、NaClの濃度、0を表します。陽イオン交換による精製後、12.5%SDS-PAGEゲル上で8B6のFabの分析。E。 GFPの蛍光を用いて検出し、10 nmのGFPタグSERTに8B6のFabの結合は。 この図の拡大版をご覧になるにはこちらをクリックしてください。
電子6 "SRC =" /ファイル/ ftp_upload / 54792 / 54792fig6.jpg "/>
図6:Sの -シタロプラムの存在下でのSERT-8B6複合体の代表的ゲルろ過クロマトグラフィーA。。精製されたSERT-8B6複合体のゲル濾過溶出プロファイル。 11.5 mLで溶出する主ピークは、SERT-8B6複合体です。 15のピーク- 。17 mLのGFPおよびFab Bが含まれています 。 15%SDS-PAGEゲル - 4で精製SERT-8B6複合体の解析。 SERTおよびFabの重鎖及び軽鎖の位置はダッシュ。Cで示しています。サイズ分離分画のFSEC。 SERT-8B6複合体は、トリプトファン蛍光を用いて検出しました。フラクション17は、Fabとの複合体なかったSERTより多くの量が含まれています。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図7:S -シタロプラム A にバインドされたSERT-8B6複合体の結晶化 。成長の2週間後SERT-8B6複合体の直方体状結晶の光学顕微鏡。スケールバーは200μmである。Bに等しいです。 SERT-8B6結晶は3.15ÅにX線を回折します。ブルーリングは3.15オングストロームを表します。 この図の拡大版をご覧になるにはこちらをクリックしてください。
表 1:Sの -シタロプラム にバインドされたSERT-8B6コンプレックスのための結晶化画面 この表をダウンロードするにはこちらをクリックしてください。
ディスカッション
生物物理学的手法による膜タンパク質構造の決意は、多くの医学的に重要なトランスポーター、受容体、およびチャネル11のための困難な仕事で残っています。ここでは、S -シタロプラムに結合したヒトセロトニントランスポーターの構造決意のために開発され、詳細な専門知識を共有しています。我々は、これらの方法は、他のコンフォメーションの状態だけでなく、他の困難な膜タンパク質の構造にSERTの構造を決定するのに有用であろうことが予想されます。さらに、ここに記載の生化学的技術も、洗剤中の精製SERTおよび近天然の脂質環境の機能を研究するために使用することができます。
SERTの結晶化には、いくつかのツールや技術の開発時にヒンジ結合しました。まず、トランスポーターの熱安定性の改善は、膜6からのトランスポーターの抽出後の種々の界面活性剤ミセルに行儀たSERT変異体を生産しました。第二に、使用精製、結晶化、さらに改善された安定性全体に高親和性リガンドのS -シタロプラムのコンフォメーション不均一性を減少させました。第三に、免疫化および結晶化の両方を容易にする2週間の短期間におけるSERTの大量の産生のために許可されたBacMamによって発現系7の開発。最後に、結晶にSERT - 抗体複合体の秩序だったパッキングを促進する8B6抗体の発見のために許可された3Dエピトープを認識する高親和性抗体を選択するための戦略の開発。
重要なステップと試薬の数だけでなく、多くの場合、プロトコル全体で発生する一般的な問題があります。まず、高力価SERT P2ウイルスの発生が問題となり得ます。このプロトコールに記載されるようにP2ウイルスを生成するために、P1ウイルスの低濃度を追加すると、通常、この問題を軽減、及びP2のウイルス力価が低い場合に、P3ウイルスはusinすることができます0.0001のMOIでグラムウイルス。 1×10 8ウイルス粒子未満の力価を有するウイルスは、/ mLを使用すべきではないと、ほとんどの場合、低タンパク質の収量になります。発現のために、HEK293S GnTIを-彼らはNを欠いているので、細胞が選ばれたが、私の活動を-acetylglucosaminyltransferaseので、複雑なNの -glycansを合成することはできません、代わりにのみ高マンノースN -glycansを生成します。遠藤切断は、Nは、アスパラギンに接続されたN -acetylglucosamineを残して、細胞外ループ2(EL2)内の2つのサイトで高マンノースグリカンのグリコシル化を-結合しました。 Nの消化は、糖が結晶化のための可能性が高いことが重要であるEL2の表面エントロピーを減少させる-結合しました。抗体の生成のために、SERT ICは、免疫のために使用されるべきです。 GFPは12高度に免疫原性であり、完全にSECによって除去することが困難であるため、抗体を生成するために融合タグとして使用されるべきではありません。 SERTの柔軟なN末端およびC末端にもありませんでしたこれらの領域に対する抗体を回避するために、構築物に含まれます。マウスは、再構成された30μgのタンパク質で免疫することができます。 図13は、説明されているように、抗体の高い血清濃度が検出され、ハイブリドーマ細胞を産生することができるまで、マウスを免疫続けます。熱安定構築物は、通常、免疫のための最良の選択です。トランスポーターは行儀で、精製後の生物学的活性を保持している場合、これは、多くの場合、抗体を惹起するのに十分です。 8B6抗体は、WT SERTに対して提起されました。結晶化のために、FSECによって判断されるように単分散複合体を含有するSECからのみピーク画分を合わせ、濃縮する必要があります。 SERT-8B6の結晶は、条件の狭い範囲で成長し、特にSERTの結晶成長に関連する問題をトラブルシューティングするために取るべき手順がいくつかあります。このバッファは、結晶成長をサポートしていないため、HClで調整トリス塩基は、リザーバー溶液中で使用すべきではありません。従ってCRIあります代わりにNaOHで調整トリスを使用するtical。結晶が成長しないか、多くの小さな結晶が認められた場合、PEG 400濃度が少しでも増加または減少が賢明でしょうので、もしSERTの結晶は、PEG 400の狭い濃度範囲で成長します。また、添加剤6-アミノヘキサン酸は、核形成を改善するために最適化された画面で使用しました。タンパク質のドロップ率:よく溶液はまた、結晶成長のための係数を決定する鍵です。一般的に、より大きな3次元結晶の成長をサポートする1:2に近いドロップ比で、推奨される1:2から1.5の比率をドロップします。最後に、ロープロファイル24ウェルプレートの使用は、おそらく、蒸気拡散速度の変更に、また、結晶成長に向けて非常に重要です。
SPA法に代わるアプローチは、アッセイ5を結合フィルタを使用してコカイン結合コンホメーションのラットセロトニントランスポーターを安定化変異体をスクリーニングするために開発されました。これとは対照的に、SPAのBAsedのアッセイは、リガンドに結合したままSERTの割合の決意によって、次のシーケンシャル加熱工程を可能にします。したがって、これは、サンプル数が少ないから融解温度を迅速に決意することを可能にします。 SPA法は、放射性標識された高親和性リガンドの可用性に依存しないリガンドがマイクロモル以下の親和性で結合する知られていないならば、別のアプローチが必要になります。多くの他の方法は、一般的に、蛍光色素および熱量14の結合のようなタンパク質の安定性を測定するために使用されるが、低スループットであり、直接的に機能を測定または大量のタンパク質を必要とすることができませんされています。 SPA法を用いることができない場合、代替の一高スループットアプローチは、サンプルは、残りのトランスポーターの画分の分離に続いて加熱さFSECベースの熱安定性アッセイ15(FSEC-TS)、です。 FSEC-TSは、クロマトグラフィー挙動およびオリゴマー状態にアクセスするための有用なアプローチであるとpでありますSPA法と一緒に使用することができますowerful補完的なツール。
様々な一般的なタンパク質発現系の比較もSERT発現の16のための哺乳動物細胞を使用することを好むことが分かったと当然これは、おそらく、哺乳動物由来の多くのタンパク質の場合です。我々は発現のために使用している方法は、SERTに合わせたが、そう容易に適合しているされています。高レベルの発現に有利な条件を慎重式、温度、ウイルス濃度、水酸化ナトリウム、酪酸などのヒストンデアセチラーゼ阻害剤の存在の時間を変化させることによって同定されるべきです。
私たちは、一般的に高親和性結合リガンドを保持するために再構成の前に一緒にCHSと、このようなC12Mなどの軽度の長鎖界面活性剤中でアフィニティー精製を好みます。疎水性の吸収を使用して再構成は、我々はいくつかの他の輸送体および受容体のために有効であることが判明している穏やかな手法です。この場合抗原は、このような界面活性剤で十分に安定である設け、透析、希釈、またはSECによって高い臨界ミセル濃度を有する界面活性剤の除去は、17を用いることができ、成功しません。もし適切な抗体が検出されなかった例では、我々はほとんど常に問題が抗原の機能または変性の損失によるものであり、そのような場合には、我々が正常タンパク質生化学に特別な注意を払って新しい予防接種を行って見つけます。最後に、高親和性で結合するリガンドおよび抗体は、合理的に計画された結晶化実験のための基礎を形成する必要があり、熱安定性変異体を利用することによって、人は、異なる界面活性剤の性質を変化させることによって、条件の広い範囲をスクリーニングすることができます。さらに、脂質中間相18中の結晶化またはバイセル19を使用して、常にミセル中の結晶化の代替として考慮されるべきです。
これらの原理および方法は、いくつかのMODIFIで使用することができ発現し、そして他の発現宿主から精製し、そして高親和性薬物の標的の構造決意するために特に有用であろうことが困難である多くの他の膜貫通タンパク質の陽。
開示事項
The authors have nothing to disclose.
謝辞
We thank D. Cawley for generating monoclonal antibodies. We thank A. Penmatsa and K. Wang for sharing ideas and expertise developed from the dopamine transporter. L. Vaskalis for assistance with figures, H. Owen for help with manuscript preparation and other Gouaux laboratory members for helpful discussions. J.A.C. has support from a Banting postdoctoral fellowship from the Canadian Institutes of Health Research. E.M.G. is supported by the National Science Foundation Graduate Research Fellowship. We are particularly grateful to Bernie and Jennifer LaCroute for their generous support, as well as for funding from the NIH (5R37MH070039). E.G. is an investigator of the Howard Hughes Medical Institute.
資料
| Name | Company | Catalog Number | Comments |
| DH10Bac | Invitrogen | 10361-012 | |
| Kanamycin | Fisher | BP906-5 | |
| Gentamicin | Fisher | BP918-1 | |
| Tetracycline | Sigma | T-7660 | |
| Bluo-gal | Invitrogen | 15519-028 | 5-Bromo-3-indolyl β-D-galactopyranoside |
| Isopropyl beta-D-1-thiogalactopyranoside | Anatrace | I1003 | IPTG |
| Miniprep kit | Qiagen | 27106 | |
| Cellfectin II | Invitrogen | 10362-100 | Sf9 transfection reagent |
| Sf9 | ATCC | CRL-1711 | |
| Sf-900 III SFM media | Life Technologies | 12658-027 | |
| HEK-293S GnTI- | ATCC | CRL-3022 | |
| Freestyle 293 media | Life Technologies | 12338-018 | 293 expression media |
| Fetal Bovine Serum (FBS) | Life Technologies | 0984018DJ | |
| Sodium butyrate | Sigma | 303410 | |
| S-citalopram | Sigma | E4786 | Anagrade |
| n-Dodecyl-beta-D-Maltopyranoside | Anatrace | D310 | |
| Cholesteryl hemmisuccinate | Sigma | C6013 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850457P | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine | Avanti Polar Lipids | 850757P | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoglycerol | Avanti Polar Lipids | 840457P | |
| Leupeptin | Sigma | L2884 | |
| Pepstatin A | Sigma | P5318 | |
| Aprotinin | Sigma | A1153 | |
| PMSF | Sigma | P7626 | |
| Desthiobiotin | Iba Life Sciences | 2-1000-05 | |
| Asolectin | Sigma | 11145 | |
| Cholesterol | Sigma | C-8667 | |
| Lipid A | Sigma | L5399 | |
| Brain polar lipid | Avanti Polar Lipids | 141101C | |
| Biobeads | Biorad | 152-3920 | Hydrophobic absorption resin |
| Goat anti-mouse IRDye 680RD | Odyssey | 926-68070 | Used as secondary antibody for western blotting |
| Lauryl maltose neopentyl glycol | Anatrace | NG310 | Anagrade |
| Serotonin | Sigma | H9523 | |
| pFastBac 8B6 | Available from authors | ||
| pEG Bacmam SERT Strep II | SERTIC, Available from authors | ||
| pEG Bacmam SERT GFP twin Strep His | SERTTC, Available from authors | ||
| pEG Bacmam SERT ts3 GFP twin Strep His | SERTCC, Available from authors | ||
| Imidazole | Sigma | 56749 | |
| n-Octyl β-D-maltoside | Anatrace | O310 | Anagrade |
| Thrombin | Haematologic Technologies | HCT-0020 | |
| EndoH | New England Biolabs | P0702 | |
| Trizma-HCl | Sigma | T5941 | Tris is used for preparation of crystallization reservoirs |
| PEG 400 | Sigma | 91893 | |
| 6-aminohexanoic acid | Sigma | 7260 | |
| Trypsin-EDTA | Fisher | MT25052CV | |
| Isoplate-96 TC | PerkinElmer | 6005070 | |
| PolyJet | SignaGen | SL100688 | Polymer transfection reagent for mamalian cells |
| Copper HIS-Tag YSI SPA Beads | PerkinElmer | RPNQ0096 | His-tag affinity SPA beads |
| Citalopram, [N-Methyl-3H] | PerkinElmer | NET1039250UC | |
| ThermoMixer C | Eppendorf | 5382000023 | heating block for thermostability assay |
| ThermoTop | Eppendorf | 5308000003 | |
| SmartBlock PCR 96, thermoblock for PCR plates | Eppendorf | 5306000006 | |
| 0.2 µm syringe filter | Olympus Plastics | 25-243 | |
| 1 L filter system | Corning | 430517 | |
| 2 L flat bottom tissue culture flask | Genemate | F-5909-2000 | |
| 2 L baffled tissue culture flask | Genemate | F-5909-2000B | |
| CO2 incubator | Thermo Scientific | 3950 | |
| Forma Orbital Shaker | Thermo Scientific | 416 | |
| Strep-Tactin resin | Iba Life Sciences | 2-1208-025 | Strep affinity resin |
| Extruder | Northern Lipids | ||
| Li-Cor imaging system | Odyssey | western blot imaging system | |
| XK16 column | GE Healthcare | 28-9889-37 | column used for Strep-Tactin and Talon purificaiton |
| 100 kDa MWCO protein concentrator | Millipore | UFC910096 | |
| 30 kDa MWCO protein concentrator | Millipore | UFC903024 | |
| Äkta FPLC | GE Healthcare | UPC-900 | |
| HPLC | Shimadzu | 51476 | |
| Superose 6 (10/300) column | GE Healthcare | 17-5172-01 | Used for FSEC |
| Tangential flow apparatus | Pall Filtron | ||
| 0.2 µm filter tangential flow cell | Pall Filtron | PSM20C11 | |
| 30 kDa MWCO tangential flow concentrator | Pall Filtron | OS030T12 | |
| Talon resin | Clonetech | 635504 | His-tag affinity resin used for Fab purification |
| 1 mL HiTrap SP column | GE Healthcare | 17115101 | Cation exchanger used for Fab purification |
| Superdex 200 10/300 GL column | GE Healthcare | 17-5175-01 | Used for SEC separation of SERT-8B6 |
| 24-well VDXm plate | Hampton Research | HR3-306 | |
| 18 mm coverslips | Hampton Research | HR3-239 | |
| Virocyt virus counter | Virocyt | 2100 | |
| MicroBeta Trilux | PerkinElmer | 1450 | 96-well scintillation counter |
| HiTrap SP column | GE Healthcare | 17115101 | |
| Sertraline | Sigma | S6319 |
参考文献
- Kristensen, A. S., et al. SLC6 neurotransmitter transporters: structure, function, and regulation. Pharmacol Rev. 63 (3), 585-640 (2011).
- Broer, S., Gether, U. The solute carrier 6 family of transporters. Br J Pharmacol. 167 (2), 256-278 (2012).
- Andersen, J., Kristensen, A. S., Bang-Andersen, B., Stromgaard, K. Recent advances in the understanding of the interaction of antidepressant drugs with serotonin and norepinephrine transporters. Chem Commun (Camb). 25 (25), 3677-3692 (2009).
- Hahn, M. K., Blakely, R. D. The functional impact of SLC6 transporter genetic variation. Annu Rev Pharmacol Toxicol. 47, 401-441 (2007).
- Abdul-Hussein, S., Andrell, J., Tate, C. G. Thermostabilisation of the serotonin transporter in a cocaine-bound conformation. J Mol Biol. 425 (12), 2198-2207 (2013).
- Green, E. M., Coleman, J. A., Gouaux, E. Thermostabilization of the human serotonin transporter in an antidepressant-Bound Conformation. Plos One. 10 (12), e0145688 (2015).
- Goehring, A., et al. Screening and large-scale expression of membrane proteins in mammalian cells for structural studies. Nat Protoc. 9 (11), 2574-2585 (2014).
- Kawate, T., Gouaux, E. Fluorescence-detection size-exclusion chromatography for precrystallization screening of integral membrane proteins. Structure. 14 (4), 673-681 (2006).
- De Becker, G., et al. The adjuvant monophosphoryl lipid A increases the function of antigen-presenting cells. Int Immunol. 12 (6), 807-815 (2000).
- Coleman, J. A., Green, E. M., Gouaux, E. X-ray structures and mechanism of the human serotonin transporter. Nature. , (2016).
- White, S. H. The progress of membrane protein structure determination. Protein Sci. 13 (7), 1948-1949 (2004).
- Gambotto, A., et al. Immunogenicity of enhanced green fluorescent protein (EGFP) in BALB/c mice: identification of an H2-Kd-restricted CTL epitope. Gene Ther. 7 (23), 2036-2040 (2000).
- Galfre, G., Howe, S. C., Milstein, C., Butcher, G. W., Howard, J. C. Antibodies to major histocompatibility antigens produced by hybrid cell lines. Nature. 266 (5602), 550-552 (1977).
- Deller, M. C., Kong, L., Rupp, B. Protein stability: a crystallographer's perspective. Acta Crystallogr F Struct Biol Commun. 72, 72-95 (2016).
- Hattori, M., Hibbs, R. E., Gouaux, E. A fluorescence-detection size-exclusion chromatography-based thermostability assay for membrane protein precrystallization screening. Structure. 20 (8), 1293-1299 (2012).
- Tate, C. G., et al. Comparison of seven different heterologous protein expression systems for the production of the serotonin transporter. Biochim Biophys Acta. 1610 (1), 141-153 (2003).
- Rigaud, J. L., Levy, D. Reconstitution of membrane proteins into liposomes. Methods Enzymol. 372, 65-86 (2003).
- Caffrey, M., Cherezov, V. Crystallizing membrane proteins using lipidic mesophases. Nat Protoc. 4 (5), 706-731 (2009).
- Faham, S., Bowie, J. U. Bicelle crystallization: a new method for crystallizing membrane proteins yields a monomeric bacteriorhodopsin structure. J Mol Biol. 316 (1), 1-6 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved