Method Article
ゲルの表面上に成長する植物の根の光シート蛍光顕微鏡
要約
This protocol shows a plant sample preparation method for light-sheet microscopy. The setup is characterized by mounting the plant vertically on the surface of a gel and letting it grow in controlled bright conditions. This allows long-term observation of plant organ development in standardized conditions.
要約
One of the key questions in understanding plant development is how single cells behave in a larger context of the tissue. Therefore, it requires the observation of the whole organ with a high spatial- as well as temporal resolution over prolonged periods of time, which may cause photo-toxic effects. This protocol shows a plant sample preparation method for light-sheet microscopy, which is characterized by mounting the plant vertically on the surface of a gel. The plant is mounted in such a way that the roots are submerged in a liquid medium while the leaves remain in the air. In order to ensure photosynthetic activity of the plant, a custom-made lighting system illuminates the leaves. To keep the roots in darkness the water surface is covered with sheets of black plastic foil. This method allows long-term imaging of plant organ development in standardized conditions.
概要
単一細胞は器官分化と増殖の間にどのように動作するかを理解所の開発における重要な問題の一つがあります。理想的には、遺伝子発現パターンと細胞内のタンパク質の局在化のような細胞事象は、組織のより大きな文脈に照らして見ることができます。この目的は、技術的な課題を提起し、高い空間だけでなく、光毒性作用を引き起こす可能性があり、長期間にわたって時間分解能で全臓器の観察を必要とします。植物はすぐに環境の変化に適応するので、成長条件を厳密に制御しなければなりません。植物の生理学的状態に干渉することなく、長期的画像化を行うために、三つの試料室内に、1)成長条件を確保しなければならない、2)安定した長期間にわたって実装サンプル、および3)イメージング低光強度で光損傷および非生理的条件を避けるために。
生理的成長conditi顕微鏡試料室におけるアドオンは、長期の実験のために重要です。 3 -共焦点顕微鏡1のためのイメージング成長チャンバーを記述する利用可能なプロトコルの数があります。しかし、共焦点顕微鏡は、ストレス反応を引き起こす可能性が植物に高い光強度を紹介し、通常4増殖を阻害します。また、ほとんどの従来の顕微鏡は、彼らが自分自身を再配向し、重力のベクトルに向かって成長しようとするので、植物には最適ではないサンプルの唯一の水平方向の位置を、可能にします。 9 -過去10年間で、光シート顕微鏡は、数日から5までの期間のための細胞の解像度で大標本の開発をキャプチャするための強力なツールとして浮上しています。ライトシート顕微鏡は、垂直方向に試料を配置することができますし、ますます10根の発達を研究する植物の研究に使用されている-最近、ベルテによってレビュー21、トンとMaizel 22。上記の研究10,13の多く- 18,21-は、ゲル17の表面に根を成長させることによって特徴付け実装サンプルの特別な方法を採用したエルンストHK Stelzerの実験室に最適化され、実施されました。これらの研究では、特注の顕微鏡た植物を下から保持され、使用されました。これとは対照的に、広く利用可能な光シート顕微鏡の大部分は上部からのサンプルを保持します。したがって、この特定の調製方法を容易に適用することができません。ここで紹介する方法はOpenSPIM 23、選択平面照明顕微鏡(SPIM)を適用し、強化するためのオープンアクセスプラットフォームに適用可能な十分に確立された上で、表面実装方法のためのプロトコルを提供します。
このプロトコルの全体的な目標は、OpenSPIM光シート顕微鏡でシロイヌナズナの根の長期的なイメージングを可能にすることです。これは、複数の直立した植物を成長させることによって達成されます液体培地にルーツを持つゲルのurface葉は空気中のまま。植物の光合成活動を確保するために、カスタムメイドの照明システムは、葉ではなく、根( 図1)を照明します。
プロトコル
1.シロイヌナズナ培養イメージングの前に
- 10グラムのスクロース、0.97グラムのMES(2-(N-モルホリノ)エタンスルホン酸)と1のLのddH 2 O(二重蒸留水、2.15グラムMS-培地を加えることによって、(半強ムラシゲ・スクーグ培地)½MS培地を準備)1リットルボトルに。 KOHを使用してpHを5.8に調整します。
- ½MS培地に15グラム/ Lのジェランガムを追加し、121℃で20分間、それをオートクレーブ。
- 約2mmの厚さを有するゲルの層を作成するために、正方形のペトリ皿(245 X 245 X 25ミリメートル)に熱い培地30mlを注ぎます。料理は、媒体が固化することを可能にするために、室温まで冷却してみましょう。
- 1 mLの滅菌H 2 Oは、ガラスピペットまたは千μLのピペットチップを使用して種をピックアップし、ゲルの表面上にそれらをまく含む1.5 mLの反応管に滅菌したシロイヌナズナの種子を置きます。別に約10mm離れて種子を置きます。テープでプレートをシール。
- 4で24時間プレートをインキュベート°C(成層)。
- 6日間の光の120〜140マイクロモル/㎡/ sの量で16/8時間昼/夜サイクルで22℃で例えば 、成長インキュベーター内でプレートを育成。 10日まで、古い植物を使用することができます。
2.植物試料調製方法
注意:試料ホルダーは、3Dプリントすることができるのいずれか、または手が図2Cに示されている寸法を使用してマシンのワークショップで行われました。 3Dモデルファイルは、補足資料(Supplemental_File _-_ 3D_Sample_Holder.stl)に設けられています。材料リストに3Dプリントを注文するためのリンクを参照してください。
- 5gを50mlの半MS培地を含む50mLのボトルにアガロース低融点及び121℃で20分間、それをオートクレーブ加えます。
- 1.5mLの反応チューブ中の1%低融点アガロース溶液のアリコート。 4℃で保存は(少なくとも二ヶ月のために使用することができます)。
- 80℃で1 %%低融点アガロースのアリコートを融解し、それがダウンして冷まします33°C。
- 超音波ユニット内の試料ホルダーを清掃してください。 70%エタノールで試料ホルダーを滅菌し、滅菌水で洗浄します。
- メスを用いて植物の周りにゲルをカットします。
- 平らなへらでブロックを持ち上げて、第二のスパチュラを用いて試料ホルダーに慎重にスライドさせます。
- 100μLのピペットを使用して(33℃)を1%アガロースを用いて試料ホルダーにゲルを接着。
- 10μLピペットを用いて、1%アガロースでゲル上で植物を接着。葉はゲルで覆われていないことを確認するために、立体顕微鏡を使用してください。関心のある領域に直接ゲルを配置しないでください。
- 乾燥から植物を防ぐために、途切れることなく動作します。可能な限り千μLのピペットチップ内に試料ホルダーを挿入します。キャップとしてピペットチップを使用し、植物が配置されているサンプルホルダの一端の上に慎重にスライドさせます。
- ピペットチップボックスに試料ホルダーを入れ、必要に応じてより多くの植物を準備します。植物はDIRECすることができますTLY画像化され又は成長インキュベーターに戻さ。
3.顕微鏡を設定します
注:LED照明システムは、特注のランプです。 LEDリングを構築するために必要な技術的な詳細は、図3および材料のリストに記載されています。基板設計のための補足資料ファイル(Supplemental_File _-_ LED_Ring_Board.brd)を参照してください。
- ネジや接着剤( 例えば両面テープ)OpenSPIM X / Y / Z /θステージアームの下側のLEDリング。
- 調整可能な電源(0-30 V、最大2 A)でLEDリングを接続します。
- (シロイヌナズナ、120〜140マイクロモル/メートル2 / s で 、 図3Dのための)所望の光強度に電圧を調整します。
- 70%エタノールで試料室を滅菌し、滅菌水で洗浄します。
- ベンジンやレンズクリーニングティッシュで対物レンズを清掃してください。 70%エタノールを用いて対物レンズを滅菌します。
- perfusiを接続します一方向の配列内の試料室にチューブに。新鮮な½MS培地と蠕動灌流ポンプの隣に別の空のボトルを含む1リットルのボトルを置きます。 1灌流チューブを使用して、試料室の下側の入口と媒体とボトルを接続します。別の灌流チューブを使用して使用される媒体をゴミ箱に空き瓶と試料室の上部の排気口に接続します。
- 1mL /分への流れの速度を設定します。
注:試料室をオーバースピルしないために、それが流入よりも流出を有することが重要です。ポンプ速度を増加または流出のための大きな内径を有する管を使用しますか。 - 70%エタノールで洗浄し、水面上に試料室に置く前に、それらを乾燥させ、3ミリメートルの小さな正方形に黒いプラスチックホイルをカット。
- 試料ホルダーからピペットチップを取り外し、試料室に試料ホルダーを挿入します。新たに製造されたサンプルホルダーがステージアームの形状に合わない場合は、細かい砂を使用しますそれは薄くするか、それが薄すぎる場合には、Oリング(∅6ミリメートル)を使用する紙。
- ふたを作成するには、2 50×25ミリメートル片に黒のアルミ箔をカット。各ピースの一辺の中央でカット5ミリメートルを行います。三角形のくぼみ( 図1D)を作成するために折ります。三角形のくぼみは、試料ホルダーを向けた状態で試料室の上部に蓋を置くことにより、2つの蓋でサンプルチャンバーを閉じます。植物の葉は、蓋の日陰ではなく、照明系からの光を受けていることを確認してください。
- 視野内の新興側根を配置するためにX / Y / Zと回転ステージを使用して、関心領域を探します。
- 記録する前に、システムは、少なくとも15分間平衡化することを可能にします。
- セットアップ画像取得。
- 3μmのzの間隔で217の画像(650ミクロン)のスタックを設定し、17時間の全期間の15分の撮像間隔で経過時間を設定します。
注:上の詳細なドキュメントOpenSPIMソフトウェアを動作させる方法(http://openspim.org/Acquisition#Acquiring_a_Stack)で見つけることができます。
- 3μmのzの間隔で217の画像(650ミクロン)のスタックを設定し、17時間の全期間の15分の撮像間隔で経過時間を設定します。
- 記録を開始します。
結果
光シート顕微鏡( 図1)を用いて根系を観察しながら、この試料調製方法は、顕微鏡試料室内部に植物の栽培を可能にします。植物は、カスタム設計されたサンプルホルダー( 図2)に搭載されたゲル(1/2 1.5%ジェランガムを含むMS培地)の層の表面上に成長します。サンプルホルダーは3Dは、材料として透明樹脂を使用して印刷されます。寸法を強調製造バージョンを、 図2Cに示されています。根は、連続的に灌流システムによって更新された液体(1/2 MS培地)中に浸漬されています。葉は空気中に残り、継続的に130マイクロモル/㎡/ sは、植物( 図1A、Bおよび図3A-C)上記リング状に配置されている青色と赤色LEDからの光強度で照明されています。 LEDリングは、私たちのマシンのワークショップで製造されており、我々は、 図3及び材料リストにLEDリングを構築する方法についての技術的な詳細を提供します。光強度は、連続的に30〜250マイクロモル/ m 2 /秒( 図3D)の範囲に調整することができます。根系は、水面を覆う黒色プラスチックホイルの小シート( 図1)によって遮光されます。検出レンズにより集光された照明の任意の迷光がGFPフィルタ( 図3E)によってフィルタリングされます。
この設定では、成長しているシロイヌナズナ側根の時間経過は、20X / 0.5レンズ( 図4)を使用して、17時間記録しました。側根は、プライマリルートの奥深くに位置している鞘細胞層、中にその起源を持っています。延長期間にわたって組織の内部より深い撮像能力を実証するために、より高い倍率(40X / 0.75)は、横方向ROの形成を捕捉するために使用しました。38時間( 図5)の期間内にプライマリルートのうち出現までの第一段階の原基からOT。データセットの典型的な2Dスライスは、図に示されています。図5(b)。この記録は、細胞の解像度で3D( 図5A)における側根形成のダイナミクスに追従することを可能にします。
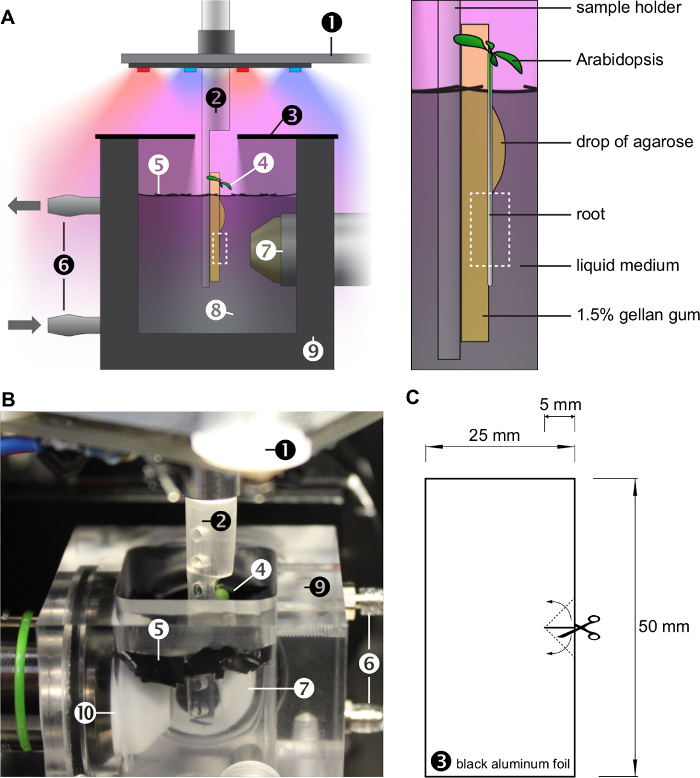
図1:OpenSPIM 試料室内の成長条件。 A)は、撮像室のスケッチ。植物は、ゲルの表面上に直立成長している( 図2も参照)、カスタム構築されたサンプルホルダーに取り付けられました。根は継続的に灌流システムにより交換された液体培地中で成長しています。植物は、大気中で成長し、赤色及び青色LED(また図3を参照)によって照明される葉。根系は、ウィットを網掛けされています水面を覆っている黒いプラスチックホイルのH小さなシート。黒色アルミ箔の2つの部分からなる蓋はさらに水面下の光の量を減少させ、試料室の湿度を維持します。右側の拡大パネルには、液体培地に浸漬ゲルのブロックの表面上に成長する植物を強調しています。アガロースの低下は、ゲル上にルートをマウントします。破線のボックスは、顕微鏡で観察した関心領域を示しています。蓋なしの撮影室(のB)写真)。 シロイヌナズナ :LEDリングとX / Y / Z /θステージ(2):(1): -数字(1)A及びB中の(10)を表す試料ホルダー(3)の蓋(4) (5)ブラックプラスチックホイルのシート(6):灌流システム(7):検出対物レンズ(8)液体媒体、(9):試料室(10)の照明対物レンズ。 C)蓋は黒色アルミ箔の2つの部分からなります。ターゲット= "_空白">この図の拡大版をご覧になるにはこちらをクリックしてください。

図2: 試料ホルダー。 A)3Dモデル。 3Dモデルファイルは、補足材料に設けられています。 、透明なアクリルプラスチック(4)及び(5):樹脂(6)透明樹脂(3) - (1)は、異なる材料を使用して、3D印刷のB)写真。試料ホルダーのC)技術的な図面、数字はミリ表します。 D)工場で製造されたサンプルホルダーの写真を搭載しています。破線の領域は、顕微鏡で観察することができます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
/ "/ 55044 / 55044fig3.jpgをアップロード>
図3: 工場照明のセットアップ。ランプA)概略回路図です。 LEDのペアは、方向雷のために個別にオン/オフすることができます。 LED:発光ダイオード、R:抵抗、T:トランジスタ、JP:ピンヘッド。プリント回路基板):B)照明ランプの最終的な設計は、PCB-ソフトウェア(PCBを使用して描かれました。私たちは、補足資料で基板設計ファイルを提供します。ボードは、その後、製造され、当研究所のMIBAの機械工場で組み立てました。 LEDリングのC)写真はオン。赤と青のLEDの4対がリング状に配置されています。 D)の電圧範囲は3.5 Vと14.0 V.抵抗との間で調整することができますが30から250マイクロモル/メートルの範囲の光の量に到達するために使用された2 /秒(R1-8:220オーム、R9-12:1220オーム)。 E)ランプ、GFPおよびYFPの発光スペクトル。 TP://ecsource.jove.com/files/ftp_upload/55044/55044fig3large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
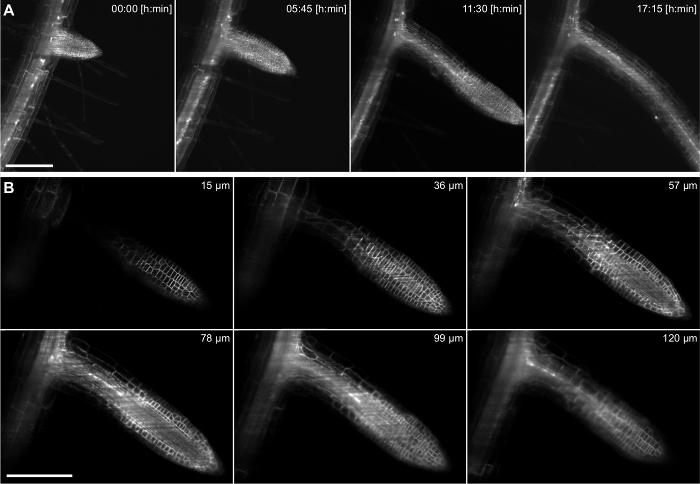
図4: 側根 シロイヌナズナ の時間経過の記録 。 (pUBQ10 :: YFP-PIP1; 4)5日齢の苗は、膜マーカーを発現し、特に側根に発展鞘細胞をマーキング核レポーター(pGATA23 :: NLS-GUS-GFP)。 217の画像(3μmのz軸間隔)のスタックは、20X / 0.5レンズを使用して、17時間の記録のために15分ごとに捕獲されました。 A)69のうち4時間点は、最大値投影に示されています。 B)1つの時点のzスタックの六217のうち、単一のスライスが示されています。 AとBの中のスケールバーは100μmで表します。ロード/ 55044 / 55044fig4large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
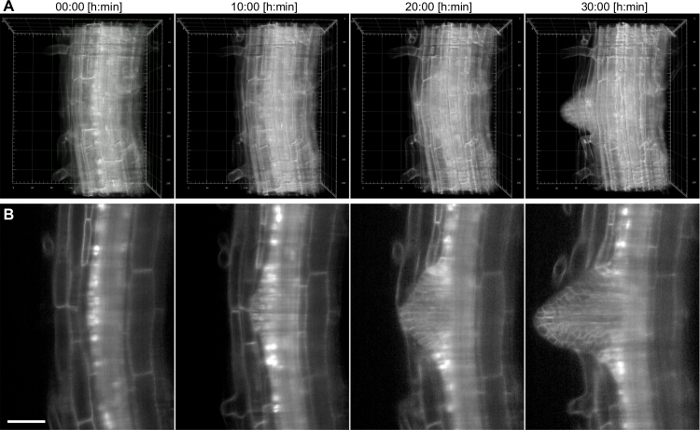
図5: 側根 シロイヌナズナ の時間経過の記録 。 (pUBQ10 :: YFP-PIP1; 4)6日齢の苗は、膜マーカーを発現し、特に側根に発展鞘細胞をマーキング核レポーター(pGATA23 :: NLS-GUS-GFP)。 200の画像(1.5μmのz軸間隔)のスタックは、40X / 0.75のレンズを使用して、38時間の記録のために15分ごとに捕獲されました。 A)4時点の3Dレンダリング、グリッド内の数字は、主根の中心面を通してミクロン、B)単一のスライスを表します。スケールバーは50μmで表します。 お願いしますこの図の拡大版をご覧になるにはこちらをクリックしてください。
Supplemental_File _-_ 3D_Sample_Holder.stl。 3Dモデルファイルが提供されます。 このファイルをダウンロードするにはこちらをクリックしてください。
補足ファイルは、リングBoard.brdをLED。ボード・デザイン・ファイルが提供されています。 このファイルをダウンロードするにはこちらをクリックしてください。
ディスカッション
光シート蛍光顕微鏡は、低毒性及び生理学的状態で試料を保持したまま、高時空間解像度で大容量をキャプチャするために使用することができる超高速取得速度を、結合する大きな利点を有します。光シート顕微鏡の解像度は、共焦点顕微鏡9のそれと比較することができます。しかし、光の散乱や吸収が個別に励起および放出経路に沿って発生し、全体的な画質は、表面に比べて不透明な組織内部の有意に低いことができます。この合併症を回避するために1は、垂直軸に沿ってサンプルを回転させ、異なる方向から同じボリュームを観察する可能性を使用することができます。しかし、これは必ずしも有利ではない、 例えば側根は、より多くの情報を得ることなく、低画質の結果後ろから根およびイメージングの一方の側に現れます。しかしながら、回転は、主SAMPを正確に位置決めすることができます最良の方法でル。対物レンズの古典的な水平方向の配置は、サンプル実装の新しい方法を可能にします。植物が垂直位置から利益を得ます。ここで紹介する、「ゲルの表面上の「実装方法は、このようなゲル24,25の内側に根を埋め込むなど、他の取り付け方法に比べていくつかの利点があります。 1)根系は、液体媒体と直接接触しています。試料室は、連続的に新鮮な培地を提供する灌流システムに接続されています。また、急速に、異なる媒体または薬剤を適用するために、サンプルチャンバの全体積を交換するために使用することができます。彼らは実験室で成長させるために使用される2)前準備植物が成長サンプリングします。植物は、蛍光顕微鏡下で選択することができ、唯一の希望植物が用意する必要があります。 3)植物がタッチされることなく、シャーレから試料保持部に転送されます。これにより、植物は、さらに、それが成長incubato中に成長していた同じゲル上で開発することができますrおよび機械的ストレスが最小限に低減されます。 4)試料上の図は、サンプルと検出目的との間の空間は、単に屈折率が異なる媒質なし他の材料で充填されているため、遮るもののない、光収差が最小になります。
長期的イメージングを行うために、植物の照明システムは、植物の光合成活動を確保する必要があります。ほとんどの研究室では植物は根が光にさらされている。すなわち 、透明なゲルに成長します。これは、自分の環境に対して異なる応答を引き起こし、それらの生化学および開発26,27の変化を誘導することができます。根系の光の量を低減するために、黒いプラスチック箔を水表面を覆うために使用されるだけでなく、黒色アルミニウム箔製の蓋は、サンプルチャンバをカバーしました。植物に達することができる光は、蓋内の中央穴を通って出ます。この設定では、背景光の増加は、suggestinを認められませんでした赤色および青色LEDからの迷光の量が有意にGFPフィルター及び遮光アプローチによって減少したG。この光は、カメラのバックグラウンドノイズを増加させることなく、画像収集中にオンに保つことができました。
サンプルホルダーは、3D印刷のために設計されています。試験されたいくつかのプラスチックは、試料のドリフトで、その結果、100%安定していなかったとしてしかし、材料の選択が重要です。したがって、代わりに樹脂を使用するか、またはポリエチレン(PEP)ロッドを粉砕することにより、試料ホルダーを構築することをお勧めします。両面照明システムの光シート顕微鏡セットアップを使用する場合、試料ホルダは、回転角度に応じて光シートの干渉する可能性があります。プレートから植物をすくう時の機械的ストレスを低減するために、スパチュラの平らな角度を使用します。植物はすぐに乾燥して、非常に最初の時間のための空気の流れを体験することができます。ヲ、任意の風(急速な運動、エアコンの流れ)を避けるようにしてください可能な限りrkが途切れ1,000μLのピペットチップ内に試料ホルダーをスライドさせます。顕微鏡の内部では、液体でプラント全体を浸し、乾燥した葉を保持しないことが重要です。
技術は、側根形成の初期段階を撮像するための理想的です。成熟した根の先端の長期撮影を行う場合には1は、シロイヌナズナの根が視野の外に急速に、100〜300ミクロン/時間と一緒に成長することを心に留めておく必要があります。非常に便利な将来の実装では、長期間にわたって、次の根の先端成長を可能にする自動化された追跡アルゴリズムである可能性があります。取得プロセスの間に、光媒体の栄養組成物などの環境条件を制御する能力は、植物は、変化に適応する方法を検討可能にします。ルートは、デキサメタゾン誘導性28またはβ-ESTRを使用して、例えば、化学的に遺伝子発現を活性化する薬剤を適用するために使用することができる液体媒体と直接接触します誘導システム29を adiol。しかし、それは、薬物を洗い流すために試料室の容積全体を交換するために時間がかかります。セットアップは、培地交換を促進するために試料室の容積を最小化することによって改善することができます。それにもかかわらず、この技術は、大きな可能性を秘めています。光シート顕微鏡を用いた実装手順、標準化された生育条件と穏やかな画像取得の組み合わせは、生理的なレベルでの高解像度で、植物の開発の長期的な研究を可能にします。これは、研究者は、植物の開発の基本的なメカニズムを探求するのに役立ちます。
開示事項
The authors have nothing to disclose.
謝辞
私たちは、オーディオ機器のための重要な読書/視聴のためにマーチャーシュFendrychとステファンStadlbauerに感謝します。 OpenSPIMへの貢献のためのISTオーストリアでMIBAマシンショップに感謝します。これらの結果につながる研究がREAグラント合意N°[291734]と欧州研究評議会(プロジェクトERC-2011の下で、欧州連合(EU)のセブンス枠組み計画(FP7 / 2007-2013年)の人々プログラム(マリー・キュリー・アクション)から資金提供を受けています-StG-20101109-PSDP)。
資料
| Name | Company | Catalog Number | Comments |
| Agarose, low melting | VWR | AFFY3282125GM | |
| Black aluminum foil | Thorlabs | BKF12 | |
| Black plastic foil | Carl Roth | HT83.2 | |
| LED blue (453 nm) | OSRAM | LD CN5M-1R1S-35-1 | |
| LED red (625 nm) | OSRAM | LR T66F-ABBB-1-1 | |
| LED board - PCB design software | Cadsoft Eagle | ||
| MES monohydrate | Duchefa | M1503.0100 | |
| Micropore Surgical Tape | 3M | 1530-1 | |
| Murashige & Skoog Medium (MS-Medium) | Duchefa | M0221 | |
| Phytagel | Sigma-Aldrich | P8169 | |
| Sample holder 3D print | i.materialise | https://i.materialise.de/shop/item/sampleholder-openspim-zeisslightsheetz1 | |
| Square Petri dishes (245 x 245 x 25 mm) | VWR | 734-2179 | |
| Sucrose | Sigma-Aldrich | 84097-1KG |
参考文献
- Grossmann, G., Guo, W. -J., et al. The RootChip: an integrated microfluidic chip for plant science. Plant Cell. 23 (12), 4234-4240 (2011).
- Busch, W., Moore, B. T., et al. A microfluidic device and computational platform for high-throughput live imaging of gene expression. Nat Methods. 9 (11), 1101-1106 (2012).
- Calder, G., Hindle, C., Chan, J., Shaw, P. An optical imaging chamber for viewing living plant cells and tissues at high resolution for extended periods. Plant Methods. 11 (1), 22(2015).
- Dixit, R., Cyr, R. Cell damage and reactive oxygen species production induced by fluorescence microscopy: effect on mitosis and guidelines for non-invasive fluorescence microscopy. Plant J. 36 (2), 280-290 (2003).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical Sectioning Deep Inside Live Embryos by Selective Plane Illumination Microscopy. Science. 305 (5686), 1007-1009 (2004).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. K. Reconstruction of Zebrafish Early Embryonic Development by Scanned Light Sheet Microscopy. Science. 322 (5904), 1065-1069 (2008).
- Keller, P. J., Schmidt, A. D., et al. high-contrast imaging of animal development with scanned light sheet-based structured-illumination microscopy. Nat Methods. 7 (8), 637-642 (2010).
- Höckendorf, B., Thumberger, T., Wittbrodt, J. Quantitative Analysis of Embryogenesis: A Perspective for Light Sheet Microscopy. Dev Cell. 23 (6), 1111-1120 (2012).
- Stelzer, E. H. K. Light-sheet fluorescence microscopy for quantitative biology. Nat Methods. 12 (1), 23-26 (2015).
- Maizel, A., Von Wangenheim, D., Federici, F., Haseloff, J., Stelzer, E. H. K. High-resolution live imaging of plant growth in near physiological bright conditions using light sheet fluorescence microscopy. Plant J. 68 (2), 377-385 (2011).
- Sena, G., Frentz, Z., Birnbaum, K. D., Leibler, S. Quantitation of Cellular Dynamics in Growing Arabidopsis Roots with Light Sheet Microscopy. PLoS ONE. 6 (6), e21303(2011).
- Costa, A., Candeo, A., Fieramonti, L., Valentini, G., Bassi, A. Calcium Dynamics in Root Cells of Arabidopsis thaliana Visualized with Selective Plane Illumination Microscopy. PLoS ONE. 8 (10), (2013).
- Šamajová, O., Takáč, T., von Wangenheim, D., Stelzer, E. H. K. Update on methods and techniques to study endocytosis in plants. Endocytosis in Plants. , 1-36 (2012).
- Rosquete, M. R., Von Wangenheim, D., et al. An auxin transport mechanism restricts positive orthogravitropism in lateral roots. Curr Biol. 23 (9), 817-822 (2013).
- Lucas, M., Kenobi, K., et al. Lateral root morphogenesis is dependent on the mechanical properties of the overlaying tissues. Proc Natl Acad Sci USA. 110 (13), 5229-5234 (2013).
- Vermeer, J., von Wangenheim, D., et al. A Spatial Accommodation by Neighboring Cells Is Required for Organ Initiation in Arabidopsis. Science. 343 (6167), 178-183 (2014).
- Von Wangenheim, D., Daum, G., Lohmann, J. U., Stelzer, E. H. K., Maizel, A. Live Imaging of Arabidopsis Development. Arabidopsis Protocols. 1062, 539-550 (2014).
- Berson, T., von Wangenheim, D., et al. Trans-Golgi network localized small GTPase RabA1d is involved in cell plate formation and oscillatory root hair growth. BMC Plant Biol. 14 (1), 252(2014).
- Langhans, M., Meckel, T. Single-molecule detection and tracking in plants. Protoplasma. 251 (2), 277-291 (2014).
- Novak, D., Kucharova, A., Ovecka, M., Komis, G., Samaj, J. Developmental nuclear localization and quantification of GFP-tagged EB1c in Arabidopsis root using light-sheet microscopy. Front Plant Sci. 6, (2015).
- Von Wangenheim, D., Fangerau, J., et al. Rules and Self-Organizing Properties of Post-embryonic Plant Organ Cell Division Patterns. Curr Biol. 26 (4), 439-449 (2016).
- Berthet, B., Maizel, A. Light sheet microscopy and live imaging of plants. J Microsc. , (2016).
- Pitrone, P. G., Schindelin, J., et al. OpenSPIM: an open-access light-sheet microscopy platform. Nat Methods. 10 (7), 598-599 (2013).
- de Luis Balaguer, M. A., et al. Multi-sample Arabidopsis Growth and Imaging Chamber (MAGIC) for long term imaging in the ZEISS Lightsheet Z.1. Dev Biol. 419 (1), (2016).
- Ovečka, M., Vaškebová, L., Komis, G., Luptovčiak, I., Smertenko, A., Šamaj, J. Preparation of plants for developmental and cellular imaging by light-sheet microscopy. Nat Protoc. 10 (8), 1234-1247 (2015).
- Yokawa, K., Kagenishi, T., Kawano, T., Mancuso, S., Baluška, F. Illumination of Arabidopsis roots induces immediate burst of ROS production. Plant Signal Behav. 6 (10), 1460-1464 (2011).
- Silva-Navas, J., et al. D-Root: a system for cultivating plants with the roots in darkness or under different light conditions. Plant J. 84 (1), 244-255 (2015).
- Aoyama, T., Chua, N. -H. A glucocorticoid-mediated transcriptional induction system in transgenic plants. Plant J. 11 (3), 605-612 (1997).
- Brand, L., et al. A versatile and reliable two-component system for tissue-specific gene induction in Arabidopsis. Plant Physiol. 141 (4), 1194-1204 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved