Method Article
Fiche Fluorescence Microscopy Lumière de racines de plante qui pousse sur la surface d'un gel
Dans cet article
Résumé
This protocol shows a plant sample preparation method for light-sheet microscopy. The setup is characterized by mounting the plant vertically on the surface of a gel and letting it grow in controlled bright conditions. This allows long-term observation of plant organ development in standardized conditions.
Résumé
One of the key questions in understanding plant development is how single cells behave in a larger context of the tissue. Therefore, it requires the observation of the whole organ with a high spatial- as well as temporal resolution over prolonged periods of time, which may cause photo-toxic effects. This protocol shows a plant sample preparation method for light-sheet microscopy, which is characterized by mounting the plant vertically on the surface of a gel. The plant is mounted in such a way that the roots are submerged in a liquid medium while the leaves remain in the air. In order to ensure photosynthetic activity of the plant, a custom-made lighting system illuminates the leaves. To keep the roots in darkness the water surface is covered with sheets of black plastic foil. This method allows long-term imaging of plant organ development in standardized conditions.
Introduction
L'une des questions clés dans le développement de compréhension des plantes est de savoir comment des cellules individuelles se comportent lors de la différenciation des organes et de la croissance. Idéalement, les événements cellulaires, comme les profils d'expression des gènes et des protéines intracellulaires localisation, peut être vu à la lumière d'un contexte plus large du tissu. Cet objectif pose des défis techniques et nécessite l'observation d'un organe entier avec une forte spatiale ainsi que la résolution temporelle sur des périodes de temps prolongées, ce qui peut entraîner des effets photo-toxicité. Comme les plantes adaptent rapidement aux changements environnementaux, les conditions de croissance doivent être étroitement contrôlés. Afin de faire l'imagerie à long terme sans interférer avec l'état physiologique de la plante, trois choses doivent être assurés conditions, 1) de plus en plus dans la chambre d'échantillon, 2) échantillon montage stable sur de longues périodes de temps, et 3) l'imagerie avec de faibles intensités lumineuses pour éviter photo-dommages et des conditions non physiologiques.
conditi croissante Physiologicalons dans la chambre microscope d'échantillons sont cruciales pour les expériences à long terme. Il y a un certain nombre de protocoles disponibles qui décrivent des chambres de croissance d'imagerie pour microscopes confocaux 1 - 3. Cependant, la microscopie confocale introduit de haute intensité lumineuse à l'usine, ce qui peut provoquer des réactions de stress et inhibe généralement la 4 croissance. En outre, la plupart des microscopes conventionnels ne permettent un positionnement horizontal de l'échantillon, ce qui est optimal pour les plantes car ils tentent de se réorienter et de se développer vers le vecteur de gravité. Au cours des dix dernières années, la lumière de la fiche microscopie a émergé comme un outil puissant pour capturer le développement de grands spécimens à une résolution cellulaire pour des périodes allant jusqu'à plusieurs jours 5 - 9. Light-feuille au microscope permet de positionner l'échantillon verticalement et est de plus en plus utilisé dans la recherche des plantes à étudier le développement des racines 10-21, récemment examiné par Berthet et 22 Maizel. La plupart des études mentionnées 10,13 - 18,21 ont été optimisées et menées dans le laboratoire de Ernst HK Stelzer employant une manière spéciale de l' échantillon de montage caractérisé par la croissance de la racine à la surface d'un gel 17. Dans ces études, un microscope sur mesure a été utilisé, dans lequel la plante est maintenue par le bas. En revanche, la majorité des gros disponibles microscopes lumière feuille de retenue de l'échantillon à partir du haut. Ainsi, cette méthode de préparation particulière ne peut pas être facilement appliquée. La méthode présentée ici fournit un protocole pour la méthode bien établie sur la surface de montage applicable pour la OpenSPIM 23, une plate - forme d'accès ouvert pour l' application et l' amélioration sélective Plan Illumination Microscopy (SPIM).
L'objectif global de ce protocole est de permettre l'imagerie à long terme des racines Arabidopsis dans la OpenSPIM lumière feuille microscope. Ceci est accompli en culture d'une plante à la verticale sur le surface d'un gel avec les racines dans un milieu liquide tandis que les feuilles restent dans l'air. Afin d'assurer l' activité photosynthétique de la plante, un système d'éclairage sur mesure illumine les feuilles mais pas les racines (figure 1).
Protocole
1. Arabidopsis La culture Avant imagerie
- Préparer le milieu ½ SM (demi-Murashige et Skoog) en y ajoutant 2,15 g de milieu MS, 10 g de saccharose, 0,97 g de MES (acide 2- (N - morpholino) éthanesulfonique) et 1 L ddH 2 O (eau bidistillée ) dans une bouteille de 1 L. Ajuster le pH à 5,8 en utilisant KOH.
- Ajouter 15 g / L gomme gellane au milieu ½ MS et l'autoclave pendant 20 min à 121 ° C.
- Verser 30 ml de milieu chaud dans des boîtes de Pétri carrées (245 x 245 x 25 mm) pour créer une couche de gel ayant une épaisseur d'environ 2 mm. Laisser refroidir la vaisselle à la température ambiante pour laisser le milieu se solidifier.
- Mettez les graines d'Arabidopsis stérilisés dans un tube de réaction de 1,5 ml contenant 1 ml H 2 O. stérile Ramassez les graines à l' aide d' une pipette de verre ou une pointe de pipette de 1000 pi et semez - les sur la surface du gel. Placez les graines séparément environ 10 mm d'intervalle. Sceller la plaque avec du ruban adhésif.
- Incuber la plaque pendant 24 h à 4° C (stratification).
- Cultiver la plaque dans un incubateur de croissance, par exemple à 22 ° C dans un cycle 16/8 h de jour / nuit avec 120-140 pmol / m² / s quantité de lumière pendant 6 jours. Jusqu'à 10 jours plantes âgées peuvent être utilisés.
2. Plante échantillon Méthode de préparation
Remarque: Le porte-échantillon peut être 3D imprimée ou fabriqués à la main dans un atelier de la machine en utilisant les dimensions représentées sur la figure 2C. Le fichier du modèle 3D est fourni dans le matériau supplémentaire (Supplemental_File _-_ 3D_Sample_Holder.stl). Voir le lien pour commander l'impression 3D dans la liste des matériaux.
- Ajouter 5 g de faible fondre agarose dans un flacon de 50 ml contenant 50 ml de milieu ½ MS et l'autoclave pendant 20 min à 121 ° C.
- Aliquoter la solution d'agarose à bas point de fusion à 1% dans 1,5 ml tubes de réaction. Conserver à 4 ° C (peut être utilisée pendant au moins deux mois).
- Faire fondre une partie aliquote de 1 agarose %% bas point de fusion à 80 ° C et laissez-le refroidir à33 ° C.
- Nettoyer le porte-échantillon dans un appareil à ultrasons. Stériliser le porte-échantillon avec 70% d'éthanol et laver avec de l'eau stérile.
- Couper le gel autour de la plante à l'aide d'un scalpel.
- Soulevez le bloc avec une spatule plate et faites-le glisser avec précaution sur le porte-échantillon en utilisant une deuxième spatule.
- Coller le gel sur le support d'échantillon avec 1% d'agarose (à 33 ° C) à l'aide d'une pipette 100 uL.
- Collez la plante sur le gel avec 1% d'agarose en utilisant une pipette de 10 pi. Utiliser un microscope stéréo pour vérifier que les feuilles ne sont pas recouvertes de gel. Ne pas placer le gel directement sur la région d'intérêt.
- Pour empêcher la plante de se dessécher, travailler sans interruption. Insérez le porte-échantillon dans une pointe de pipette de 1000 pi à chaque fois que possible. Utilisez la pointe de la pipette comme un bouchon et faites-le glisser avec précaution sur une extrémité du porte-échantillon où l'usine est située.
- Mettre le porte-échantillon dans une boîte de pointe de la pipette et de préparer plus de plantes si nécessaire. Les plantes peuvent être directly imagé ou remis dans l'incubateur de croissance.
3. Mettre en place le microscope
Remarque: Le système d'éclairage à LED est une lampe construite sur mesure. Les détails techniques nécessaires pour construire l'anneau LED peuvent être trouvés dans la figure 3 et la liste des matériaux. Voir le fichier matériel supplémentaire (Supplemental_File _-_ LED_Ring_Board.brd) pour la conception de la carte.
- Vis ou de la colle (par exemple , ruban adhésif double face) l'anneau de LED sur le côté inférieur du bras OpenSPIM x / y / z / θ stade.
- Connectez l'anneau LED avec une alimentation réglable (0-30 V, max 2 A).
- Régler la tension à l'intensité lumineuse désirée (pour Arabidopsis, 120-140 pmol / m 2 / s, la figure 3D).
- Stériliser la chambre d'échantillon avec 70% d'éthanol et laver avec de l'eau stérile.
- Nettoyez l'objectif avec un tissu benzine et le nettoyage des lentilles. Stériliser la lentille d'objectif avec 70% d'éthanol.
- Connecter les perfusisur les tubes à la chambre d'échantillon dans un agencement unidirectionnel. Mettre une bouteille de 1 L contenant frais ½ milieu MS et une autre bouteille vide à côté de la pompe à perfusion péristaltique. Raccorder la bouteille avec du milieu avec l'entrée inférieure de la chambre d'échantillon en utilisant un tube de perfusion. Branchez la sortie supérieure de la chambre d'échantillon avec la bouteille vide à la poubelle le moyen utilisé en utilisant un autre tube de perfusion.
- Régler la vitesse d'écoulement de 1 ml / min.
NOTE: Pour ne pas Overspill la chambre d'échantillon, il est important d'avoir une sortie plus élevée que l'afflux. Soit augmenter le taux de pompage ou d'utiliser un tube d'un diamètre intérieur plus grand pour la sortie. - Coupez une feuille de plastique noir en 3 mm petits carrés, laver avec 70% d'éthanol et les laisser sécher avant de les placer dans la chambre de l'échantillon sur la surface de l'eau.
- Retirer la pointe de la pipette du porte-échantillon et insérez le porte-échantillon dans la chambre d'échantillon. Si le porte-échantillon nouvellement fabriqué ne rentre pas dans le bras de la scène, utiliser un sable finpapier pour le rendre plus mince ou d'utiliser un joint torique (∅ 6 mm) dans le cas où elle est trop mince.
- Pour créer les couvercles, couper la feuille d'aluminium noir en deux 50 x 25 mm pièces. Faire un 5 mm découpés dans le milieu d'un côté de chaque pièce. Plier pour créer une indentation de triangle (figure 1D). Fermer la chambre d'échantillon avec les deux couvercles en plaçant le couvercle sur le dessus de la chambre d'échantillon avec les indentations triangulaires faisant face au porte-échantillon. Assurez-vous que les feuilles des plantes ne sont pas à l'ombre des paupières et de recevoir la lumière du système d'éclairage.
- Trouver la région d'intérêt en utilisant la x / y / z et rotation de phase pour positionner une racine latérale débouchant dans le champ de vision.
- Avant l'enregistrement, permettent au système de stabiliser au moins 15 min.
- Configuration de la d'acquisition d'image.
- Définir une pile de 217 images avec 3 um z espacement (650 um) et régler l'intervalle de temps à 15 min d'intervalle d'imagerie pour une durée totale de 17 h.
NOTE: Une documentation détaillée surcomment faire fonctionner le logiciel OpenSPIM peut être trouvée sur (http://openspim.org/Acquisition#Acquiring_a_Stack).
- Définir une pile de 217 images avec 3 um z espacement (650 um) et régler l'intervalle de temps à 15 min d'intervalle d'imagerie pour une durée totale de 17 h.
- Commencer l'enregistrement.
Résultats
Cette méthode de préparation des échantillons permet la culture de la plante à l' intérieur de la chambre d'échantillon de microscope en observant le système racinaire au microscope optique d'une feuille (figure 1). La plante pousse sur la surface d'une couche de gel (½ de milieu MS contenant 1,5% de gomme de gellane) monté sur un porte-échantillon personnalisé conçu (figure 2). Le porte-échantillon est en 3D imprimée en utilisant une résine transparente en tant que matériau. Une version fabriquée mettant en évidence les dimensions est représenté sur la figure 2C. Les racines sont immergées dans un liquide (½ milieu MS), qui est actualisé en permanence par un système de perfusion. Les feuilles restent dans l'air et sont continuellement éclairés avec une intensité lumineuse de 130 pmol / m² / s provenant de LED bleues et rouges qui sont disposés dans un anneau au- dessus de l'usine (Figure 1A, B et figure 3A-C). L'anneau LED est fabriqué dans notre atelier de la machine etnous fournissons des détails techniques sur la façon de construire l'anneau LED dans la figure 3 et la liste des matériaux. L'intensité lumineuse peut être réglée en continu allant de 30 à 250 pmol / m 2 / s (Figure 3D). Le système racinaire est ombragée par de petites feuilles d'une feuille de plastique noir recouvrant la surface de l' eau (figure 1). Toute la lumière parasite de l'illumination qui est recueillie par la lentille de détection est filtré par le filtre de la GFP (Figure 3E).
Avec cette configuration, un laps de temps d'une racine latérale Arabidopsis croissante a été enregistrée pendant 17 h en utilisant une lentille 20X / 0,5 (Figure 4). La racine latérale a son origine dans la couche de cellules de pericycle, qui est situé au fond de la racine primaire. Afin de démontrer les capacités d'imagerie encore plus profondes à l'intérieur d'un tissu pour des périodes de temps prolongées, un plus fort grossissement (40x / 0,75) a été utilisé pour capturer la formation d'un ro latéralot de la première étape primordium jusqu'à l'émergence de la racine primaire à l' intérieur d' une période de 38 heures (figure 5). Une tranche 2D exemplaire de l'ensemble de données est représenté sur la figure. 5B. Cet enregistrement nous permet de suivre la dynamique de la formation de racines latérales en 3D (figure 5A) avec une résolution cellulaire.
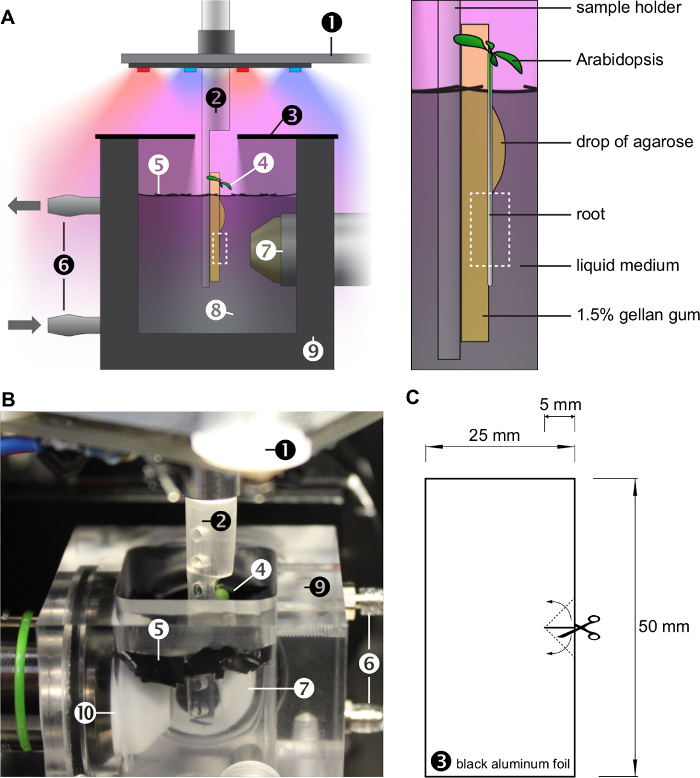
Figure 1: Les conditions de croissance à l' intérieur de la chambre d'échantillon de OpenSPIM. A) Croquis de la chambre d'imagerie. La plante se développe à la verticale sur la surface d'un gel, monté sur un porte-échantillon construit sur mesure (voir également la figure 2). Les racines se développent dans un milieu liquide, qui est continuellement échangé par un système de perfusion. La plante laisse croître dans l' air et sont éclairés par des LED rouges et bleues (voir aussi la figure 3). Le système racinaire est ombrée wit h petites feuilles d'une feuille de plastique noir recouvrant la surface de l'eau. Un couvercle formé de deux morceaux de feuille d'aluminium noir réduit encore la quantité de lumière au-dessous de la surface de l'eau et maintient l'humidité dans la chambre d'échantillon. Le panneau agrandi sur la droite met en évidence la croissance des plantes sur la surface d'un bloc de gel immergé dans le milieu liquide. Une goutte d'agarose monte la racine sur le gel. La boîte en pointillé indique la région d'intérêt observée par le microscope. B) Photographie de la chambre d'imagerie (sans couvercle). Numbers (1) - (10) A et B représentent: (1): x / y / z / θ-scène avec anneau de LED, (2): porte-échantillon, (3): couvercle, (4): Arabidopsis thaliana , (5): feuilles de noir feuille de plastique, (6): système de perfusion, (7): détection objectif, (8): milieu liquide, (9): chambre d'échantillon (10): illumination objectif. C) Le couvercle est fait de deux morceaux de papier d'aluminium noir. target = "_ blank"> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2: Le porte-échantillon. A) modèle 3D. Le fichier du modèle 3D est fourni dans le matériau supplémentaire. B) Photographie d'impressions 3D à l' aide de différents matériaux (1) - (3): plastique acrylique transparent, (4) et (5): résine, (6): résine transparente. C) Schéma technique du porte-échantillon, les chiffres représentent millimètre. D) Photo du porte-échantillon fabriqué avec une plante monté. La zone en pointillé peut être observée par le microscope. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
télécharger / 55044 / 55044fig3.jpg "/>
Figure 3: configuration d'éclairage des plantes. A) schéma de circuit de la lampe. Paires de LED peuvent être activés / désactivés individuellement pour la foudre directionnelle. LED: diode électroluminescente, R: résistance, T: transistor, JP: pinhead. B) La conception finale de la lampe d'éclairage a été établi en utilisant un PCB logiciel (PCB: circuit imprimé). Nous fournissons le fichier de conception de la carte dans le matériau supplémentaire. Le conseil a ensuite été fabriqué et assemblé dans MIBA l'atelier d'usinage de notre institut. C) Photographie de l'anneau de LED allumé. Quatre paires d'un rouge et une LED bleue sont disposées dans un anneau. D) La plage de tension peut être réglée entre 3,5 V et 14,0 V. Les résistances ont été utilisés pour atteindre la quantité de lumière allant de 30 à 250 pmol / m 2 / s (R1-8: 220 Ohm, R9-12: 1,220 Ohm ). E) Le spectre d'émission de la lampe, GFP et YFP. tp: //ecsource.jove.com/files/ftp_upload/55044/55044fig3large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
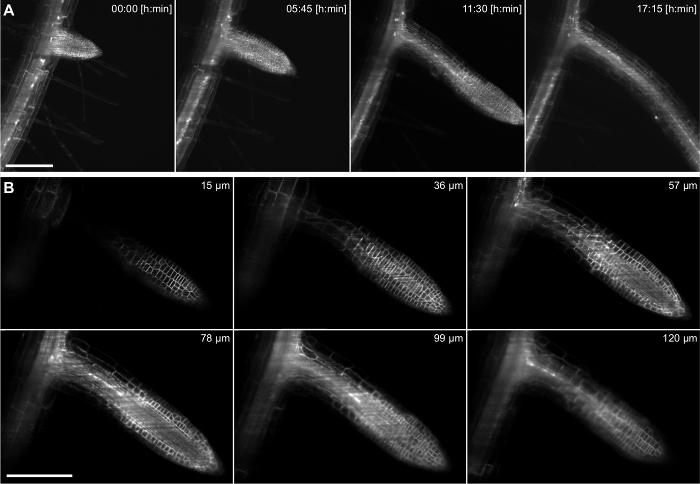
Figure 4: enregistrement Time lapse de Arabidopsis thaliana des racines latérales. Le vieux 5 jours plantules exprime un marqueur de membrane (pUBQ10 :: YFP-PIP1; 4) et un journaliste nucléaire (pGATA23 :: nls-GUS-GFP) marquant spécifiquement pericycle cellules qui se développent dans une racine latérale. Une pile de 217 images (3 um z-espacement) a été capturé toutes les 15 minutes pendant 17 heures d'enregistrement en utilisant une lentille 20X / 0,5. A) quatre points de temps sur 69 sont représentés dans une projection d'intensité maximale. B) Six des 217 tranches individuelles d'un z-stack d'un point de temps sont affichés. Les barres d'échelle en A et B représentent 100 um.charge / 55044 / 55044fig4large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
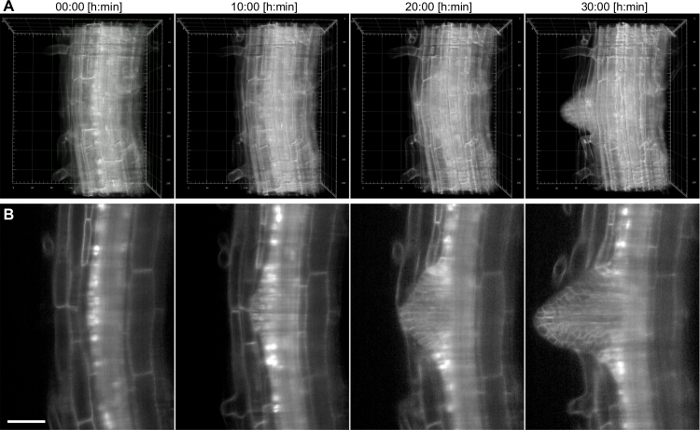
Figure 5: Temps d' enregistrement laps de Arabidopsis thaliana des racines latérales. Le vieux 6 jours plantules exprime un marqueur de membrane (pUBQ10 :: YFP-PIP1; 4) et un journaliste nucléaire (pGATA23 :: nls-GUS-GFP) marquant spécifiquement pericycle cellules qui se développent dans une racine latérale. Une pile de 200 images (1,5 um z-espacement) a été capturé toutes les 15 min pour 38 h d'enregistrement en utilisant une lentille 40X / 0,75. A) rendu 3D de quatre points de temps, les numéros dans la grille représentent um, B) seule tranche à travers le plan central de la racine principale. La barre d'échelle représente 50 um. S'il vous plaîtcliquez ici pour voir une version plus grande de cette figure.
Supplemental_File _-_ 3D_Sample_Holder.stl. Le fichier du modèle 3D est fourni. S'il vous plaît cliquer ici pour télécharger ce fichier.
LED fichier supplémentaire Anneau Board.brd. Le fichier de conception de la carte est fournie. S'il vous plaît cliquer ici pour télécharger ce fichier.
Discussion
Fiche Lumière Fluorescence Microscopy a le grand avantage de combiner faible phototoxicité et la vitesse d'acquisition ultrarapides, qui peut être utilisé pour capturer un grand volume avec une résolution spatio-temporelle tout en gardant l'échantillon dans un état physiologique. La résolution d'un microscope optique , la feuille peut être comparée à celle d'un microscope confocal à 9. Toutefois, la diffusion de la lumière et l'absorption se produit le long du trajet d'excitation et d'émission individuelle et la qualité globale de l'image peut être nettement inférieur à l'intérieur des tissus opaques par rapport à la surface. Pour contourner cette complication, on peut utiliser la possibilité de faire tourner l'échantillon le long de l'axe vertical et d'observer le même volume de différentes directions. Mais ce n'est pas toujours avantageux, par exemple , les racines latérales émergent sur un côté de la racine et de l' imagerie par derrière les résultats d'une faible qualité d'image sans obtenir plus d' informations. Toutefois, la rotation peut être principalement utilisé pour positionner le sample de la meilleure façon. La disposition horizontale classique des lentilles de l'objectif permet de nouvelles façons de montage de l'échantillon. Les plantes bénéficient d'une position verticale. Présenté ici, le "sur la surface du gel" Méthode de montage présente plusieurs avantages par rapport à d' autres méthodes de montage telles que l' incorporation de la racine à l' intérieur d'un gel 24,25. 1) Le système racinaire est en contact direct avec le milieu liquide. La chambre d'échantillon est reliée à un système de perfusion qui fournit en continu milieu frais. Il peut également être utilisé pour échanger rapidement la totalité du volume de la chambre d'échantillon pour appliquer différents supports ou des médicaments. 2) Avant de goûter les installations de préparation poussent comme ils sont utilisés pour se développer dans les laboratoires. Les plantes peuvent être sélectionnés sous le microscope de fluorescence et seules les plantes désirées doivent être préparées. 3) L'usine est transférée de la boîte de Pétri au titulaire de l'échantillon sans être touché. De ce fait, la plante peut développer davantage sur le même gel il a été de plus en plus dans la incubato de croissancer et la contrainte mécanique est réduit à un minimum. 4) La vue sur l'échantillon ne soit pas obstruée et les aberrations optiques sont réduites au minimum parce que l'espace entre l'échantillon et l'objectif de détection est uniquement remplie de fluide, et aucun autre matériaux ayant différents indices de réfraction.
Afin de réaliser une imagerie à long terme, le système d'éclairage de l'installation est nécessaire pour assurer l'activité photosynthétique de la plante. Dans la plupart des laboratoires plantes poussent sur un gel transparent, à savoir les racines sont exposées à la lumière. Cela peut provoquer des réponses différentes à leur environnement et induit des changements dans leur biochimie et le développement 26,27. Afin de réduire la quantité de lumière sur le système racinaire, une feuille de plastique noir a été utilisé pour couvrir la surface de l'eau ainsi qu'un couvercle en feuille d'aluminium noir couvert la chambre d'échantillon. Lumière peut atteindre la plante sort par le trou central du couvercle. Dans cette configuration, aucune augmentation de la lumière de fond a été observée, suggesting que la quantité de lumière parasite provenant des DEL rouge et bleue a été significativement réduite par le filtre de la GFP et les approches d'ombrage. Cela a permis à garder la lumière allumée lors de l'acquisition d'image sans augmenter le bruit caméra de fond.
Le porte-échantillon est conçu pour l'impression 3D. Cependant, le choix du matériau est crucial car plusieurs matières plastiques qui ont été testés ne sont pas stables à 100%, ce qui entraîne une dérive de l'échantillon. Par conséquent, il est recommandé d'utiliser des résines à la place ou construire le porte-échantillon par broyage d'un polyéthylène (PEP) tige. Lors de l'utilisation d'une installation de microscope en nappe de lumière avec un système d'éclairage à double face du porte-échantillon peut interférer avec l'une des feuilles de lumière en fonction de l'angle de rotation. Pour réduire le stress mécanique pendant l'excavation de la plante à partir de la plaque, utilisez un angle plat de la spatule. La plante peut rapidement sécher et l'écoulement d'expérience de l'air pour la première fois. Essayez d'éviter tout courant d'air (mouvements rapides, le flux d'air conditionné), work sans interruption et faites glisser le porte-échantillon dans une pointe de pipette de 1000 pi à chaque fois que possible. A l'intérieur du microscope, il est crucial de ne pas tremper la plante entière en liquide et conserver les feuilles sèches.
La technique est idéale pour l'imagerie premiers stades de la formation de racines latérales. Lors de l'exécution à long terme imagerie des extrémités des racines matures, il faut garder à l'esprit que les racines d'Arabidopsis grandir avec 100-300 um / h rapidement hors du champ de vision. Une mise en œuvre future très utile pourrait être un algorithme de suivi automatisé, ce qui permettrait à la croissance de la pointe de la racine suivante sur des périodes de temps prolongées. La capacité de contrôler les conditions environnementales telles que la lumière et la composition en nutriments du milieu au cours du processus d'acquisition permet enquête adaptation des plantes aux changements. La racine est en contact direct avec le milieu liquide, qui peut être utilisé pour appliquer des médicaments pour activer chimiquement l' expression génique, par exemple en utilisant la dexaméthasone ou 28 inductible de la β-estradiol système inductible 29. Cependant, il faut du temps pour échanger la totalité du volume de la chambre d'échantillonnage pour laver un médicament. L'installation peut être améliorée en réduisant le volume de la chambre d'échantillon afin d'accélérer l'échange milieu. Néanmoins, cette technique a un grand potentiel. La combinaison de la procédure de montage, des conditions de croissance normalisées et l'acquisition d'image douce en utilisant la lumière feuille microscopie permet des études à long terme de développement de la plante avec une haute résolution à un niveau physiologique. Cela aidera les chercheurs à étudier les mécanismes fondamentaux du développement des plantes.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
Nous remercions Matyáš Fendrych pour la lecture critique / visualisation et Stephan Stadlbauer pour l'équipement audio. Merci à la Miba Machine Shop à IST Austria pour leur contribution à la OpenSPIM. La recherche menant à ces résultats ont reçu un financement du Programme People (Actions Marie Curie) du septième programme-cadre de l'Union européenne (FP7 / 2007-2013) en vertu de REA convention de subvention n ° [291734] et le Conseil européen de la recherche (projet ERC-2011 -StG-20101109-PSDP).
matériels
| Name | Company | Catalog Number | Comments |
| Agarose, low melting | VWR | AFFY3282125GM | |
| Black aluminum foil | Thorlabs | BKF12 | |
| Black plastic foil | Carl Roth | HT83.2 | |
| LED blue (453 nm) | OSRAM | LD CN5M-1R1S-35-1 | |
| LED red (625 nm) | OSRAM | LR T66F-ABBB-1-1 | |
| LED board - PCB design software | Cadsoft Eagle | ||
| MES monohydrate | Duchefa | M1503.0100 | |
| Micropore Surgical Tape | 3M | 1530-1 | |
| Murashige & Skoog Medium (MS-Medium) | Duchefa | M0221 | |
| Phytagel | Sigma-Aldrich | P8169 | |
| Sample holder 3D print | i.materialise | https://i.materialise.de/shop/item/sampleholder-openspim-zeisslightsheetz1 | |
| Square Petri dishes (245 x 245 x 25 mm) | VWR | 734-2179 | |
| Sucrose | Sigma-Aldrich | 84097-1KG |
Références
- Grossmann, G., Guo, W. -J., et al. The RootChip: an integrated microfluidic chip for plant science. Plant Cell. 23 (12), 4234-4240 (2011).
- Busch, W., Moore, B. T., et al. A microfluidic device and computational platform for high-throughput live imaging of gene expression. Nat Methods. 9 (11), 1101-1106 (2012).
- Calder, G., Hindle, C., Chan, J., Shaw, P. An optical imaging chamber for viewing living plant cells and tissues at high resolution for extended periods. Plant Methods. 11 (1), 22(2015).
- Dixit, R., Cyr, R. Cell damage and reactive oxygen species production induced by fluorescence microscopy: effect on mitosis and guidelines for non-invasive fluorescence microscopy. Plant J. 36 (2), 280-290 (2003).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical Sectioning Deep Inside Live Embryos by Selective Plane Illumination Microscopy. Science. 305 (5686), 1007-1009 (2004).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. K. Reconstruction of Zebrafish Early Embryonic Development by Scanned Light Sheet Microscopy. Science. 322 (5904), 1065-1069 (2008).
- Keller, P. J., Schmidt, A. D., et al. high-contrast imaging of animal development with scanned light sheet-based structured-illumination microscopy. Nat Methods. 7 (8), 637-642 (2010).
- Höckendorf, B., Thumberger, T., Wittbrodt, J. Quantitative Analysis of Embryogenesis: A Perspective for Light Sheet Microscopy. Dev Cell. 23 (6), 1111-1120 (2012).
- Stelzer, E. H. K. Light-sheet fluorescence microscopy for quantitative biology. Nat Methods. 12 (1), 23-26 (2015).
- Maizel, A., Von Wangenheim, D., Federici, F., Haseloff, J., Stelzer, E. H. K. High-resolution live imaging of plant growth in near physiological bright conditions using light sheet fluorescence microscopy. Plant J. 68 (2), 377-385 (2011).
- Sena, G., Frentz, Z., Birnbaum, K. D., Leibler, S. Quantitation of Cellular Dynamics in Growing Arabidopsis Roots with Light Sheet Microscopy. PLoS ONE. 6 (6), e21303(2011).
- Costa, A., Candeo, A., Fieramonti, L., Valentini, G., Bassi, A. Calcium Dynamics in Root Cells of Arabidopsis thaliana Visualized with Selective Plane Illumination Microscopy. PLoS ONE. 8 (10), (2013).
- Šamajová, O., Takáč, T., von Wangenheim, D., Stelzer, E. H. K. Update on methods and techniques to study endocytosis in plants. Endocytosis in Plants. , 1-36 (2012).
- Rosquete, M. R., Von Wangenheim, D., et al. An auxin transport mechanism restricts positive orthogravitropism in lateral roots. Curr Biol. 23 (9), 817-822 (2013).
- Lucas, M., Kenobi, K., et al. Lateral root morphogenesis is dependent on the mechanical properties of the overlaying tissues. Proc Natl Acad Sci USA. 110 (13), 5229-5234 (2013).
- Vermeer, J., von Wangenheim, D., et al. A Spatial Accommodation by Neighboring Cells Is Required for Organ Initiation in Arabidopsis. Science. 343 (6167), 178-183 (2014).
- Von Wangenheim, D., Daum, G., Lohmann, J. U., Stelzer, E. H. K., Maizel, A. Live Imaging of Arabidopsis Development. Arabidopsis Protocols. 1062, 539-550 (2014).
- Berson, T., von Wangenheim, D., et al. Trans-Golgi network localized small GTPase RabA1d is involved in cell plate formation and oscillatory root hair growth. BMC Plant Biol. 14 (1), 252(2014).
- Langhans, M., Meckel, T. Single-molecule detection and tracking in plants. Protoplasma. 251 (2), 277-291 (2014).
- Novak, D., Kucharova, A., Ovecka, M., Komis, G., Samaj, J. Developmental nuclear localization and quantification of GFP-tagged EB1c in Arabidopsis root using light-sheet microscopy. Front Plant Sci. 6, (2015).
- Von Wangenheim, D., Fangerau, J., et al. Rules and Self-Organizing Properties of Post-embryonic Plant Organ Cell Division Patterns. Curr Biol. 26 (4), 439-449 (2016).
- Berthet, B., Maizel, A. Light sheet microscopy and live imaging of plants. J Microsc. , (2016).
- Pitrone, P. G., Schindelin, J., et al. OpenSPIM: an open-access light-sheet microscopy platform. Nat Methods. 10 (7), 598-599 (2013).
- de Luis Balaguer, M. A., et al. Multi-sample Arabidopsis Growth and Imaging Chamber (MAGIC) for long term imaging in the ZEISS Lightsheet Z.1. Dev Biol. 419 (1), (2016).
- Ovečka, M., Vaškebová, L., Komis, G., Luptovčiak, I., Smertenko, A., Šamaj, J. Preparation of plants for developmental and cellular imaging by light-sheet microscopy. Nat Protoc. 10 (8), 1234-1247 (2015).
- Yokawa, K., Kagenishi, T., Kawano, T., Mancuso, S., Baluška, F. Illumination of Arabidopsis roots induces immediate burst of ROS production. Plant Signal Behav. 6 (10), 1460-1464 (2011).
- Silva-Navas, J., et al. D-Root: a system for cultivating plants with the roots in darkness or under different light conditions. Plant J. 84 (1), 244-255 (2015).
- Aoyama, T., Chua, N. -H. A glucocorticoid-mediated transcriptional induction system in transgenic plants. Plant J. 11 (3), 605-612 (1997).
- Brand, L., et al. A versatile and reliable two-component system for tissue-specific gene induction in Arabidopsis. Plant Physiol. 141 (4), 1194-1204 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon