Method Article
マイクロ Rna による液体生検: プラズマ miRNA 署名分類 (MSC) がん検診用の経験
* これらの著者は同等に貢献しました
要約
ここでは、早期肺癌発見のため循環マイクロ Rna 署名分類テストの実施試験をスクリーニングして、BioMILD で採用された詳細なプロトコルを提示します。
要約
前臨床段階で早期肺癌発見のため液体の生検など、低侵襲テストの開発は、この致命的な病気の予後を改善することが重要です。マイクロ Rna (Mirna) は、特定の小さな、非コーディング RNAs 生体信号の細胞外のメッセンジャーとして機能するかもしれない遺伝子の発現を調節する、腫瘍とその周囲の微小環境間のクロストークから派生した組織です。彼らは従って肺癌の早期発見のための理想的な候補者を表すことができます。この作品での肺がん検診では、試用版で登録ボランティアの血漿サンプル カスタム作られたマイクロ カードおよび量的なリアルタイム PCR を使用して循環 miRNA テストの将来の検証のための方法論的ワークフローを提案します。さらに、以来、miRNAs の溶血に関するより一般的な技術的な問題のリリースは分析に影響を与える、標準の操作手順に含まれている品質管理手順は掲載されています。プロトコルは再現性のある、信頼性の高い定量的な結果を与えるただし、大臨床シリーズを使用する場合事前分析と解析の両方の機能で慎重に評価します。
概要
肺癌は、最も一般に診断されたがんすべて癌診断1の約 25% を占める、世界中です。過去 2 年間、減らされたタバコの使用のために主に肺癌の死亡率の着実な減少にもかかわらず肺がん両方の男性と女性の癌死の主要な原因のまま。2017 年に、それは約 25%、アメリカ合衆国、ヨーロッパ、それぞれ1,2で全がんによる死亡の 20% を占めると予測されます。
以来、症状は、通常病気の早期では発生しないが、肺癌の大部分は後半の段階で診断されます。これは、治療的介入と治療3の貧しい人々 の有効性の限られた可能性に します。したがって、多くの科学的な努力を目的で早期肺癌発見の効果的なテストを識別します。
さまざまな試験をスクリーニングは、低線量計算トモグラフィー (例) 初期段階肺がん4を検出するための撮影と比較してより良いツールに対し、胸部が肺がん検診に値を持っていないことを示しています。さらに、手法を使って thatscreening 削減肺がん死亡率現在および元ヘビースモーカー5間で 20% までが示されています。これらのデータは、いくつかのプロ社会4,6ガイドラインで定義されている危険度が高い人口の肺がん検診の使用をサポートします。
例のスクリーニングに関する主要な懸念の中でのメモの偽陽性・過剰診断率が高いがあります。この科学的なコミュニティはこれらの問題を克服し、例のスクリーニング検査の特異性を高めるのための戦略を探しています。非侵襲的な相補的なバイオ マーカーの開発はここで役に立つかもしれない。日には、捜査では、Mirna、DNA、遺伝子のメチル化、小さなタンパク質など他の候補バイオ マーカーの広範なリストがある7。
血液ベースのバイオ マーカー、Mirna、循環と免疫応答バイオ マーカーを含むより高度な検証フェーズ8に達する。免疫応答バイオ マーカーは、両方の細胞と表面の腫瘍抗原に対する免疫応答肺がん患者9組み込まれている知識に基づいています。例えば、AjonaらC4d、診断、肺がん10の予後、古典的補体経路の分解産物の役割を評価しました。そうでなければ、市販の抗体血清テスト 7 腫瘍関連抗原を非小細胞肺癌患者で検証されており、感性の 36% を示し, 特異性11の 91% を調べるします。免疫応答バイオ マーカーは、興味深いですが潜在的な臨床応用のための検証研究が必要があります。
miRNAs は内生小さい非コード Rna 保存機構と動物や植物の王国中大の機能的意義。Mirna の役割はタンパク質翻訳を調節する: ターゲット遺伝子12の大規模なセットの発現を抑えます。それはよく記載されている変化 ofmiRNAs の式がほとんどの人間のがん12,13,14の病因に貢献します。さらに、腫瘍と間質細胞の両方解放機構の解明に、血漿、血清15,1617 尿などの体液に RNA 結合蛋白質、協会の定款によって安定化された Mirnaと唾18。ホスト応答と腫瘍とその微小環境19動的相互作用、Mirna を循環を反映したがって場合があります。一緒に取られてこれらの観測を行った循環 miRNAs ひと癌の検出のための biomarkers の有望なクラス。
さまざまな方法で検出できる Mirna を循環: マイクロ アレイ プラットフォーム20、定量的逆転写 PCR (RT qPCR)21、および次世代シーケンス (NGS)14,22。前述の技術に基づいて様々 な発現プロファイル研究は、最後の年で開発されています。マイクロ アレイは、高スループット技術、何千もの 1 つの単一のアッセイの miRNAs を分析することです。ただし、低ダイナミック レンジと Rt-qpcr や NGS に比べて特異性があります。さらに、マイクロ アレイ、非定量法、そのためさらなる実験的検証が必要。シーケンス ベースのメソッドは、未知の miRNAs の同定を許可し、検出フェーズに特に適しています。一方、NGS メソッドはまだ高価であり、特別な機器や専門家の多くは、こうして大検証コホートと臨床23利用の制限が必要になります。現時点では、RT qPCR、診断/臨床コンテキスト24miRNA 検出を循環させるため最も採用されているプラットフォームです。Mirna の解析に使用できるさまざまな RT qPCR テクノロジーがありますが、TaqMan PCR によって続いた茎ループ RT は、最も広く使用されている25。この手法は、非常に敏感で正確な (単一のヌクレオチドの差別)、高ダイナミック レンジ;しかし、知られている miRNAs のみの検出が可能します。
マイクロ Rna 品質管理研究 (miRQC) Mestdaghらは広く Mirna プロファイリング 3 前述技術26に基づいていくつかの市販のプラットフォームの特性を調査によって。196 miRNAs 組織と血清のサンプルを分析することによって異なるプラットフォームのパフォーマンスは、再現性や感度、精度、特異性、差動式の一致の面で評価されました。結果ことを示した NGS に基づいてプラットフォームとマイクロ アレイ技術は高い再現性と特異性、RT qPCR プラットフォームより正確な敏感なと特に体などの低入力 RNA サンプルのためのより高い検出率を持っていた流体。こうして Rt-qpcr よう日常臨床検査の潜在的なアプリケーションのための最も適切な方法です。
2011 年・ ソッツィら分析最初例 screeningtrial (INT IEO トライアル)27の登録ボランティアや Mirna を循環する 24 の相互比率によって構成される 4 つの miRNA 署名から収集した血漿検体の miRNA のプロファイル生成されました。これらの署名された、患者から病気自由な個人を識別することができるまたは致死例疾患検出28前に時間または最大 2 年間に肺がん。さらに論文では最初に説明した同じグループ時間 miRNA 署名分類 (MSC)、3 つのレベルのリスクの患者を分類するために 4 つの miRNA 署名を組み合わせることによって得られる: 高、中、低です。その臨床的有用性は、軽度のスクリーニング試験、観測アーム29と年次または隔年の例の腕を比較する無作為化試験に登録 1,000 以上の個人の大規模な回顧展セットで検証されました。確かに、MSC と手法の組み合わせ削減例偽陽性率が約 5 倍と 3 つの MSC リスク グループ全生存期間に関連付けられています。
「Fondazione IRCCS Istituto ナツィオナーレ ・ デイ ・周辺」で 2013 年に後で (ミラノ、それ) 将来スクリーニング試験 (BioMILD) ベースの MSC テストが開始されたプラズマを用いた手法を実装します。BioMILD 試験に登録ボランティアはすぐに別のカスタム作られたマイクロ カードを使用したプロファイリング miRNA のプラズマに処理手法と血の撤退を受けます。手法と結果の組み合わせでは、特定健診でアルゴリズムの24を定義します。
現在の仕事から血液サンプルのコレクション、プラズマ分離、RNA の抽出、BioMILD 試験で使用される全体の方法論的プロトコルが記載されてし、Rt-qpcr マイクロ カードを作った 24 Mirna 発現プロファイルのカスタムを使用します。高い一貫性と再現性を考えると、これらの手順も使用できます他の疾患における液体生検の miRNA ベースの開発のため。
プロトコル
当院の研究倫理委員会で承認されたプロトコル
。1 プラズマ サンプル コレクション
K 2 EDTA のスプレー塗装と室温で保管バキュテナー チューブ内- 収集 10 mL 全血のサンプル。
。 メモ: 溶血を抑える、2 h でプラズマを区切ります。熱衝撃を避けるために、セル換散非特異的 miRNA のリリースにつながる低温 (すなわち、4 ° C) で全血を格納しないでください 。
- 内で 1 時間、別の 1,258 x g と 10 分のための 4 ° C でまず遠心分離によるプラズマ
- リンパ球性のリングが付いている接触を慎重に回避 15 mL チューブに上清のプラズマを転送します 。
- 遠心分離機プラズマ 1,258 x g で 10 分のための 4 ° C 2 時間
- 1.5 mL クリオバイアル、管の基部に血漿分画の収集を回避するのにプラズマの分注 1 mL 。
- ストアすべての因数で −、溶血の評価の 1 つを除いて、80 ° C。5 週間以内、分子の分析を実行する必要があります 。
2。吸光光度測定による溶血の評価
- プラズマ分離ステップの吸光光度法、キュベットで作る、1:10 直後後 (例えば、100 μ L の 1 X 900 μ L 中のプラズマの 1x PBS で血漿の希釈PBS) とそれを均質化するミックス
注: 血漿サンプルは固定されません吸光光度測定、凍結サンプルの (および特に lipemic のサンプルで) として吸光光度分析に干渉 flocculates を形作ることができる前にします 。
- 375 で吸光度を読み 414 nm nm、541 nm、および 576 nm 紫外可視分光光度計, を用いたベースライン補正解決 750 で nm とパスの長さ 10 mm. の 1 mL の 1x PBS を使用して空白の測定を行い 。
- 414 で吸光度の比を計算する nm ・ 375 nm; 1.4 より溶血されましたサンプルを考慮すると血の撤退を繰り返す (表 1 に QC1).
3。血漿総 RNA 抽出
均質化ソリューションの mL あたり 1 チオグリセ μ- 20 1 チオグリセ/均質化 (OMG) ソリューションの準備。1 チオグリセは粘性なので慎重に正確な測定のためのピペットします。それを使用する前に OMG ソリューションまたは 2-10 ° C で氷の上を冷やす
注: 作業ソリューションは 2 ~ 10 ° C で安定して 1 ヶ月 。
- 中断凍結乾燥 DNase ヌクレアーゼ フリーの 275 μ L を追加することによって私はバイアルに水し、軽くミックス (ボルテックスにかけないでください)。視覚補助として追加 5 μ L ブルーの私を再構成した DNase を染めるし、ヌクレアーゼ フリー チューブの単回使用の因数にソリューションを分配します。再構成した DNase を保存私-10-30 ° c ° C
- プラズマの 200 μ L から、追加 200 μ L 冷蔵 OMG ソリューションの 。
- 渦 15-30 秒完全な均質化を確保するため。泡が発生した場合は氷に落ち着くサンプルを聞かせて
- 追加 200 μ L の換散バッファーと 25 μ L の試料と 20 の渦にプロティナーゼ K の s.
- 、Thermomixer で 15 分間サンプルが 37 で予熱加温 ° C
- 楽器のデッキ プレート トレイの各サンプルのカートリッジをロードし、適切な位置に、栓を配置します 。
- 計測器カートリッジ内の適切な位置にライセートを転送します 。
- DNase の追加 5 μ L 私カートリッジ内の適切な位置にソリューションします 。
- 各溶出チューブのベースにヌクレアーゼ フリー水の追加 60 μ L.
- 選択、" RSC miRNA 組織 " メソッドと実行自動精製を開始。RNA サンプルの合計で格納できる − 80 ° C
4。Taq ベースの RT
- Taq マイクロ Rna を逆転写キット cDNA に RNA を変換する興味の miRNAs の Taq RT プライマー プールを使用します 。
- カスタム Taq RT プライマー プール 6 μ を使用してキットの手順に従って 1.5 mL 遠心チューブに氷の上の RT の反作用の組合せの準備 12 μ L.
- 追加 3 μ l の最終体積 15 μ L の RNA を合計、5 分氷でインキュベート
- ロード熱 cycler の構成のとおりに RT の反作用: 16 ° C、30 分、30 分、85 ° C で 4、5 分押しの 42 ° C ° C
注: cDNA は少なくとも 1 週間の-20 ° c-15 ストアをすることができます 。
5。中古増幅
- ミックス 2.5 μ L 各 RT 製品の 25 μ L の総ボリュームの 6.25 μ L ヌクレアーゼ フリー水、3.75 μ L カスタム Taq プール、2 x Taq マスター ミックスの 12.5 μ L.
- は、次の熱プロファイルに従って熱 cycler を使用して中古増幅反応を実行: 95 ° C、10 分、2 分、2 分、12 サイクル 95 ° C の 15 ° C、72 ° C、55 s、および 4 分の 60 ° C、押し 99.9 ° C 10 分、4 ° C
- は 0.1 X テ, pH 8.0 175 μ L を追加することによって、製品を希釈します
。 注: 希釈は少なくとも 1 週間の 15-20 ° C ~ で店をすることができます 。
6。カスタム Taq アレイ マイクロ Rna カード RT qPCR 反応
- 使用 384 ウェル microfluidicCustom Taq 配列マイクロ Rna カード 8 サンプル 24 特定 miRNAs (重複で発見) の血漿中濃度を同時に測定します。24 の miRNAs の MiRBase id (v21): ミール-101 が 3 p がミール-106 a-5 p、ミール-126 が 3 p は-ミール-133a-3 p は、ミール-140 が 3 p、ミール-140、5 p、ミール-142、3 p、ミール-145 が 5 p はミール-148b-3 p は-ミール-15 b-5 p は、ミール-16 は 5 p、ミール-17 は 5 pミール-197 は 3 p が-ミール-19b-3 p は、ミール-21 は 5 p、ミール-221 が 3 p、ミール-28 が 3 p がミール-30 b-5 p はミール-30 c-5 p はミール 320 a がミール 451 a、ミール-486 は 5 p、ミール-660 は 5 p、およびが-ミール-92 a-3 p
- Taq ユニバーサル マスター ミックス × 2 の 56.25 μ L とヌクレアーゼ フリー水 0.5 mL チューブの 55.69 μ L 希釈のプリアンプのサンプルのミックス 1.13 μ L.
- カスタム Taq アレイ マイクロ Rna カードに最大 8 PCR 反応混合物をロードします 。
- 2 分の 311 × g で遠心します。
- アレイ カード シーラーとカスタム カードをシールします 。
- 反応が続いて、サイクリングのパラメーターの変更リアルタイム PCR システムを使用して、リアルタイムの実行: 94.5 ° C、10 分、30 の 97 ° C の 40 のサイクル 59.7 60 ° C、s、s.
7。データの外挿と比世代
- バック グラウンド信号およびすべての試金およびサンプルの 0.15 の固定しきい値を削除する自動ベースラインを設定、raw の Ct 値を取得する
- ソフトウェアを使用します。貧しい増幅曲線および/または受動的な参照信号とスポットを削除します 。
- で生の Ct 値をエクスポート " .xls " フォーマットし、さらに分析の 2 つの重複の Ct の平均値を使用します 。
- 相関 Mirna ' 臨床研究サンプルの上で歴史的な測定に表現レベル(表 2)。各カスタム作られたマイクロ カードのサンプルの少なくとも 50% は、ピアソンの結果する場合 ' s 相関 < 97.5、繰り返してカード (表 1 の QC2).
- 計算、− すべての Mirna、miRNA 比 log2 値に相当の間 ΔCts です 。
8。署名関連の miRNA による溶血の評価
- 生成次の miRNA 比それぞれカットオフ (log2 値) を用いた短い記憶域血漿検体用 miRNA の溶血関連署名 (1-5 週間で − 80 ° C)。ミール-126/451 < − 0.07、15 b/451 < − 3.67、221/451 < − 3.18、30 b/451 < − 1.1、126/486-5 p < − 0.33、15 b/486-5 p < − 3.86、221/486-5 p < − 3.17、30 b/486-5 p < − 1.42、126/92 a < 1.8、15 b/92 a < − 221/92 a、1.8 < − 1.04 30 b/92 a < 0.87、126/16 < − 15 b/16 2.85 < − 6.33、221/16 < − 5.9、30 b/16 < − 3.68 。
- 比 (8 のうち 16) の少なくとも 50% がそれぞれカットオフを超える溶血のサンプルとして分類 (表 1 の QC3).
9。リスク レベルの定義: 高、中間、および低
図 3 で報告された MSC を構成する miRNA 比- 4 つ定義署名: 病 (RD)、積極的な病 (RAD) の存在の危険性の危険性病気 (PD), と積極的な疾患 (PAD) の存在 。
- 各署名に対して短い記憶域血漿検体のそれぞれのカットオフ値を超える比率を定義 (1-5 週間で − 80 ° C)。超える比肯定的な考慮する必要がある数は RD の PD、27 のうち 9、RAD のパッド ( 図 3 A) 28 のうち 14 。
- 属性各サンプルにそれぞれの MSC リスク レベル次のように: 場合リスクは低く RD neg ∩ PD neg ∩ RAD neg ∩ パッド neg; 中間リスク場合 RD pos ∪ PD pos ∩ RADneg ∩ パッド neg;または高リスク場合 RAD pos ∪ パッド pos ( 図 3 B).
結果
BioMILD 試用版が重い喫煙者個人の大規模コホートで一次スクリーニング検査として組み合わせた例 MSC アプローチの効率のテストを目的とした肺がんの早期発見のための前向き研究。リスクのクラスは 24 プラズマ循環 miRNAs の比率を評価する miRNA のテストに基づいて各ボランティアに起因します。主報告30,31,32溶血は偽の結果は、血液細胞によって miRNAs の非特異的なリリースのため得ることができるので、miRNA を循環の解析の重要な問題です。方法論的ワークフロー提案の事前分析の品質管理は、溶血されましたを識別する (表 1に QC1) をステップし、こうして非解析、血漿サンプルは記述されていた。図 1は、溶血 (図 1A) とそれぞれ A414/A375 値と非溶血されました (図 1B) 血漿検体の吸光光度分析をレポートします。臨床における分子テストの結果、有志管理のため重要なこの QC1 が許可された採血を繰り返すと、ほとんどの場合、サンプルを復元します。
分子処理後 RT qPCR のパフォーマンスを正確に技術的な問題を識別するために評価されるべき。図 2Aは、受動的な参照信号に起因する低性能と Rt-qpcr を示しています。この場合新しいマイクロ カードに事前の増幅産物をリロードすることをお勧めします。図 2Bのように、RT qPCR がうまくカード miRNA の式の値が歴史上の測定と対等であることを確認する最初のポスト分析の品質管理手順に進みます (表 1の QC2)。QC2 ステップが失敗した場合、中古増幅反応、逆のトランスクリプションの間に、技術的な問題が発生したし、逆のトランスクリプションから始まって全体の分子の処理を繰り返しすると便利です。
最後の品質管理手順 (表 1の QC3) 評価分子レベルにおいても溶血。(ミール 16、ミール 451、ミール-486-5 p、およびミール 92 a) 4 の赤血球固有 Mirna の発現レベルを比較した 4 非溶血関連 miRNAs (ミール 126、ミール 15 b、ミール-221、ミール-30 b) のそれらに、miRNA の溶血に関する署名の生成によって構成される、16 (4 x 4) miRNA 比。肯定的なサンプルは、プロトコル セクション 9 および図 3で説明したよう最終的な MSC リスク レベルの分類に否定的なサンプルが進む中、溶血されましたように分類されます。
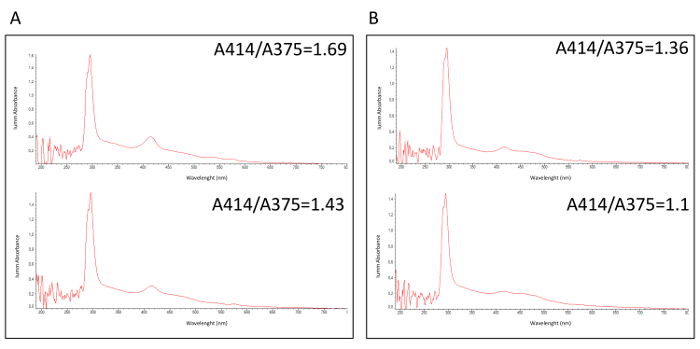
図 1:新鮮血漿試料の吸光光度分析します。溶血されました 2 (A) の吸光光度プロファイルおよび (B) 2 非溶血されました血漿検体、波長 A414 A375 比吸光度を測定します。この図の拡大版を表示するのにはここをクリックしてください。
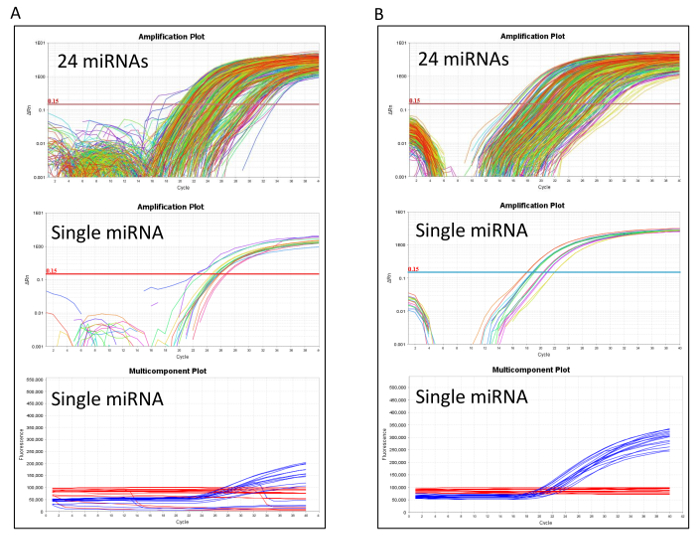
図 2: マイクロ流体 Rt-qpcr パフォーマンス カード解析します。増幅と多成分は、貧困層の比較 (A) と (B) 良い品質マイクロ カードを印刷します。すべての 24 の miRNAs と単一代表 miRNA は、各パネルで報告されます。多成分のプロットは、これらの RT qPCR 反応で発生する受動的な参照信号を示しています。この図の拡大版を表示するのにはここをクリックしてください。
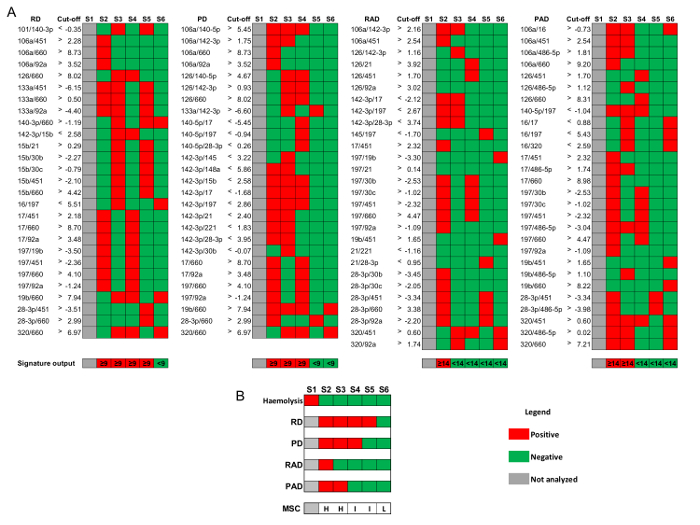
図 3:リスク層別化のための MSC アルゴリズム。ボランティアから 6 の血漿サンプルを考慮した代表的な結果は、スクリーニング試験 BioMILD に在籍。(A) 疾患 (RD)、積極的な病 (RAD) 病 (PD)、積極的な疾患 (PAD) と対応するカットオフ値 (log2)-80 ° c で保存血漿検体の存在の存在の危険性のリスクの miRNA 比の署名少なくとも 1 週間、5 週間まで。(B) 組み合わせ高 (H) で解析可能なサンプルを分類する 4 つの署名の中間 (I) と低 (L) MSC リスク レベル。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
落とし穴と方法論的ワークフローの課題
BioMILD は、診断ツールとして循環の miRNAs の分析最初の前向き研究は、しきい値とカットオフ データ解析のために利用された回顧シリーズから生成されます。血漿検体の異なるストレージの間隔の問題を克服するためにパラメーターが MSC のパフォーマンスの増加の可能性に洗練されたことができます。しかし、Mirna の解析を開始する前に全体的なプロセスのいくつかの側面は、包含の規準、検体の採取、処理など慎重に評価する必要があります、データ解析のバイオインフォマティクス アルゴリズムを採用します。次のセクションは、各単一ステップの主要な問題に対処し、それらを克服する戦略を立案し、本稿で説明したワークフローのほとんどの重要なポイントについて説明します。
調査の人口
スクリーニング試験 BioMILD の登録基準: 50 〜 75 年古い、重い現在または過去 (10 年未満) の喫煙者、少なくとも 30 パック年と 5 年以内にがんのない前の歴史。この人口の推定肺がんの有病率と年間発生率であった約 1% 0.7%。提案プロトコルで説明されているように MSC テストを適用するために分析した人口は、類似した特性を維持しなければなりません。特に、上記 QC2 ステップは同様の母集団から得られた特定の過去のデータとの比較を含みます。97.5 以下の相関関係は、技術的な問題を示すものになる可能性が、その一方で、変更された循環 miRNA レベル肺癌のリスクを反映してほとんどの人が実際にしきい値以下。つまり、ここで報告されたパラメーターと QC2 ステップを肺癌のリスクが高い人口に適用する場合は、許容可能なサンプルを除外すること。新しい、適切な参照パラメーターも、各人口の期待される結果によると分析のために特定を定義する必要があります。
採血し、溶血
生物学的サンプルのコレクションです重要な事前分析ステップ サンプル品質や特性を損なう従って分析の最終結果を変更可能性がありますので血液サンプルについては、新鮮な血液を収集し、試料を可能な限り迅速に処理することが重要です。サンプルは、4 ° C で保存するも凍結・融解の通路は、セル換散 (溶血) および RNA の劣化を引き起こす可能性がありますので、血撤退後冷凍する必要があります。溶血処理を最小限に抑えるためには、血液コレクション31から 2 h でプラズマを分離することをお勧めします。
溶血は赤い血球 (赤血球) の内訳と周囲の環境に自分のコンテンツの結果リリースが主原因です。これは、循環赤血球細胞内コンテンツのリリースが大幅に潜在的プラズマ解析30の精度に影響を与える、血中マイクロ Rna プロファイルを変えるためにのテスト miRNAs の問題かもしれない。
また血漿検体の溶血の最小限のレベルを識別するためにできることは、バイオ マーカーとしての miRNAs の循環に基づく研究にとって重要です。溶血以来 [高度溶血サンプルの赤黄色からプラズマの色の範囲、2 つの遠心分離手順後外観検査によって最初評価できます。しかし、単なる目視検査は、分子バイオ マーカー研究のコンテキストで十分な区別できない場合があります。
溶血血漿サンプルを識別するために簡単な事前分析方法は、吸光光度測定波長 (λ) = 414 主なヘモグロビンのピーク吸光度、干渉の他のソースの適切な調整後の nm。375 で吸光度値に 414 nm ピークを正規化は、そのため、nm、33脂質のコンテンツを示すもの。軽症 independenthemolysis スコア (HS) の組み合わせで、またはより良い、使用される34をすることができます。このオンカラム ベースのプロシージャは、少なくとも 6.1 mg/dL 無料ヘモグロビンを識別できます。それ以外の場合、赤血球固有 Mirna 検出による溶血検体を識別できます。フォルトゥナートらが効率的にできる 16 の miRNAs 比率に基づいて特定の溶血関連シグネチャを識別も溶血の非常に低い割合は、赤血球固有 miRNA レベル32でかなりの増加を引き出すことができる、のでプラズマ サンプル33溶血を分類します。述べられるすべてのアッセイは、吸光度比 414/375 以来の組み合わせで使用されるかもしれないおよび/または溶血関連 Mirna を測定品質管理としてポスト分析フェーズで使用できるに対し、さらにコストを節約予備解析の段階で HS を採用ステップ。
Mirna の分離と RNA の純度を循環
抽出 RNA プロシージャは、以降の解析の成功のための非常に影響力のあるステップです。抽出など、プラズマの低入力サンプルから始まって miRNAs の正確な数量を確保するため可能な限り効率的にする必要があります。プラズマは、多くの蛋白質、核酸、RT qPCR の下流の酵素反応を妨害することができますし、循環 Mirna 検出に影響を与える可能性があります他のコンポーネントなどの高濃度が特徴です。いくつかの抽出方法は、研究のこれらのタイプで使用されているが、一般に、RNA 濃縮のシリカ系有機抽出がプラズマ阻害剤より良いし、TRIzol だけで35の除去をできます。それにもかかわらず、手動で抽出はここ数年で自動抽出による交換済み。汚染、高い再現性および経済の時間使用のマイナーなリスク手動隔離のプロトコルに比べて自動化システムの主な利点であります。また、自動抽出法は、血液サンプル手動プロトコル36と比較して最高の効率から最高のマイクロ Rna 量をもたらした。
正規化の問題
血中 miRNA の正常化はまだ物議を醸す問題です。確かに、サンプルの質や量の違いは、存在や病気、従って曖昧なデータ解釈につながるとの結論を誤解を招くリスクによる Mirna 発現レベルの真の変化の同定と干渉することができます。これまでのところ、コンセンサスの欠如は、様々 な正規化戦略37になりました。
血漿から抽出された総 RNA は通常紫外線吸光光度法または蛍光を用いた吸光光度法などの標準的な数量化のしきい値を下回るこうして RNA 質量標準化38を排除します。その結果、溶出 RNA 量が固定ではなく、固定ボリュームが RT 反応39の入力として選択されます。
組織サンプルで miRNA 解析に使用成績のハウスキーピング、RNU48 と RNU6 のようなには適していない細胞マイクロ Rna 測定を正規化両方ないので常に RNase を介した劣化40のための循環の検出疾患特異的37の自由化もと。すべての循環の miRNAs はコントロールを参照として効果的に使用できるかは明らかです。たとえば、ミール 16 よくハウスキーピング、d の提案します。それはがん患者28,37の血漿検体を自由化は母国の調査は示した。また、ミール 16 レベルは高度溶血30に影響されます。
高スループット試金のためいくつかの Mirna を測定し、平均の式の値に正規化ですが一般に認められた41miRNAs の限られた数は、分析する必要がある場合、この正規化の方法は適用できません。正規化の問題を回避するためにボエリらは以前に 24 の miRNAs28相互比率に基づいてアルゴリズムを確立しました。診断ツールの開発に非常に有用であるにもかかわらず、このようなアプローチは、おそらく腫瘍の開発の役割を持っている、従って機能キャリブレータとして Mirna を識別する Mirna を変更効果的に区別することを容易に許可しません。肺がんの早期発見、血清ミール-テストを開発したビアンキらのグループが採用したもう一つの効果的な戦略は、6"ハウスキーピング血清-Mirna"小さいサンプルの中でさまざまな群の幾何平均を正規化に基づいていたと患者42のクラス。
MiRNA ベース液生検と潜在的なアプリケーションの機能
プラズマ ベースの MSC は、重い喫煙者で肺癌の早期診断の研究分子非侵襲的なテストです。MSC テスト (SE、87%)、高い感性と負の予測値 (NPV、99%) による手法、肺癌発見前に中間またはリスクの高い科目を識別できます。具体的には、MSC を例のスクリーニング手法だけで29の 19.7% から 3.7%、偽陽性を減らすことによって実装できます。MSC テストはまた唯一肺がん患者を考慮したとき良好な予後に示している単独で、または他の臨床病理学的パラメーター43,44との組み合わせで監視ツールとして使用することができます。潜在的に、MSC テストはスクリーニングの費用対効果の減少肺がん診断アルゴリズムの一貫性を向上できます。
MSC のほか早期肺癌発見のための他の非侵襲的なテストが報告されています。ビアンキら。循環のミール テスト 34 miRNA 署名45、に基づいて、13 miRNA 署名42に削減を提案しました。得られた血清サンプル fordiscovery と検証から連続観測の喫煙被験者 (コスモス) 例スクリーニング試験では、欧州機関のオンコロジー (IEO)、ミラノ、イタリア) で実行されます。ミール テストは、リスクの高いボランティアの肺がん検診の 78% の精度を示した。13 血中 Mirna と MSC を構成する 24 の間だけ 5 miRNAs (ミール 92 a、ミール-30 b、ミール-30 c、ミール-148a とミール-140-5 p) の重複だった。異なるタイプのサンプル (プラズマ対血清) を開始し、データの精緻化によるものと考えられます。実際には、ミール - テストは、血清、ハウスキーピングとして振舞っている著者の選択した 6 Mirna を 3 含まれていた MSC miRNA 比 (ミール 15 b、ミール-19b とミール 197) の中でも。それにもかかわらず、プラズマでの MSC とミール実験血清より深く肺癌の検出のため液体生検の miRNA ベースの使用を検証します。
MiRNAs 肺がんバイオ マーカーの同定のためプロファイリングは、喀痰サンプル46にも行われています。喀痰を簡単に収集することができます、それで非常に安定する miRNA の発現レベルが表示されます。ただし、肺がん検診ボランティアは 50-55 歳以上であり、痰になり、入手が困難な COPD などの併存と重い喫煙者であります。確かに、別の体液の中でプラズマとして miRNAs の潜在的な役割を調査するための最良の選択肢の一つです (ただしに限定されない) 肺がんバイオ マーカー。
全体的に、本稿で説明する手順は制限なし (神経系、心血管疾患や糖尿病、癌) から検討した病理学のタイプとの目的で、様々 な疾患のコンテキストに関連することができます。臨床使用 (診断、予後、治療にも反応をバイオ マーカー)。
開示事項
ガブリエラ ・ ソッツィ、マティア ・ ボエリ、羽後 Pastorino は、この資料で明らかに miRNA 署名に関する Gensignia 生命科学へのライセンス 3 つの特許出願の共同発明者です。残りのすべての著者を送信した作業に関連して利益相反宣言しません。
謝辞
パオラ ・ Suatoni、エレナ Bertocchi、ノースカロライナ州ニニ、アナマリア Calanca、著者に感謝し、キアラ バンフィ処理のボランティア試験、行政の援助;クラウディオ ・ Jacomelli とデータ管理のクラウディオ ・ チッテリオ。仕事はがん研究のためにイタリア語協会支えられた [捜査官補助金 GS、および 12162 にアップ、14318 15928 号 (特別プログラム「がんリスク評価と早期診断の革新的なツール」、5 × 1000)];イタリア保健省 [グラント号RF-2010];国立がん研究所 (アメリカ) から UO1 CA166905 を付与します。MB は、財団 Pezcoller 奨学金によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| 1x PBS | Lonza | BE-17-516 | |
| 20xTE Buffer, pH 8.0 | Molecular probe | T11493 | Dilute the 20X stock solution to have the final concentration of 0,1X in Nuclease-free water |
| Nuclease-free water | |||
| Maxwell RSC miRNA Tissue Kit | Promega | AS1460 | The kit contains Homogenization Solution, DNase I, Proteinase K, Lysis Buffer and cartridges. For 1-Thioglycerol, inhalation and contact with skin and eyes should be avoided. Use it under a Fume Cabinet. |
| TaqMan MicroRNA Reverse Transcription Kit | Thermo Fisher | 4366596 | |
| Custom TaqMan RT Primer Pool | Thermo Fisher | 4459649 | |
| TaqMan PreAmp Master Mix 2X | Thermo Fisher | 4391128 | |
| Custom TaqMan PreAmp pool | Thermo Fisher | 4459657 | |
| TaqMan Universal Master Mix II, No UNG 2x | Thermo Fisher | 4440048 | |
| Custom TaqMan Array MicroRNA Cards | Thermo Fisher | 4449137 | Bring the Custom TaqMan Array MicroRNA Cards to room temperature before to load samples |
| Vacutainer Safety-Lock Blood Collection Set | Becton Dickinson | 367286-364815 | |
| Vacutainer plastic spray-coated K2EDTA tube. | Becton Dickinson | 366643 | Lavender BD Hemogard closure |
| Cuvette PS semi-micro | VWR/PBI | 643-0326 | Light path 10 mm |
| NanoDrop 2000c UV-VIS Spectrophotometer | Thermo Fisher | ||
| Cryogenic vials 1.5 ml | Sigma-Aldrich | Z359033 | |
| Centrifuge 5810R | Eppendorf | Bring the centrifuge to 4 °C before starting plasma collection | |
| Heraeus Multifuge 3S+ Centrifuge | Thermo Fisher | D-37520 | |
| Vortex Mixer | Velp Scientifica | F202A0173 | |
| ThermoMixer T- shaker | Euroclone | A00564 | Bring the Thermo Mixer to 37 °C before starting RNA extraction |
| Maxwell RSC Instrument | Promega | AS4500 | |
| GeneAmp PCR System 9700 thermo-cycler | Thermo Fisher | ||
| ViiA 7 Real-Time PCR System | Thermo Fisher | ||
| ViiA 7 RUO software | Thermo Fisher | ||
| Arrey Card Staker/Sealer | Thermo Fisher | 4331770 |
参考文献
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer Statistics, 2017. CA Cancer J Clin. 67 (1), 7-30 (2017).
- Malvezzi, M., et al. European cancer mortality predictions for the year 2017, with focus on lung cancer. Ann Oncol. , 10 (2017).
- Miller, K. D., et al. Cancer treatment and survivorship statistics, 2016. CA Cancer J Clin. 66 (4), 271-289 (2016).
- Kanne, J. P. Screening for lung cancer: what have we learned. AJR Am. J Roentgenol. 202 (3), 530-535 (2014).
- Aberle, D. R., et al. Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med. 365 (5), 395-409 (2011).
- Wender, R., et al. American Cancer Society lung cancer screening guidelines. CA Cancer J Clin. 63 (2), 107-117 (2013).
- Molina-Vila, M. A., et al. Liquid Biopsy in Non-Small Cell Lung Cancer. Front Med (Lausanne). , 69 (2016).
- Sozzi, G., Boeri, M. Potential biomarkers for lung cancer screening. Transl Lung Cancer Res. 3 (3), 139-148 (2014).
- Shepherd, F. A., Douillard, J. Y., Blumenschein, G. R. Immunotherapy for non-small cell lung cancer: novel approaches to improve patient outcome. J Thorac Oncol. 6 (10), 1763-1773 (2011).
- Ajona, D., et al. Investigation of complement activation product c4d as a diagnostic and prognostic biomarker for lung cancer. J Natl Cancer Inst. 105 (18), 1385-1393 (2013).
- Boyle, P., et al. Clinical validation of an autoantibody test for lung cancer. Ann Oncol. 22 (2), 383-389 (2011).
- Hayes, J., Peruzzi, P. P., Lawler, S. MicroRNAs in cancer: biomarkers, functions and therapy. Trends Mol Med. , (2014).
- Croce, C. M. Causes and consequences of microRNA dysregulation in cancer. Nat Rev Genet. 10 (10), 704-714 (2009).
- Iorio, M. V., Croce, C. M. MicroRNA dysregulation in cancer: diagnostics, monitoring and therapeutics. A comprehensive review. EMBO Mol Med. 4 (3), 143-159 (2012).
- Schwarzenbach, H., Nishida, N., Calin, G. A., Pantel, K. Clinical relevance of circulating cell-free microRNAs in cancer. Nat Rev Clin Oncol. 11 (3), 145-156 (2014).
- Mitchell, P. S., et al. Circulating microRNAs as stable blood-based markers for cancer detection. Proc Natl Acad Sci U S A. 105 (30), 10513-10518 (2008).
- Hanke, M., et al. A robust methodology to study urine microRNA as tumor marker: microRNA-126 and microRNA-182 are related to urinary bladder cancer. Urol Oncol. 28 (6), 655-661 (2010).
- Park, N. J., et al. Salivary microRNA: discovery, characterization, and clinical utility for oral cancer detection. Clin Cancer Res. 15 (17), 5473-5477 (2009).
- Boeri, M., Pastorino, U., Sozzi, G. Role of microRNAs in lung cancer: microRNA signatures in cancer prognosis. Cancer J. 18 (3), 268-274 (2012).
- Castoldi, M., et al. A sensitive array for microRNA expression profiling (miChip) based on locked nucleic acids (LNA). RNA. 12 (5), 913-920 (2006).
- Chen, C., et al. Real-time quantification of microRNAs by stem-loop RT-PCR. Nucleic Acids Res. 33 (20), 179 (2005).
- Schulte, J. H., et al. Deep sequencing reveals differential expression of microRNAs in favorable versus unfavorable neuroblastoma. Nucleic Acids Res. 38 (17), 5919-5928 (2010).
- Tiberio, P., Callari, M., Angeloni, V., Daidone, M. G., Appierto, V. Challenges in using circulating miRNAs as cancer biomarkers. Biomed Res Int. , 731479 (2015).
- Boeri, M., et al. Recent advances of microRNA-based molecular diagnostics to reduce false-positive lung cancer imaging. Expert Rev Mol Diagn. 15 (6), 801-813 (2015).
- Benes, V., Castoldi, M. Expression profiling of microRNA using real-time quantitative PCR, how to use it and what is available. Methods. 50 (4), 244-249 (2010).
- Mestdagh, P., et al. Evaluation of quantitative miRNA expression platforms in the microRNA quality control (miRQC) study. Nat Methods. 11 (8), 809-815 (2014).
- Pastorino, U., et al. Early lung-cancer detection with spiral CT and positron emission tomography in heavy smokers: 2-year results. Lancet. 362 (9384), 593-597 (2003).
- Boeri, M., et al. MicroRNA signatures in tissues and plasma predict development and prognosis of computed tomography detected lung cancer. Proc Natl Acad Sci U S A. 108 (9), 3713-3718 (2011).
- Sozzi, G., et al. Clinical Utility of a Plasma-Based miRNA Signature Classifier Within Computed Tomography Lung Cancer Screening: A Correlative MILD Trial Study. J Clin Oncol. 32 (8), 768-773 (2014).
- Pritchard, C. C., et al. Blood cell origin of circulating microRNAs: a cautionary note for cancer biomarker studies. Cancer Prev Res (Phila). 5 (3), 492-497 (2012).
- Kirschner, M. B., et al. Haemolysis during sample preparation alters microRNA content of plasma. PLoS One. 6 (9), 24145 (2011).
- Kirschner, M. B., et al. The Impact of Hemolysis on Cell-Free microRNA Biomarkers. Front Genet. 4 (94), (2013).
- Fortunato, O., et al. Assessment of circulating microRNAs in plasma of lung cancer patients. Molecules. 19 (3), 3038-3054 (2014).
- Appierto, V., et al. A lipemia-independent NanoDrop((R))-based score to identify hemolysis in plasma and serum samples. Bioanalysis. 6 (9), 1215-1226 (2014).
- Kim, D. J., et al. Plasma components affect accuracy of circulating cancer-related microRNA quantitation. J Mol Diagn. 14 (1), 71-80 (2012).
- Kulstein, G., Marienfeld, R., Miltner, E., Wiegand, P. Automation of DNA and miRNA co-extraction for miRNA-based identification of human body fluids and tissues. Electrophoresis. 37 (21), 2742-2750 (2016).
- Schwarzenbach, H., da Silva, A. M., Calin, G., Pantel, K. Data Normalization Strategies for MicroRNA Quantification. Clin Chem. 61 (11), 1333-1342 (2015).
- Schlosser, K., McIntyre, L. A., White, R. J., Stewart, D. J. Customized Internal Reference Controls for Improved Assessment of Circulating MicroRNAs in Disease. PLoS ONE. 10 (5), 0127443 (2015).
- Kroh, E. M., Parkin, R. K., Mitchell, P. S., Tewari, M. Analysis of circulating microRNA biomarkers in plasma and serum using quantitative reverse transcription-PCR (qRT-PCR). Methods. 50 (4), 298-301 (2010).
- Wang, K., et al. Comparing the MicroRNA spectrum between serum and plasma. PLoS One. 7 (7), 41561 (2012).
- Mestdagh, P., et al. A novel and universal method for microRNA RT-qPCR data normalization. Genome Biol. 10 (6), 64 (2009).
- Montani, F., et al. miR-Test: A Blood Test for Lung Cancer Early Detection. J Natl Cancer Inst. 19 (6), 063 (2015).
- Sestini, S., et al. Circulating microRNA signature as liquid-biopsy to monitor lung cancer in low-dose computed tomography screening. Oncotarget. 20 (32), 32868-32877 (2015).
- Verri, C., et al. Mutational Profile from Targeted NGS Predicts Survival in LDCT Screening-Detected Lung Cancers. J Thorac. Oncol. (17), 10 (2017).
- Bianchi, F., et al. A serum circulating miRNA diagnostic test to identify asymptomatic high-risk individuals with early stage lung cancer. EMBO Mol Med. 3 (8), 495-503 (2011).
- Gyoba, J., Shan, S., Roa, W., Bedard, E. L. Diagnosing Lung Cancers through Examination of Micro-RNA Biomarkers in Blood, Plasma, Serum and Sputum: A Review and Summary of Current Literature. Int J Mol Sci. 17 (4), 494 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved