Method Article
MicroRNA baseado biópsia líquida: A experiência de miRNA o Plasma assinatura classificador (MSC) para triagem de câncer de pulmão
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, apresentamos o protocolo detalhado, adoptado no BioMILD triagem julgamento para executar o teste de classificador de assinatura microRNA circulantes para detecção precoce de câncer de pulmão.
Resumo
O desenvolvimento de um teste minimamente invasivo, como biópsia líquida, para detecção precoce de câncer de pulmão em sua fase pré-clínica é crucial para melhorar o resultado desta doença mortal. MicroRNAs (miRNAs) são tecidos específicos, pequeno, regulando a expressão de gene, que pode agir como mensageiros extracelulares de sinais biológicos de RNAs não-codificantes derivado a Cruz-conversa entre o tumor e seu microambiente circundante. Eles, portanto, poderiam representar os candidatos ideais para detecção precoce de câncer de pulmão. Neste trabalho, propõe-se um fluxo de trabalho metodológico para a validação prospectiva de um teste de miRNA circulantes usando cartões personalizados feitos microfluidic e PCR quantitativo em tempo real em amostras de plasma de voluntários matriculados em um julgamento de rastreio do cancro do pulmão. Além disso, desde que a liberação de miRNAs relacionados com hemólise e questões técnicas mais gerais pode afetar a análise, as etapas de controle de qualidade, incluídas nos procedimentos operacionais normalizados também são apresentadas. O protocolo é reprodutível e dá resultados quantitativos confiáveis; no entanto, quando se utiliza grandes séries clínicas, características pré-analíticas e analíticas devem ser cautelosamente avaliadas.
Introdução
Câncer de pulmão é mais comumente diagnosticado cancro em todo o mundo, representando cerca de 25% de todos os diagnósticos de câncer1. Apesar da constante redução na taxa de mortalidade por câncer de pulmão nas últimas 2 décadas, principalmente devido à redução do tabagismo, câncer de pulmão continua a ser a principal causa de morte por cancro em homens e mulheres. Em 2017, prevê-se a conta por cerca de 25% e 20% das mortes totais de câncer nos Estados Unidos e na Europa, respectivamente de1,2.
Uma vez que os sintomas não ocorrem geralmente na doença de início, a maioria dos cânceres de pulmão é diagnosticada em fases finais. Isto leva a uma possibilidade limitada de intervenção terapêutica e a pobre eficácia dos tratamentos3. Portanto, muitos esforços científicos visam identificar um teste efetivo para a detecção precoce de câncer de pulmão.
Uma variedade de testes de rastreio mostra que a radiografia de tórax não tem valor no rastreio do cancro do pulmão, enquanto baixa dose calculada a tomografia computadorizada (LDCT) é uma ferramenta melhor em comparação com a radiografia para a detecção precoce estágio pulmão câncer4. Além disso, demonstrou-se caras com o uso de LDCT reduziram mortalidade por cancro do pulmão até 20% entre os fumantes pesados antigos e atuais5. Estes dados suportam ao uso de despistagem do cancro de pulmão em uma população de alto risco, conforme definido nas orientações por várias sociedades profissionais4,6.
Digno de nota, entre as principais preocupações sobre rastreio LDCT, há a alta taxa de resultados falso-positivos e excesso de diagnóstico. Que sendo assim, a comunidade científica está procurando uma estratégia superar esses problemas e aumentar a especificidade do teste de rastreio de LDCT. O desenvolvimento de biomarcadores complementares não-invasivos pode ser útil aqui. Até o momento, há uma extensa lista de biomarcadores de candidato sob investigação, tais como os miRNAs, DNA sem célula, metilação do gene, pequenas proteínas e outros7.
À base de sangue de biomarcadores, incluindo biomarcadores da resposta imune e circulando os miRNAs, são aqueles que atingem os mais avançados validação fase8. Os biomarcadores da resposta imune são baseados no conhecimento que respostas imunes contra ambos os antígenos intracelulares e superfície do tumor são edificadas em câncer de pulmão pacientes9. Por exemplo, Ajona et al avaliado o papel de C4d, um produto de degradação da via clássica do complemento, no diagnóstico e prognóstico de câncer de pulmão10. Caso contrário, um soro de auto-anticorpos comercialmente disponível teste examinando sete antígenos relacionados ao tumor ter sido validado em pacientes de câncer de pulmão não-pequenas células e mostrou 36% de sensibilidade e 91% de especificidade11. Biomarcadores da resposta imune são interessantes, mas mais estudos de validação são necessários para uma potencial aplicação clínica.
os miRNAs são endógenos pequenas não-codificantes RNAs com um mecanismo conservado e grande significado funcional por todo os reinos animal e vegetal. O papel dos miRNAs é regulamentar a tradução da proteína: eles reprimir a expressão de um grande conjunto de genes alvo12. Tem sido bem documentado que a expressão das alterações ofmiRNAs contribuir para a patogênese do câncer humano mais12,13,14. Além disso, tanto o tumor e as células do estroma liberam miRNAs, estabilizados por sua incorporação em microvesicles ou através da Associação de proteínas RNA-obrigatórias, em fluidos corporais como soro e plasma15,16, urina17 e saliva18. Circular miRNAs pode refletir, portanto, a resposta do hospedeiro e a interacção dinâmica entre o tumor e seu microambiente19. Tomados em conjunto estas observações fizeram miRNAs circulando uma promissora classe de biomarcadores para a detecção de câncer humano.
Circulam os miRNAs pode ser detectado usando métodos diferentes: microarray plataformas20, quantitativos reversa transcrição PCR (RT-qPCR)21e na próxima geração (NGS) de sequenciamento14,22. Vários estudos de perfil de expressão baseados nas tecnologias acima mencionadas foram desenvolvidos nos últimos anos. Microarray é uma tecnologia de alto rendimento, capaz de analisar até milhares de miRNAs em um único ensaio. No entanto, tem menor alcance dinâmico e especificidade em relação ao RT-qPCR ou NGS. Além disso, microarray é um método não-quantitativo, portanto mais validação experimental é necessária. Métodos baseados em sequência podem permitir a identificação dos miRNAs desconhecidos e adequam-se especialmente em uma fase de descoberta. Por outro lado, métodos NGS ainda são caros e requerem equipamento especial e especialista em bioinformaticians, limitando assim a sua utilização em coortes de validação grandes e em ambientes clínicos23. No momento, RT-qPCR é a plataforma mais adotada para miRNA deteção em um contexto clínico/diagnóstico24de circulação. Existem diferentes tecnologias de RT-qPCR disponíveis para análise de miRNAs, mas o Hairpin loop RT seguido por TaqMan PCR é o mais amplamente utilizado,25. Esta técnica é extremamente sensível e exata (simples discriminação de nucleotídeos) e tem uma alta gama dinâmica; no entanto, permite a detecção de miRNAs conhecidas apenas.
O controle de qualidade do microRNA estudo (estudo miRQC) por Mestdagh et al . investigaram as características de algumas plataformas disponíveis comercialmente para miRNAs de perfil baseado em três tecnologias referidas26extensivamente. Analisando o 196 miRNAs em tecidos e amostras de soro, o desempenho de diferentes plataformas foi avaliado em termos de reprodutibilidade, sensibilidade, precisão, especificidade e concordância de expressão diferencial. Os resultados mostraram que plataformas com base em NGS e tecnologias de microarray tinham uma maior reprodutibilidade e especificidade, mas RT-qPCR plataformas foram mais precisos, sensíveis e tinham uma maior taxa de detecção, especialmente para amostras de RNA entradas baixas, como corpo fluidos. Assim, RT-qPCR parece ser o método mais adequado para uma aplicação potencial no diagnóstico clínico rotineiro.
Em 2011, Sozzi et al analisaram o perfil de miRNA de amostras do plasma coletadas de voluntários matriculados em um primeiro LDCT screeningtrial (julgamento de INT-IEO)27 e quatro assinaturas de miRNA compostas por relações recíprocas entre 24 circulando miRNAs foram gerados. Essas assinaturas foram capazes de discriminar indivíduos livres de doença, de pacientes com qualquer ou letal de câncer de pulmão, o tempo ou até 2 anos antes de deteção de doença LDCT28. Em um papel ainda mais, o mesmo grupo que descreveu pela primeira vez o classificador de assinatura de miRNA (MSC), obtido através da combinação de quatro assinaturas miRNA para estratificar os pacientes em três níveis de risco: alto, intermediário e baixo. Sua utilidade clínica foi validada em um grande conjunto de retrospectivo de mais de 1.000 indivíduos matriculados no julgamento de rastreio suave, um estudo randomizado comparando anuais ou bienais braços LDCT com uma observação braço29. Com efeito, a combinação de MSC e LDCT reduziu a taxa de falso-positivo LDCT por aproximadamente 5 vezes e foram os três grupos de risco MSCassociado a sobrevivência global.
Mais tarde, em 2013 no "Fondazione IRCCS Istituto Nazionale dei Tumori" (Milão, la) uma prospectiva triagem trial (BioMILD) implementação LDCT com o plasma teste baseado do MSC foi lançado. Voluntários inscritos no julgamento de BioMILD submeter-se a retirada LDCT e sangue é processada imediatamente para separar o plasma para miRNA usando cartões personalizados microfluidic feito de criação de perfil. A combinação dos resultados LDCT e MSC define o específico algoritmo24de triagem.
No presente trabalho, é descrito o protocolo metodológico todo usado no julgamento de BioMILD, partir de coleta de amostra de sangue, para isolamento de plasma, extração de RNA, e a expressão de 24 miRNAs perfis usando personalizado feito RT-qPCR microfluidic cartões. Dada a alta consistência e reprodutibilidade, estes procedimentos também podem ser usados para o desenvolvimento de biópsias líquidos miRNA-baseado em outras doenças.
Protocolo
o protocolo foi aprovado pelo Comitê de ética de pesquisa da nossa instituição.
1. coleta de amostra de plasma
- coletar 10 mL de sangue total amostra em tubos Vacutainer com pulverizador-revestido K 2 EDTA e armazenar à temperatura ambiente.
Nota: Para minimizar a hemólise, separar o plasma dentro de 2h. Não guarde o sangue total em baixa temperatura (ou seja, 4 ° C) para evitar o choque térmico e lise que levam a uma liberação de miRNA inespecíficos da pilha. - Dentro de 1 h, separar o plasma por uma primeira etapa de centrifugação em 1.258 x g e 4 ° C durante 10 min.
- Transferir o plasma sobrenadante para um tubo de 15 mL, com cuidado, evitando contato com o anel linfocítico.
- Centrifugação do plasma uma segunda vez a 1.258 x g e 4 ° C durante 10 min.
- Alíquota 1 mL de plasma em cryovials de 1,5 mL, evitando coletar a fração de plasma na base do tubo.
- Armazenar todas as alíquotas em − 80 ° C, exceto para a avaliação da hemólise. A análise molecular deve ser realizada dentro de 5 semanas.
2. Avaliação de hemólise por medição espectrofotométrica
- imediatamente após a etapa de separação do plasma, em uma cubeta por espectrofotometria, fazer um 01:10 diluição da amostra plasma em 1X PBS (por exemplo, 100 µ l de plasma em 900 µ l de 1 X PBS) e misture para homogeneizar a la
Nota: A amostra de plasma deve não ser congelada antes das medições espectrofotométricas, como o congelamento-descongelamento da amostra (e nomeadamente nas amostras lipémicas), poderiam formar Flocula que interferem com a análise espectrofotométrica. - Ler a absorvância a 375 nm, 414 nm, 541 nm e 576 nm, utilizando um espectrofotômetro UV-Vis, com uma correção de base fixou-se em 750 nm e um comprimento de caminho de 10 mm. executam uma medição em branco usando 1 mL de 1X PBS.
- Calcular a relação entre a absorvância a 414 nm e 375 nm; se superior a 1,4, considere o exemplo hemolizado e repetir a retirada de sangue (QC1 na tabela 1).
3. Extração do RNA Total de plasma
- Prepare uma solução de 1-Thioglycerol/homogeneização (OMG) com 20 µ l de 1-Thioglycerol / mL de solução de homogeneização. Desde 1-Thioglycerol é viscoso, pipete cuidadosamente para medições precisas. Esfriar a solução OMG no gelo ou 2-10 ° c antes de usá-lo
Nota: A solução é estável a 2-10 ° C para 1 mês. - Suspender o liofilizado DNase eu adicionando 275 µ l de nuclease livre dentro do frasco de água e misture suavemente (não o vórtice de fazer). Como uma ajuda visual, adicionar 5 µ l de azul tintura para o reconstituído DNase eu e dispense a solução em alíquotas de uso único em tubos de nuclease-livre. Armazenar leite reconstituído DNase eu a-30 ° C de -10 ° C.
- a partir de 200 µ l de plasma, adicionar 200 µ l da solução de refrigerados OMG.
- Vortex 15-30 s para garantir uma homogeneização completa. Caso de formação de espuma, deixar a amostra a resolver na Ice.
- Adicionar 200 µ l de tampão de Lise e 25 µ l de Proteinase K para a amostra homogeneizada e vórtex por 20 s.
- Incubar as amostras por 15 min em um thermomixer pré-aquecida a 37 ° C.
- Carregar um cartucho para cada amostra na bandeja do convés do instrumento e coloque a ponteira na posição correta.
- Transferir o lisado para a posição apropriada no cartucho instrumento.
- Adicionar 5 µ l de DNase solução para a posição apropriada no cartucho.
- Adicionar 60 µ l de água livre de nuclease, para a base de cada tubo de eluição.
- Selecione o " miRNA RSC tecido " método e começar a purificação automatizada executada. As amostras de RNA totais podem ser armazenadas em − 80 ° C.
4. Baseado em Taq RT
- usar o Pool de Primer Taq RT com os miRNAs de interesse para converter o RNA em cDNA com o Kit de transcrição reversa Taq MicroRNA.
- Preparar 12 µ l da mistura de reação de RT no gelo em um tubo de microcentrifugadora de 1,5 mL de acordo com as instruções do kit, usando 6 µ l da Taq personalizado RT Primer piscina.
- Adicionar 3 µ l de RNA para um volume final de 15 µ l de total e incubar no gelo por 5 min.
- Carregar a reação de RT em um thermo-cycler configurado da seguinte forma: 16 ° C por 30 min, 42 ° C por 30 min, 85 ° C por 5 min e espera a 4 ° C.
Nota: O cDNA pode ser loja-15 a-20 ° C durante pelo menos uma semana.
5. Pré-amplificação
- Mix 2,5 µ l de cada produto RT com 12,5 µ l de Taq Master Mix 2x, 3,75 µ l Taq personalizado piscina e 6,25 µ l nuclease água livre, para um volume total de 25 µ l.
- Realizar a reação de Pre-amplificação utilizando um thermo-reciclador de acordo com o seguinte perfil térmico: 95 ° C por 10 min, a 55 ° C por 2 min, 72 ° C por 2 min, 12 ciclos de 95 ° C por 15 s e 60 ° C por 4 min , em seguida, mantenha a 99,9 ° C por 10 min e em 4 ° C.
- Diluir o produto adicionando µ l 175 de 0.1 X et, pH 8.0.
Nota: O produto diluído pode ser loja-15 a-20 ° C durante pelo menos uma semana.
6. Reação de RT-qPCR em Custom Taq matriz MicroRNA cartões
- uso o 384-bem microfluidicCustom Taq matriz MicroRNA cartão para medir os níveis plasmáticos dos 24 miRNAs específicos (manchados em duplicado) em 8 amostras simultaneamente. MiRBase ID (v21) para os 24 miRNAs são: tem-miR-101-3 p, p tem-miR-106a - 5p, tem-miR-126-3, tem-miR-133a - 3P, tem-miR-140-3 p, tem-miR-140-5 p, p tem-miR-142-3, tem-miR-145-5 p, tem-miR-148b - 3P, p tem-miR-15b - 5p, tem-miR-16-5, tem-miR-17-5 p, tem-miR-197-3 p, p tem-miR-19b - 3P, tem-miR-21-5, tem-miR-221-3 p, tem-miR-28-3-p, tem-miR-30b - 5p, tem-miR - 30c - 5p, tem-miR-320a, tem-miR-451a, tem-miR-486-5 p, tem-miR-660-5 p e tem-miR-92a - 3 p.
- Mix 1.13 µ l da amostra diluída PreAmp com 56.25 µ l de 2 X Taq Universal Master Mix e 55.69 µ l de água livre de nuclease em um tubo de 0,5 mL.
- Carregar até 8 mistura de reação de PCR nos cartões personalizados Taq matriz MicroRNA.
- Centrifugar a 311 x g por 2 min.
- Selar a placa personalizada com o aferidor do cartão matriz.
- Executar o tempo real reação usando um sistema de PCR em tempo real modificando os parâmetros de ciclismo como seguido: 94,5 ° C por 10 min, 40 ciclos de 97 ° C por 30 s e 59,7 ° C por 60 s.
7. Extrapolação de dados e geração de rácios
- uso do software para obter valores de Ct crus, definindo uma linha de base automática para remover os sinais de fundo e um limite fixo de 0,15 para todos os ensaios e amostras. Remover manchas com curvas de amplificação pobre e/ou sinais de referência passiva pobres.
- Exportar crus valores de Ct em ". xls " Formatar e usar o valor Ct dizer as duas duplicatas para posterior análise.
- Os miRNAs correlacionam ' níveis de expressão de histórico das medições de amostras do estudo clínico (Tabela 2). Se pelo menos 50% das amostras em cada cartão personalizado feito microfluidic resultar em um Pearson ' correlação s < 97,5, repita o cartão (QC2 na tabela 1).
- Calcular o − ΔCts entre todos os miRNAs, equivalentes aos valores dos rácios miRNA log2.
8. Avaliação de hemólise pelo miRNA relacionada assinatura
- gerar a assinatura de miRNA hemólise relacionados usando os seguintes rácios de miRNA com respectivos cortes (valores log2) para amostras de plasma de armazenamento curto (1-5 semanas em − 80 ° C): miR-126/451 < − 0.07, 15b/451 < − 3,67, 221/451 < − 3.18, 30b/451 < − 1.1, 126/486-5p < − 0,33, 15b/486-5 p < − 3.86, 221/486-5 p < − 3,17, 30b/486-5 p < − 1,42, 126/92a < 1.8, 15B/92a < − 1.8, 221/92a < − 1.04, 30b/92a < 0,87, 126/16 < − 2,85, 15b/16 < − 6,33, 221/16 < − 5.9, 30b/16 < − 3,68.
- Classificar como amostras hemolisadas, onde pelo menos 50% dos rácios (8 de 16) ultrapassar o respectivo limite (QC3 na tabela 1).
9. Definição do nível de risco: alto, intermediário e baixo
- definir quatro assinaturas dos rácios de miRNA compondo o MSC, conforme relatado na Figura 3: risco de doença (RD), risco de doença agressiva (RAD), presença de doença (PD) e presença de doença agressiva (PAD).
- Para cada assinatura, definir os rácios que exceda o valor de corte respectivos para amostras de plasma de armazenamento curto (1-5 semanas em − 80 ° C). O número de relações superiores necessários para ser considerado positivo é 9 de 27 para RD e PD e 14 de 28 para RAD e PAD ( Figura 3).
- Atributo para cada amostra, como segue o respectivo nível de risco MSC: baixo risco se RD neg ∩ PD neg ∩ RAD neg ∩ PAD neg; risco intermediário se RD pos ∪ PD pos ∩ RAD neg ∩ PAD neg; ou de alto risco se RAD pos ∪ PAD pos ( Figura 3 B).
Resultados
O julgamento de BioMILD é um estudo prospectivo para detecção precoce de câncer de pulmão com o objetivo de testar a eficiência de uma abordagem combinada de LDCT-MSC como testes de rastreio de primeira linha em uma grande coorte de indivíduos de fumante. Uma classe de risco é atribuída a cada voluntário com base o teste de miRNA, que avalia os rácios entre 24 miRNAs circulantes do plasma. Como amplamente relatado30,31,32, hemólise é uma questão crítica para a análise de miRNA, que circula desde resultados falsos podem ser obtidos devido a uma liberação não específica de miRNAs pelos glóbulos. O fluxo de trabalho metodológico proposto, um controle de qualidade pré-analítico passo (QC1 na tabela 1) para identificar hemolizado, e, portanto, não-analisáveis, amostras de plasma foi descrito. Figura 1 relata uma análise espectrofotométrica de hemolisadas (Figura 1A) e não-hemolizado amostras de plasma (Figura 1B) com os respectivos valores de A414/A375. Em um contexto clínico foram o resultado de um teste molecular é crucial para a gestão de voluntário, este QC1 permite repetir a recolha de amostras de sangue e, na maioria dos casos, restaurando a amostra.
Após o processamento molecular, o RT-qPCR desempenho deve ser avaliado com precisão para identificar quaisquer problemas técnicos. Figura 2 A mostra um RT-qPCR com um baixo desempenho devido a um sinal de referência passiva pobre. Neste caso recarregar o produto pré-amplificação para um novo cartão microfluídicos é recomendado. Quando o RT-qPCR executa bem, como ilustrado na Figura 2B, o cartão continua para a primeira etapa de controle de qualidade analítica de post para garantir que os valores de expressão de miRNA são comparáveis com a medição histórica (QC2 na tabela 1). Se a etapa de QC2 falhar, pode ter ocorrido um problema técnico, durante a transcrição reversa ou nas reações pré-amplificação, e é conveniente repetir o todo processamento molecular a partir de transcrição reversa.
A última etapa de controle de qualidade (QC3 na tabela 1) avalia a hemólise também a nível molecular. Níveis de expressão de 4 miRNAs específicos de eritrócitos (mir-16, 451-mir, mir-486-5 p e mir-92a) foram comparados aos de 4 não-hemólise relacionados miRNAs (mir-126, mir-15b, mir-221 e mir-30b), gerando a assinatura de miRNA relacionados com hemólise composta pelo 16 (4x4) miRNA rácios. Amostras positivas são classificadas como hemolizado, enquanto amostras negativas para a classificação de nível de risco final MSC seguir o procedimento descrito na seção de protocolo 9 e Figura 3.
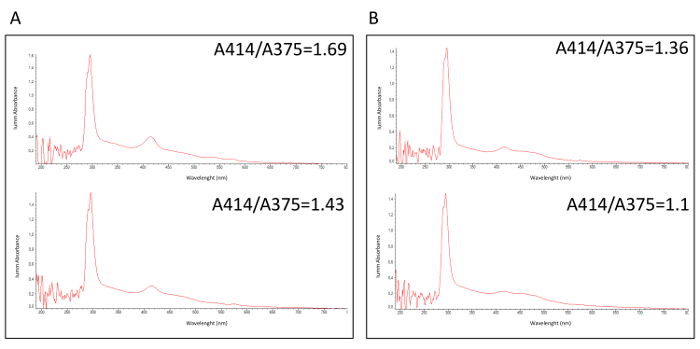
Figura 1: Análise espectrofotométrica de amostras de plasma fresco. Espectrofotométricos perfis do (A) 2 hemolizado e amostras de plasma não hemolizado 2 (B), medir a proporção de absorbância entre A414 e A375 comprimentos de onda. Clique aqui para ver uma versão maior desta figura.
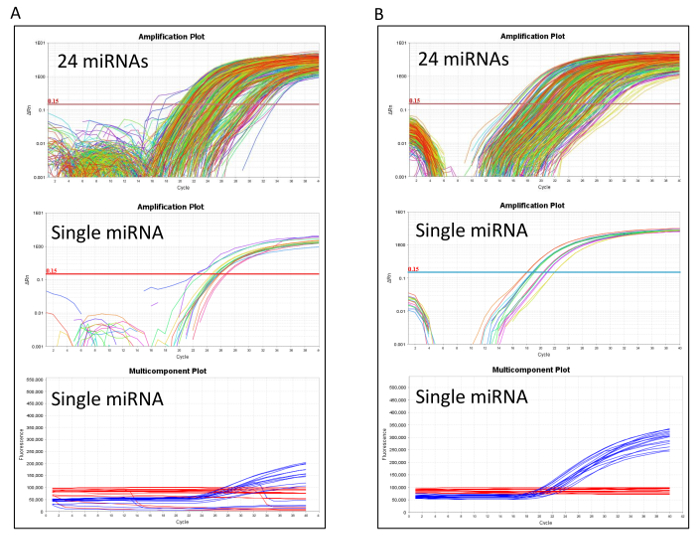
Figura 2 : RT-qPCR desempenho em microfluidic cartões análise. Amplificação e multicomponente parcelas pobres comparando (A) e (B) cartões de microfluidic de boa qualidade. Todos os 24 miRNAs e um único miRNA exemplificando são relatados em cada painel. As parcelas multicomponentes ilustram os sinais de referência passiva ocorrendo nessas reacções RT-qPCR. Clique aqui para ver uma versão maior desta figura.
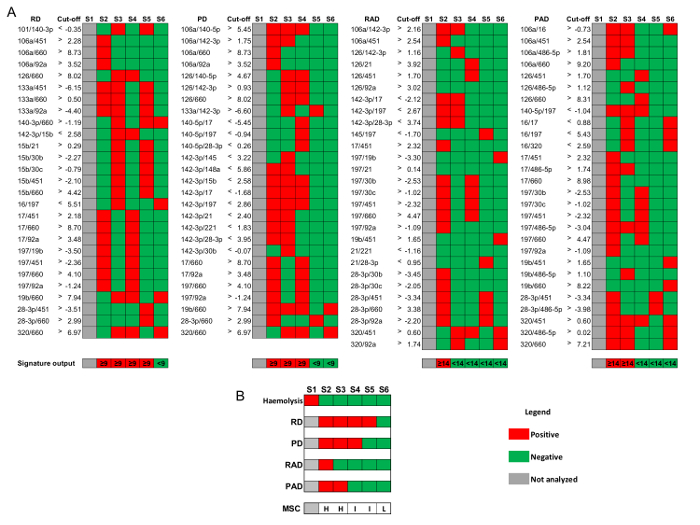
Figura 3: Algoritmo MSC para estratificação de risco. Resultados representativos considerando 6 amostras de plasma de voluntários matriculados em BioMILD julgamento de triagem. (A) assinaturas dos miRNA-rácios de risco de doença (RD), risco de doença agressiva (RAD), presença de doença (PD), presença de doença agressiva (PAD) e os correspondentes valores de interrupção (log2) para amostras de plasma armazenados a-80 ° C para a pelo menos 1 semana e até 5 semanas. (B) combinação de quatro assinaturas para estratificar amostras analisáveis em alta (H), intermediário (I), baixo (L) MSC risco e nível. Clique aqui para ver uma versão maior desta figura.
Discussão
Armadilhas e desafios metodológicos fluxo de trabalho
Como BioMILD é o primeiro estudo prospectivo, analisando os miRNAs circulantes como uma ferramenta de diagnóstico, limiares e cortes utilizados para análise de dados foram gerados da série retrospectiva. A fim de superar a questão do intervalo diferente de armazenamento de amostras de plasma, os parâmetros podem ser refinados, possivelmente, obter um aumento de desempenho do MSC. No entanto, antes de iniciar a análise de miRNAs, vários aspectos do processo geral precisam ser cuidadosamente avaliadas, tais como os critérios de inclusão, a coleta e processamento, e o algoritmo de Bioinformática adotado para análise de dados. As seções a seguir irão focar os pontos mais críticos de fluxo de trabalho descrito no presente documento, abordando os principais aspectos de cada passo a passo e em seguida, propor estratégias para superá-los.
População de estudo
Critérios de inscrição para o BioMILD julgamento de rastreio são: 50-75 anos velhos, pesados atuais ou antigos (menos de 10 anos) fumantes pelo menos 30 anos-maço e sem história prévia de câncer dentro de 5 anos. Nessa população, a prevalência de câncer de pulmão estimado e incidência por ano foram cerca de 1% e 0,7%, respectivamente. Para aplicar o teste de Mestrado conforme descrito no protocolo proposto, a população analisada deve manter características semelhantes. Em particular, o QC2 passo descrito acima envolve a comparação com os dado dados históricos obtidos de uma população semelhante. Enquanto uma correlação abaixo 97,5 pode ser indicativa de problemas técnicos, por outro lado, a maioria dos indivíduos com níveis alterados de miRNA circulantes, refletindo o risco de ter câncer de pulmão são na verdade abaixo desse limite. Em outras palavras, se a etapa de QC2 com os parâmetros relatados aqui é aplicada a uma população em maior risco de desenvolver câncer de pulmão, pode excluir amostras aceitáveis. Parâmetros de referência adequada, Nova então deveriam ser definidos que são específicos para cada população analisada de acordo com os resultados esperados.
Hemólise e coleta de sangue
A coleta de amostras biológicas é um passo crucial pré-analítico, uma vez que pode prejudicar as características e qualidade da amostra e assim, modificar os resultados finais das análises. Em relação as amostras de sangue, é importante coletar sangue fresco e processar o espécime tão rapidamente quanto possível. Amostras não devem ser armazenadas a 4 ° C nem congeladas após retirada de sangue, já que a congelação e descongelação passagens podem induzir lise celular (hemólise) e degradação de RNA. Para minimizar o processo de hemólise, sugere-se para separar o plasma dentro de 2h do sangue coleção31 .
Hemólise é em grande parte devido ao esgotamento das células vermelhas do sangue (hemácias) e a consequente liberação de seu conteúdo no ambiente circundante. Isto pode ser um problema para circulação miRNAs testes porque liberação de hemácias conteúdo intracelular altera dramaticamente o perfil de microRNA no sangue, potencialmente afetando a precisão de análise baseada em plasma30.
Ser capaz de identificar também os níveis mínimos de hemólise em amostras de plasma é fundamental para estudos baseados em miRNAs como biomarcadores de circulação. Hemólise inicialmente pode ser avaliado por inspeção visual, desde após as duas etapas de centrifugação, que a cor do plasma pode variar de amarelo para vermelho para amostras muito hemolisadas. No entanto, mera inspeção visual pode não ser suficientemente sensível no contexto da investigação de biomarcador molecular.
Um método simples para identificar amostras hemolisadas plasma pré-analítico é a medição espectrofotométrica em comprimento de onda (λ) = 414 nm da absorvância da oxihemoglobina principal pico, após o ajuste apropriado para qualquer outra fonte de interferência. Por esse motivo, nós normalizado o pico de 414 nm para o valor de absorvância a 375 nm, indicativo do conteúdo lipídico33. Como alternativa, ou melhor, em combinação, uma lipemia-independenthemolysis marcar (HS) podem ser usados34. Este procedimento baseado em espectrofotometria pode identificar pelo menos 6,1 mg/dL de hemoglobina livre. Caso contrário, as amostras hemolisadas podem ser identificadas através da detecção de miRNAs específicos de eritrócitos. Pois nem uma muito baixa percentagem de hemólise pode provocar um aumento considerável de níveis específicos de eritrócitos miRNA32, et al . Fortunato identificado uma assinatura específica de hemólise relacionados com base em 16 miRNAs-rácios que podem eficientemente classifica a hemólise em amostras de plasma33. Todos os ensaios mencionados podem ser utilizados em combinação desde o rácio de absorvância 414/375 e/ou os HS são adotados em uma fase pré-analítica, economizando custos adicionais, Considerando que os miRNAs relacionados com hemólise de medição pode ser usado em uma fase pós-analítica como um controle de qualidade passo.
Circulam os miRNAs isolamento e pureza de RNA
A extração de procedimento de RNA é um passo muito influente para o sucesso das análises subsequentes. A partir de uma amostra de entrada baixa, tais como plasma, extração precisa ser tão eficiente quanto possível garantir uma quantificação exata dos miRNAs. Plasma é caracterizada por altas concentrações de muitas proteínas, incluindo nucleases e outros componentes que podem interferir com a jusante reações enzimáticas de RT-qPCR e poderiam afetar a deteção de miRNAs circulando. Vários métodos de extração têm sido utilizados nestes tipos de estudos, mas em geral, extração orgânica, seguida pelo enriquecimento de RNA baseada em sílica permite a remoção de inibidores de plasma melhores então TRIzol sozinho35. No entanto, nos últimos anos, extração manual foi substituída por extração automatizada. O menor risco de contaminação, a maior reprodutibilidade e o uso do tempo econômico são as principais vantagens dos sistemas automatizados, em comparação com protocolos de isolamento manual. Além disso, métodos de extração automatizada renderam as maiores quantidades de miRNA de amostras de sangue e a eficiência a mais elevada em comparação com protocolos manual36.
Questão de normalização
Normalização dos níveis de plasma miRNA ainda é uma questão controversa. De fato, diferenças na qualidade de amostra ou quantidade podem interferir com a identificação das verdadeiras mudanças nos níveis de expressão de miRNAs causadas pela presença ou risco de doenças e assim levando a interpretações de dados ambíguos e enganosa conclusões. Até agora, a falta de consenso resultou em várias estratégias de normalização37.
RNA total extraído de amostras de plasma geralmente é inferior ao limiar dos métodos de quantificação padrão tais como a espectrofotometria UV ou espectrofotometria de fluorescência, impedindo assim o RNA padronização em massa38. Consequentemente, um volume fixo, em vez de uma quantia fixa de RNA eluted deve ser escolhida como entrada para a reação de RT39.
Limpeza transcrições usadas para análise de miRNA em amostras de tecido, como RNU48 e RNU6, não são adequados para normalizar miRNA extracelular medições, como os dois nem sempre são detectáveis em circulação, devido à degradação mediada por RNase40, e também são desregulamentado em uma forma específica da doença37. Não está claro se qualquer circulação miRNAs efetivamente poderiam ser usados como controles de referência. Por exemplo, miR-16 é frequentemente sugerido para tarefas domésticas, mas ddiferentes estudos têm demonstrado que isso é desregulamentado em amostras de plasma de pacientes de câncer28,37. Além disso, miR-16 níveis são altamente afetados por hemólise30.
Enquanto para os ensaios do elevado-throughput medir vários miRNAs e normalizando no valor médio de expressão é geralmente aceites,41, quando um número limitado de miRNAs precisa ser analisado, esta abordagem de normalização não pode ser aplicada. A fim de contornar a questão da normalização, et al . Boeri anteriormente estabelecido um algoritmo baseado em relações recíprocas entre 24 miRNAs28. Esta abordagem, apesar de ser muito útil para o desenvolvimento da ferramenta diagnóstica, não permite facilmente distinguir efetivamente alterado miRNAs que possivelmente tendo um papel no desenvolvimento do tumor e, portanto, identificar os miRNAs como calibradores de funcionamento. Outra estratégia eficaz, adoptada pelo grupo de Bianchi et al . que desenvolveu um soro miR-teste para detecção precoce do câncer de pulmão, baseou-se na normalização sobre a média geométrica de um grupo de 6 "limpeza soro-miRNAs" variando menos entre amostras e classes de pacientes42.
Características de miRNA-based biópsia líquida e potencial aplicação
MSC baseadas em plasma é um teste não-invasivo molecular estudado para diagnóstico precoce de câncer de pulmão em fumantes pesados. O teste MSC pode identificar assuntos intermediários ou de alto risco antes da detecção de câncer de pulmão por LDCT, com alta sensibilidade (SE, 87%) e valor preditivo negativo (NPV, 99%). Especificamente, MSC poderia implementar triagem LDCT através da redução de resultados falso-positivos para 3,7%, de 19,7% para LDCT sozinho29. O ensaio MSC também mostrou ter um desempenho bom prognóstico, quando se considera o único pulmão pacientes com câncer e poderia ser usado como uma ferramenta de monitoramento, sozinho ou em combinação com outros parâmetros clínicos patológicos43,44. Potencialmente, o teste MSC poderia permitir maior consistência de algoritmos diagnóstico com câncer de pulmão, diminuindo assim a análise custo-eficácia.
Além de MSC, registaram-se outros testes não-invasivos para detecção precoce de câncer de pulmão. Bianchi et al. propõe-se uma circulação miR-teste com base em uma assinatura de 34-miRNA45e, em seguida, reduzido para uma assinatura de 13 miRNA42. Obtiveram-se fordiscovery de amostras de soro e validação de contínua observação de fumadores sujeitos (COSMOS) LDCT triagem julgamento, realizado em instituição europeia de Oncologia (IEO, Milão, Itália). O miR-teste mostra que 78% de precisão para detecção de câncer de pulmão em voluntários de alto risco. Entre os soro-13 miRNAs e os 24 compondo o MSC, apenas 5 miRNAs foram sobrepostas (miR-92a, miR-30b, miR - 30c, miR-148a e miR-140-5 p). Isto pode ser devido ao tipo de diferentes a partir de amostras (soro vs plasma) e a elaboração de dados. Na verdade, para o miR-teste, os autores selecionados 6 miRNAs comportando-se como serviço de limpeza no soro, 3 dos quais foram incluídos também entre os rácios de miRNA MSC (miR-15b, miR-19b e miR-197). Não obstante, o MSC no plasma e o miR-teste em amostras de soro mais profundamente validam o uso de biópsia líquida baseada em miRNA para detecção do câncer de pulmão.
Os MiRNAs profiling para a identificação de biomarcadores de câncer de pulmão foi realizado também em amostras de escarro46. Escarro pode ser facilmente coletado e os níveis de expressão de miRNA parecem ser extremamente estável nele. No entanto, voluntários de rastreio de câncer de pulmão são mais de 50-55 anos e fumantes pesados com co-morbidades como a DPOC, tornando assim difícil a obtenção de escarro. Com efeito, entre os diferentes fluidos do corpo, plasma é uma das melhores alternativas para investigar o papel potencial dos miRNAs como (mas não limitado a) biomarcadores de câncer de pulmão.
No geral, o procedimento descrito no presente documento pode ser relevante no contexto de várias doenças, com nenhuma restrição no tipo da patologia investigada (de cancro, a diabetes e doenças cardiovasculares ou sistema nervoso) e no propósito de uso clínico (um biomarcador para diagnóstico, prognóstico ou mesmo resposta ao tratamento).
Divulgações
Gabriella Sozzi, Mattia Boeri e Ugo Pastorino são co-inventores de três pedidos de patente licenciados para Gensignia Ciências da vida, sobre a assinatura de miRNA divulgada neste artigo. Todos os restantes autores declaram sem conflitos de interesse em relação aos trabalhos apresentados.
Agradecimentos
Os autores Obrigado Paola Suatoni, Elena Bertocchi, Carolina Ninni, Annamaria Calanca, e Chiara Banfi para manipulação de voluntários nos ensaios e de assistência administrativa; e Claudio Jacomelli e Claudio Citterio para gerenciamento de dados. O trabalho foi apoiado pela Associação italiana para pesquisa do câncer [investigador bolsas n º 15928 para cima, 14318 GS, e 12162 (programa especial "Ferramentas inovadoras para avaliação de risco de câncer e o diagnóstico precoce", 5 x 1000)]; o Ministério da saúde italiano [Grant não. RF-2010]; Grant UO1 CA166905 do Instituto Nacional do câncer (EUA). MB foi apoiado por uma bolsa de Pezcoller Fondazione.
Materiais
| Name | Company | Catalog Number | Comments |
| 1x PBS | Lonza | BE-17-516 | |
| 20xTE Buffer, pH 8.0 | Molecular probe | T11493 | Dilute the 20X stock solution to have the final concentration of 0,1X in Nuclease-free water |
| Nuclease-free water | |||
| Maxwell RSC miRNA Tissue Kit | Promega | AS1460 | The kit contains Homogenization Solution, DNase I, Proteinase K, Lysis Buffer and cartridges. For 1-Thioglycerol, inhalation and contact with skin and eyes should be avoided. Use it under a Fume Cabinet. |
| TaqMan MicroRNA Reverse Transcription Kit | Thermo Fisher | 4366596 | |
| Custom TaqMan RT Primer Pool | Thermo Fisher | 4459649 | |
| TaqMan PreAmp Master Mix 2X | Thermo Fisher | 4391128 | |
| Custom TaqMan PreAmp pool | Thermo Fisher | 4459657 | |
| TaqMan Universal Master Mix II, No UNG 2x | Thermo Fisher | 4440048 | |
| Custom TaqMan Array MicroRNA Cards | Thermo Fisher | 4449137 | Bring the Custom TaqMan Array MicroRNA Cards to room temperature before to load samples |
| Vacutainer Safety-Lock Blood Collection Set | Becton Dickinson | 367286-364815 | |
| Vacutainer plastic spray-coated K2EDTA tube. | Becton Dickinson | 366643 | Lavender BD Hemogard closure |
| Cuvette PS semi-micro | VWR/PBI | 643-0326 | Light path 10 mm |
| NanoDrop 2000c UV-VIS Spectrophotometer | Thermo Fisher | ||
| Cryogenic vials 1.5 ml | Sigma-Aldrich | Z359033 | |
| Centrifuge 5810R | Eppendorf | Bring the centrifuge to 4 °C before starting plasma collection | |
| Heraeus Multifuge 3S+ Centrifuge | Thermo Fisher | D-37520 | |
| Vortex Mixer | Velp Scientifica | F202A0173 | |
| ThermoMixer T- shaker | Euroclone | A00564 | Bring the Thermo Mixer to 37 °C before starting RNA extraction |
| Maxwell RSC Instrument | Promega | AS4500 | |
| GeneAmp PCR System 9700 thermo-cycler | Thermo Fisher | ||
| ViiA 7 Real-Time PCR System | Thermo Fisher | ||
| ViiA 7 RUO software | Thermo Fisher | ||
| Arrey Card Staker/Sealer | Thermo Fisher | 4331770 |
Referências
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer Statistics, 2017. CA Cancer J Clin. 67 (1), 7-30 (2017).
- Malvezzi, M., et al. European cancer mortality predictions for the year 2017, with focus on lung cancer. Ann Oncol. , 10 (2017).
- Miller, K. D., et al. Cancer treatment and survivorship statistics, 2016. CA Cancer J Clin. 66 (4), 271-289 (2016).
- Kanne, J. P. Screening for lung cancer: what have we learned. AJR Am. J Roentgenol. 202 (3), 530-535 (2014).
- Aberle, D. R., et al. Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med. 365 (5), 395-409 (2011).
- Wender, R., et al. American Cancer Society lung cancer screening guidelines. CA Cancer J Clin. 63 (2), 107-117 (2013).
- Molina-Vila, M. A., et al. Liquid Biopsy in Non-Small Cell Lung Cancer. Front Med (Lausanne). , 69 (2016).
- Sozzi, G., Boeri, M. Potential biomarkers for lung cancer screening. Transl Lung Cancer Res. 3 (3), 139-148 (2014).
- Shepherd, F. A., Douillard, J. Y., Blumenschein, G. R. Immunotherapy for non-small cell lung cancer: novel approaches to improve patient outcome. J Thorac Oncol. 6 (10), 1763-1773 (2011).
- Ajona, D., et al. Investigation of complement activation product c4d as a diagnostic and prognostic biomarker for lung cancer. J Natl Cancer Inst. 105 (18), 1385-1393 (2013).
- Boyle, P., et al. Clinical validation of an autoantibody test for lung cancer. Ann Oncol. 22 (2), 383-389 (2011).
- Hayes, J., Peruzzi, P. P., Lawler, S. MicroRNAs in cancer: biomarkers, functions and therapy. Trends Mol Med. , (2014).
- Croce, C. M. Causes and consequences of microRNA dysregulation in cancer. Nat Rev Genet. 10 (10), 704-714 (2009).
- Iorio, M. V., Croce, C. M. MicroRNA dysregulation in cancer: diagnostics, monitoring and therapeutics. A comprehensive review. EMBO Mol Med. 4 (3), 143-159 (2012).
- Schwarzenbach, H., Nishida, N., Calin, G. A., Pantel, K. Clinical relevance of circulating cell-free microRNAs in cancer. Nat Rev Clin Oncol. 11 (3), 145-156 (2014).
- Mitchell, P. S., et al. Circulating microRNAs as stable blood-based markers for cancer detection. Proc Natl Acad Sci U S A. 105 (30), 10513-10518 (2008).
- Hanke, M., et al. A robust methodology to study urine microRNA as tumor marker: microRNA-126 and microRNA-182 are related to urinary bladder cancer. Urol Oncol. 28 (6), 655-661 (2010).
- Park, N. J., et al. Salivary microRNA: discovery, characterization, and clinical utility for oral cancer detection. Clin Cancer Res. 15 (17), 5473-5477 (2009).
- Boeri, M., Pastorino, U., Sozzi, G. Role of microRNAs in lung cancer: microRNA signatures in cancer prognosis. Cancer J. 18 (3), 268-274 (2012).
- Castoldi, M., et al. A sensitive array for microRNA expression profiling (miChip) based on locked nucleic acids (LNA). RNA. 12 (5), 913-920 (2006).
- Chen, C., et al. Real-time quantification of microRNAs by stem-loop RT-PCR. Nucleic Acids Res. 33 (20), 179 (2005).
- Schulte, J. H., et al. Deep sequencing reveals differential expression of microRNAs in favorable versus unfavorable neuroblastoma. Nucleic Acids Res. 38 (17), 5919-5928 (2010).
- Tiberio, P., Callari, M., Angeloni, V., Daidone, M. G., Appierto, V. Challenges in using circulating miRNAs as cancer biomarkers. Biomed Res Int. , 731479 (2015).
- Boeri, M., et al. Recent advances of microRNA-based molecular diagnostics to reduce false-positive lung cancer imaging. Expert Rev Mol Diagn. 15 (6), 801-813 (2015).
- Benes, V., Castoldi, M. Expression profiling of microRNA using real-time quantitative PCR, how to use it and what is available. Methods. 50 (4), 244-249 (2010).
- Mestdagh, P., et al. Evaluation of quantitative miRNA expression platforms in the microRNA quality control (miRQC) study. Nat Methods. 11 (8), 809-815 (2014).
- Pastorino, U., et al. Early lung-cancer detection with spiral CT and positron emission tomography in heavy smokers: 2-year results. Lancet. 362 (9384), 593-597 (2003).
- Boeri, M., et al. MicroRNA signatures in tissues and plasma predict development and prognosis of computed tomography detected lung cancer. Proc Natl Acad Sci U S A. 108 (9), 3713-3718 (2011).
- Sozzi, G., et al. Clinical Utility of a Plasma-Based miRNA Signature Classifier Within Computed Tomography Lung Cancer Screening: A Correlative MILD Trial Study. J Clin Oncol. 32 (8), 768-773 (2014).
- Pritchard, C. C., et al. Blood cell origin of circulating microRNAs: a cautionary note for cancer biomarker studies. Cancer Prev Res (Phila). 5 (3), 492-497 (2012).
- Kirschner, M. B., et al. Haemolysis during sample preparation alters microRNA content of plasma. PLoS One. 6 (9), 24145 (2011).
- Kirschner, M. B., et al. The Impact of Hemolysis on Cell-Free microRNA Biomarkers. Front Genet. 4 (94), (2013).
- Fortunato, O., et al. Assessment of circulating microRNAs in plasma of lung cancer patients. Molecules. 19 (3), 3038-3054 (2014).
- Appierto, V., et al. A lipemia-independent NanoDrop((R))-based score to identify hemolysis in plasma and serum samples. Bioanalysis. 6 (9), 1215-1226 (2014).
- Kim, D. J., et al. Plasma components affect accuracy of circulating cancer-related microRNA quantitation. J Mol Diagn. 14 (1), 71-80 (2012).
- Kulstein, G., Marienfeld, R., Miltner, E., Wiegand, P. Automation of DNA and miRNA co-extraction for miRNA-based identification of human body fluids and tissues. Electrophoresis. 37 (21), 2742-2750 (2016).
- Schwarzenbach, H., da Silva, A. M., Calin, G., Pantel, K. Data Normalization Strategies for MicroRNA Quantification. Clin Chem. 61 (11), 1333-1342 (2015).
- Schlosser, K., McIntyre, L. A., White, R. J., Stewart, D. J. Customized Internal Reference Controls for Improved Assessment of Circulating MicroRNAs in Disease. PLoS ONE. 10 (5), 0127443 (2015).
- Kroh, E. M., Parkin, R. K., Mitchell, P. S., Tewari, M. Analysis of circulating microRNA biomarkers in plasma and serum using quantitative reverse transcription-PCR (qRT-PCR). Methods. 50 (4), 298-301 (2010).
- Wang, K., et al. Comparing the MicroRNA spectrum between serum and plasma. PLoS One. 7 (7), 41561 (2012).
- Mestdagh, P., et al. A novel and universal method for microRNA RT-qPCR data normalization. Genome Biol. 10 (6), 64 (2009).
- Montani, F., et al. miR-Test: A Blood Test for Lung Cancer Early Detection. J Natl Cancer Inst. 19 (6), 063 (2015).
- Sestini, S., et al. Circulating microRNA signature as liquid-biopsy to monitor lung cancer in low-dose computed tomography screening. Oncotarget. 20 (32), 32868-32877 (2015).
- Verri, C., et al. Mutational Profile from Targeted NGS Predicts Survival in LDCT Screening-Detected Lung Cancers. J Thorac. Oncol. (17), 10 (2017).
- Bianchi, F., et al. A serum circulating miRNA diagnostic test to identify asymptomatic high-risk individuals with early stage lung cancer. EMBO Mol Med. 3 (8), 495-503 (2011).
- Gyoba, J., Shan, S., Roa, W., Bedard, E. L. Diagnosing Lung Cancers through Examination of Micro-RNA Biomarkers in Blood, Plasma, Serum and Sputum: A Review and Summary of Current Literature. Int J Mol Sci. 17 (4), 494 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados