Method Article
大ボリューム内の特定の細胞内標的を見つけるため連続切片的階層構造イメージング
要約
このプロトコルは、走査型電子顕微鏡 (SEM) を用いたナノスケールの分解能でイメージングのための組織の特定のセルを対象します。多数の生物学的素材の樹脂包埋切片に SEM で階層的にし、ターゲットを識別するために光学顕微鏡でされる最初
要約
光と電子顕微鏡の組み合わせを使用して階層的なイメージングによる混合細胞またはティッシュ内の微細構造の解像度で特定のセルをターゲットを実現できます。樹脂に埋め込まれたサンプルは超薄切片の何百ものリボンで構成される配列に分割、シリコンウエハや伝導コーティング coverslips の部分に堆積しました。配列は、fluorophores が付いている分類後広い場蛍光顕微鏡 (蛍光光学顕微鏡 (FLM)) または光学顕微鏡 (LM) 急速な大面積の概要については、スマート フォンのカメラのようなデジタル家電を使用して低解像度で作成されます。重金属で染色後、走査型電子顕微鏡 (SEM) の配列が作成されます。ターゲットの選定は、FLM によって生成された 3 D 再構成や蛍光マーカーが利用できない場合、中間解像度で SEM 画像のスタックから作られた 3 D 再構成から可能です。微細構造の解析に選択したターゲットは最終的にで高分解能 SEM に記録されます (数ナノメートル画像ピクセル)。どんなウルトラミクロトームに後付けすることができますリボン処理ツールが示されています。これのアレイ生産および断面のナイフ ボートから基質除去に役立ちます。SEM で配列の自動イメージングを可能にするソフトウェアプラット フォームを説明しています。シリアル ブロック面 SEM (SBF SEM) または集束イオンビーム (FIB SEM)、SEM などの EM の大きなボリューム データを生成する他の方法と比べてこのアプローチには 2 つの主要な利点: (1) スライスしたアップ バージョンではいえ、樹脂包埋試料は保存されています。それはさまざまな方法で染色し、解像度の異なるイメージを作成できます。(2) セクションが後に汚すことができると、重金属と強くブロック染色サンプルを使用して SEM 画像のコントラストを紹介または導電性組織ブロックをレンダリングする必要はありません。これにより、メソッドがさまざまな材料と生物学的質問に適用されます。特にプレフィックス付きの材料など、銀行生検と病理研究所から直接埋め込みでき 3 D で再構築します。
概要
大量の超微細構造の解像度で組織を再構築するため SEM に基づくさまざまなイメージング手法の数は、使用される1をされている: 包括的なレビューは利用できる例えばSBF SEM2、FIB SEM3、および配列のために、。(AT)4断層撮影。後者の方法のサンプル素材は、基板上のシリアル セクションの配列として保存されて、しながら SBF SEM FIB SEM は、破壊的な方法は、サンプル ブロックに取り組んでいるイメージング中にかかります。SEM で樹脂の充電のため強くメタライズド サンプル ブロック5にも依存します。
その一方で、特定の細胞または組織サンプル内の対象の構造体を識別すると、相関光と電子顕微鏡 (クレム)6,7,8から特に利益することができます。これは蛍光信号9を消すだろうから重金属の大量のアプリケーションを排除する対象 FLM を使用します。このような少しメタライズド サンプルのみ AT が選択の方法です配列は、LM のイメージング後重金属染色後簡単に場合がありますので。また、AT のほぼすべてのサンプルの型を使用する、日常も採取病理学者の宝箱10。
AT のもう一つの大きな利点は、階層11または多重解像度画像12の可能性: 高解像度で、すべてのイメージを必要はありません (例えばFLM) 異なるモダリティや、目標を選択可能性がありますように、低解像度の SEM 画像。高解像度組織またはセル人口の興味深い領域のみを画像デジタル データ ストレージ領域を節約し、は扱いやすい、小型のイメージ データ セットが生成されます。ここでは、AT ワークフローはむしろ弱くメタライズド サンプルを使用して示されて: 親水性の樹脂に埋め込まれた高圧冷凍植物の根 (シロイヌナズナ)。
配列を準備、ステンド グラス、FLM の SEM、イメージ画像のスタックは、登録方法などを説明しています。また、FLM ボリュームの 3 D 復元を使用して、ナノスケールの分解能 SEM イメージングのための特定のセルを選択する方法を示しています。
プロトコル
注: サンプルのブロック重合する必要があります、いくつかの重金属が含まれています。固定と1 a 図Bに示すように 2 つのサンプルがされているプロトコルを埋め込むことは別の場所の11に説明。一言で言えば、図 1 aに示されているサンプルは、1% OsO41% 酢酸ウラン、その後、最初とスパー樹脂埋め込みen のブロック染色化学、修正しました。高圧は図 1 bに凍っていた、示されているサンプルを凍結置換アセトン、酢酸ウラニウム 0.4% と Lowicryl HM20 樹脂に埋め込まれました。次の準備ステップ パウダー フリー手袋を使用します。
1. 配列を作成します。
- サンプル ブロックのトリミング
注: は常に部品を挿入するときにもネジを締めます。- サンプル ブロックを挿入、ウルトラミクロトームのサンプル ホルダー、ホルダー トリミング ブロックに、ウルトラミクロトームの下段にそれをスライドさせます。
- サンプルの周りの樹脂の小さな縁のみを残してかみそりの刃で埋め込まれた組織の周り離れて樹脂をトリムします。ターゲットに到達するまで上からトリミングします。
注: ブロック面の形状があります台形または長方形 (我々 は正常に両方の図形を使用している)。長方形の長い方の辺をリーディング エッジとトレーリング エッジとしてリボンを安定させる接着剤の混合物で広いエリアをカバーできるように使用することが重要です。 - 試料ホルダーを挿入、ウルトラミクロトームの腕、下段にナイフ ホルダーしてトリミング ブロックを置き換えます。ダイヤモンド トリム ナイフ (通常 45 °) をナイフ ホルダーに挿入します。ブロック顔トリミング ナイフのエッジに正確に平行に合わせます。
メモ: まさに平行リード (下) と末尾の (上端) を生成するために、反対側をトリムするのにはナイフのみを移動します。90 ° トリミング ナイフは、大量 (数百セクション)、有利であります。 - すべての 4 つの側面を滑らかにし、リーディング エッジとトレーリング エッジが水平の位置に今、試料ホルダーを回転します。
- 接着剤の混合物が付いているブロックの先頭と末尾の側面を慎重にコートします。つまようじ13固定いくつかの毛から形成される小さなブラシを使用します。秒以内にこの混合物の溶剤が蒸発するのですぐにこの手順を実行します。この混合物とブロック面を汚染してはなりません。5-10 分のための乾燥コーティング サンプル ブロックができます。
注: セクションの多数の (> 200)、時間と、接着剤の膨らみがトレーリング エッジで造り上げるし、潜在的引き戻すセクション ナイフエッジ上のでのみ、リーディング エッジをコートに良いかもしれません。
- 基板の準備
- (約 2 × 2.5 cm2のジャンボ ナイフ) ナイフ ボートに収まるサイズにシリコンウェハーの部分をカットします。必要な場合、マーク ウェーハ部分 (数字または文字) ダイヤモンド スクライバー クリーニングする前に、恒久的なマーカーを洗浄した後。イソプロパノールと糸くずの組織による手動でシリコンウエハをクリーンします。
注: 相関イメージング使用インジウム-スズ酸化物 (ITO)-ガラス coverslips をコーティングします。非常に慎重に処理する必要があります、余分なクリーニングは必要ありません。 - 取り外し可能な接着剤を用いたキャリア プレートの一端に基板を修正します。
注: また、基板端が身動き粘着テープの 2 つのストライプを使用してナイフエッジに平行。 - プラズマは、親水性の表面を得るための空気と基板 (グロー放電) をアクティブにします。これは、水のドロップが非常に薄膜である (図 2d低接触角) に基板スプレッドに置かれたそのような方法で行ってください。親水化パラメーターによって異なります使用; プラズマ装置ここで使用されるパラメーター、材料表を参照してください。
注: プラズマ活性化は非常に不安定、だから基板使用直前にこれを実行します。 - ナイフ ボートで基板の最適なぬれ性を達成するためにナイフエッジに近いマウント基板の基板ホルダーのクランプにキャリアを挿入します。
注: コンピューター支援設計 (CAD) 図面を含む基板ホルダーの詳細な説明は、ワッカーらに与えられます。11
- (約 2 × 2.5 cm2のジャンボ ナイフ) ナイフ ボートに収まるサイズにシリコンウェハーの部分をカットします。必要な場合、マーク ウェーハ部分 (数字または文字) ダイヤモンド スクライバー クリーニングする前に、恒久的なマーカーを洗浄した後。イソプロパノールと糸くずの組織による手動でシリコンウエハをクリーンします。
- 断面作製
- ジャンボ ダイヤモンド ナイフとナイフ ホルダーを挿入逃げ角 (ジャンボ ナイフの 0 °) を設定し、蒸留水でナイフ ボートを埋めます。ナイフをサンプルに 1-2 mm の距離に近づきます。
- 基板ホルダーのネジ 1-3 (図 2 a) を使って水の中に基板を下げます。喫水線が基板の上から 3 番目にあることを確認します。
注: は、基板とキャリア プレート間の接着剤がよく清潔なピンセットで基板に硬化されているを確認します。それを移動しないでください。 - シリコンの薄片を使用するときに地面とのクリアランスを見にくいので、それがわかるまで基板を下げるが床に触れます。今基板少量を上げます。基板もキャリアに切削しながらナイフ ボートが触れていることを確認します。
- スポイトやピペットを使って船に水のレベルを調整します。両眼を見ながら追加または水表面の全領域、ウルトラミクロトームのトップ光の均一な反射を示すまで水を削除します。
- ウルトラミクロトームの下のライトをスイッチします。腕が中間位置で、取り消し、ウルトラミクロトームのハンド ホイールを使用してではないことを確認します。ナイフエッジの反射までサンプルへのアプローチ、ナイフ ブロック面に表示されます。
- ナイフをサンプルに合わせて、ウルトラミクロトームの調整オプションを使用します。まず、ナイフを回転させる回転し、サンプルを傾けます。
注: 正しく配置される場合はサンプルとナイフの間のギャップを見ることができる光のストライプ (まっすぐな平行線とない楔形) 平行エッジを示しています。 - サンプルの傾きをチェック: 光のストライプが太くならないかどうかを確認またはサンプルを上下に移動しながら薄くします。必要な場合は、これを修正するアーク調整ネジを使用します。ブロックの顔のすぐ上 (それはそれを触れていない) まで、サンプルに近いナイフを移動します。
- 切削速度と切削ウィンドウ コントロール ユニットに (飼料)、切片厚を設定します。
- セクショニングを開始します。必要な場合は、最初の完全なセクションがカットされているまでを待ちます。フォーム リボンにくっついているようにするいくつかのセクションをカット (接着剤が再度適用されるそれ以外の場合)。価値の高い飼料を開始 (最大 200 超ナイフの nm) まで最初の完全なセクションがカットされています。その後、目的のフィードの値を設定します。適切なリボンの安定、セクション厚さ 100 nm と切削速度 1 mm/s は良い出発点。最低の達成可能な切片厚が約 60 nm、サンプル品質に応じて。
- 断面を停止します。ナイフエッジからすべての不要な (一部カット) セクションを削除してまつげ/猫の毛を使用してボートです。小さな破片がたくさんある場合周りに浮かぶピペットで完全に水分を除去し、新鮮な水でボートを満たし。今プロセスは最初の生産的なリボンの準備です。
- 断面
- セクショニングを開始します。数 (実際の数は、セクションおよび基板のサイズによって異なります) のセクションがカットされて、一度セクショニング プロセスを停止し、まつげ14またはより良いまだ、ナイフエッジを優しくなでるナイフエッジからリボンをリリース、非常に猫の毛から柔らかい毛。
- 操作 (プッシュ/プル) 基板に向かうまつげとリボン、最初のセクションを基板に取り付けます。
注: 基板の乾燥部分にくっついてそれまでリボンを優しくプッシュする必要です。 - 断面と基板にリボンをアタッチする続行します。1 つの側面の開始、各新しいリボンの他に徐々 に移動します。
注: は、既に添付しているリボンの緩みを避けるために大規模な水の動きを避けてください。気流の場合も同じです。息盾、ウルトラミクロトームと配信を使用します。不利な環境条件では、15ウルトラミクロトーム用の囲いをお勧めします。 - 基板は完全にリボンで覆われているとき (通常 4-5 リボンが可能)、優しくリフト アウト基板基板ホルダーのマイクロマニピュレーター ネジを使用してナイフ ボートから。
注: 適切な動き、: 垂直方向に持ち上げて (スクリュー 1) (ネジ 3) を回転/傾斜や両方の組み合わせ。 - 埃のない環境でそれを保存する前に乾燥リボン配列ができます。乾燥後、接着マウント基板、できるだけ早くキャリアから取り外します (同じ日に、それ以外の場合、基板を削除するあまりにも難しいかもしれないまたは取り外す時に壊れる可能性があります)。
2. LM 用染色
注: 異なる染色/ラベリング手法は蛍光プロトコルを含む、可能です。ここで直接、むしろ非特異的な染色は細胞壁の輪郭が選択されます。
-
Propidium ヨウ化染色
- パラフィルムでシャーレ (直径 30 cm) の大きなグラスの底をカバーし、湿気の多い部屋を構築するウェットティッシュで皿の端を並べる。
- 約 300-500 μ L の coverslip ごとの解決策を使用します。パラフィルムで各 coverslip の一滴を置き、セクションは染色液と接触しているので、ドロップに逆さまガラスを置きます。カバー皿と光からサンプルを保護するためにアルミ箔で包んでください。4 ° C で 16 時間サンプルをインキュベートします。
- 鉗子で、coverslip を削除し、80 mL の蒸留水で 100 mL ビーカー内を上下移動して洗浄します。新鮮な水と別のビーカーにこの手順を繰り返します。乾燥した圧縮空気で慎重に coverslip。
3. FLM の画像のスタックを記録
- 一般的な広視野 FLM のステージ上 coverslip の場所。
- 観察される蛍光の適切なフィルター セット (テーブルの材料) を選択します。
- 最適な対物レンズを各セクションで、オブジェクトのイメージを取る: ビューのフィールドを入力し、方向を一定に維持しようとします。ルート ヒントの 40 X 空気目的が使用されました。
注: リボンが完全にまっすぐではない、回転ステージが撮影中のセクションの方向を変更する助けることができます。可能であれば、特定の機能の画像をセンターまたは記録された画像の端に等距離にあるセクションの端などの機能を維持します。 - 可能であれば、飽和ピクセルを制限し、露光時間を一定に保つに 16 ビットを使用します。
4. FLM 画像のスタックの登録
- 仮想スタックとしてフィジー16に一連のイメージをインポートします。
- [ファイル] メニューから新しい TrakEM17 (空白) を開きます。
- イメージ フィールドを右クリックし、「レイヤーごとの 1 つのスライス」として TrakEM スタックをインポートします。
- レイヤー (イメージ フィールドに右クリック) を整列させる、範囲を設定 (最初の最後にイメージ)、参照として [なし] を選択します。すべての設定、既定値を使用し、目的の変換として剛を選択します。
- 登録が終了し、満足のいく、によって一直線に並べられたデータセットを保存を右クリックし、エクスポート] を選択します。フラット イメージに、範囲を最初から最後の画像に設定し、結果のスタックを表示するソフトウェアします。スタックは、tif 形式で保存します。
5. 染色と SEM イメージングのためのマウント
注: 染色ソリューションを準備する材料の表を参照してください。ソリューションは、光や空気から保護まで 12 ヶ月の間に、4 ° C で保存されるかもしれない。
注意: クエン酸とウラニル酢酸鉛には、有毒な重金属が含まれています。手袋を着用し、自治体の指示に従って廃棄します。
- パラフィルムでシャーレ (直径 30 cm) の大きなグラスの底をカバーし、湿気の多い部屋を構築するウェットティッシュで皿の端を並べる。
注: 鉛クエン酸の過度の降水量を防ぐために染色の滴近くペトリ皿内 NaOH のいくつかのペレットが位置しているが重要です。 -
ウラニル アセテート染色
- 堆積物の小粒子が数秒間 2,680 x g でウラニル酢酸溶液を遠心します。
- 約 300-500 μ L の coverslip ごとの解決策を使用します。パラフィルムで各 coverslip の一滴を置き、セクションは染色液と接触しているので、ドロップに逆さまガラスを置きます。
- 室温で 10 分間インキュベート、染色中に料理をカバーしています。
- 蒸留水をビーカーで上下に移動することによって十分に洗うと鉗子 coverslip でいっぱい削除 (ステップ 2.1.3 を参照してください)。
-
クエン酸の染色をリードします。
- ウラニル酢酸孵卵中における鉛の混合水溶液を準備します。
注: 鉛クエン酸は、任意の沈殿物を削除する使用の直前に常にフィルターする必要があります。またステップ 5.2.1 のように数秒間 2,680 x g 鉛クエン酸溶液を遠心します。 - 約 300-500 μ L の coverslip ごとの解決策を使用します。ウラニル アセテート染色後、coverslips を洗濯する前にすぐに、パラフィルムで各 coverslip の一滴を置き、セクションは染色液と接触しているので、ドロップに逆さまガラスを置きます。ウラニル アセテート染色後、coverslips を洗濯する前にすぐに、パラフィルムの滴 (300-500 μ L) を配置します。
注: 沈殿物の形成を避けるためには、息をしていない鉛クエン酸水滴に。 - ドロップへ裏返し洗浄 coverslip の場所 (それを乾燥する必要はありません)。
- 室温で 5 分間インキュベート、染色中に料理をカバーしています。
- 鉗子で、coverslip を削除し、新鮮な水 (ステップ 5.2.4) ビーカーで上記のようにそれを洗います。
- ウラニル酢酸孵卵中における鉛の混合水溶液を準備します。
- 乾燥した圧縮空気で慎重に coverslip。
-
SEM 用試料を取り付け
- 粘着性カーボン パッド付きアルミ スタブのシリコン ・ ウェハーをマウントします。
注: ito coverslips 可能性がありますいずれかを使用してマウント シルバー塗装と銅テープ、導電性表面がスタブに接続されていることを確認- または上記カーボン パッド。その場合は、シルバー塗装のドロップで ITO 表面からスタブへの導電性接続が可能です。
- 粘着性カーボン パッド付きアルミ スタブのシリコン ・ ウェハーをマウントします。
6. 階層、SEM イメージング
注: 電界放出型、低の一次エネルギーを選択 (3 kV 以下)、セカンダリまたは後方散乱電子の効率的なコレクションの 50 から 800 pA、充電を避けるために、適切な作動距離までの範囲で電流。ビーム電流の選択サンプル プロパティによって異なります (e.g、樹脂を埋め込み);。電子線照射量は微小電流 (サンプルへの害が少ない) と撮影速度のために有益でありしたがって合計画像の取込時間を下げる高電流間の妥協にもなります。後方散乱電子の専用探知機は、良好なコントラストを提供する、サンプルの充電に感受性が低いとサンプルの表面の成果物 (ひだ、ナイフをマーク) の表示。ヒストグラムが中央に配置されるよう、コントラストと明るさを調整する必要があります。
-
SEM イメージング
- まず約 100 x の低倍率で各コーナーのイメージを掴んで配列の 4 つのコーナーを定義します。関心 (ROI) アレイ全体を囲む領域を作成します。次のパラメーターでイメージング プロトコルを割り当てる: (例 1,000 nm) の大きな画像のピクセル サイズと短い滞留時間 (例えば、0.2 μ s) で高速撮像、二次電子 (SE) 検出器を使用します。
注: で、大規模なスキャンの視野 (FOV)、画像の周辺部で歪みになる可能性があります電子光学的限界を克服するために (ほとんどの SEM の製造業者によって提供される) 専用の低倍率モードを使用または使用中、1 ~ 2 k スキャン フィールド1 つの画像。 - 最初のセクションで組織だけをまとめた投資収益率を作成すると、セクションを生成します。スタンプ ツールを使用してすべての後続のセクションにクローンを作成します。曲がったリボンに合わせて必要なとき・ ロワを回転させます。
- 中間的なピクセル サイズを使用してイメージのシリーズを記録 (約 50 nm) と識別し、ターゲットの構造の把握に十分長い時間住む。FOV を 6-10 k ピクセルの範囲の単一のイメージを使用します。
注: アトラス 5 ソフトウェアは自動的にシリアルのセクション全体で大規模な投資収益率/セクションの区域をカバーする隣接する画像で構成されるモザイクを収集できます。 - 高分解能 SEM 用ターゲット構造を含む、このセクション内の設定サイトを作成します。ステージ精度のアカウントに十分な投資収益率を作る。確認し、サイトの位置を調整します。
注: それは、オート フォーカスと autostigmation を実行する、センターなしの構造の細部は、例えば「空の」材料の座っていないことそのような方法で Roi を配置することが重要です。、空胞。 - オート フォーカス設定を定義し、少なくとものパフォーマンスをチェック (すなわち段階は旅行、最長距離) リボンの長さイメージングされるサイトに近い小さな roi。
- 高分解能 SEM 獲得のため撮像プロトコルを定義します。膜コンパートメントを表示するには、3-5 nm イメージのピクセル サイズを選択します。検出器によって滞留時間を選択すると、画像はあまりにも騒々しいではありません。
- 取得を開始する前に少なくともチェック ・ プロトコル ・ オプションを使用して各リボンの最初のセクションにフォーカスの値を定義します。
- ターゲット ・ ロワの全体のシリーズで自動の SEM 画像を開始します。
- 好ましくは tif 形式の画像シリーズとして集録されたデータをエクスポートします。
- まず約 100 x の低倍率で各コーナーのイメージを掴んで配列の 4 つのコーナーを定義します。関心 (ROI) アレイ全体を囲む領域を作成します。次のパラメーターでイメージング プロトコルを割り当てる: (例 1,000 nm) の大きな画像のピクセル サイズと短い滞留時間 (例えば、0.2 μ s) で高速撮像、二次電子 (SE) 検出器を使用します。
7. SEM 画像のスタックの登録
- 仮想スタックとしてフィジーにイメージをインポートします。
注: これらのセクションの数と投資収益率の大きさに応じて数 GB の範囲で大きなデータ ファイルになります。 - 作物 SEM イメージ、できるだけ興味の構造に近い領域にさらなる処理のためのスタックし、明るさとコントラストを調整します。
- [ファイル] メニューから新しい TrakEM17 (空白) を開きます。
- イメージ フィールドを右クリックし、「レイヤーごとの 1 つのスライス」として TrakEM スタックをインポートします。
- (イメージ フィールドに右クリック) レイヤーを整列、モードとして最小二乗法を選択して、範囲を設定 (最初の最後にイメージ)、参照として [なし] を選択します。設定、既定値を使用して目的の変換として剛を選択します。
- 登録が完了したと満足のいく、によって一直線に並べられたデータセットを保存を右クリックし、エクスポート] を選択します。フラット イメージに、範囲を最初から最後の画像に設定し、結果のスタックを表示するソフトウェアします。スタックは、tif 形式で保存します。
結果
ワークフローは、レジン ブロックに埋め込まれているサンプル (図 1) 開始を紹介します。サンプル準備の間にいくつかの重金属を組織に導入する必要がありますが、それはむしろ強い金属化用に最適化されたプロトコルを使用する必要はありません。図 1 aは、(クレス) ブロック - 従来で染色 1% OsO4と 1% 酢酸ウラン、図 1 bでのシロイヌナズナ根が弱だけ中にメタライズド 0.5% 酢酸ウラニルを扱う植物の根を示しています。後者のサンプルの種類は、蛍光を抑制する傾向があるいくつかの重金属相関アプローチに最適です。専用基板ホルダー (図 2)、いくつかの百セクションの配列することができます (図 1) を生成します。蛍光標識後そのような配列標準ワイド フィールド FLM (図 1) のイメージを作成し、重金属ソリューションで染色、解像度が異なる (図 1E-G) SEM のイメージします。
再現性の高い世代のアレイのための重要なツール、基板上にミクロトームのナイフの船からいくつかのリボンを配置するときに特に、基板ホルダー (図 2 a、筆者らの研究室ではカスタム設計された) とジャンボ ダイヤモンド顕微鏡スライド (図 2 b) に対応するのに十分な大きさのボートを持つナイフ。フラット メニスカス、リボンの良い観測を許可する必要があるし、基板のプラズマ クリーニングによって達成することができます: 蒸留水の小さな液滴は、図 2 (未処理基板) のように基板上のレンズのような構造を形成してはいけません(図 2 D、プラズマ活性化基板) 薄膜が。Ito coverslip の乾燥部分に接続されているリボンが簡単にこれらの条件の下で (図 2 e) を可視化しを観察、水から基板のリフト アウト時に制御します。
例として、FLM (図 3 a) 標準的な広い視野を持つアレイ propidium ヨウ化植物細胞壁にラベルを付けるとステンド グラスをイメージしました。セクションのみ 100 nm の厚さでも、過剰染色ここで示すように、少しぼかしを紹介します。登録後、再建されたボリュームに完全に囲まれている 2 つのセルが 3 D で高分解能イメージングのための画像のスタック (図 3 b) から選ばれた (また見なさい補足ムービー S1)。次の追加染色ウラニルのアセテートおよび鉛のクエン酸と、配列をイメージしました、SEM の3 C を図60 nm イメージ ピクセルで記録、概要が表示されます画像の中心の暗い正方形は、オート フォーカス機能を実行すると、追加投与量は、わずかな汚染につながった位置を示します。これらの連続切片 (435 スライスの 51 に 248 をスライス、合計で) に、適切な 5 nm 画像ピクセル サイズで記録された FLM スタックで選択した 2 つのターゲット細胞を含む (図 3 D;映画 S2 の補足も参照してください。)。
ここで説明した SEM 内のアレイの自動化された階層的なイメージングは、ソフトウェア/ハードウェア プラットフォーム ソリューション ツァイス アトラス 5 で行われました。まず、アレイ全体の概要と SE 検出器を使用して作成された非常に大きな (1,000 nm) 画像のピクセルと非常に低い滞留時間 (図 4 a)。組織のみをまとめた投資収益率は最初の部分に配置され、配列のすべての他のセクションに反映されます。このセクションの設定は 60 nm イメージ ピクセル (図 4 b) 長い滞留時間を使用して記録されます。最後に、2 つのターゲット細胞プラスワン ステージの不正確さを考慮して細胞を周囲の「層」を含むサイト セットは、次のパラメーターがセットアップされました: ESB (後方散乱エネルギー選択) 検出器、5 nm イメージ ピクセル、非常に長い (40 μ s) に住む (の時図 4)。このような画像をズームイン空胞 (V)、(M) のミトコンドリア、核 (N) 小胞体 (矢印) など細胞レベル下の詳細 (図 4) を示しています。1 つの標的細胞の細胞内の細部に全体の配列の概要からズームインの補足映画 S3も参照してください。
(200 のセクション) を示す配列に加えて、追加生産する約 8 h を取った 250 セクションの 1 つ、FLM で (手動で) 記録する LM、および 1 日のために 1 泊。合計では、個々 のアレイの数に応じて約 1-2 時間を取る後染色します。アトラスの実行を設定する必要が SEM の記録、数時間と自動記録された h 3-4、高分解能 (5 nm ピクセル サイズ) の約 5 日間中間解像度 (60 nm ピクセル サイズ) セクション セット (200 のセクション、450 x 200 μ m2) 投資収益率(200 のセクション、55 x 30 μ m2) の 2 つのターゲット細胞を含みます。ここで示したサンプルの低金属含有量が、ため暗黙的に指定 (現在利用可能な検出器) 40 μ s のドウェル時間高解像度の投資収益率の良好な信号対雑音検出を到達するために非常に遅いスキャン速度が持っていた注意してください。
落とし穴になりやすい全体のワークフローにいくつかの手順があります: 理想的にはリボンがもっとまたはより少なくまっすぐと (図 5 a) 正しい順序で配置をする必要があります。ただし、ベント (図 5 b)、曲線 (図 5)、または壊れたリボンがしばしば生産されます。不適切なトリミング (リーディング エッジとトレーリング エッジない正確に平行)、または非一様に適用接着剤による非対称または不均一浸透したサンプルからも可能性があります。特に面倒なサンプルは、非常にハードとソフトの両方のコンポーネントを含みます。後者のコンポーネント (図 5) を示す植物の根の細胞壁などに侵入することは困難があります。その場合は、ひだ (矢印) はすることができます簡単に可変圧縮と区分の間に弛緩によって引き起こされます。自動イメージング、SEM、Roi はリボンの曲率に合わせて回転できるので曲線リボンは大きな問題ありません。
プロトコルの別の重要なステップを染色: 不十分な洗浄することができますセクション (図 5 e, F) の残基につながるし、最悪の場合 (図 5 階で 2 つのターゲットのセルの 1 つ上の円) の最も興味深い領域をカバーします。また、塵 (図 5、光強散乱粒子)、例えば、ナイフ ボートに汚い基板キャリアで導入は、深刻な問題を引き起こす可能性が: FLM では、ほこりを高輝度にすることができます (cf.補足的な映画のいくつかのスライスS1) いくつか登録アルゴリズムが機能しないそのような程度。ただし、TrakEM17 「整列」機能は、補足ムービー S1に示すようこのようなスタックを処理できます。
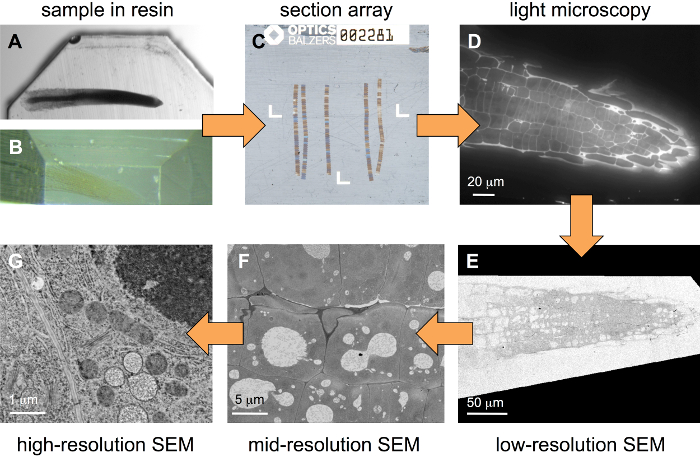
図 1: 相関の階層的なイメージングのためのワークフロー 。樹脂ブロック (A、強くメタライズド サンプル) に埋め込まれたサンプルから始まって、サンプルを最初トリミング (B、弱くメタライズド サンプル) して、配列に配置連続切片 (C) のいくつかのリボンで構成され、ここで、Ito coverslip、ウルトラミクロトームを使用して生成されます。蛍光色素で染色後画像のスタックは、広視野 FLM (D) に記録されます。塩さらに重金属のラウンドを染色後スタックが異なる解像度 (イメージ ピクセル サイズ) で SEM (電子-G) で作成されます。この図の拡大版を表示するのにはここをクリックしてください。

図 2: 配列の準備のためのツール。基板ホルダーは標準ウルトラミクロトーム (A) に接続されている動きの 7 軸マニピュレーターから組み立て: 円で強調表示されます、ネジが上下 (1) と水平方向の動き (2) および (3) 基板のキャリアの傾斜.プラズマ活性化ウェーハ マウント スライド サイズのアルミ キャリア (B) の部分でここ (矢印) の大型基板に対応する大型船とジャンボ ダイヤモンド ナイフ。20 μ L の滴蒸留水は、未処理のシリコン ウエハー基板 (C) または (D) プラズマ活性化基板上に配置されます。4 リボンの下の端、ito coverslip に接続されたナイフ ボートに浮かんでいます。この図の拡大版を表示するのにはここをクリックしてください。
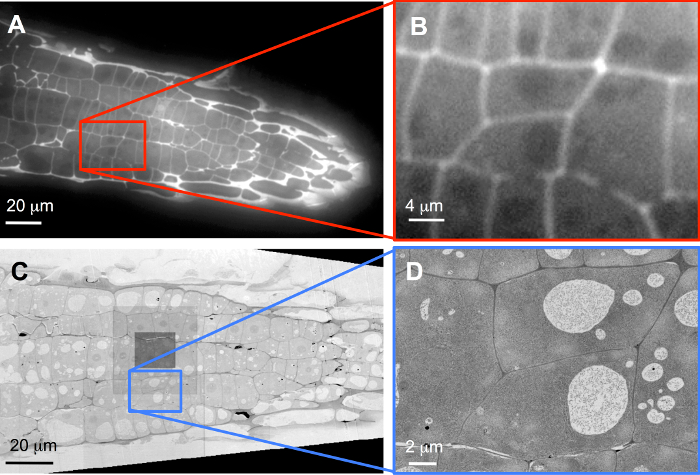
図 3: LM データと SEM データの相関します。FLM (A, B) と (A, C) の概要と標的細胞 (B、 D) 記録と SEM (C, D)。ソフトウェア ズームであり、元のデータが真実を示す 5 nm イメージ ピクセル サイズで 60 nm イメージ ピクセル サイズ、および (D) と (C) を記録しながらの 1,388 × 1,040 ピクセル カメラ チップの 40 倍の対物レンズで記録された (B)SEM での解像度の増加この図の拡大版を表示するのにはここをクリックしてください。

図 4: ツァイス アトラス 5 でを使用して SEM でイメージング階層1,000 nm 画素 SE 検出器 (A) を使用して、配列の概要を記録しました。セクションはすべてのセクションで組織に配置され、60 nm イメージ ピクセル (B) と記録の ROI を設定します。サイトを標的細胞に置かれ、5 nm イメージ ピクセル (C) で記録されたシリアルの ROI を設定します。このような高解像度画像 (D) にズームすると、液胞 (V)、(N) の核、ミトコンドリア (M) 小胞体 (矢印) などの細胞内膜コンパートメントが表示されます。この図の拡大版を表示するのにはここをクリックしてください。
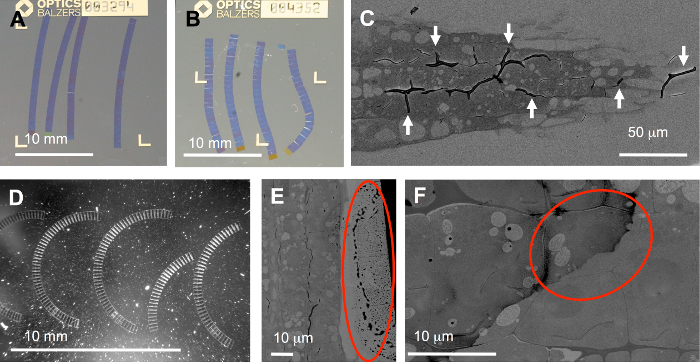
図 5: 典型的な問題。1. セクショニング プロセスに起因: 断面中に ito coverslips は理想的なストレート (A) ですが、不規則な圧縮にリボンがもひだ (C) または曲線リボン (D)、ベント (B) を引き起こす可能性があります。2. 断面と染色中と水、例えば、リボンの基板の処理によって引き起こされる: 散乱粒子を基板 (D)、セクション ( e円)、または汚れの液滴の縁に不十分なため組織にまみれて(F) を染色後の洗浄。この図の拡大版を表示するのにはここをクリックしてください。
補足ムービー S1: FLM 画像のスタックします。435 画像はフィジー16 TrakEM17を使用して整列し、動画ファイル (.avi) として保存されます。このファイルをダウンロードするここをクリックしてください。
補足映画 S2: SEM 画像のスタックします。210 のイメージは、フィジー16 TrakEM17を使用して整列されます。このデータ セットの元のスタック (300 画像) は、15 GB でした。それは x でスケーリングされた (後で配置および 2 つのターゲット細胞のみにトリミング) 3.3 GB からスタックを小型化して 0.2 倍 y フィジーを使用し、その .avi ムービーとして保存します。このファイルをダウンロードするここをクリックしてください。
補足映画 S3: SEM で解像度の異なるレベルを持つズーム映画に作成され、.mp4 形式でアトラス 5 ソフトウェアからエクスポートします。このファイルをダウンロードするここをクリックしてください。
ディスカッション
マルチ モーダル階層が組織内の特定のセルを対象にワークフローを示した: 連続切片、特注基板ホルダーを用いた導電性基板上に配置されたアレイに樹脂包埋標本をスライスします。ラベリング、fluorophore および FLM で画像処理、再生ボリュームが標的細胞を選択するため使用されます。後にコントラストを紹介する重金属ラウンド追加染色, 自動化されたソフトウェア プラットフォームを使用して SEM でナノスケールの分解能でいくつかの百のセクションこれらのターゲットが作成されます。
いくつかの長いリボンで密集配列を生産するには、ここで説明したような基板ホルダーが必要です。熟練した、患者の人は、いくつかのリボンを付けるナイフ ボート半浸漬シリコン基板と基板上に座っている、リボンまで徐々 に水のレベルを下げることによって配列を取得することがあります。しかし、私たちの経験、基板ナイフ ボート (cf. 注プロトコルに 1.3.2 で) の任意の部分に触れているときに形成を粉砕する傾向があります。さらに、この手順は難しく ito 基板: (1) 伊藤ガラスの透明性のためリボンの両端が添付される; が、水のエッジを参照してくださいすることは困難です。(2) と ito の表面は非常に洗練されたシリコンウエハよりはるかにざらざら、リボン リフト アウトいくつかのセクションから成る小さな断片が浮かぶかもしれないしセクションの順序をこのように破壊の間に壊れる傾向にあります。
ワークフロー全体 FLM データに相関することがなく可能です。この場合、いくつかのセッションで実行する、SEM でのデータ収集があります。初期の 3 D 再構成または少なくとも低または中程度の解像度のデータの評価のターゲットを識別する必要があります。また、明視野 LM の従来の組織学的汚れ、(要求しない FLM) を適用する可能性があります。もちろん、その他オプション6,7,8 18での初期の論文ですでに実証として、アレイにラベルまたは遺伝子蛍光タンパク質 (XFPs) をエンコードまたはラベルを埋め込み済み抗体試料中の蛍光の温存。
議論法の一般的な制限は、特定の厚さのセクション、3 D ボリュームの結果として得られる離散サンプリングの使用: SEM セクション表面 (d からのみデータを収集するために、Z の解像度をセクションの厚さと同じくらい良いのみすることができます選択したプライマリ エネルギー/着陸エネルギー epending)。つまり、結果として得られる 3D ボリュームが例えば異方性ボクセル。、100 nm3場合 100 x 5 x 5 nm のセクションと 5 の画像ピクセル サイズ nm を使用。1 μ m 以下のサイズの範囲で非常に小さなエンティティは、これは真の微細構造の説明のために十分はない可能性があります。技術的な制限は、自動化イメージング、SEM で使用段階の精度です。このため、完全なターゲット領域がイメージ化されることを保証するためステージ精度の仕様よりも大きな ROI を選択する必要は。
相関 AT に比べて SBF SEM と FIB SEM ブロック顔画像処理方法として、上記の異方性ボクセルの決定的な欠点があります。FIB-SEM、適切なドリフト補正されている場合、5 nm3 x 5 x 5 の等方性ボクセルを取得できます。
配列の準備中のセクションの損失による再建された量のギャップは、SBF SEM や FIB SEM. が検出されない懸念もあります。接着剤によって、良いリボン安定化と、通常リボンの最後のセクションの唯一の問題はある: まつげを使用してナイフエッジから離すときは破損している可能性があります。しかし、我々 の経験ですべての 20-50 のセクションで 1 つのセクションの損失は画像の位置合わせに影響しません。
その一方で、後の配列を染色する可能性使うと良好な信号と SEM 用もここに示すルート ヒントを冷凍高圧など弱くメタライズド サンプルのコントラスト。したがって、多数の化学固定法と配線の手順によって最適な微細構造保全を妥協する必要はありません。また、金属の中間程度で病理学研究室からルーチンのサンプルは、優れたデータ10を提供します。このようなポスト埋め込みコントラスト強調は一般的に SBF SEM と FIB SEM のため不可能です。さらに、これらのメソッドは破壊的なので、すなわちイメージング、異なる解像度でサイト画像階層または時間の後で、繰り返されるイメージング中にサンプルを消費することはできません。原則として、大きな FOVs (例えば、コネクトミクス全体のマウスの頭脳の複数のミリメートルまで) から成る、無制限のボリューム作成モザイクをステッチで、AT 中 100 μ x 100 μ m を超えて FOVs FIB SEM によるセクションの膨大な数を得ることができます。ルーチンの楽器と達成するために困難です。
説明でワークフローのさらなる自動化 SBF SEM と FIB SEM の上記の方法を実行両方区分および完全に自動化された方法で同じ楽器内イメージングので決定的な利点であります。断面のオートメーションの 1 つの種類が存在する:、ATUMtome12を生成し、セクションの何千もの収集が、カプトン テープの使用基板はこのような配列、FLM の画像に困難。ここで使用される ito の coverslips にも超解像イメージングが可能なはず。自動化のためのさらに、非常に望ましいターゲットを FLM データ スタックの記録となります。その一方で、オートメーションが高くなり、基板ホルダーを除くここに示すワークフローに依存している (ハードウェア) の面でのみ計測ルーチン EM 研究所または中核施設、ロウで通常利用可能なアクセスのレベルします。
開示事項
キットには、基板ホルダーの機能モデルの供給のための Boeckeler メンツによる払い戻しを受けています。マレーネ Thaler はツァイス顕微鏡 gmbh 社は、この資料に記載されている顕微鏡システムのメーカーの従業員です。さらに、ツァイスはツァイス アトラス SEM と FIB SEM の楽器のための大面積、3 D イメージング アプリケーションの広い範囲のソリューション パッケージなど特定のソリューションを提供しています。他のすべての著者が明らかにする何もあります。
謝辞
この仕事は、教育・研究、プロジェクト MorphiQuant 3 D ドイツ連邦環境省から補助金 FKZ 13GW0044 によって支えられました。テクニカル サポートありがとうカロリン バーテルス。
資料
| Name | Company | Catalog Number | Comments |
| Instrumentation | |||
| Ultramicrotome | RMC | PT-PC | Alternative: Leica UC7 |
| Substrate holder | RMC | ASH-100 | Alternative: home built |
| Plasma cleaner | Diener | Zepto 40kHz | Alternatives: Ted Pella Pelco or other benchtop plasma cleaner Example Parameters for Diener Zepto with 40kHz generator (0-100W); 0.5 mbar, 5 sccm (Air), 10% performance |
| Widefield fluorescence light microscope | Zeiss | Axio Observer.Z1 | Alternatives: Leica, Nikon, Olympus |
| Fluorescence filter set | Zeiss | 43 HE (Cy3/DsRed) | |
| Objective lens | Zeiss | Zeiss Neofluar 40x | 0.75 NA |
| Decent workstation able to handle GB-sized image data | |||
| FESEM | Zeiss | Ultra 55 | Alternatives: FEI, Jeol, Hitachi, TESCAN |
| Name | Company | Catalog Number | Comments |
| Sectioning | |||
| Razor blades | Plano | T585-V | |
| Diamond knife for trimming 45° | Diatome | DTB45 | |
| Diamond knife for trimming 90° | Diatome | DTB90 | |
| Jumbo diamond knife for sectioning | Diatome | DUJ3530 | |
| Silicon wafer (pieces) | Si-Mat | Custom Made | Doping: P/Bor, orientation: <100>, thickness: 525 ± 25 µm, resistivity: 1-30 Ω-cm http://si-mat.com/silicon-wafers.html |
| ITO-coated coverslips | Balzers | Type Z | 22 × 22 × 0.17 mm https://www.opticsbalzers.com/de/produkte/deckglas-fenster/corrslide.html |
| Aluminium carrier | Custom Made | 76 × 26 mm | |
| Wafer forceps | Ideal-tek | 34A.SA | |
| Stubs forceps | Dumont | 0103-2E1/2-PO-1 | Dumoxel-H 2E 1/2 |
| Diamond scriber | Plano | T5448 | |
| Eyelash/very soft cat's hair | Selfmade | Alternative: Plano | |
| Brush | Selfmade | ||
| Pattex contact adhesive | Pattex | PCL3C | Kraftkleber Classic (the yellowish one) |
| Fixogum | Marabu | 290110001 | for fixing substrate to carrier |
| Adhesive tape | 3M | 851 | for fixing substrate to carrier |
| Isopropanol | Bernd Kraft | 07029.4000 | |
| Xylene | Carl Roth | 4436 | thinner for glue mixture |
| Rotihistol | Carl Roth | 6640 | alternative, limonene based thinner |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Image processing | Open source | Fiji (http://fiji.sc/#download) | |
| Image acquisition | Zeiss | Atlas 5 AT (module for Zeiss SEM) | Alternative for automated image acquisition: WaferMapper: https://software.rc.fas.harvard.edu/lichtman/LGN/WaferMapper.html |
| Name | Company | Catalog Number | Comments |
| Staining | |||
| Propidiumiodide | Sigma-Aldrich | P4170 | Stock solution: 1.5 mM in 0.1 % sodium azide |
| Uranylacetate | Science Services | E22400 | |
| Lead(II) Nitrate | Merck | 107398 | |
| Tri Sodium Citrate Dihydrate | Merck | 106448 | |
| NaOH pellets | Merck | 106469 | |
| 1M NaOH solution | Bernd Kraft | 01030.3000 | |
| Glass petri dish | Duran | 23 755 56 | |
| Name | Company | Catalog Number | Comments |
| Mounting | |||
| Stubs | Plano | G301F | |
| Carbon pads | Plano | G3347 | |
| Copper tape | Plano | G3397 | double-sided adhesive, conductive |
| Silver paint | Plano | G3692 | Acheson Elektrodag 1415M |
| Name | Company | Catalog Number | Comments |
| Solutions/mixtures | |||
| Adhesive mixture for coating blocks | Pattex contact adhesive /xylene as thinner, ratio 1:3. (Alternative for xylene: Rotihistol) | ||
| Reynolds lead citrate | 50 mL: Dissolve 1.33 g of lead(II) nitrate in 10 mL of dH2O. Dissolve 1.76 g of tri-sodium citrate dihydrate in 10 ml dH2O. Mix both and add 1 M sodium hydroxide until the solution is clear. Fill up with dH2O to 50 mL. | ||
| Propidium iodide staining solution | Prepare 1:1500 dilution from stock in dH2O. Vortex for adequate mixing. | ||
| Aqueous uranyl acetate | Dissolve 3 % uranyl acetate in dH2O (mix thoroughly). |
参考文献
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: Volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Wanner, A. A., Kirschmann, M. A., Genoud, C. Challenges of microtome-based serial block-face scanning electron microscopy in neuroscience. J Microsc. 259 (2), 137-142 (2015).
- Kizilyaprak, C., Daraspe, J., Humbel, B. Focused ion beam scanning electron microscopy in biology. J Microsc. 254 (3), 109-114 (2014).
- Wacker, I., Schröder, R. R. Array tomography. J Microsc. 252 (2), 93-99 (2013).
- Tapia, J. C., Kasthuri, N., Hayworth, K. J., Schalek, R., Lichtman, J. W., Smith, S. J., Buchanan, J. High-contrast en bloc staining of neuronal tissue for field emission scanning electron microscopy. Nat protoc. 7 (2), 193-206 (2012).
- Lucas, M. S., Günthert, M., Gasser, P., Lucas, F., Wepf, R. Bridging Microscopes: 3D Correlative Light and Scanning Electron Microscopy of Complex Biological Structures. Methods Cell Biol. 111, 325-356 (2012).
- De Boer, P., Hoogenboom, J. P., Giepmans, B. N. Correlated light and electron microscopy: ultrasructure lights up!. Nat Methods. 12 (6), 503-513 (2015).
- Verkade, P., Müller-Reichert, T. . Methods in Cell Biology Correlative Light and Electron Microscopy III. 140, 1-352 (2017).
- Gibson, K. H., Vorkel, D., Meissner, J., Verbavatz, J. -. M. Fluorescing the Electron: Strategies in Correlative Experimental Design. Methods Cell Biol. 124, 23-54 (2014).
- Wacker, I., Schröder, R. R., Schroeder, J. A. Pathology goes 3D: Exploring the potential of array tomography versus FIB nanotomography for a CADASIL sample. Ultrastruct Pathol. 41 (1), 114-115 (2017).
- Wacker, I., Spomer, W., Hofmann, A., Thaler, M., Hillmer, S., Gengenbach, U., Schröder, R. R. Hierarchical imaging: a new concept for targeted imaging of large volumes from cells to tissues. BMC Cell Biol. 17 (1), 38 (2016).
- Hayworth, K. J., Morgan, J. L., Schalek, R., Berger, D. R., Hildebrand, D. G. C., Lichtman, J. W. Imaging ATUM ultrathin section libraries with WaferMapper: a multi-scale approach to EM reconstruction of neural circuits. Front Neural Circuits. 8, (2014).
- Micheva, K. D., O'Rourke, N., Busse, B., Smith, S. J. Array Tomography: Production of Arrays. Cold Spring Harb Protoc. 11, 1267-1269 (2010).
- Fahrenbach, W. H. Continuous serial thin sectioning for electron microscopy. J. Elec. Microsc. Tech. 1 (4), 387-398 (1984).
- Harris, K. M., et al. Uniform serial sectioning for transmission electron microscopy. J Neurosci. 26 (47), 12101-12103 (2006).
- Schindelin, J., Arganda-Carreras, I., Frise, E., Kaynig, V., Longair, M., Pietzsch, T., Preibisch, S., Rueden, C., Saalfeld, S., Schmid, B., Tinevez, J. -. Y., White, D. J., Hartenstein, V., Eliceiri, K., Tomancak, P., Cardona, A. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Cardona, A., Saalfeld, S., Schindelin, J., Arganda-Carreras, I., Preibisch, S., Longair, M., Tomancak, P., Hartenstein, V., Douglas, R. J. TrakEM2 software for neural circuit reconstruction. PLoS ONE. 7 (6), e38011 (2012).
- Micheva, K. D., Smith, S. J. Array Tomography: A new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55 (1), 25-36 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved