Method Article
最適化された小型リン定量法を用いた粒状水酸化第二鉄に酸の吸着を確認する手順
要約
鉄を含むフィルター材料に酸の吸着を調査する手順について述べる少しの努力と高い信頼性で、特に粒状水酸化第二鉄。バッファー溶液中、ホスホン酸、ローテーターを用いた吸着剤との接触をもたらしたし、小型リン定量法によって解析し。
要約
鉄を含むフィルター材料に酸の吸着を調査する手順を紹介する特に粒状水酸化第二鉄 (GFH)、少しの努力と高い信頼性。ホスホン酸、例えばトリメチルホスホン酸ニトリル (NTMP) は GFH 有機酸 (例えば酢酸) または良いバッファー (例えば2-(Nmorpholino) によってバッファー溶液中の回転子の接触ethanesulfonic 酸) 【 MES 】 とN- シクロヘキシル-2-ヒドロキシ-3-aminopropanesulfonic 酸 [CAPSO]) 50 mL 遠沈管の特定の時点の 10 mM の濃度で。その後、膜ろ過 (0.45 μ m 孔サイズ)、合計後とりわけ開発された定量法 (ISOミニ) を用いたリン (合計 P) 濃度の測定します。このメソッドは、変更および ISO 6878 法の簡略化: 4 mL のサンプルを4と K2S2O8スクリュー キャップでバイアル、H2と混合、148-150 ° c 1 時間加熱、NaOH で混ぜ、アスコルビン酸、酸性モリブデン酸アンチモン (iii) (10 mL の最終巻) とブルー錯体を生成します。リン濃度に正比例は、色の輝度、光光度法による測定 (880 nm)。使用されるバッファー濃度には pH 4 と 12 の間ホスホン酸の吸着に重要な影響がないことを示しています。したがって、バッファーは吸着サイトのホスホン酸とは競合しません。さらに、バッファーの比較的高い濃度は NaOH 量と一致する ISO 6878 で指定されたよりも消化に (8K2S2O) の酸化剤の高用量濃度を必要とします。各バッファー。簡素化にもかかわらず ISOミニ方法は標準化された方法と比較してその精度が失われません。
概要
モチベーション
表面水に、必要であるとりわけ、欧州水枠組み指令1の実装のコンテキストで栄養を減らす努力リン排出量のより詳細な検討が必要です。浄水処理、冷却水の硬度の安定剤として、洗剤や洗浄剤剤として繊維、紙工業の漂白剤として使用されている (図 1)、酸の化学物質グループは特に量・環境関連2関連します。ホスホン水ボディ2,3,4の長期的な富に貢献する疑いがあります。たとえば、日光または MnIIと溶存酸素の存在下で紫外線によるホスホンは微生物学的利用可能な隣酸塩5,6に低下する可能性が。リン酸の供給過剰リンの水域の生態学的地位の継続的な改善のための重要なターゲット物質を作る、水域の生態学的不均衡の本質的な特徴であります。
ホスホンは、7、8,9,10を塩、鉄やアルミを使用してときに、析出・凝集による廃水から削除できます。このプロセスでは、金属は難溶性の金属水酸化物に変換されます。比較的大きな比表面積を持つこれらの極の群れは負荷電の酸の吸着剤として機能します。しかし、凝集プロセスは 2 つの主要な不利な点を持つことができます。に応じて、排水汚泥量試料量の 30% までの11に発生します。この汚泥は、分離、扱われ、さらに堆積またはフィルター ステージで処分します。さらに、ホスホン複雑な追加の凝集剤をことができます、特に硬さが低水排水中の群れの形成を防ぐため。この効果は、凝集剤の増加量によって補正できます。ただし、これは高められた β 値につながる (β = 排水中リン凝集剤のモル比)11,12。複雑な排水のマトリックスでは、したがって、最適な凝集剤投与量のコントロールが複雑に。
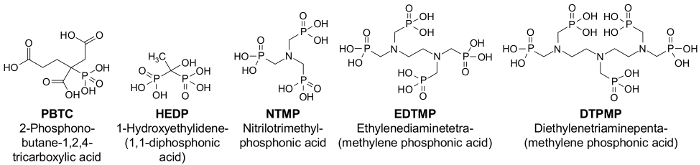
図 1: 重要なホスホン11.の構造式この図の拡大版を表示するのにはここをクリックしてください。
金属含有表面に酸の高吸着親和性を悪用可能な代替は、上記されていない欠点は、酸化鉄 (洗面) に基づくフィルター材料。そのようなフィルター材料の文献はリン酸13,14,15,16の除去への調査を中心に述べる。粒状水酸化第二鉄 (GFH) ホスホン少しワークロードと有意な関連が特にこの作品で、選択の粒状フィルター材料の吸着能力の調査を可能にするプロシージャを紹介します。コスト削減します。吸着量の研究は、次の手順に分けることができます: ホスホン酸ソリューション、吸着試験 (、顆粒のホスホン酸溶液の接触) ホスホン酸分析の準備。すべてのステップは、完全に調整しなければなりません。
吸着テストと適切なバッファーの使用のための概念
吸着能力の研究のためバッチまたは列のテストを実行できます。吸着等温式または吸着剤の pH 依存性を決定するためにバッチ アプローチは、いくつかのパラメーターを変えることの可能性を時間の短い期間内に多くの結果を取得できるので優れています。PH 値は、吸着に影響を与える最も重要な要因の 1 つです。遵守や pH 値の調整は、吸着剤との接触以前に試料溶液の pH 値の単純な調整は通常不十分である検査技師にとって大きな挑戦です。各吸着剤の材料は、おおよその点電荷 (PZC) の pH を目指して通常。したがって、吸着剤と直接接触のとき 8 の pH 値に変化したこと、水溶液、例えばpH 3 に調整可能です。排水は、この効果を減衰する自然のバッファリング能力をほとんどの場合は。合成廃水を使用する場合、ただし、特定のターゲット物質の除去のみの特定の吸着剤を検討する、すなわち、具体的に対象物質、例えば、競争力のあるスパイクは、純粋な水、陰イオン。対照的に粉末吸着剤、pH 値は、酸を追加することによって目的の範囲で簡単に維持することができますオープン攪拌容器、このフォームで pH 無調整の基地とバッチのアプローチで行うことができます、粒状になります。顆粒均一中断を維持するために非常に高い攪拌速度が必要、材料の非常に急速な摩耗で発生します。このような耐摩耗性を意図しない場合穏やかな方法は、ソリューションの継続的に混合顆粒を保つために閉じた遠沈管を回転します。PH 値を一定に保つ唯一の方法は、バッファーを使用するここでは。
リン酸塩及びフィルター材料の鉄を含むホスホン酸塩の吸着を調査することができるためにバッファーの次の要件を満たす必要があります: リン;無色。水溶性。せいぜい、ないの錯化剤;ホスホン極フィルター素材への吸着についての競争無し使用される; 異なるバッファーの同じような構造バッファーまたはその分解物合計 P 定量消化後ない複雑な色のスペクトルの吸光度にマイナスの影響を持つ必要があります。生化学研究分野のいわゆる良いバッファーが開発した17,18,19、ちょうどこれらの特質があります。したがって、この作品の調査について表 1にバッファーが選ばれました。PK 値の各バッファーは、バッファーによって一定保つことができる範囲を示します。ただし、pH 範囲 < 5、クエン酸 (CitOH) と (中) 酢酸などの有機酸は使用する必要があります。クエン酸は錯化剤が、それは、ほとんど鉄を含むフィルター材料がとにかく不安定になる ph のバッファーします。酢酸とモップはいた NTMP のスラリー ゲーサイト (α-成熟) ph 4.6 と 7.2 への吸着を調査するノバックと石7によって既に使用います。しかし、吸着の pH 依存性の実験は、バッファリングせず場所を取った。
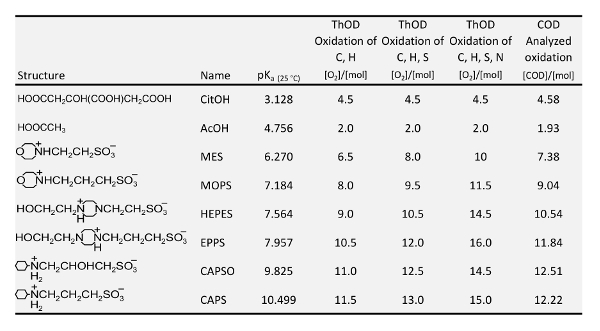
表 1: pK、値20、理論的酸素要求量 (ソード) と分析実際化学的酸素要求 (量 COD) 本研究で使用されるバッファーの。
合計 P 決定 (ISOミニ) 緩衝液に適応
各吸着試験後各ソリューションは、残留ホスホン酸濃度を分析する必要があります。ごく最近、0.1 μ g/L の範囲で定量の限界による環境試料中の酸の定量法が導入されました。それは IC-誘導結合プラズマ質量法および (ホスホンの「無料」ホスホン酸への変換) の陽イオン交換と陰イオン交換器 (酸濃度の前) の21の使用に基づいています。さらに、すでに 1997 年にノバックの22から法で導入された 15 100 μ g/L、鉄III、高速液体クロマトグラフィーおよびこれらの吸光光度検出を使用する保存とホスホンの pre 錯形成に基づいているの検出のより高い限界複合体。ただし、これらのメソッドは、非常に時間がかかり、高価です。唯一リン含有化合物は、ホスホン酸合成廃水を研究、合計 P 濃度を決定するホスホン酸濃度を決定するのに十分です。無機リン酸の定量は、後者前の消化を必要と合計 P の決定よりもはるかに少ない問題実験者を提示します。事前に加えられなければならない化学物質の量は、サンプルで現在の化合物に正確にマッチしなければなりません。
リン酸イオンの定量現在主にマーフィーとライリーの23により導入されたメソッドを使用して実行されます。このメソッドは激しく着色されたリンモリブデン ブルー錯体の吸光光度検出に基づいて ([PSb2Mo12O40]− λmaxで 880 で nm) リン酸の存在下で形成されていると酸性モリブデン酸アスコルビン酸とアンチモン (iii) 還元剤24として使用しています。他の研究 [H+] の最適な比率で: [ミズーリ州] 60 8025,26に決定しました。合計 P、消化を決定するためにすなわちC O P, リン含有 C P 社債 P-O-P の破壊化合物し、リンのリン酸への酸化は、リンモリブデン青形成24前に遂行されなければなりません。.Eisenreichら27は、酸性の環境で酸化剤ペルオキソ (8K2S2O) の使用に基づいて簡易法を発表しました。これらの結果の多くは ISO 687828, リン酸 P 及び水試料 (排水・海水) の全 P 濃度の定量のための手順を体系的に説明する開発組み込まれています。
ISO 6878 (図 2) によると総 P 決定 K2S2O8の少なくとも 30 分の酸性 pH (硫酸の使用) で三角フラスコで消化されるべきサンプルが必要です。消化力の後の pH 値は 3-10 NaOH とのエルレンマイヤー フラスコ 50 mL のメスフラスコに転送されるコンテンツを使用してに設定されます。このフラスコにアスコルビン酸、モリブデン酸塩及びアンチモンを含む酸性溶液をサンプルに追加され、その後、水で満たされました。880 の波長でのこの青の色の強度を測定 10 ~ 30 分後 nm。リン酸定量の場合、消化は省略されます。つまり、サンプルはアスコルビン酸と同様、アンチモン、モリブデン酸を含む溶液 50 mL メスフラスコに混合され青発色の強さは、光度計で測定します。
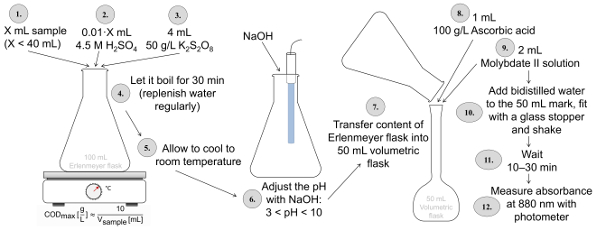
図 2: ISO 6878 NaOH とアスコルビン酸、モリブデン酸を含むを使用して着色後の pH 調整、ペルオキソ二硫酸カリウム硫酸を使用して消化を適用によると総 P 決定のプロシージャ ソリューションです。この図の拡大版を表示するのにはここをクリックしてください。
それする必要があります常に世話をすると消化中にサンプルが沸騰しないと ph 3-10 サンプルの調整は時間が長いので、総 P 測定のプロシージャは非常に複雑。非常に短い時間でできるだけ多くのサンプルを分析するために、合計 P とオルト リン酸定量の小型フォームはこの ISO メソッドに基づいて開発されました。図 3では、このメソッドの各ステップをまとめたものです。カラー ソリューションの最終巻は、この小型定量法 (ISOミニ) 10 mL (ISO 方式でこれは 50 mL)。したがって、ISOミニメソッドは、5 分の 1 を使用するソリューションの量を減らします。ISOミニメソッドで、148-150 ° c 最も高い可能な酸化を取得する、その消化が (消化をホット プレートに三角フラスコ提案 ISO 法) と対照をなしてサーモスタットで実施は。アスコルビン酸と酸性モリブデン酸溶液と共に消化後 NaOH が追加されます。
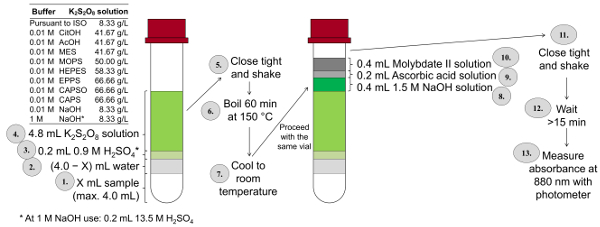
図 3: ISO 6878 の変更および小型形態に応じて合計 P 決定のプロシージャ (ISOミニ) バイアル 10 mL スクリュー キャップを使用して、バッファーに依存カリウム ペルオキソ二硫酸濃度、加熱サーモスタットと添加以前にそれを転送することがなく直接消化サンプルに試薬を色します。この図の拡大版を表示するのにはここをクリックしてください。
サンプルに含まれている有機バッファー必要があります効果的に pH 値を維持するためにホスホン酸 (5-30 μ M) と比較すると比較的高濃度 (10 mM) であります。これらのバッファーは、吸着試験後合計 P の分析のため消化する必要があります。したがって、酸化剤の投与量を考慮するあまりにも多くの酸化剤消化後に形成された複雑な色の形成を妨げてはならない、各バッファーにマッチしなければなりません。合計 P 定量分析化学的酸素要求量 (COD) に基づいて各バッファーの消化に必要な K2S2O8数量を推定するために、どのように多くの電子の比較を時に変換できる、O2 K2S2O8の削減が必要です。
O2 + 4 H+ + 4 e- → 2 H2O
S2O82 - + 2 e- → 2、42-
したがって、特定の分子の酸化は、O の2分子として倍のペルオキソ二硫酸分子を必要です。したがって、20 mL のサンプル ボリュームの場合、サンプルのタラを超えない 500 mg/L ISO メソッドを使用する場合。しかし、MES の表 1から最小のモル質量と良いバッファーの場合でも既に 2.4 g/L のタラは 10 mM の濃度で存在。吸着テストおよび ISOミニメソッド本稿の手順プロトコルに加えて、調査必要なバッファー濃度, ホスホン酸吸着にバッファーと K2S2O8 の影響ISOミニ方法で彼らの消化に必要な水酸化ナトリウム投与量と量。
フロイントリッヒ吸着モデル
吸着等温線、すなわち、特定の接触時間後の吸着 (mg/L P) の溶存濃度 c に適用される (例えばmg/g の P 吸着剤の) q の読み込みをモデルには Freundlich29によって提案された式。
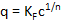
Ln(c) 上得られた実測値 q および c をプロット関数 ln(q) の形で線形回帰によって決まりますこの関数の勾配は 1/n と KF値30y 軸切片に対応します。
プロシージャの概要
ホスホンに関して粒状水酸化第二鉄の吸着容量を決定するためのプロセス全体は、いくつかのステップに分かれています、プロトコル」に記載されています。分析試薬 (プロトコルのセクション 1) の十分な量を準備する必要は。数週間の耐久性です。ホスホン酸含有溶液 (セクション 2)、準備し、吸着試験 (粒状材料のホスホン酸溶液の接触) が続く (セクション 3) と合計 P 小型 ISO 法 (セクション 4) によるとの分析。
プロトコル
1. すべての準備合計 P 測定ソリューションが必要
注: 以下の解決策のいくつかの準備、ISO 687828説明します。これらの製法は、少しこの作品の手法に適応されています。化学物質の純度の必要度は、添付のマテリアルのリストで見つけることができます。
- H2の準備など4ソリューション (13.5、9、0.9 M H2SO4)
注意: は、ヒューム フードの下で動作します。- 13.5 M H24の準備
- 25 mL の水で 100 mL のメスシリンダーのシリンダーを入力し、ビーカーに氷に囲まれた 100 mL ガラス瓶の中にそれを転送します。
- 75 ml の濃硫酸の同じメスシリンダーを入力し、ボトルの水に攪拌下でそれを転送します。注意:熱開発。
- それは十分に (最大 40 ° C) 冷却されるとすぐに、ボトルをビーカーから慎重に取る。
- 調製された 9 M H2SO4 (モリブデン酸溶液の調製に必要な)
- 700 mL の水で卒業 1 L シリンダーを入力し、バケツに氷に囲まれた 3 L ガラス ビーカーにそれを転送します。
- 700 ml の濃硫酸の同じ卒業 1 L シリンダーを入力し、3 L ビーカーの水に攪拌下でそれを転送します。注意:熱開発。
- (最大 40 ° C) まで十分に冷やすとすぐにバケツ 3 L ビーカーを慎重に取るし、2 L ガラス瓶の中にその内容を転送します。
- 0.9 M H24の準備
- 約 100 mL の水を 250 mL のメスフラスコを入力します。
- だから 9 M H2の 25 mL を転送4 (1.1.2 参照) 25 mL のピペットを使用して 250 mL のメスフラスコに。注意:熱開発。
- 250 mL リング マークまで水で 250 mL のメスフラスコを埋めます。
- 周辺、ストッパー メスフラスコは均質化のため数回振るし、250 mL ガラス瓶の中に、メスフラスコのコンテンツを転送します。
- 13.5 M H24の準備
- リンス液 (約 2 M) HCl の準備
注意: は、ヒューム フードの下で動作します。- 1 L の水を 2 L 卒業シリンダーを入力します。
- 400 ml 32% (w/w) 塩酸のこのメスシリンダーを入力します。
- 600 mL のメスシリンダーに 2 L の容量を得るために水を追加します。
- 攪拌棒 (例えば、卒業ピペット) と 2.5 L のガラス瓶に、メスシリンダーのコンテンツ転送メスシリンダーのコンテンツ。
- クローズ ボトルは、それを振る逆さま数回均質化のため。
- 色の変化が明らかになるまでの間だけは、このソリューションを再利用できます。その後、洗浄液を捨て、新しいものを準備します。
- HCl 溶液 (10.2 および 2 M) の調製
注意: は、ヒューム フードの下で動作します。- 10.2 M HCl として 32 %hcl (w/w) を使用します。
- 2 M HCl の準備
- 32 %15 mL を 100 mL のメスフラスコを埋める HCl (10.2 M) 15 mL のピペットを使用しています。
- 32% の別の 4.67 mL を加えてメスフラスコ、ピペットを使用する HCl (10.2 M)。
- 100 mL リング マークまで水で、メスフラスコを埋めます。
- ストッパーをメスフラスコを閉じるし、それを振る逆さま数回均質化のため 100 mL ガラス瓶の中に、メスフラスコのコンテンツを転送します。
- 水酸化ナトリウム溶液の調製 (10, 2, 1.5 M NaOH)
注意: は、ヒューム フードの下で動作します。- 小さなビーカーに水酸化ナトリウムの 100.0 g (10 M)、(2 M) の 20 g や 15 g (1.5 M) の重さし、250 mL のメスフラスコにビーカーの内容を転送します。
- 250 mL リング マークまで水で、メスフラスコを埋めます。ストッパーをメスフラスコを閉じて、それを振る逆さま数回均質化のため (注意:ソリューションは、高温になることができます)。水のレベルの高さは、もはやリング マークに対応している場合より多くの水 (溶解プロセスの結果として合計ボリュームの変更) を追加します。
- 250 mL のペットボトルに、メスフラスコの内容を転送 (注意: NaOH 溶液のガラスびんを使用しないでください)。
- K2S2O8溶液/懸濁液の調製 (8.33 フレーム 41.67、50.00、58.33、66.66 g/L)
注: 異なる集中ペルオキソ二硫酸の混合物がリンを決定するため必要です。それらのいくつかは K2S2O8約 50 g/l 20 ° C での飽和制限値の上なので茶色のガラス瓶に直接 K の2S2O8の重さし、それに対応する水量を注ぐことをお勧めですか使用容積測定フラスコ準備のため)。- 2.08 g (8.33 g/L) の重量を量る 10.42 g (41.67 g/L)、12.50 (50.00 g/L) 14.58 g (58.33 g/L) または固体 K2S2O の8ブラウン 250 mL ガラス瓶に直接の 16.67 g (66.66 g/L)。
- 250 ml の水をメスシリンダーを埋めるし、瓶の中 K の2S2O8をこの水を注ぐ。
- すべての成分を溶解しているまで、またはのみわずかな濁りがあるボトルの内容をかき混ぜます。
- マグネチックスターラー不溶 K2S2O8は、できるだけ均一としても得ることができることを確保するために高乱流下 O8 K2S2の抽出を行います。
- 100 g/L アスコルビン酸溶液の調製
- 500 mL のメスフラスコにアスコルビン酸の 50 g の重量を量る。
- 500 mL リング マークまで水で、メスフラスコを埋めます。
- アスコルビン酸を完全に溶解するまで、マグネチックスターラーでメスフラスコのコンテンツをかき混ぜます。(気をつけてボリュームを与えるバー攪拌) 少しより多くの水を追加することによりリング マークと一致する水面のレベルを修正する必要があります。ブラウン 500 mL ガラス瓶の中に、メスフラスコのコンテンツを転送します。
- モリブデン酸の準備私 (リン酸を決定するために必要な) ソリューション
- 100 mL ガラス瓶に直接固体 (NH4)6Mo7O24∙4H2O の 13.0 g の重量を量る。100 mL の水で、メスシリンダーを記入し、瓶にそれを注ぐ。それを完全に溶解するまで、マグネチックスターラーでボトルの内容をかき混ぜます。
- 固体 K (SbO) C4H4O6∙½H2O 新鮮な 100 mL の瓶に直接 0.35 g の重量を量る。100 ml の水をメスシリンダーを記入し、それを完全に溶解するまで、ボトルの K (SbO) C4H4O6∙½H2O. 攪拌コンテンツでボトルにそれを注ぐ。
- だから 9 M H2の 300 ml をメスシリンダーを埋める4 (1.1.2 参照) とブラウン 500 mL ガラス瓶の中に注ぐ。
- だから 9 M H2の 300 ml (NH4)6Mo7O24∙4H2O ソリューションを追加4。その後、K (SbO) C4H4O6∙½H2O ソリューションをこの混合物に追加します。クローズ ボトルは、均質化のため逆さまにそれの数回を振る。
- (合計 P を決定するために必要な) モリブデン酸 II ソリューションの準備
- 100 mL ガラス瓶に直接固体 (NH4)6Mo7O24∙4H2O の 13.0 g の重量を量る。100 mL の水で、メスシリンダーを記入し、瓶にそれを注ぐ。それを完全に溶解するまで、マグネチックスターラーでボトルの内容をかき混ぜます。
- 固体 K (SbO) C4H4O6∙½H2O 新鮮な 100 mL の瓶に直接 0.35 g の重量を量る。100 ml の水をメスシリンダーを記入し、それを完全に溶解するまで、ボトルの K (SbO) C4H4O6∙½H2O. 攪拌コンテンツでボトルにそれを注ぐ。
- 70 ml の水をメスシリンダーを入力します。追加し、230 mL の 9 M H24 (1.1.2 参照) メスシリンダーで水に (すなわち、300 mL を埋める)。慎重に (例えば、卒業ピペット) ロッドとメスシリンダーのコンテンツをホモジナイズしてください。ブラウン 500 mL ガラス瓶の中にメスシリンダーの内容を転送 (現在のコンテンツ: 6.9 M H2SO4)。
- だから 6.9 M H2の 300 ml (NH4)6Mo7O24∙4H2O ソリューションを追加4。その後、K (SbO) C4H4O6∙½H2O ソリューションをこの混合物に追加します。クローズ ボトルは、均質化のため逆さまにそれの数回を振る。
- 内部品質標準の準備 (IQS: 1 mg/L KH2PO4P の 0.9 mM H2SO4)
- 大量の恒常性が達成されるまで KH2PO4 105 ° c 乾燥オーブンで小さなガラス皿の数グラムを乾燥乾燥器で部屋の温度まで KH2PO4を冷却します。
- 1 L メスフラスコに 0.2197 g ± 0.0002 g 織ってから直接 KH2PO4の重量を量るし、メスフラスコに約 800 mL の水を追加します。
- 9 M H2の 5 mL を追加し、今4 (1.1.2 参照) まで水を 5 mL ホール ピペットと塗りつぶしフラスコを使用してフラスコに 1 L リング マーク。
- 磁気攪拌のメスフラスコのコンテンツを攪拌し、1 L のガラス瓶に、メスフラスコの内容を転送 (現在のコンテンツ: 50 mg/L KH2PO4-45 mM H2P など4)。このソリューションは、IQS の準備のため、原液として今後使用できます。
- この溶液 10 mL を 10 mL のピペットを使用して 500 mL のメスフラスコに移す、容積測定フラスコ 500 mL リング マークまで水で満たし、磁気攪拌のメスフラスコのコンテンツをかき混ぜます。
- 500 mL ガラス瓶の中に、メスフラスコの内容を転送 (現在の内容: 1 mg/L KH2PO4-0.9 mM H2P など4)。このソリューションは、知能指数です。
2. 準備ホスホン酸含有バッファー ソリューション
- 重量または容積測定フラスコに必要なバッファーをピペット (1 l、例えば0.01 M バッファーのターゲット濃度: 100 %572 μ L 中、CitOH· の 2.1014 gH2O、MES のモップ、HEPES、エップス、2.3732 g 2.5233 g 2.3831 g 2.0926 g 1.9520 g CAPSO、キャップ、2.2132 g、2 メートル naoh 水溶液 5 mL)。
- 水で約 4 分の 3 にメスフラスコを記入し、(1 l、例えば、1 mL 1 g/L ホスホン酸 P の P を 1 mg/L の濃度になる) の事前に準備された 1 g/L ホスホン酸 P 原液を追加します。
- リング マークまで水でフラスコを満たす、すべての成分が分解し、ガラスのボトルにそれを転送するまで、マグネチックスターラーでフラスコの内容をかき混ぜます。
- を攪拌しながら調整 (例えば、2 と 10.2 M) 塩酸または水酸化ナトリウム (例えば、2 と 10 M) と緩衝液 (例えば、pH 6 MES) 望ましい pH 値 (酸・塩基性溶液添加避けるべき不要なを防ぐためにイオン強度の増加)。
- ホスホン酸 P 濃度を決定するするには、ステップ 4 によると進みます。
3. 吸着試験の手順
- 蒸留水 (例えば、0.5 mm の網目のふるいの上) で徹底的にフィルター材料を洗って、それからそれを 80 ° C で乾燥
注:プロトコルはここで一時停止することができます。 - 50 mL の遠心管にフィルター材料 (例えば、粒状の水酸化第二鉄) の重量を量る。
注:プロトコルはここで一時停止することができます。 - 50 mL のマークまで手順 2 からホスホン酸含有溶液を 50 mL 遠心管をすばやく入力します。
- すぐに管を閉じて (接触時間開始さあ今から) 実行中の回転子にクランプします。
- 特定の期間 (例えば、1 h) のための分あたり 20 回転でチューブを回転させます。
- 空のガラス瓶に、シリンジ フィルター (0.45 μ m 孔サイズ) と上澄みの約 10-20 mL をフィルターします。
注:プロトコルはここで一時停止することができます。 - 濾液の pH 値を判断し、ホスホン酸 P を決定する濃度は、手順 4 に進みます。リン酸吸着を調査した場合に、手順 5 に進みます。
4. ISOミニによると総 P (ホスホン酸 P) の定量
注: 次の手順は、図 3に示すがまた。
- 分析するサンプルの因数を転送 (Vサンプル最大 4 mL) 10 mL スクリュー キャップのバイアルにマイクロ ピペットを使用して (キャップを含むバイアルは HCl に中古リンスする必要があります (1.2 参照) と H2O 80-100 ° C で乾燥した)。
注: プロトコルはここで一時停止することができます。 - 以前に追加されたサンプルと共に 4 mL の容量を取得するマイクロ ピペットで水を加える (V水4 mL-Vサンプルを =)。
注: プロトコルはここで一時停止することができます。 - 0.9 M H2の 0.2 mL を追加し、4ソリューション (1.1.3 参照) マイクロ ピペットを使用しています。再生ソリューションの場合と同様で、多くの場合、サンプルでは、1 M NaOH の濃度がある場合は、13.5 M H2の 0.2 mL を追加し4ソリューション (1.1.1 を参照) (注意:硫酸のこのソリューションは非常に濃縮)。
注: プロトコルはここで一時停止することができます。 - 4.8 mL を追加、K2S2O8溶液/懸濁液の濃度を (1.5 を参照してください)、サンプルに含まれているバッファーに依存 (0.01-1 での ISO に対応する M NaOH: 8.33 g/L K2S2O8; 0.01 MCitOH、中、MES: 41.67 g/L;0.01 M モップ: 50.00 g/L;0.01 M HEPES: 58.33 g/L;0.01 M エップス、CAPSO、キャップ: 66.66 g/L)。
- 非常にしっかりとキャップと瓶を閉じて、それを振る。
- 148-150 ° C で 1 時間のサーモスタットにバイアルを加熱します。
- サーモスタットから小瓶を取り出して、室温まで冷ます。
注: プロトコルはここで一時停止することができます。 - バイアルを開き、1.5 M NaOH 溶液 0.4 mL を追加 (1.4 参照)。
注: プロトコルはここで一時停止することができます。 - 100 g/L アスコルビン酸溶液 0.2 mL を追加 (1.6 参照)。
- その後、0.4 mL モリブデン酸 II ソリューションを追加 (1.8 を参照してください)。
- バイアルを閉じるし、均質化のため逆さに向けることです。
- 発色の 4 h の最大最小 15 分待ちます。
- 測定スペクトルの吸光度 (A) 波長 880 nm の吸光度計。
- (の盲目の定量) 4 mL (1.9 参照) IQS のにとっても、水の 4 つの mL を定期的に 4.1 4.13 手順実行します。
- 合計 P またはホスホン酸 P 濃度に基づいて特定分析サンプル (A)、(、ブラインド) ブラインド サンプルとサンプル量 (Vサンプル) の吸光度吸光度分析のサンプルを次を使用して計算します。方程式 (0.287 1 cm キュベットと検量線の傾きに対応し、光度計によって逸脱することができます)。
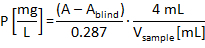
5. o PO43 -の定量-P ISOミニによると
注: 粒状フィルター材料、無機のオルト リン酸イオンの吸着は調査するときは、この測定法を使用できます。この場合は、テストするサンプルは、消化する必要はありません。
- 分析するサンプルの因数を転送 (Vサンプル、最大 9.4 mL) 10 mL スクリュー キャップのバイアルにマイクロ ピペットによる (キャップを含むバイアルは HCl に中古リンスする必要があります (1.2 参照) と H2O 80-100 ° C で乾燥した)。
注: プロトコルはここで一時停止することができます。 - 以前に追加されたサンプルと共に 9.4 mL の容量を取得するマイクロ ピペットで水を加える (V水9.4 mL-Vサンプルを =)。
注: プロトコルはここで一時停止することができます。 - 100 g/L アスコルビン酸溶液 0.2 mL を追加 (1.6 参照)。
- その後、モリブデン酸の 0.4 mL を追加私ソリューション (1.7 を参照)。
- バイアルを閉じるし、均質化のため逆さに向けることです。
- 発色の 4 h の最大最小 15 分待ちます。
- 測定スペクトルの吸光度 (A) 波長 880 nm の吸光度計。
- (の盲目の定量) 4 mL (1.9 参照) IQS のにとっても、水の定期的に 9.4 mL の 5.1 5.7 手順実行します。
- (、ブラインド) ブラインド サンプルとサンプル量 (Vサンプル) の分析サンプル (A) の特定の吸光度、に基づいて 4.15 で方程式を用いた分析のサンプルのオルト リン酸 P 濃度を計算できます。
結果
これらの手法で得られた等温線の例
GFH によって異なる pH 値で NTMP の吸着の調査の場合プロトコルを適用するときを得た結果の例を図 4に示します。3 ホスホン酸のグループ、それがうちホスホン酸のグループの数 1 つ (PBTC) と 5 つの異なる可能なホスホンの広いスペクトルの最も代表的なホスホン酸ので NTMP が選ばれた (DTPMP)。さらに、NTMP のモル質量 (299.05 g/mol) が酸の中間の範囲でもある (HEDP: 206.03 g/mol、DTPMP: 573.20 g/mol)。図 4、吸着等温線、すなわち、上記の残留ホスホン酸濃度ホスホン酸の読み込みは後 1 h の回が望ましくないにつながる可能性がより長い接触の接触時間の異なるバッファーと pH 値に描かれ粒子間の長時間接触による材料の摩耗。それぞれの等温線は 1 mg/l NTMP ソリューションの-P と、目的の ph に依存を 0.01 M を作成し、塩酸または水酸化ナトリウムによる pH 値に調整濃度のバッファーします。これは、4.0 (中)、6.0 (MES)、(エップス) 8.0、10.0 (CAP) 12.0 (NaOH) だった。1 h の接触時間の結果として、GFH 濃度によって溶液中の水素イオン濃度指数 2.0 の最大によって変更: 4.0 6.0 (中) 6.0 7.3 (MES)、8.0-8.2 (エップス) 9.4 10.0 (CAP) 10.9 12.0 (NaOH)。GFH PZC は約 8.6 設定 pH 値 > 8.6 の場合 pH 値 GFH との接触により減少し、pH 値 < 8.6 で増加したことは必然です。これは、さらに離れて調整 pH 値は 8.6 から強い pH 変化だった。
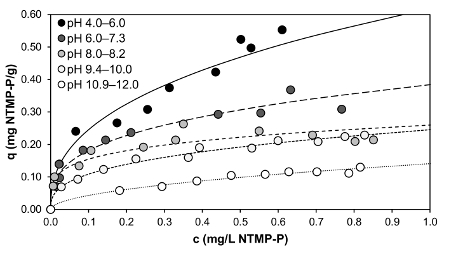
図 4: NTMP の読み込み (初期濃度 1 mg/L NTMP の-P) 0.7 の濃度で投与粒状水酸化第二鉄に室温で 1 時間接触後 14 g/L.グラフで述べられた pH 値で 0.01 mol/L の濃度で次のバッファーが使用された: 中 (pH 4.0 6.0)、MES (pH 6.0 7.3)、エップス (pH 8.0 8.2)、キャップ (pH 9.4 10.0)、水酸化ナトリウム (pH 12.0 10.9)。プロット曲線は、Freundlich 等温線です。この図の拡大版を表示するのにはここをクリックしてください。
図 4にすべて等温線フレンドリッヒ方程式を用いたモデル化された (pH の増加とともに右に左から r ² 値: 0.952、0.986 0.890 0.905 0.875; 対応する n 値: 1.942、2.824 4.440 3.067 2.488; 対応する KF値: 0.619、0.141 0.245、0.260 0.384)。4-6、NTMP P/g を実現した、最大 0.55 mg のローディングの pH 値を 1.8 mg NTMP/g に対応します。高い pH 値、吸着性が低い。鉄の水酸化物プロトン化や脱プロトン化した pH 値によって可能性があります彼らの表面に Fe OH 基の数が多いがあります。PH 値の深さの表面は主にプロトン化、すなわち、正荷電、つまり、ほぼ全体の pH 範囲は負荷電、ポリオキソの酸を集めています。高い pH 値は、増加の静電反発7につながる負の方向で鉄水酸化物表面の電荷を移動します。興味深いことに、オハイオ州- 0.01 M の濃度に対応する pH 12 でも吸着が発生しました。したがって、成功した脱着くらいの濃度 NaOH 溶液を使用する必要があります。
他の研究者の結果と比較して最大 0.55 mg NTMP P/-g GFH のこの作品での最大荷重は低いようです。Boelsら14発見 71 mg 合成逆浸透濃縮物 30 mg/l NTMP の実験で NTMP P/-g GFH の 21.7 の mg に相当する GFH の NTMP/g の最大荷重 (9.3 mg/L NTMP-P) pH 7.85 で。彼らは粉末 GFH を使用し、HCO3- 24 h 用のバッファーとしても機能するに含まれている合成ソリューションを攪拌しました。はるかに高い初期濃度を使用粉末 GFH、高い表面領域に発生する可能性があり、したがって、優れた吸着性能の結果、この仕事の結果とその結果を直接比較することはできません。さらに、接触時間が長くこの仕事のように。ノバックと石7は、7.2 の pH で 0.42 g/L ゲーサイト スラリーで 40 μ M NTMP ソリューション (NTMP P/L の 3.72 mg) で実験を行いました。ソリューションは、約 30 μ M NTMP/g 針鉄鉱 (NTMP P/g の 2.79 mg) の最大読み込みにつながる 2 時間攪拌しました。1 mM モップは、バッファーとして使用されました。再度、結果は初期ホスホン酸の濃度が高いためこの作業の結果を直接比較できません。加えて、ゲーサイト群れから成って、スラリーは高表面積を持っていた。しかし、Boelsらから等温線の図形14とノバックと石の7作品のものに同意してフレンドリッヒ モデルにより取り付けられたそれらのすべて。
ホスホン酸吸着と必要なバッファー濃度に及ぼすバッファー
またバッファーを使って平衡 ph が達されること時間の非常に短い期間内に吸着挙動を決定する前の実験を示していた。PH は、ホスホン酸含有溶液 (pH 調整) で選択された pH 値から大幅に逸脱できます。この平衡 pH 8.6 (独自調査) によるとここで説明した粒状の水酸化第二鉄をしたフィルター材料の追究してゆく傾向があります。したがって、接触時間 (最終 pH) 後の pH 値は、ホスホン酸の吸着が発生する程度のために決定的と想定することができます。
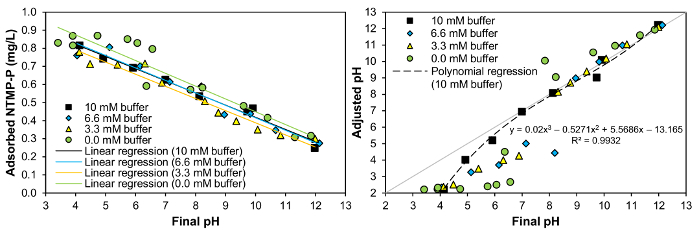
図 5: 左: NTMP の読み込み (初期濃度 1 mg/L NTMP の-P) 1 h の接触時間後別のバッファー濃度で pH 値の関数として 2.5 g/L 粒状水酸化第二鉄に。右: pH 値 pH 値の接触時間も 1 h 設定バッファーの異なる濃度で粒状の水酸化第二鉄との接触前に原液の中、MES、モップ、エップス、CAPSO、キャップ後の比較。この図の拡大版を表示するのにはここをクリックしてください。
図5 右図で異なるバッファー濃度 NTMP 含有溶液で設定された pH 値が 1 mg/L NTMP 間 1 時間接触後は最終 pH 値と比較されます-P と 2.5 g/L GFH。それは特定 pH 値相関以前ソリューション内の設定し最終的な pH の値は達成可能な比較的信頼性の高い pH 調整が可能な 10 mM の濃度でバッファーが使用された場合にのみ従って明白になります。これは、多項式回帰法による決定、右上図の再現相関関数に反映されます。事実バッファー濃度 2-4 の値がプリセット 6-7 の最終的な pH の値を取得するためにしなければならなかった 10 mM 以下の場合を示す吸着のために決定的である最終的な pH の値を予測でき、吸着テスト f を安全に実行または、このようなバッファー濃度が大変。
図 5、1 mg/L NTMP の吸着の範囲の左側の図で-2.5 g/L GFH の P 濃度別のバッファーの最終 pH 値の関数として描かれています。4-12 によると pH の範囲で pH 値の読み込みの非線形依存性を仮定して方程式 y = ax+b の a、線形回帰の値を計算検討したすべてのバッファー濃度が非常に似ているため (10 mM: = −0.0673、b 1.0914、r ² を = = 0.9837; 6.6 mM:、= −0.0689、b = r ² 1.1047 = 0.9512;3.3 mM: −0.0672、b = 0.0672 r ² を = = 0.9570;0 mM: = −0.0708、b = r ² 1.157 = 0.8933)。10 mM のバッファー最高だった、決定係数を示した非常に明確にこのバッファー濃度だけでなく最終 pH 値の調整は、簡単だった、また吸着に関して最も信頼性の高い結果が達成されました。バッファーなしのコースだけは、pH 5 と 7 の間の吸着範囲の可能な偏差を示します。ただし、バッファリング、非常に低い pH 値が原液で置かれなければならなかったことがなく、これらの最終的な pH の値を達成するためにいくつかのわずかにあったのみ上記の 2。最終調整 pH の非常に強い差、したがって、不可能だ最終 pH 値がバッファーの場合吸着の範囲のために決定的でなかったこと。それが想定される場合は、表 1に記載されている良いバッファーの使用は GFH、すなわち上に酸の吸着に重要な影響を持たない、吸着サイト、ホスホン酸とバッファーの間の競争がない従って。このような選択は流行するだけ GFH に NTMP の吸着がモノ ・二体15の形成の主因です。良いバッファーに少し傾向を形成する金属錯体17,19, NTMP ができれば GFH によってバインドされている理由であるが、その一方で、あります。活性炭などの少ない極表面と吸着剤の場合は、良いバッファーも無料吸着サイトを占有し、したがって、ホスホン酸の吸着に影響を与えることと想定することができます。そのため活性炭に酸の吸着の研究にこれらのバッファーの使用は推奨されません。
ISO のキャリブレーションミニ法と ISO に準拠
図 6内部品質を使用して検量線標準を示しています (知能指数: 1 mg/L KH2PO4-0.9 mM H2P など4) ISO 6878 として変更された ISOミニP o PO の合計4法によると3--P 決定。線形回帰に基づく、ISO 6878 に相当するキャリブレーション関数は y = 0.0033 + 0.2833 x (r ² = 0.99978)。リン酸定量結果キャリブレーション関数 y の小型のバリアントに適用する線形回帰 = 0.0058 + 0.2864 x (r ² = 0.99999)。Y = 0.2890 x +:0.0020 (r ² = 0.99985) ISOミニ方法に従って合計の P の定量のための校正機能は同様に非常によく似た、非常に正確です。すべての亜種は、非常に高い ISOミニメソッドが 5 分の 1 の試料量の減少によって精度を損なわないことを意味決定係数を持っていた。測定スペクトルの結果から分析のサンプルの P 濃度を決定するための校正機能によって定められる変換方程式は、4.15 の手順でプロトコルで与えられます。経験は、ブラインド サンプルの吸光度は、880 で以来通常無視されることができる示している光度計によって放射される信号は非常に小さい測定範囲で非常に強くジャンプできる nm。したがって、0.287 4 mL サンプル ボリューム (ISOミニ) での測定値は、リン濃度 1 mg/L p. に対応しました。
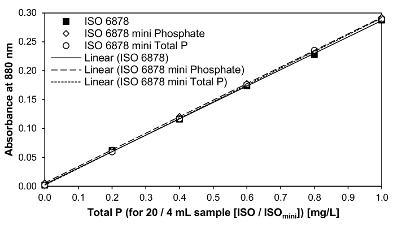
図 6: 合計の P と ISO 6878 と ISOミニオルト リン酸 P の定量のための検量線。IQS (1 mg/L KH2PO4-0.9 mM H2P など4) プロトコルの 1.9 ポイントに従って使用されました。ISO 法の知能指数は 0.8、1.6、2.4、因数で ISOミニの改良による、4、8、12、16、20 mL の因数で使用された 3.2、4.0 mL。この図の拡大版を表示するのにはここをクリックしてください。
ISO の妥当性およびバッファー依存性適量ミニメソッド
すでに述べたように、吸着試験で信頼性の高い pH 調整のみバッファー濃度 0.01 M で可能です。しかし、このようなバッファー濃度ほとんどのバッファーの高い K2S2O8投与量よりも ISO 6878 で指定されたが必要です。さらに、ISO は、3-10 は、消化後の pH プローブを使用して pH 値を設定する必要があることを定めています。このような pH 調整は、小さなスクリュー キャップ瓶で実行できません、ので異なるバッファー解決のため一致する水酸化ナトリウム投与量が未定だった図 7は 1 mg/l NTMP の異なるバッファー含有溶液の吸光度を示しています-P これら ISOミニに従って異なる K2S2O8量と消化されの変化量と扱われるとき消化後 NaOH。したがって、各行列は、次の手順に基づいていた: 溶液 4 mL が 0.2 mL 0.9 M H2SO4を混ぜて、異なる K2S2O8数量で提供されいっぱい H2O 同じ9 mL の容量。これは今 (148-150 ° C で 1 h) プロトコルに従い消化されました。冷却した後、異なる NaOH 量が追加され、H2o. 9.4 mL の容量をいっぱいにその後、アスコルビン酸溶液 0.2 mL とモリブデン酸 II 溶液 0.4 mL を加えた。吸光度の測定 (880 nm) 色試薬の付加の後で 4 時間行った。この時間は、特定の吸光度が安定したことを確認に選ばれました。1 mg/l NTMP ソリューション-P と 1 M NaOH も調べた。ただし、K2S2O8と NaOH 量、2H ではなく、4量変化した pH が消化のために十分に低いことを確認します。対象の吸光度値が 0.287 (検量線図6 を参照)。したがって、図 7これらの値は、この値から逸脱した明るい緑色で最大 5% で表示されます。各マトリックスの 1 つの値は、濃い緑で強調表示されます。これは K2S2O8と緩衝液のこのタイプの通常の ISOミニメソッドの推奨水酸化ナトリウム投与量を示します。
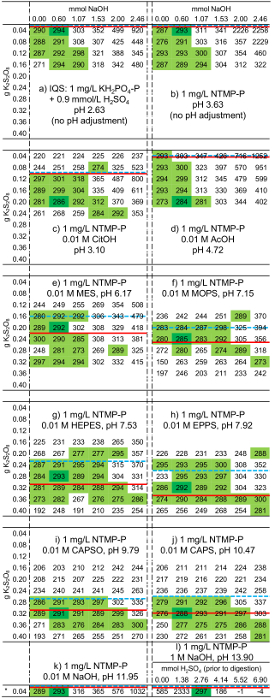
図 7: 分光吸光度 (× 1000) ホスホン酸-バッファー含むの異なるソリューション異なる K2S2O8と 880 の波長で水酸化ナトリウム投与量 1 cm キュベットの nm。手順 4 mL ソリューション (として、図に示すように、pK、バッファーの値、熱力学の pK 値・ ゴールドバーグらから適応するように調整その4 0.9 M H2の 0.2 mL を混合 10 mL スクリュー キャップのバイアルと K の2S2O8 (下図の図) の量が異なる濃度 0.01 M と 25 の ° C の31の20 ) が置かれました。水は消化する前にすべてのサンプルを 9 mL の合計量を取得し、されました。今バイアルは、148-150 ° C で 1 h (消化) 用のサーモスタットで加熱しました。室温に冷却した後 (図に示すように)、水酸化ナトリウムの量が異なるを加え、水添加量 9.4 mL すべてのバイアルに存在していたことが保障されました。0.2 mL のアスコルビン酸、モリブデン酸 II ソリューション、880 で吸光度 0.4 mL の添加後 4 h nm が決定されました。ソリューション l の場合 (1 mg/L NTMP-1 M NaOH で P)、H24 K2S2O8ではなくバリエーション豊富でしたので量。ここでは、すべてのサンプルでは NaOH の投与量は 1.5 M NaOH、すなわち、0.60 m モルの水酸化ナトリウム 0.4 mL に対応しました。ライト グリーン: ターゲット値から最大偏差は 5%: 287。ダーク グリーン: このバッファーとホスホン酸を含むソリューションの推奨設定です。破線: タラ、直線: ソード。この図の拡大版を表示するのにはここをクリックしてください。
色形成過程における還元的条件が勝つ必要があり、過剰な K2S2O8はこのソリューションの結果を妨げる可能性、および b (図 7) をない (IQS) または K2 量が非常に小さいS2O8 (バッファーなし NTMP のみ) が必要ですが、K の2S2O8必要以上の高い量が吸光度の急激な減少に自動的につながるしないことを示します。必要がありますここで説明したその他の酸 1 mg/l PBTC ソリューション b に類似しているソリューションで-P (吸光度: 0.3005)、1 mg/L HEDP-P (0.3035) 1 mg/L の試料-P (0.2952) または 1 mg/L DTPMP-P (0.2936) は、ISO のミニを使用して完全消化されました。0.6 モル水酸化ナトリウム 0.04 g K2S2O8とプロトコルに従ってメソッド。したがって、このメソッドは、ホスホン NTMP 以外にも使用できます。
表 1は、ハック LCK 514 キュベット急速なテストによって 0.01 M 緩衝液で測定される各バッファーと化学的酸素要求 (量 COD) の酸化反応の理論的酸素要求量 (ソード) を示します。それは、重クロム酸カリウム、COD の測定に使用される酸化剤が有機的に結びついた窒素32を酸化しない知られています。良いバッファー測定 COD だった常に C と H の酸化の理論量と C、H と S の酸化の間C、H と S の酸化のため理論値に対応した測定値 C-オハイオ州のグループ (HEPES、エップス、CAPSO) のバッファーに対してのみC-オハイオ州のグループ (MES のモップ、CAP) が含まれていないバッファーでスルホ グループが明らかに低下していない完全に硫酸塩へ。
7jにソリューション7 c 、それ見ることができる非常に明確に NaOH の量とは関係なく、バッファーの代金引換によると必要な酸化剤の量を大幅に下回って K2S2O8量がないこと目標値の達成に貢献します。10 ミリメートルで、これらのソリューションでバッファーは約 NTMP の 1000 倍の濃度を持っていた。バッファーは消化されない場合、ホスホン酸が完全に酸化することができますそれは保証できません。K2S2O8量だけタラを超えては、ターゲット値の信頼性の高い達成に貢献しました。したがって、だったのでバッファー (ソード) の完全酸化のための理論的なオキシダント要件を適用するすべてのバッファーに必要な窒素と明らかにもいくつかのバッファー、スルホない完全に分解しました。タラを超えて任意の酸化剤は、バッファーと反応しなかったし、したがって、十分な過剰 K2S2O8ホスホン酸を酸化するがあった。NTMP には、窒素も含まれています。これがない完全に酸化する硝酸、すべてホスホン酸グループは明らかにリン酸に酸化します。そうでなければ、1 つは、K2S2O8の 1 mg/L p. 豊富な過剰は確かに存在する吸光度を見つけられないかといくつかの K の2S2、ホスホン酸が、消化後の完全酸化に貢献O8はまだ存在していたし、青いモリブデン酸リン酸複合体の減少のために必要であるアスコルビン酸と反応できます。結果は、目標値よりも低い吸光度でした。
、各行の水酸化ナトリウム NaOH 量から始まっての量と吸光度が増加しました。したがって、それも生じたことバッファーの代金引換によると必要な酸化剤の量は、以下測定した吸光度値がターゲット値に従い NTMP 明らかに完全に消化されなかった (ソリューション7 cを参照してくださいが7 階、および7 h)。この場合、吸光度の増加は低すぎるためモリブデン酸塩イオンの自己抑制のためだった [H+]: [ミズーリ州] 比26, とすべての対応はのみランダムなため。したがってとより高い K2S2O8量より NaOH を使用して消化力の後、K2S2O8 pH 値を減らします。
ほとんどのソリューションで吸光度も目標値に従って水酸化ナトリウム投与が適用されなかった場合でも。場合によっては、ただし、この値からの偏差が発生した可能性があります NaOH の不在という事実に起因したので、最適 [H+]: [ミズーリ州] 比率は保持されませんでしたし、複雑な色が不安定になったため。したがって、分析ソリューション、NaOH を推奨すると、0.6 モルの投与量に関係なく、これにより、色錯体証明最も安定します。再生ソリューションはしばしば 1 M NaOH の濃度を持っています。そのようなケースは、行列 l によって覆われています。ここでは、4用量が許されている、消化後 pH を調整する pH プローブの使用はより安全なプロシージャをここでことを証明するように H2の非常に狭いスペクトルのみが示されました。
図 7のすべての暗い緑の吸光度値 (n = 12)、1.013 MG/L の平均値を与える図 6の検量線によると P 濃度への変換、標準偏差は 0.014 mg/l. です。つまり、ターゲット値 (1.000 mg/L) から標準偏差だけ 0.11 2.67% ((-および 1.013 0.014-1.000)/1.000 × 100% = 0.11%;(および 1.013 + 0.014-1.000)/1.000 × 100% = 2.67%)。これは ISOミニメソッドの精度を示しています。
ディスカッション
酸の重要性が増し廃水廃水処理または受信側の水ボディを保護するためにこれらの化合物を除去する信頼性の高い方法の研究が必要です。現時点では産業排水5,11,12,13,14,16から酸の除去に非常にほとんどの研究を します。手順提示ここ物質、特に粒状の水酸化第二鉄、鉄酸化物への吸着により酸の除去に関する調査をすることができますショー実施迅速かつ確実にときに従い、特定のプロトコル。
吸着の研究に決定的な点は、pH 値のメンテナンスです。これは、バッファーを使用せず回転遠心分離機管で実行できません。この記事で良いバッファーが 0.01 M の濃度でのみ許容 pH 調整が可能、GFH に酸の吸着に大きな影響はありませんでもこの濃度を示した。良いバッファーのアプリケーションはまた、活性炭などではなく、非極性材料に酸の吸着に関する研究のため、ここに示す手順を使用できない理由理由です。良いバッファーと競合ホスホン無料吸着サイト。
提案手法が、ホスホン酸、吸着剤に接触した後する必要があります直接測定するない決定を介してを示唆している HPLC22または IC-誘導結合プラズマ質量21による酸の直接分析は非常に複雑で高価なため、合計 P の標準化された方法 (ISO 687828) 一般的に消化が行われて、合計 P 定量用うち H2による、4と K2S2O8ホット プレート、pH 値に設定されます 3-10 の手段によってNaOH と青い色の複雑な (色強度はリン酸濃度に正比例) は、アスコルビン酸とモリブデン酸溶液の助けを借りて形成されます。この標準的な方法は非常に労働と時間がかかり、なぜ ISO 法 (ISOミニ) のより速い変形は開発されました。ISOミニメソッドは、五分の一に量を減らします。消化快適で起こるサーモスタットと NaOH 量消化が修正された後。このメソッドにより、非常に短い時間内で実施されるリン測定の数が多いと ISO 法と比較して精度が損なわれない。
各バッファーは異なる代金引換です。さらに、0.01 M の比較的高い必要なバッファー濃度サンプル成分の十分な消化力を保障するために酸化剤のかなり高い金額が ISO 法に規定よりも皆無を意味します。K2S2O8投与量が低すぎる、または高すぎる、誤った測定結果は発生します。ISOミニメソッドでこの K2S2O8投与量、従って一致各バッファーに個別にします。もう一つの重要なポイントは、水酸化ナトリウムの投与量です。原則として再生ソリューション > 0.1 m NaOH 濃度があります。それを避けるために [H+]: [ミズーリ州] 比色複雑な25,26の形成に従わない、H2の適切な調整消化する前に4の数量はそのために必要ないる。この問題発生再生ソリューションを再利用数回、それによって pH 値、COD を変更します。信頼性と簡単な pH 測定は、スクリュー キャップの容器では不可能ですので、適切な pH 調整がされていない、ここで、紹介した ISOミニ方法はしたがって、非常に高い pH 値のサンプルの限界に達する。再生ソリューションは、ISO メソッドを使用するため勧めします。
開示事項
利害の対立が宣言されていません。
謝辞
著者はウィリー ・ ヘイガー財団、シュトゥットガルトによる金融支援に感謝しています。我々 はまたホスホン酸のサンプルを提供するため Zschimmer & シュワルツ Mohsdorf GmbH & Co. KG の従業員に感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Sulfuric acid (H2SO4) | Merck (Darmstadt, Germany) | 1120802510 | 98% (p.a.) |
| Hydrochloric acid (HCl) | VWR Chemicals (Fontenay-sous-Bois, France) | 20254.401 | 32% (AnalaR NORMAPUR, p.a.) |
| Sodium hydroxide (NaOH) | Merck (Darmstadt, Germany) | 1064981000 | ≥99% (p.a.) |
| Acetic acid (AcOH) | VWR Chemicals (Fontenay-sous-Bois, France) | 20104.334 | 100% (p.a.) |
| 2-(N-morpholino)ethanesulfonic acid (MES) | SigmaAldrich (St. Louis, MO, USA) | M3671-250G | ≥99% |
| 3-(N-morpholino)propanesulfonic acid (MOPS) | SigmaAldrich (St. Louis, MO, USA) | M1254-250G | ≥99.5% |
| 4-(2-Hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | SigmaAldrich (St. Louis, MO, USA) | H3375-250G | ≥99.5% |
| 4-(2-Hydroxyethyl)-1-piperazinepropanesulfonic acid (EPPS) | SigmaAldrich (St. Louis, MO, USA) | E9502-250G | ≥99.5% |
| N-cyclohexyl-2-hydroxyl-3-aminopropanesulfonic acid (CAPSO) | SigmaAldrich (St. Louis, MO, USA) | C2278-100G | ≥99% |
| N-cyclohexyl-3-aminopropanesulfonic acid (CAPS) | SigmaAldrich (St. Louis, MO, USA) | C2632-250G | ≥98% |
| 2-Phosphonobutane-1,2,4-tricarboxylic acid (PBTC) | Zschimmer & Schwarz (Mohsdorf, Germany) | CUBLEN P 50 | 50% technical |
| 1-Hydroxyethane 1,1-diphosphonic acid monohydrate (HEDP·H2O) | SigmaAldrich (St. Louis, MO, USA) | 54342-50G | ≥95.0% |
| Nitrilotris(methylene phosphonic acid) (NTMP) | SigmaAldrich (St. Louis, MO, USA) | 72568-50G | ≥97.0% |
| Ethylenediamine tetra(methylene phosphonic acid) (EDTMP·1.4H2O) | Zschimmer & Schwarz (Mohsdorf, Germany) | - | |
| Diethylenetriamine penta(methylene phosphonic acid) (DTPMP·6H2O) | Zschimmer & Schwarz (Mohsdorf, Germany) | - | |
| Potassium dihydrogen phosphate (KH2PO4) | Merck (Darmstadt, Germany) | 1048731000 | ≥99.5% (p.a.) |
| Potassium peroxodisulfate (K2S2O8) | Merck (Darmstadt, Germany) | 1050920250 | ≥99.0% (p.a.) |
| L(+)-Ascorbic acid (C6H8O6) | Merck (Darmstadt, Germany) | 1004680500 | ≥99.7% (p.a.) |
| Ammonium heptamolybdate tetrahydrate ((NH4)6Mo7O24·4H2O) | Merck (Darmstadt, Germany) | 1011800250 | ≥99.0% (p.a.) |
| Granular ferric hydroxide (GFH) | Hego BioTec (Berlin, Germany) | - | FerroSorp RW |
| Syringe membrane filters | Sartorius Stedim Biotech GmbH (Göttingen, Germany) | 17765----------Q | Minisart RC Hydrophilic 25 mm 0.45 μm pore size |
| Single-use syringes for membrane filtration | Henke Sass Wolf (Tuttlingen, Germany) | 5200.X00V0 | 3-part Soft-Ject Luer 20 mL |
| Rotator | LLG Labware (Meckenheim, Germany) | 6.263 660 | uniROTATOR2 |
| Clamp for rotator | LLG Labware (Meckenheim, Germany) | 6.263 664 | Clamp for uniROTATOR2 |
| Screw cap vial | Glasgerätebau Ochs (Bovenden, Germany) | 135215 | Präparatenglas Duran, 16x100 mm, thread GL18, cap with PTFE seal |
| Micropipette | Eppendorf (Hamburg, Germany) | 3123000047 | eppendorf Research plus 10–100 µL |
| Micropipette | Eppendorf (Hamburg, Germany) | 3123000063 | eppendorf Research plus 100–1000 µL |
| Micropipette | Eppendorf (Hamburg, Germany) | 3123000071 | eppendorf Research plus 0.5–5 mL |
| Precision balance | Precisa Gravimetrics (Dietikon, Switzerland) | - | Precisa LX 220 A SCS |
| Thermostat | Hach (Berlin, Germany) | LTV077 | HT200S High Temperature Thermostat |
| Thermostat | Merck (Darmstadt, Germany) | 1712000001 | Spectroquant TR 320 |
| Spectrophotometer | Jasco Labor- u. Datentechnik (Groß-Umstadt, Germany) | - | UV/VIS Spectrophotometer Jasco V-550 |
| Centrifuge tube | Sarstedt (Nümbrecht, Germany) | 62.559.001 | Tube 50 mL, 115x28 mm, flat/conical base PP, assembled cap |
| pH probe | WTW (Weilheim, Germany) | 103635 | WTW pH-Electrode SenTix 41 |
| pH device | WTW (Weilheim, Germany) | - | WTW Multi 350i |
| COD determination | Hach (Berlin, Germany) | LCK514 | 100–2000 mg/L O2 |
| Sieve | Retsch (Haan, Germany) | 60.131.000500 | Test sieve 0.5 mm mesh (ISO 3310/1) stainless steel |
| Drying cabinet | Memmert (Schwabach, Germany) | - | Modell 600 |
参考文献
- . Directive 2000/60/EC of the European Parliament and of the Council of 23 October 2000 establishing a framework for Community action in the field of water policy. Official Journal of the European Communities. , 327 (2000).
- Rott, E., Steinmetz, H., Metzger, J. W. Organophosphonates: A review on environmental relevance, biodegradability and removal in wastewater treatment plants. Science of the Total Environment. 615, 1176-1191 (2018).
- Grohmann, A., Der Horstmann, B. . Der Einsatz von Phosphonaten unter umwelttechnischen Gesichtspunkten (The use of phosphonates under environmental aspects). , (1989).
- Studnik, H., Liebsch, S., Forlani, G., Wieczorek, D., Kafarski, P., Lipok, J. Amino polyphosphonates-chemical features and practical uses, environmental durability and biodegradation. New Biotechnology. 32 (1), 1-6 (2015).
- Matthijs, E., de Oude, N. T., Bolte, M., Lemaire, J. Photodegradation of ferric ethylenediaminetetra(methylenephosphonic acid) (EDTMP) in aqueous solution. Water Research. 23 (7), 845-851 (1989).
- Nowack, B., Stone, A. T. Degradation of nitrilotris(methylenephosphonic acid) and related (amino)phosphonate chelating agents in the presence of manganese and molecular oxygen. Environmental Science & Technology. 34 (22), 4759-4765 (2000).
- Nowack, B., Stone, A. T. Adsorption of phosphonates onto goethite-water interface. J. Colloid Interface Science. 214 (1), 20-30 (1999).
- Nowack, B., Stone, A. T. The influence of metal ions on the adsorption of phosphonates onto goethite. Environmental Science & Technology. 33 (22), 3627-3633 (1999).
- Nowack, B., Stone, A. T. Competitive adsorption of phosphate and phosphonates onto goethite. Water Research. 40 (11), 2201-2209 (2006).
- Zenobi, M. C., Hein, L., Rueda, E. The effects of 1-hydroxyethane-(1,1-diphosphonic acid) on the adsorptive partitioning of metal ions onto γ-AlOOH. Journal of Colloid and Interface Science. 284 (2), 447-454 (2005).
- Rott, E., Minke, R., Steinmetz, H. Removal of phosphorus from phosphonate-loaded industrial wastewaters via precipitation/flocculation. Journal of Water Process Engineering. 17, 188-196 (2017).
- Klinger, J., Sacher, F., Brauch, H. J., Maier, D., Worch, E. Behaviour of phosphonic acids during drinking water treatment. Vom Wasser. 91, 15-27 (1998).
- Boels, L., Tervahauta, T., Witkamp, G. J. Adsorptive removal of nitrilotris(methylenephosphonic acid) antiscalant from membrane concentrates by iron-coated waste filtration sand. Journal of Hazardous Materials. 182 (1-3), 855-862 (2010).
- Boels, L., Keesman, K. J., Witkamp, G. J. Adsorption of phosphonate antiscalant from reverse osmosis membrane concentrate onto granular ferric hydroxide. Environmental Science & Technology. 46 (17), 9638-9645 (2012).
- Martínez, R. J., Farrell, J. Understanding Nitrilotris(methylenephosphonic acid) reactions with ferric hydroxide. Chemosphere. 175, 490-496 (2017).
- Chen, Y., Baygents, J. C., Farrell, J. Removing phosphonate antiscalants from membrane concentrate solutions using granular ferric hydroxide. Journal of Water Process Engineering. 19, 18-25 (2017).
- Good, N. E., Winget, G. D., Winter, W., Connolly, T. N., Izawa, S., Singh, R. M. M. Hydrogen ion buffers for biological research. Biochemistry. 5 (2), 467-477 (1966).
- Good, N. E., Izawa, S. Hydrogen ion buffers. Methods in Enzymology. 24, 53-68 (1972).
- Ferguson, W. J., et al. Hydrogen ion buffers for biological research. Analytical Biochemistry. 104 (2), 300-310 (1980).
- Goldberg, R. N., Kishore, N., Lennen, R. N. Thermodynamic quantities for the ionization reactions of buffers. Journal of Physical and Chemical Reference Data. 31 (2), 231-370 (2002).
- Schmidt, C. K., Raue, B., Brauch, H. J., Sacher, F. Trace-level analysis of phosphonates in environmental waters by ion chromatography and inductively coupled plasma mass spectrometry. International Journal of Environmental Analytical Chemistry. 94 (4), 385-398 (2014).
- Nowack, B. Determination of phosphonates in natural waters by ion-pair high-performance liquid chromatography. Journal of Chromatography A. 773 (1-2), 139-146 (1997).
- Murphy, J., Riley, J. P. A modified single solution method for the determination of phosphate in natural waters. Analytica Chimica Acta. 27, 31-36 (1961).
- Worsfold, P., McKelvie, I., Monbet, P. Determination of phosphorus in natural waters: A historical review. Analytica Chimica Acta. 918, 8-20 (2016).
- Going, J. E., Eisenreich, S. J. Spectrophotometric studies of reduced molybdoantimonylphosphoric acid. Analytica Chimica Acta. 70, 95-106 (1974).
- Pai, S. C., Yang, C. C., Riley, J. P. Effects of acidity and molybdate concentration on the kinetics of the formation of the phosphoantimonylmolybdenum blue complex. Analytica Chimica Acta. 229, 115-120 (1990).
- Eisenreich, S. J., Bannerman, R. T., Armstrong, D. E. A simplified phosphorus analysis technique. Environmental Letters. 9 (1), 43-53 (1975).
- . . ISO 6878:2004. Water quality-Determination of phosphorus-Ammonium molybdate spectrometric method. , (2004).
- Freundlich, H. Über die Adsorption in Lösungen (About the adsorption in solutions). Z. Physical Chemistry. 57, 385-470 (1907).
- Ho, Y. S., Porter, J. F., McKay, G. Equilibrium isotherm studies for the sorption of divalent metal ions onto peat: Copper, nickel and lead single component systems. Water Air & Soil Pollution. 141 (1-4), 1-33 (2002).
- Li, L., Zhang, S., Li, G., Zhao, H. Determination of chemical oxygen demand of nitrogenous organic compounds in wastewater using synergetic photoelectrocatalytic oxidation effect at TiO2 nanostructured electrode. Analytica Chimica Acta. 754, 47-53 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved