Method Article
Optimierte Verfahren zur Bestimmung der Adsorption von Phosphonaten auf Granular Ferric Hydroxid mit einer miniaturisierten Phosphor Entschlossenheit Methode
In diesem Artikel
Zusammenfassung
Dieses Papier stellt ein Verfahren zur Untersuchung der Adsorption von Phosphonaten auf Eisen-haltige Filtermaterialien, besonders granular ferric Hydroxid, mit wenig Aufwand und hohe Zuverlässigkeit. In einer gepufferten Lösung ist das Phosphonat in Kontakt das Adsorbens mit ein Rotator gebracht und dann über eine miniaturisierte Phosphor-Bestimmung-Methode analysiert.
Zusammenfassung
Dieses Papier stellt ein Verfahren zur Untersuchung der Adsorption von Phosphonaten auf Eisen-haltige Filtermaterialien, besonders granular ferric Hydroxid (GFH), mit wenig Aufwand und hohe Zuverlässigkeit. Das Phosphonat, z. B.Nitrilotrimethylphosphonic Säure (NTMP), bringt in Kontakt mit der GFH in ein Rotator in einer Lösung gepuffert durch eine organische Säure (z.B. Essigsäure) oder gute Puffer (z. B.2-(N- Morpholino) Ethanesulfonic Säure) [MES] und N- Cyclohexyl-2-Hydroxyl-3-Aminopropanesulfonic Säure [CAPSO]) in einer Konzentration von 10 mM für eine bestimmte Zeit in 50 mL Zentrifuge Röhren. Anschließend, nach der Membranfiltration (0,45 µm Porengröße), die insgesamt Phosphorkonzentration (Gesamt-P) wird anhand einer eigens entwickelten Entschlossenheit-Methode (ISOMini). Diese Methode ist eine Modifikation und Vereinfachung der ISO 6878-Methode: eine 4 mL Probe gemischt mit H2SO4 und K2S2O8 in eine Schraubkappe Fläschchen, 1 h auf 148-150 ° C erhitzt und dann mit NaOH gemischt , Ascorbinsäure und gesäuerte Molybdat mit antimony(III) (Endvolumen von 10 mL), einen blauen Komplex zu produzieren. Die Farbintensität, die linear proportional zur Phosphorkonzentration, wird spektralphotometrisch gemessen (880 nm). Es wird gezeigt, dass die verwendeten Puffer-Konzentration keinen signifikanten Einfluss auf die Adsorption von Phosphonat zwischen pH 4 und 12 hat. Die Puffer konkurrieren daher nicht mit der Phosphonat für Adsorption Websites. Darüber hinaus erfordert die relativ hohe Konzentration des Puffers eine höhere Dosierung Konzentration des Oxidationsmittels (K2S2O8) für die Verdauung als die angegebene in ISO 6878, welches zusammen mit der NaOH-Dosierung abgestimmt ist für jeden Puffer. Trotz der Vereinfachung verliert die ISO-Mini -Methode nicht seine Genauigkeit im Vergleich zu den standardisierten Methode.
Einleitung
Motivation
Die Anstrengungen zur Verringerung der Nährstoffeinträge in Oberflächengewässer, die notwendig sind, unter anderemim Zusammenhang mit der Umsetzung der Europäischen Wasserrahmenrichtlinie1, erfordern eine genauere Prüfung der Phosphoremissionen. Ist der Stoffgruppe der Phosphonaten (Abbildung 1), die als Bleichmittel Stabilisatoren in Textil- und Papierindustrie, als Antiscalants in Trinkwasser-Aufbereitung, als Härte Stabilisatoren des Kühlwassers und in Wasch- und Reinigungsmitteln, verwendet werden besonders relevant in Bezug auf Quantität und Umweltrelevanz2. Phosphonaten werden verdächtigt, einen Beitrag zur langfristigen Eutrophierung von Wasser Körper2,3,4. Zum Beispiel durch UV-Strahlung des Sonnenlichts oder im Beisein von MnII und gelöster Sauerstoff, können Phosphonaten in mikrobiologisch verfügbaren Phosphate5,6abgebaut werden. Das Überangebot an Phosphat ist ein wesentliches Merkmal der ökologisch unausgewogen Gewässer, wodurch Phosphor eine wichtiges Ziel Substanz zur nachhaltigen Verbesserung des ökologischen Zustands der Gewässer.
Phosphonaten können durch Fällung/Flockung aus dem Abwasser entfernt, wenn mit Eisen oder Aluminium7,8,9,10 Salze. In diesem Prozess werden Metalle in kaum löslichen Metall-hydroxide verwandelt. Diese polaren Herden mit einer relativ großen spezifischen Oberfläche dienen als Adsorbentien für die negativ geladenen Phosphonaten. Die Flockung Prozess haben jedoch zwei Hauptnachteile. Je nach dem Abwasser können Schlamm Volumen von bis zu 30 % das Probenvolumen11auftreten. Dieser Schlamm muss getrennt, behandelt und in einem weiteren Sedimentation oder Filterstufe entsorgt werden. Darüber hinaus Phosphonaten können Komplex der zusätzlichen Flockungsmittel und somit verhindern die Bildung von Herden, vor allem im Abwasser mit geringer Wasserhärte. Dieser Effekt kann durch erhöhte Mengen an Flockungsmittel kompensiert werden. Dies führt jedoch zu erhöhten β-Werte (β = Molverhältnis von Flockungsmittel zu Phosphor im Abwasser)11,12. Eine komplexe Abwasser-Matrix kann daher die Kontrolle über eine optimale Flockungsmittel Dosierung erschweren.
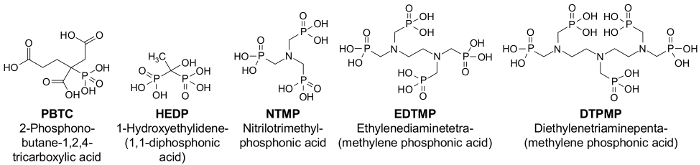
Abbildung 1: strukturelle Formeln wichtig Phosphonaten11. Bitte klicken Sie hier für eine größere Version dieser Figur.
Eine mögliche Alternative, die die hohe Adsorption Affinität von Phosphonaten metallhaltigen Oberflächen und nutzt hat keinen der oben genannten Nachteile sind Filtermaterialien basierend auf Eisenoxide (Hydr). Für solche Filtermaterialien präsentiert die Literatur vor allem Untersuchungen über die Eliminierung von Phosphat13,14,15,16. Dieses Papier stellt eine Prozedur ermöglicht die Untersuchung von der Aufnahmekapazität der selektiven granulierten Filtermaterialien in dieser Arbeit vor allem mit granular ferric Hydroxid (GFH), bezüglich Phosphonaten mit wenig Arbeitsaufwand und erhebliche Kosten zu sparen. Die Studie über die Aufnahmekapazität kann in folgende Schritte unterteilt werden: Vorbereitung der Phosphonat Lösung, Adsorption Test (Kontakt der Phosphonat-Lösung mit Granulat) und Phosphonat Analyse. Alle Schritte müssen perfekt aufeinander abgestimmt sein.
Konzept zur Adsorption Test und die Verwendung von geeigneten Puffern
Für das Studium der Aufnahmekapazität können Batch oder Spalte Tests durchgeführt werden. Ermittlung der Adsorption Isothermen oder pH-Abhängigkeiten von der Adsorbens ist der Batch-Ansatz bevorzugt, da viele Ergebnisse durch die Möglichkeit, mehrere Parameter variieren innerhalb kurzer Zeit erreicht werden können. Der pH-Wert ist einer der wichtigsten Einflussfaktoren Adsorption. Einhaltung bzw. Anpassung des pH-Wertes ist eine große Herausforderung für den Labortechniker, da die einfache Einstellung des pH-Wertes in der Probenlösung zuvor auf den Kontakt mit dem Adsorptionsmittel in der Regel nicht ausreicht. Jedes Adsorbens Material ist in der Regel bestrebt, den pH-Wert um diesen Punkt Null kostenlos (PZC) ungefähre. Dementsprechend ist es möglich, dass eine wässrige Lösung, z. B.auf pH 3 eingestellt auf einen pH-Wert von 8 im unmittelbaren Kontakt mit dem Adsorbens ändert. Abwasser hat meist eine natürliche Pufferkapazität, die diesen Effekt vermindert. Wenn nur die Entfernung eines bestimmten Ziel-Stoffes jedoch ist mit einer speziellen Adsorbens untersucht werden, synthetisches Abwasser muss verwendet werden, d. h., reines Wasser, die speziell mit dem Ziel Substanz oder, z.B., wettbewerbsfähige gespickt ist Anionen. Im Gegensatz zu pulverförmige Adsorbentien, wo der pH Wert kann leicht instand zu halten in den gewünschten Bereich durch Zugabe von Säuren und Basen in der offenen rührgefäßes, keine pH-Einstellung in dieser Form möglich ist, in einem Batch-Ansatz mit Granulaten. Um Granulat homogen ausgesetzt zu halten, sind sehr hohe Geschwindigkeiten rührende erforderlich, die in sehr schnellen Abrieb des Materials führen würde. Wenn solche Abrieb unbeabsichtigte ist, ist die sanfteste Methode, geschlossenen Zentrifuge Rohre, um das Granulat kontinuierlich in die Lösung gemischt zu halten rotieren. Der einzige Weg, um den pH-Wert konstant zu halten ist in diesem Fall, Puffer zu verwenden.
Die folgenden Anforderungen für Puffer erfüllt sein, um zu untersuchen, die Adsorption von Phosphat und Phosphonaten auf Eisen-haltige Filtermaterialien können: frei von Phosphor; farblos; löslich; im besten Fall keine Komplexbildner; keine Konkurrenz mit Phosphonaten hinsichtlich Adsorption auf polar Filtermaterialien; ähnliche Struktur der verschiedenen Puffer verwendet; und Puffer oder deren Abbauprodukte müssen keinen negativen Effekt auf die spektrale Absorption der Farbe Komplex nach der Verdauung für insgesamt P-Ermittlung. Bereich der biochemischen Forschung waren für so genannte gute Puffer entwickelten17,18,19, die genau diese Eigenschaften haben. So wurden für die Untersuchungen dieser Arbeit, die Puffer in der Tabelle 1 ausgewählt. Die pKeinen Wert von jeder Puffer zeigt den Bereich, der durch den Puffer konstant gehalten werden kann. Für die pH-Bereich < 5 müssen jedoch organische Säuren wie Zitronensäure (CitOH) und Essigsäure (AcOH) verwendet werden. Zitronensäure ist ein Komplexbildner, aber es puffert in einem pH-Bereich, wo die meisten eisenhaltigen Filtermaterialien sowieso instabil werden. Essigsäure und MOPS wurden bereits Nowack und Stein7 zur Adsorption von NTMP auf Gülle goethitgruppen (α-FeOOH) bei pH 4.6 und 7.2 zu untersuchen. Ihre Experimente auf der pH-Abhängigkeit der Adsorption erfolgte jedoch ohne Pufferung.
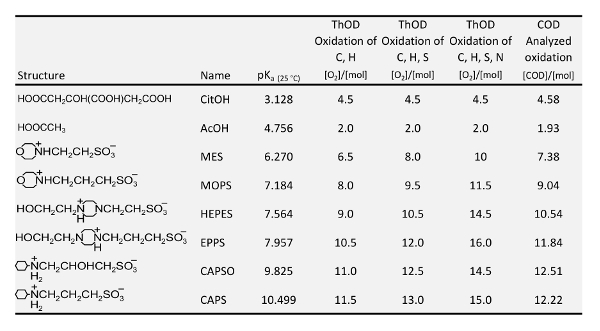
Tabelle 1: pK ein Werte 20 , Theoretischer Sauerstoffbedarf (ThSB) und analysiert aktuelle chemische Sauerstoffbedarf (CSB) des in dieser Studie verwendeten Puffer.
Gesamt-P-Ermittlung (ISOMini) angepasst an die Pufferlösung
Nach jedem Test Adsorption muss jede Lösung für die verbleibenden Phosphonat-Konzentration analysiert werden. Erst kürzlich wurde eine Methode zur Bestimmung von Phosphonaten in Umweltproben mit Grenzen der Quantifizierung im Bereich von 0,1 µg/L eingeführt. Es basiert auf der IC-ICP-MS-Methode und die Verwendung von Kationen-Austauscher (für die Umwandlung von Phosphonaten in "freien" phosphonic Säuren) und Anion Exchanger (für die Pre-Konzentration von Phosphonaten)21. Darüber hinaus wurde bereits im Jahr 1997 eine Methode von Nowack22 mit höheren Limits der Erkennung von 15-100 µg/L, eingeführt basiert auf der Pre-Komplexierung von Phosphonaten mit FeIII, Aufbewahrung mittels HPLC und den photometrischen Nachweis dieser -komplexe. Diese Methoden sind jedoch sehr aufwendig und teuer. In Studien mit synthetischen Abwasser, in denen die einzige phosphorhaltigen Substanz eine Phosphonat ist, ist es ausreichend, die Phosphonat-Konzentration zu bestimmen, durch die insgesamt P Konzentrationsbestimmung. Die Bestimmung von anorganischem Phosphat stellt den Experimentator mit weit weniger Probleme als die Bestimmung des Gesamt-P, wie letztere vorherigen Verdauung erfordert. Die Menge der Chemikalien, die pyramidenerbauer hinzukommen muss genau zu den Verbindungen in der Probe angepasst werden.
Die Bestimmung von Phosphat wird derzeit vor allem mit der Methode von Murphy und Riley23eingeführten durchgeführt. Diese Methode basiert auf die photometrische Erkennung von einem komplexen farbintensive Phosphomolybdenum blau ([PSb2Mo12O40]− mit λMax. bei 880 nm) die gebildet wird, in Anwesenheit von Phosphat und gesäuerte Molybdat mit Ascorbinsäure und antimony(III) als Reduktionsmittel24. In anderen Studien, das optimale Verhältnis von [H]+]: [Mo] war entschlossen, 60-8025,26. Um festzustellen, Gesamt-P, Verdauung, d. h., das Brechen des P-O-P, C-O-P und C-P Anleihen in phosphorhaltigen Verbindungen und die Oxidation von Phosphor zu Phosphat vorgenommen werden vor der Phosphomolybdenum blaue Bildung24 . Eisenreich Et al. 27 präsentiert eine vereinfachte Methode basiert auf der Verwendung von oxidierenden Agent disulfat (K2S2O8) im sauren Milieu. Viele dieser Erkenntnisse sind in die Entwicklung von ISO 687828, die systematisch, das Verfahren für die Bestimmung von Phosphat-P und total P-Konzentrationen in Wasserproben (Abwasser und Meerwasser erklärt) eingeflossen.
Die gesamte P Bestimmung gemäß ISO 6878 (Abbildung 2) erfordert die Probe in einen Erlenmeyerkolben von K2S2O8 bei einem sauren pH-Wert (Verwendung von Schwefelsäure) für mindestens 30 min verdaut werden. Nach der Verdauung soll der pH-Wert von 3-10 mit NaOH und den Inhalt der Erlenmeyer-Kolben in ein 50 mL volumetrischen Kolben übertragen wird. In dieser Flasche Ascorbinsäure und eine saure Lösung mit Molybdat und Antimon hinzugefügt, um die Probe und dann mit Wasser gefüllt. Nach 10-30 Minuten, die Intensität dieser blaue Färbung wird gemessen, bei einer Wellenlänge von 880 nm. Im Falle von Phosphat Bestimmung entfällt die Verdauung. Das bedeutet, die Probe wird in einem 50 mL volumetrischen Kolben mit Ascorbinsäure und eine Lösung mit Molybdat sowie Antimon gemischt, und die Intensität der Blaufärbung in das Photometer gemessen wird.
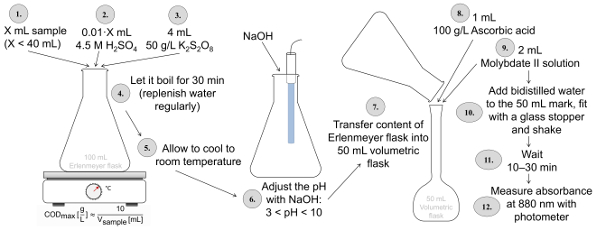
Abbildung 2 : Verfahren der insgesamt P Bestimmung gemäß ISO 6878 Anwendung Verdauung mit Schwefelsäure und Kalium disulfat, eine anschließende pH-Einstellung mit NaOH und Färbung mit Ascorbinsäure und Molybdat-haltigen Lösungen. Bitte klicken Sie hier für eine größere Version dieser Figur.
Das Verfahren des gesamten P-Ermittlung ist sehr komplex, da während der Verdauung, die es immer, die achten muss die Probe nicht über Kochen und die Anpassung der Probe auf pH 3-10 sehr lange dauert. Um möglichst viele Proben wie möglich in kürzester Zeit analysieren zu können, wurde eine miniaturisierte Form des Gesamt-P und ortho-Phosphat-Bestimmung anhand dieser ISO-Methode entwickelt. Abbildung 3 fasst die einzelnen Schritte dieser Methode. In dieser miniaturisierten Entschlossenheit Methode (ISOMini), ist der letzte Band der Farbe Lösung 10 mL (Dies ist in der ISO-Methode, 50 mL). Entsprechend reduziert die ISO-Mini -Methode die Menge der Lösungen auf ein Fünftel verwendet werden. In der ISO-Mini -Methode die Verdauung erfolgt in einem Thermostat (im Gegensatz zu den ISO-Methode, wo die Verdauung in einen Erlenmeyerkolben auf einer Herdplatte vorgeschlagen wird) 148-150 ° c, die höchste mögliche Oxidation zu erhalten. NaOH wird nach der Verdauung zusammen mit Ascorbinsäure und sauren Molybdat Lösung hinzugefügt.
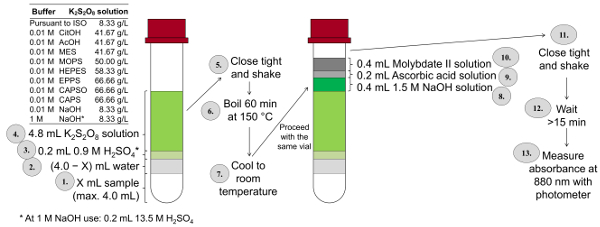
Abbildung 3 : Verfahren der gesamten P Bestimmung nach einem modifizierten und miniaturisierte Form des ISO 6878 (ISOMini) mit Schraubkappe 10 mL Fläschchen, Puffer-abhängigen Kalium disulfat Konzentrationen, Heizung Thermostat und Zugabe von Farbe Reagenzien direkt an die verdaute Probe ohne Sie vorher zu übertragen. Bitte klicken Sie hier für eine größere Version dieser Figur.
Die biologische Puffer enthalten in den Proben müssen in relativ hohen Konzentrationen (10 mM) im Vergleich zu den Phosphonat (5-30 µM) vorhanden sein, um den pH Wert effektiv erhalten. Diese Puffer müssen nach der Adsorption-Test zur Analyse des gesamten P verdaut werden. Dementsprechend muss die dosierte Menge des Oxidationsmittels in jeder Puffer, unter Berücksichtigung, dass zuviel Oxidationsmittel die Bildung von komplexen Farbe gebildet nach der Verdauung nicht beeinträchtigen sollte angepasst werden. Um die K2S2O8 benötigte Menge für die Verdauung von jeder Puffer bei der gesamten P-Bestimmung anhand der analysierten chemischen Sauerstoffbedarf (CSB) abschätzen zu können, ein Vergleich, wie viele Elektronen umgewandelt werden kann, während die Reduzierung der O2 und K2S2O8 ist erforderlich:
O2 + 4 H+ + 4 e– → 2 H2O
S2O82- + 2 e– → 2 SO42-
Daher erfordert die Oxidation eines bestimmten Moleküls doppelt soviele disulfat Moleküle als O2 Moleküle. Dementsprechend muss bei ein Probenvolumen von 20 mL COD der Probe nicht 500 mg/L überschreiten bei Verwendung der ISO-Methode. Allerdings ist auch bei MES, der gute Puffer mit der kleinsten molare Masse von Tabelle 1, bereits ein DORSCH von 2,4 g/L bei einer Konzentration von 10 mM. Neben der schrittweise Protokoll der Adsorption Test- und ISOMini Methode, dieses Papier untersucht daher die erforderlichen Puffer-Konzentration, der Einfluss der Puffer auf Phosphonat Adsorption und K2S2O8 Menge und NaOH Dosierung für ihre Verdauung in der ISO-Mini -Methode erforderlich.
Freundlich-Modell der adsorption
Adsorption Isothermen, d. h.be-Q (z. B.in mg P/g Adsorbens) über die gelöste Konzentration c (in mg/L P) der adsorptiven nach einer bestimmten Einwirkzeit angewendet kann mit der Gleichung von Freundlich29vorgeschlagenen modelliert werden:
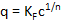
Wenn die experimentell ermittelten Werte Q und c in Form von einer Funktion ln(q) über ln(c) aufgetragen sind, entspricht die Steigung dieser Funktion durch lineare Regression bestimmt 1/n und die y-Achse abfangen, KF Wert30.
Überblick über das Verfahren
Der gesamte Prozess zur Ermittlung der Aufnahmekapazität der granular ferric Hydroxid in Bezug auf Phosphonaten ist in mehrere Schritte unterteilt und wird im Abschnitt Protokoll beschrieben. Für die Analyse ist es notwendig, eine ausreichende Menge an Reagenzlösungen (Abschnitt 1 des Protokolls) vorzubereiten. Diese sind für mehrere Wochen haltbar. Die Phosphonat-haltige Lösung ist dann bereit (Abschnitt 2), gefolgt von der Adsorption-Test (Kontakt der Phosphonat-Lösung mit dem Granulat) (Abschnitt 3) und die Analyse des gesamten P nach der miniaturisierten ISO-Methode (Abschnitt 4).
Protokoll
1. Vorbereitung aller erforderlichen Lösungen für die gesamte P-Ermittlung
Hinweis: Die Zubereitung einiger der unten beschriebenen Lösungen ist in ISO 687828erläutert. Diese Zubereitungsmethoden haben etwas an dieser Arbeitsweise angepasst. Der erforderliche Grad der Reinheit von Chemikalien finden Sie in der beigefügten Materialliste.
- Vorbereitung der H2SO4 Lösungen (13,5 und 9 0,9 M H2SO4)
Achtung: Arbeiten Sie unter Abzug.- Vorbereitung von 13,5 M H2SO4
- Einen 100 mL graduierte Zylinder mit 25 mL Wasser füllen und in eine 100 mL Glasflasche, umgeben von Eiswürfeln in ein Becherglas gelegt übertragen.
- Füllen Sie den gleichen Messzylinder mit 75 mL konzentrierte Schwefelsäure und unter Rühren in das Wasser in der Flasche übertragen. Vorsicht: Wärmeentwicklung.
- Nehmen Sie die Flasche vorsichtig aus dem Becherglas, sobald es genügend abgekühlt ist (max. 40 ° C).
- Vorbereitung von 9 M H2SO4 (erforderlich für die Zubereitung von Molybdat-Lösung)
- Füllen Sie einen 1 L Schloss Zylinder mit 700 mL Wasser und übertragen Sie diese in einen 3 L Glas Becher umgeben von Eiswürfel in einen Eimer gelegt.
- 700 mL konzentrierte Schwefelsäure den gleichen 1 L Schloss Zylinder Einfüllen und unter Rühren mit dem Wasser in den 3 L-Becher übertragen werden. Vorsicht: Wärmeentwicklung.
- Nehmen Sie 3 L Becher sorgfältig aus dem Eimer, sobald es genügend abgekühlt ist (max. 40 ° C) und übertragen Sie seine Inhalte in eine 2 L Flasche.
- Vorbereitung von 0,9 M H2SO4
- Füllen Sie eine Volumetrische 250 mL-Flasche mit ca. 100 mL Wasser.
- Übertragen Sie 25 mL 9 M H2SO4 (siehe 1.1.2) in die volumetrische 250 mL-Flasche mit einer volumetrischen 25 mL-Pipette. Vorsicht: Wärmeentwicklung.
- Füllen Sie die volumetrische Flasche 250 mL bis 250 mL-Ring-Markierung mit Wasser.
- Nahe der Volumetrische Kolben mit einem Stopfen, schütteln Sie es mehrmals zur Homogenisierung und übertragen Sie die Inhalte der volumetrischen Küvette in einem 250 mL-Glasflasche.
- Vorbereitung von 13,5 M H2SO4
- Vorbereitung von HCl Spüllösung (ca. 2 M)
Achtung: Arbeiten Sie unter Abzug.- Füllen Sie einen 2 L Schloss Zylinder mit 1 L Wasser.
- 400 mL 32 % HCl (w/w) Lösung dieser Messzylinder einfüllen.
- Fügen Sie jetzt 600 mL Wasser zu einem Gesamtvolumen von 2 L in den Messzylinder.
- Rühren Sie den Inhalt von den Messzylinder mit einem Stab (z.B. abgestufte Pipette) und Übertragung der Inhalte von den Messzylinder in eine 2,5-L-Flasche.
- Verschließen Sie die Flasche und schütteln Sie es kopfüber mehrmals für Homogenisierung.
- Diese Lösung wiederverwendet werden nur bis zu eine Farbänderung sichtbar wird. Dann verwerfen Sie der Spüllösung und bereiten Sie eine neue.
- Vorbereitung der HCl-Lösungen (10.2 und 2 M)
Achtung: Arbeiten Sie unter Abzug.- Verwenden Sie 32 % HCl (w/w) als 10,2 M HCl.
- Vorbereitung der 2 M HCl
- Füllen Sie eine Volumetrische 100 mL-Fläschchen mit 15 mL 32 % HCl (10,2 M) mit einer volumetrischen 15 mL-Pipette.
- Fügen Sie ein weiteres 4,67 mL 32 % HCl (10,2 M) in den volumetrischen Kolben mit einer Mikropipette.
- Füllen Sie die volumetrische Flasche bis zur 100 mL-Ring-Markierung mit Wasser.
- Schließen Sie die volumetrische Küvette mit einem Stopfen und schütteln Sie es kopfüber mehrmals Homogenisierung und übertragen Sie die Inhalte der volumetrischen Kolben in eine 100 mL Flasche.
- Vorbereitung der NaOH-Lösungen (10, 2, 1,5 M NaOH)
Achtung: Arbeiten Sie unter Abzug.- Wiegen von 100,0 g (10 M), 20 g (2 M) oder 15 g (1,5 M) von NaOH in einen kleinen Becher und übertragen Sie den Inhalt des Bechers in eine Volumetrische 250 mL-Flasche.
- Füllen Sie die volumetrische Flasche bis zur 250 mL-Ring-Markierung mit Wasser. Den volumetrischen Kolben mit einem Stopfen verschließen und schütteln es Kopf mehrmals für Homogenisierung (Vorsicht: Lösung kann heiß werden). Wenn die Höhe des Wasserstandes nicht mehr die Ring-Markierung entspricht, fügen Sie mehr Wasser (Gesamtvolumen Änderungen infolge der auflösenden Prozess).
- Übertragen Sie die Inhalte der volumetrischen Kolben in einer Kunststoff-Flasche 250 mL (Vorsicht: Glasflaschen nicht für NaOH Lösungen verwenden).
- Vorbereitung der K2S2O8 Lösung/Suspension (8,33, 41.67, 50.00, 58,33, 66,66 g/L)
Hinweis: Anders konzentrierten disulfat Mischungen sind für Phosphor Bestimmung erforderlich. Da einige von ihnen über die Sättigungsgrenze von K2S2O8 von ca. 50 g/L bei 20 ° C liegen, es empfiehlt sich, die K2S2O8 direkt in einer braunen Glasflasche wiegen und eine entsprechende Menge Wasser darüber Gießen (tun nicht verwenden Sie, volumetrische Fläschchen für die Vorbereitung).- Gewicht von 2,08 g (für 8,33 g/L), 10,42 g (41,67 g/L), 12,50 (50,00 g/L), 14,58 g (58,33 g/L) oder 16,67 g (66,66 g/L) von soliden K2S2O8 direkt in ein braun 250 mL-Glasflasche.
- Füllen Sie einen Messzylinder mit 250 mL Wasser und Gießen Sie dieses Wasser über die K2S2O8 in der Flasche.
- Rühren Sie den Inhalt der Flasche, bis alle Zutaten aufgelöst haben oder gibt es nur eine leichte Trübung.
- Führen Sie die Extraktion von K2S2O8 unter hoher Turbulenz auf den Magnetrührer um sicherzustellen, dass die ungelösten K2S2O8 als homogen wie möglich auch extrahiert werden können.
- Vorbereitung von 100 g/L-Ascorbinsäure-Lösung
- Wiegen Sie 50 g Ascorbinsäure in eine Volumetrische 500 mL-Flasche.
- Füllen Sie den volumetrischen Kolben bis 500 mL-Ring-Markierung mit Wasser.
- Rühren Sie den Inhalt der volumetrischen Kolben auf den Magnetrührer, bis die Ascorbinsäure vollständig gelöst ist. Es möglicherweise notwendig, das Niveau der Wasseroberfläche zu machen durch Zugabe von ein wenig mehr Wasser (Vorsicht das Rühren bar-Volumen sowie) deckungsgleich mit dem Ring-Zeichen zu korrigieren. Dann übertragen Sie die Inhalte von der volumetrischen Kolben in einer braunen 500 mL-Glasflasche.
- Vorbereitung von Molybdat ich Lösung (erforderlich für Phosphat-Bestimmung)
- Wiegen Sie 13,0 g von solid (NH4)6Mo7O24∙4H2O direkt in einen 100-mL-Glasflasche. Füllen Sie einen Messzylinder mit 100 mL Wasser und Gießen Sie sie in die Flasche. Rühren Sie den Inhalt der Flasche auf einen Magnetrührer, bis sie vollständig aufgelöst ist.
- Wiegen Sie solide K (SbO) C4H4O6∙½H2O direkt in eine frische 100 mL Glasflasche 0,35 g. Füllen Sie einen Messzylinder mit 100 mL Wasser und Gießen Sie sie in die Flasche mit K (SbO) C4H4O6∙½H2O. rühren Sie den Inhalt der Flasche, bis sie vollständig aufgelöst ist.
- Füllen Sie einen Messzylinder mit 300 mL 9 M H2SO4 (siehe 1.1.2) und Gießen Sie sie in ein braun 500 mL-Glasflasche.
- (NH4)6Mo7O24∙4H2O Lösung hinzufügen, die 300 mL 9 M H2SO4. Fügen Sie die K (SbO) C4H4O6∙½H2O Lösung diese Mischung. Verschließen Sie die Flasche und schütteln Sie sie einige Male auf den Kopf gestellt für Homogenisierung.
- Vorbereitung von Molybdat II-Lösung (für insgesamt P Bestimmung erforderlich)
- Wiegen Sie 13,0 g von solid (NH4)6Mo7O24∙4H2O direkt in einen 100-mL-Glasflasche. Füllen Sie einen Messzylinder mit 100 mL Wasser und Gießen Sie sie in die Flasche. Rühren Sie den Inhalt der Flasche auf einen Magnetrührer, bis sie vollständig aufgelöst ist.
- Wiegen Sie solide K (SbO) C4H4O6∙½H2O direkt in eine frische 100 mL Glasflasche 0,35 g. Füllen Sie einen Messzylinder mit 100 mL Wasser und Gießen Sie sie in die Flasche mit K (SbO) C4H4O6∙½H2O. rühren Sie den Inhalt der Flasche, bis sie vollständig aufgelöst ist.
- Füllen Sie ein Messzylinder mit 70 mL Wasser. Fügen Sie 230 mL 9 M H2SO4 (siehe 1.1.2) mit dem Wasser in den Messzylinder (d.h.füllen bis 300 mL). Den Inhalt der den Messzylinder mit einem Stab (z.B. abgestufte Pipette) sorgfältig zu homogenisieren. Übertragen Sie die Inhalte von den Messzylinder in eine braune 500 mL-Flasche (aktueller Inhalt: 6,9 M H2SO4).
- Hinzufügen (NH4)6Mo7O24∙4H2O Lösung, 300 mL von 6,9 M H2SO4. Fügen Sie die K (SbO) C4H4O6∙½H2O Lösung diese Mischung. Verschließen Sie die Flasche und schütteln Sie sie einige Male auf den Kopf gestellt für Homogenisierung.
- Vorbereitung des internen Qualitätsstandards (IQS: 1 mg/L KH2PO4-P in 0,9 mM H2SO4)
- Trocknen Sie ein paar Gramm KH2PO4 in eine kleine Glasschale bei 105 ° C in den Trockenschrank zu, bis Masse Beständigkeit erreicht ist und dann kühlen Sie die KH2PO4 bis auf Raumtemperatur in den Exsikkator gestellt.
- Wiegen von 0,2197 g ± 0,0002 g KH2PO4 direkt aus der Exsikkator in eine Volumetrische 1 L-Flasche und fügen Sie ca. 800 mL Wasser in den volumetrischen Kolben.
- Jetzt fügen Sie 5 mL 9 M H2SO4 (siehe 1.1.2) in den Kolben mit einem volumetrischen 5-mL-Pipette und füllen Sie die Flasche mit Wasser bis zu 1 L ring Mark.
- Rühren Sie den Inhalt der volumetrischen Kolben auf den Magnetrührer und übertragen Sie die Inhalte der volumetrischen Kolben in eine 1 L Flasche (aktueller Inhalt: 50 mg/L KH2PO4-P 45 mM H2SO4). Diese Lösung dient fortan als eine Stammlösung für die Vorbereitung des IQS.
- Übertragen Sie 10 mL dieser Lösung in eine Volumetrische 500 mL-Flasche mit einer volumetrischen 10 mL-Pipette zu, füllen Sie den volumetrischen Kolben bis 500 mL-Ring-Markierung mit Wasser und rühren Sie den Inhalt der volumetrischen Kolben auf den Magnetrührer.
- Übertragen Sie die Inhalte der volumetrischen Kolben in eine 500 mL-Flasche (aktueller Inhalt: 1 mg/L KH2PO4-P in 0,9 mM H2SO4). Diese Lösung ist der IQS.
2. Vorbereitung des Phosphonat-haltigen gepufferten Lösungen
- Wiegen oder pipette den gewünschten Puffer in einem volumetrischen Kolben (bei einer Zielkonzentration von 0,01 M Puffer in 1 L, z. B.: 572 µL 100 % AcOH, 2,1014 g CitOH· H2O, MES, MOPS, HEPES, EPPS, 2,3732 g 2,5233 g 2,3831 g 2,0926 g 1,9520 g von CAPSO, 2,2132 g von CAPS, 5 mL 2 M NaOH).
- Füllen Sie die volumetrische Flasche zu etwa drei Vierteln mit Wasser und fügen Sie eine vorbereitete 1 g/L-Phosphonat-P-Stammlösung (für eine Zielkonzentration von 1 mg/L P in 1 L, z. B.1 mL 1 g/L Phosphonat-P).
- Füllen Sie die Flasche mit Wasser bis zur Markierung der Ring, rühren Sie den Inhalt des Kolbens auf den Magnetrührer, bis alle Zutaten aufgelöst werden und in eine Glasflasche zu übertragen.
- Unter ständigem Rühren, stellen Sie den gewünschten pH-Wert in der Pufferlösung (z.B. pH 6 bei MES) mit HCl (z. B.2 und 10,2 M) oder NaOH (z. B.2 und 10 M) (die Zugabe von saure und basische Lösung sollte vermieden werden um ein unnötiges zu verhindern Erhöhung der Ionenstärke).
- Um das Phosphonat-P-Konzentration zu bestimmen, gehen Sie nach Schritt 4.
3. Verfahren der Adsorption-Prüfung
- Waschen Sie das Filtermaterial gründlich mit destilliertem Wasser (z. B.über ein Sieb mit einer Maschenweite von 0,5 mm) und trocknen Sie es dann bei 80 ° C.
Hinweis: Das Protokoll kann hier angehalten werden. - Wiegen Sie das Filtermaterial (z.B., granular ferric Hydroxid) in einem 50 mL Zentrifugenröhrchen.
Hinweis: Das Protokoll kann hier angehalten werden. - Füllen Sie die 50 mL Zentrifugenröhrchen mit Phosphonat-haltige Lösung aus Schritt 2 bis 50 mL Markierung schnell.
- Schnell verschließen Sie das Röhrchen und Klemmen Sie es in den laufenden Rotator (die Kontaktzeit von nun an beginnt).
- Drehen Sie das Rohr mit 20 Umdrehungen pro Minute für einen bestimmten Zeitraum (z.B., 1 h).
- Filtern Sie ca. 10-20 mL des Überstands mit einer Spritze Filter (0,45 µm Porengröße) in eine leere Flasche.
Hinweis: Das Protokoll kann hier angehalten werden. - Bestimmen Sie den pH-Wert des Filtrats und um festzustellen, das Phosphonat-P Konzentration mit Schritt 4 fortfahren. Fahren Sie bei der Untersuchung von Phosphat Adsorption mit Schritt 5.
4. Bestimmung des Gesamt-P (Phosphonat-P) nach ISOmini
Hinweis: Die folgende Prozedur wird auch in Abbildung 3dargestellt.
- Ein Aliquot der zu analysierenden Probe zu übertragen (V-Probe, max. 4 mL) mit einer Mikropipette in ein 10 mL-Fläschchen Schraubverschluss (das Fläschchen einschließlich der Kappe sollte vorab gespült mit HCl (siehe 1.2) und H2O und bei 80-100 ° C getrocknet).
Hinweis: Das Protokoll kann hier angehalten werden. - Fügen Sie Wasser mit einer Mikropipette ein Gesamtvolumen von 4 mL zusammen mit der Probe zuvor hinzugefügt zu erhalten (VWasser = 4 mL–-V-Probe).
Hinweis: Das Protokoll kann hier angehalten werden. - Fügen Sie 0,2 mL 0,9 M H2SO4 -Lösung (siehe 1.1.3) mit einer Mikropipette. Wenn es eine Konzentration von 1 M NaOH in der Probe, wie oft bei Regeneration Lösungen der Fall ist, fügen Sie 0,2 mL von 13,5 M H2SO4 -Lösung (siehe 1.1.1) (Vorsicht: diese Lösung von Schwefelsäure ist stark konzentriert).
Hinweis: Das Protokoll kann hier angehalten werden. - Hinzufügen von 4,8 mL einer K2S2O8 Lösung/Suspension (siehe 1.5) die Konzentration hängt der Puffer in der Probe enthaltenen (entspricht ISO bei 0,01-1 M NaOH: 8,33 g/L K2S2O8; 0,01 M CitOH, AcOH, MES: 41,67 g/L; 0,01 M MOPS: 50,00 g/L; 0,01 M HEPES: 58,33 g/L; 0,01 M EPPS, CAPSO, CAPS: 66,66 g/L).
- Das Fläschchen mit dem Deckel verschließen und schütteln.
- Erhitzen Sie das Fläschchen in einem Thermostat bei 148-150 ° C für 1 h.
- Das Fläschchen aus der Thermostat zu nehmen und auf Zimmertemperatur abkühlen lassen.
Hinweis: Das Protokoll kann hier angehalten werden. - Öffnen Sie das Fläschchen und 0,4 mL 1,5 M NaOH-Lösung (siehe 1.4).
Hinweis: Das Protokoll kann hier angehalten werden. - 0,2 mL 100 g/L-Ascorbinsäure-Lösung hinzufügen (siehe 1.6).
- Anschließend fügen Sie 0,4 mL Molybdat-II-Lösung (siehe 1.8).
- Schließen Sie das Fläschchen und umdrehen für Homogenisierung.
- Warten Sie Mindeste 15 Minuten bis maximal 4 h Farbbildung.
- Messen spektrale Absorption (A) bei einer Wellenlänge von 880 nm mit einem Photometer.
- Führen Sie die Schritte 4.1-4.13 regelmäßig für 4 mL Wasser (für die Bestimmung von einemblinden) sowie für die 4 mL einer IQS (siehe 1,9).
- Berechnen Sie die Gesamt-P oder Phosphonat-P-Konzentration der Probe Analyse auf der Grundlage der spezifischen Extinktion der Analyse Probe (A) die Extinktion der blinde Probe (einblind) und das Probenvolumen (V-Muster) mithilfe der folgenden Gleichung (0,287 entspricht der Steigung der Kalibrierungslinie mit 1 cm-Küvetten und können abweichen, je nach dem Photometer):
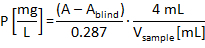
5. Ermittlung der o-PO43-- P nach ISOMini
Hinweis: Diese Bestimmung-Methode kann verwendet werden, wenn die Adsorption von anorganischen ortho-Phosphat auf granulierter Filtermaterialien untersucht werden soll. In diesem Fall muss die Probe getestet werden nicht verdaut werden.
- Ein Aliquot der zu analysierenden Probe zu übertragen (V-Probe, max. 9,4 mL) mittels einer Mikropipette in ein 10 mL-Fläschchen Schraubverschluss (das Fläschchen einschließlich der Kappe sollte vorab gespült mit HCl (siehe 1.2) und H2O und bei 80-100 ° C getrocknet).
Hinweis: Das Protokoll kann hier angehalten werden. - Fügen Sie Wasser mit einer Mikropipette ein Gesamtvolumen von 9,4 mL zusammen mit der Probe zuvor hinzugefügt zu erhalten (VWasser = 9,4 mL–-V-Probe).
Hinweis: Das Protokoll kann hier angehalten werden. - 0,2 mL 100 g/L-Ascorbinsäure-Lösung hinzufügen (siehe 1.6).
- Anschließend fügen Sie 0,4 mL Molybdat ich Lösung (siehe 1.7).
- Schließen Sie das Fläschchen und umdrehen für Homogenisierung.
- Warten Sie Mindeste 15 Minuten bis maximal 4 h Farbbildung.
- Messen spektrale Absorption (A) bei einer Wellenlänge von 880 nm mit einem Photometer.
- Führen Sie die Schritte 5.1-5.7 regelmäßig auf 9,4 mL Wasser (für die Bestimmung von einemblinden) sowie für die 4 mL einer IQS (siehe 1,9).
- Auf der Grundlage der spezifischen Extinktion der Analyse Probe (A), der blinde Probe (einblind) und das Probenvolumen (V-Muster) kann die ortho-Phosphat-P-Konzentration der Probe Analyse unter Verwendung der Gleichung in 4.15 berechnet werden.
Ergebnisse
Beispiel der Isothermen gewonnen mit dem vorgeschlagenen Verfahren
Abbildung 4 zeigt ein Beispiel für die Ergebnisse bei der Anwendung des Protokolls bei der Untersuchung der Adsorption von NTMP von GFH bei verschiedenen pH-Werten. NTMP wurde ausgewählt, weil Sie mit drei Phosphonat-Gruppen, die repräsentativsten Phosphonat für das breite Spektrum der möglichen Phosphonaten ist davon die Anzahl der Phosphonat-Gruppen zwischen eins (PBTC) und fünf variieren (DTPMP). Darüber hinaus die molare Masse von NTMP (299.05 g/Mol) befindet sich ebenfalls im mittleren Bereich von Phosphonaten (dabei: 206.03 g/Mol, DTPMP: 573.20 g/Mol). In Abbildung 4Adsorption Isothermen, d. h., das Laden von Phosphonat über die verbleibende Phosphonat-Konzentration bei verschiedenen Puffern und pH-Werte nach einer Kontaktzeit von 1 h länger Kontakt dargestellt, was oft zu unerwünschten führen könnte Abrieb des Materials durch zu lange Kontakt zwischen den Teilchen. Für jede Isotherme, eine Lösung mit 1 mg/L NTMP-P und abhängig von der gewünschten pH-Wert, Puffer in der Konzentration von 0,01 M war vorbereitet und mittels HCl oder NaOH auf einen anfänglichen pH Wert eingestellt. Dies war 4.0 (AcOH), 6.0 (MES), 8,0 (EPPS), 10.0 (CAPS) und 12.0 (NaOH). Abhängig von der Konzentration der GFH, infolge der 1 h Einwirkzeit, verändert der pH-Wert in der Lösung von maximal 2,0: 4,0-6,0 (AcOH), 6.0-7.3 (MES), 8,0-8,2 (EPPS), 9,4-10.0 (CAPS), 10,9-12.0 (NaOH). Die PZC GFH ist ca. 8,6 Folgeschäden also, dass der pH-Wert bei einer eingestellten pH Wert > 8.6 durch Kontakt mit GFH verringert und bei einem pH Wert < 8.6 erhöht. Je weiter entfernt das angepasst pH Wert war von 8,6, desto stärker wurde die pH-Wert-Änderung.
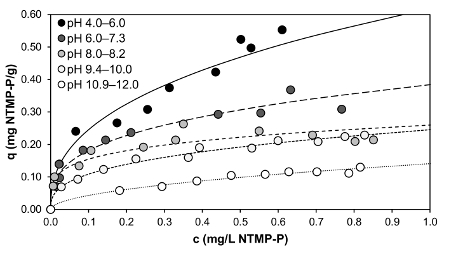
Abbildung 4 : Laden von NTMP (anfängliche Konzentration von 1 mg/L NTMP-P) auf granular ferric Hydroxid dosiert bei Konzentrationen von 0,7 - 14 g/L nach 1 h Einwirkzeit bei Raumtemperatur. Die folgenden Puffer in Konzentrationen von 0,01 Mol/L dienten bei den genannten pH-Werte im Diagramm: AcOH (pH 4,0-6,0), MES (pH 6,0-7.3), EPPS (pH 8,0-8,2), Kappen (pH 9,4-10,0) und NaOH (pH 10,9-12.0). Die Kurven gezeichnet sind Freundlich Isothermen. Bitte klicken Sie hier für eine größere Version dieser Figur.
Alle Isothermen in Abbildung 4 waren mit der Freundlich-Gleichung modelliert (² Werte von links nach rechts mit steigendem pH-Wert: 0,875, 0.905, 0.890, 0.986 0.952; entsprechende n Werte: 2.488, 3.067, 4.440, 2,824, 1.942; entsprechende KF -Werte: 0.619 0,384, 0.260, 0.245 0.141). Bei pH-Werten von 4-6, eine Belastung von bis zu 0,55 mg NTMP-P/g erreicht wurde, was 1,8 mg NTMP/g entspricht. Je höher der pH-Wert Wert ist, desto niedriger das Niveau der Adsorption. Eisen-hydroxide haben eine große Anzahl von Fe-OH-Gruppen auf ihrer Oberfläche, die protonierten oder deprotonierten abhängig von der pH Wert sein kann. Mit der Tiefe des pH-Wertes ist die Oberfläche überwiegend protonierten, d.h.positiv geladen, was bedeutet, dass der mehrzähnigen Phosphonaten, die über den fast gesamten pH-Bereich negativ geladen sind, angezogen werden. Ein höheren pH-Wert verschiebt sich die Ladung des Eisen-Hydroxid-Oberfläche in die negative Richtung, was wiederum zu erhöhter elektrostatische Abstoßung7führt. Interessanterweise kam sogar bei pH 12, das entspricht einem OH– Konzentration von 0,01 M, Adsorption. Daher müssen für erfolgreiche Desorption NaOH Lösungen mit einer viel höheren Konzentration verwendet werden.
Im Vergleich zu den Ergebnissen der anderen Forschern scheint die maximale Beladung bis zu 0,55 mg NTMP-P/g der GFH in diesem Werk eher gering sein. Boels Et al. 14 fand eine maximale Beladung von 71 mg NTMP/g der GFH, das entspricht 21,7 mg NTMP-P/g GFH in ihren Experimenten mit einem synthetischen Umkehr-Osmose-Konzentrat mit 30 mg/L NTMP (9,3 mg/L NTMP-P) bei pH 7,85. Sie verwendet pulverisierte GFH und gerührt die synthetische Lösung, die HCO3– enthalten, die auch als Puffer, 24 Stunden wirkt. Daher können nicht ihre Ergebnisse direkt zu den Ergebnissen dieser Arbeit verglichen werden, da sie eine viel höhere anfängliche Konzentration verwendet und GFH, das wahrscheinlich zu einer höheren Fläche führen gepudert, deshalb führt zu einer besseren Leistung der Adsorption. Darüber hinaus war die Kontaktzeit deutlich länger wie in dieser Arbeit. Nowack und Stein7 führte Experimente mit einem 40 µM NTMP Lösung (3,72 mg NTMP-P/L) in einem 0,42 g/L goethitgruppen Gülle bei einem pH-Wert von 7,2. Die Lösung wurde für 2 h führt auf eine maximale Beladung von ca. 30 µM NTMP/g goethitgruppen (2,79 mg NTMP-P/g) gerührt. 1 mM MOPS diente als Puffer. Die Ergebnisse können nicht wieder direkt zu den Ergebnissen dieser Arbeit aufgrund der höheren anfänglichen Phosphonat Konzentration verglichen werden. Darüber hinaus hatte die Gülle, die aus goethitgruppen Herden bestand, eine hohe Oberfläche. Aber die Formen der Isothermen von Boels Et Al. 14 und Nowack und Stein7 zustimmen, die von dieser Arbeit, und alle von ihnen könnte auch durch das Freundlich-Modell montiert werden.
Einfluss des Puffers auf Phosphonat Adsorption und erforderlichen Puffer Konzentration
Bisherige Experimenten zu bestimmen, die Adsorption Kinetik hatten gezeigt, dass auch mit dem Einsatz von Puffern, ein Gleichgewichts-pH-Wert innerhalb sehr kurzer Zeit erreicht wird. Dieser pH-Wert kann deutlich von den pH-Wert abweichen, das zuvor die Phosphonat-haltige Lösung (eingestellte pH-Wert) gegründet wurde. Dieses Gleichgewicht pH tendenziell PZC des Filtermaterials, die 8,6 für das granular ferric Hydroxid hier (nach eigenen Untersuchungen) diskutiert wurde. Daher kann ausgegangen werden, dass der pH-Wert nach der Einwirkzeit (endgültige pH-Wert) entscheidend für das Ausmaß ist, die Adsorption von das Phosphonat tritt.
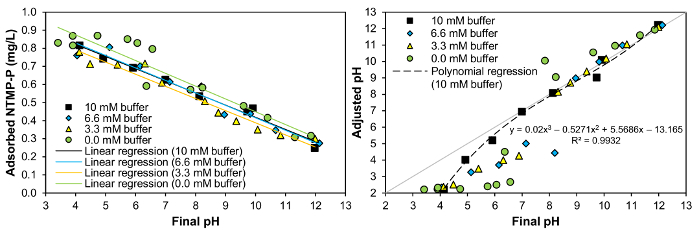
Abbildung 5: Links: Laden von NTMP (anfängliche Konzentration von 1 mg/L NTMP-P) auf 2,5 g/L granular ferric Hydroxid als Funktion des pH-Wertes bei verschiedenen Puffer Konzentrationen nach einer Einwirkzeit von 1 h. Rechts: Vergleich der pH-Wert nach 1 h Einwirkzeit mit dem pH-Wert inmitten der Stammlösung vor Kontakt mit granular ferric Hydroxid bei verschiedenen Konzentrationen der Puffer MES, MOPS, EPPS, CAPSO, AcOH und Kappen. Bitte klicken Sie hier für eine größere Version dieser Figur.
Im rechten Diagramm in Abbildung 5die pH-Werte, die in die NTMP-haltige Lösung in verschiedenen Puffer Konzentrationen festgelegt wurden sind im Vergleich zu der endgültigen pH-Werte nach 1 h Kontakt zwischen 1 mg/L NTMP-P und 2,5 g/L GFH. Es wird deutlich, dass eine bestimmte Korrelation zwischen den pH-Wert zuvor, in der Lösung festgelegt und der endgültige pH-Wert nur erreichbar war und so eine relativ zuverlässige pH-Einstellung war möglich, nur als Puffer in einer Konzentration von 10 mM verwendet wurden. Dies spiegelt sich in der Korrelationsfunktion mittels polynomialen Regression ermittelt und in das Diagramm auf der rechten Seite reproduziert. Die Tatsache zeigt, dass im Falle von Puffer-Konzentrationen unter 10 mM pH Werte von 2-4 Erlangung endgültige pH-Werte von 6-7 voreingestellt werden musste, dass die Vorhersage von der endgültigen pH-Wert, ist entscheidend für die Adsorption und somit die sichere Durchführung der Adsorption Tests f oder solche Puffer-Konzentrationen waren schwierig.
Im linken Diagramm in Abbildung 5, das Ausmaß der Adsorption von 1 mg/L NTMP-P bei 2,5 g/L GFH ist in Abhängigkeit von der endgültigen pH-Wert für verschiedene Puffer Konzentrationen dargestellt. Vorausgesetzt eine lineare Abhängigkeit der Belastung auf den pH-Wert im Bereich von pH 4-12 gemäß Gleichung y = Ax + b, die Werte durch lineare Regression berechnet für alle Puffer Konzentrationen untersucht sehr ähnlich waren (10 mM: ein = −0.0673, b = 1.0914 ² = 0.9837; 6,6 mM : ein = −0.0689, b = 1.1047 ² = 0.9512; 3,3 mM: ein = −0.0672, b =-0.0672, ² = 0.9570; 0 mM: ein = −0.0708, b = 1,157, ² = 0.8933). Der Koeffizient der Entschlossenheit, die das höchste für 10 mM Puffer war, zeigte sehr deutlich, dass mit dieser Puffer Konzentration nicht nur der endgültige pH-Wert einfacher war zu justieren, sondern auch die zuverlässigsten Ergebnisse in Bezug auf Adsorption erreicht wurden. Nur der Kurs ohne Puffer zeigt eventuelle Abweichungen der Adsorption soweit zwischen pH 5 und 7. Um diese letzte pH-Werte zu erreichen, ohne Pufferung, sehr niedrige pH-Werte in der Stammlösung eingestellt werden musste, einige davon waren jedoch nur etwas über 2. Aufgrund der sehr starken Unterschied zwischen angepassten pH und endgültige pH ist es daher möglich, dass der endgültige pH-Wert nicht entscheidend für das Ausmaß der Adsorption bei kein Puffer war. Somit ist auszugehen, dass die Verwendung von guten Puffer in Tabelle 1 genannten hat keinen wesentlichen Einfluss auf die Adsorption von Phosphonaten auf GFH, d. h., es gibt keine Konkurrenz für Adsorption Websites zwischen dem Phosphonat und Puffer. Diese Selektivität ist nur weit verbreitet, weil die Adsorption von NTMP auf GFH vor allem auf die Bildung von Mono- und zweizähnigen komplexe15ist. Gute Puffer haben auf der anderen Seite wenig Neigung zu bilden Metallkomplexe17,19, weshalb NTMP vorzugsweise von GFH gebunden ist. Im Falle von Adsorbentien mit weniger polare Oberfläche, wie z. B. Aktivkohle ist auszugehen, dass gute Puffer auch kostenlose Adsorption Websites zu besetzen und somit die Adsorption von das Phosphonat beeinflussen. Die Verwendung dieser Puffer die Adsorption von Phosphonaten auf Aktivkohle zu studieren wird daher nicht empfohlen.
Kalibrierung von ISO Mini Methode und die Einhaltung der ISO
Abbildung 6 zeigt die Kalibrierung Linien mit der internen Qualitäts standard (IQS: 1 mg/L KH2PO4-P in 0,9 mM H2SO4) nach ISO 6878 sowie die geänderte ISOMini Methode für Gesamt P und o-PO4 3 -P - Bestimmung. Basierend auf einer linearen Regression, die Kalibrierfunktion Äquivalent zu ISO 6878 wurde y = 0.0033 + 0.2833 X (² = 0.99978). Die lineare Regression beantragt, die miniaturisierte Variante Phosphat Bestimmung führte die Kalibrierung Funktion y = 0.0058 + 0.2864 X (² = 0,99999). Mit y = 0.0020 + 0.2890 X (² = 0.99985) die Kalibrierfunktion für insgesamt P-Bestimmung nach der ISO-Mini -Methode war sehr ähnlich und sehr präzise sowie. Alle Varianten haben einen sehr hohen Bestimmungskoeffizient, was bedeutet, dass die ISO-Mini -Methode nicht Genauigkeit durch die Reduktion der das Probenvolumen auf ein Fünftel beeinträchtigt. Gleichung vom Typ Conversion bestimmt mittels der Kalibrierung Funktionen für die Bestimmung der P-Konzentration in der Analyse-Probe aus der gemessenen spektralen Absorptionswerte wird in das Protokoll im Schritt 4.15 gegeben. Erfahrung hat gezeigt, dass die Extinktion der blinde Probe in der Regel seit bei 880 vernachlässigt werden kann nm durch das Photometer abgestrahlten Signals sehr stark in der sehr kleinen Messbereich springen kann. So entsprach ein Messwert bei 4 mL Probenvolumen (ISOMini) 0,287 zu einer Phosphorkonzentration von 1 mg/L P.
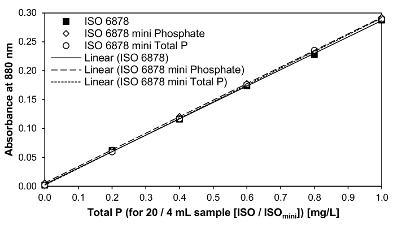
Abbildung 6: Kalibrierung Linien für die Bestimmung des Gesamt-P und ortho-Phosphat-P nach ISO 6878 und ISOMini. Ein IQS (1 mg/L KH2PO4-P in 0,9 mM H2SO4) wurde gemäß Ziffer 1.9 des Protokolls verwendet. Für die ISO-Methode diente der IQS in Aliquote von 4, 8, 12, 16 und 20 mL und für die geänderte ISOMini Methode in Aliquote von 0,8, 1,6, 2.4, 3.2 und 4.0 mL. Bitte klicken Sie hier für eine größere Version dieser Figur.
Plausibilität und Puffer-abhängige Dosierung Mengen von ISO Mini Methode
Wie bereits erwähnt ist eine zuverlässige pH-Einstellung in der Adsorption-Test nur möglich mit einer Puffer-Konzentration von 0,01 M. Eine solche Puffer Konzentration erfordert jedoch eine höhere K2S2O8 Dosierung als angegeben in ISO 6878 für die meisten Puffer. Außerdem legt die ISO der pH-Wert muss festgelegt werden, um 3 bis 10 mit einer pH-Elektrode nach der Verdauung. Da solche pH-Einstellung in einer kleinen Schraubverschluss Phiole durchgeführt werden kann, waren die passenden NaOH Dosiermenge für verschiedene Pufferlösungen zu ermitteln. Abbildung 7 zeigt die Absorption verschiedener Puffer-haltigen Lösungen mit 1 mg/L NTMP-P, wenn diese mit verschiedenen K2S2O8 Mengen entsprechend ISOMini verdaut und behandelt mit unterschiedlichen Mengen von waren NaOH nach der Verdauung. Jede Matrix wurde entsprechend auf das folgende Verfahren: 4 mL einer Lösung war gemischt mit 0,2 mL 0,9 M H2SO4, mit unterschiedlichen K2S2O8 Mengen zur Verfügung gestellt und gefüllt mit H2O, das gleiche Gesamtvolumen von 9 mL. Dies wurde nun gemäß dem Protokoll (1 h bei 148-150 ° C) verdaut. Nach dem Abkühlen wurden unterschiedliche NaOH Mengen hinzugefügt und füllte sich auf ein Gesamtvolumen von 9,4 mL mit H2O. Anschließend wurden 0,2 mL Ascorbinsäure-Lösung und 0,4 mL Molybdat-II-Lösung hinzugefügt. Die Bestimmung der Extinktion (880 nm) wurde 4 h nach der Zugabe von dieser Farbe Reagenzien durchgeführt. Diesmal wurde gewählt, um sicherzustellen, dass die spezifischen Extinktion stabil war. Eine Lösung mit 1 mg/L NTMP-P und 1 M NaOH wurde ebenfalls untersucht. Jedoch wurden anstelle der K-2S2O8 und NaOH Mengen, H2SO4 Mengen variiert um sicherzustellen, dass der pH-Wert niedrig genug für die Verdauung war. Der gezielte Absorption Wert war (siehe Kalibrierungslinie in Abbildung 6) 0,287. So sind in Abbildung 7 diese Werte dargestellt in hellem grün, das von diesem Sollwert abgewichen von maximal 5 %. Ein Wert in jeder Matrix wird durch eine dunkelgrüne Farbe hervorgehoben. Dies markiert den K2S2O8 und NaOH Dosierung Mengen für die regelmäßige ISO-Mini -Methode für diese Art der Pufferlösung empfohlen.
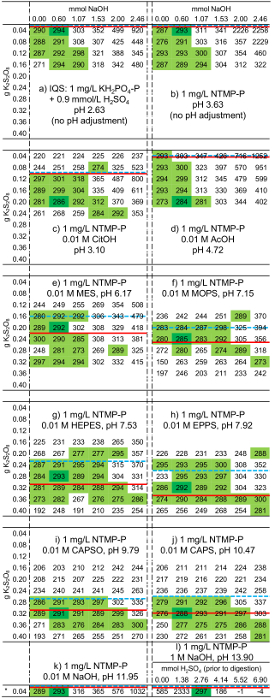
Abbildung 7: spektrale Absorption (× 1000) von verschiedenen Phosphonat - und Puffer-haltigen Lösungen mit verschiedenen K2S2O8 und NaOH Dosierung Mengen bei einer Wellenlänge von 880 nm in 1 cm-Küvetten. Vorgehensweise: 4 mL Lösung (wie in der Abbildung gezeigt und angepasst werden, um die pKeinen Wert des Puffers angepasst aus den thermodynamischen pKein Werten der Goldberg Et al. 20 zu einer Konzentration von 0,01 M und 25 ° C31) wurde in einer 10 mL Schraubverschluss Phiole, gemischt mit 0,2 mL 0,9 M H2SO4 und mit unterschiedlichen Mengen von K2S2O8 (wie in der Abbildung gezeigt) gelegt. Dann wurde Wasser hinzugefügt, um ein Gesamtvolumen von 9 mL für alle Proben vor Verdauung zu erhalten. Nun wurden die Fläschchen im Thermostaten bei 148-150 ° C für 1 h (Verdauung) beheizt. Nach dem Abkühlen auf Raumtemperatur, unterschiedliche Mengen an NaOH (wie in der Abbildung gezeigt) wurden hinzugefügt und mit dem Zusatz von Wasser, dabei wurde darauf geachtet, dass ein Gesamtvolumen von 9,4 mL in allen Fläschchen vorhanden war. 4 h nach Zugabe von 0,2 mL Ascorbinsäure-Lösung und 0,4 mL Molybdat-II-Lösung, die Extinktion bei 880 nm bestimmt war. Im Falle der Lösung l (1 mg/L NTMP-P in 1 M NaOH), die Höhe der H2SO4 statt K2S2O8variiert wurde. Hier entsprach die dosierte Menge an NaOH in allen Proben 0,4 mL 1,5 M NaOH, d. h., 0,60 Mmol NaOH. Hellgrün: maximal 5 % Abweichung vom Zielwert: 287. Dunkelgrün: die empfohlene Einstellung für diesen Puffer und Phosphonat-haltige Lösung. Gestrichelte Linie: COD, gerade Linie: ThSB. Bitte klicken Sie hier für eine größere Version dieser Figur.
Obwohl reduktive Bedingungen in den Prozess der Farbe durchsetzen müssen und übermäßige K2S2O8 damit die Ergebnisse für Lösungen beeinträchtigen ein und b (Abbildung 7), für die keine (IQS) oder nur eine sehr geringe Menge von K2 S2O8 (nur NTMP ohne Puffer) erforderlich ist, zeigen, dass höhere Mengen an K2S2O8 als erforderlich nicht automatisch zu einer abrupten Reduktion der Extinktion führen. Es sollte hier erwähnt, dass andere Phosphonaten in Lösungen analog zu Lösung b mit 1 mg/L PBTC-P (Extinktion: 0.3005), 1 mg/L dabei-P (0.3035), 1 mg/L EDTMP-P (0.2952) oder 1 mg/L DTPMP-P (0.2936) waren völlig mit der ISO-Mini verdaut Verfahren nach dem Protokoll mit 0,04 g K2S2O8 und 0,6 Mmol NaOH. Somit kann diese Methode auch für Phosphonaten als NTMP verwendet werden.
Tabelle 1 zeigt den theoretischen Sauerstoffbedarf (ThSB) für die Oxidation von jeder Puffer und der chemische Sauerstoffbedarf (CSB) Hach LCK 514 Küvette Schnelltests in einer Pufferlösung 0,01 M gemessen. Es ist bekannt, dass Kalium Dichromat, das Oxidationsmittel verwendet für die CSB-Bestimmung nicht organisch gebundenem Stickstoff32oxidieren. Für gute Puffer war die gemessene COD immer zwischen dem theoretischen Betrag für die Oxidation von C und H und die Oxidation von C, H und S. Nur für Puffer mit einem C-OH-Gruppe (HEPES, EPPS, CAPSO) entsprachen der gemessene Wert auf den theoretischen Wert für die Oxidation von C, H und S. In den Puffern, die eine C-OH-Gruppe (MES, MOPS, Kappen) nicht enthalten, ist die Sulfo-Gruppe offensichtlich nicht vollständig abgebaut um Sulfat.
Für die Lösungen 7 c , 7jganz klar ersichtlich, dass K2S2O8 Mengen erheblich unter dem Betrag des Oxidationsmittels erforderlich nach COD des Puffers, unabhängig von der NaOH-Menge, nicht zur Erreichung des Zielwerts. Bei 10 mM hatte der Puffer in diese Lösungen eine Konzentration von ca. 1000-mal höher als die von NTMP. Wenn der Puffer nicht verdaut ist, kann nicht garantiert werden, dass das Phosphonat vollständig oxidiert werden kann. Nur K2S2O8 Mengen jenseits der COD dazu beigetragen, die zuverlässige Erreichung des Zielwerts. So war es nicht notwendig für alle Puffer die theoretische Oxidationsmittel Voraussetzung für die vollständige Oxidation des Puffers (ThSB) anzuwenden, weil der Stickstoff und natürlich auch für einige Puffer Sulfo-Gruppen wurden nicht vollständig zersetzt. Oxidationsmittel jenseits der COD reagierte nicht mit dem Puffer, und daher gab es genügend Überschuss von K2S2O8 das Phosphonat zu oxidieren. NTMP enthält auch Stickstoff. Obwohl dies nicht vollständig um zu Nitrat, alle Gruppen sind offensichtlich zu Phosphat oxidiert Phosphonat oxidiert werden kann. Ansonsten würde eine nicht auffinden, die Absorption, die vorhanden ist, für 1 mg/L P. reichlich Überschuss von K2S2O8 hat sicherlich auch dazu beitragen, die vollständige Oxidation der Phosphonat, sondern nach der Verdauung einige K-2S2 O8 war noch vorhanden und könnte mit Ascorbinsäure, die notwendig ist für die Reduzierung der blauen Molybdat-Phosphat-Komplex reagieren. Das Ergebnis war eine Extinktion niedriger als der Zielwert.
In jeder Zeile erhöht die Extinktion mit der Menge an NaOH eine bestimmte Menge an NaOH ab. So kam es auch, dass unter dem Betrag des Oxidationsmittels erforderlich nach COD des Puffers, der gemessenen Absorption Wert gemäß der Zielwert sein könnte obwohl NTMP offensichtlich nicht vollständig (siehe Lösungen 7 c verdaut wurde, 7F, und 7 h). In diesem Fall ist die Zunahme der Extinktion auf selbst Abbau von Molybdat Ion aufgrund einer zu geringen [H]+]: [Mo] Verhältnis26und jegliche Korrespondenz ist daher nur zufällig. Dementsprechend könnte mit höheren K2S2O8 Mengen, mehr NaOH nach der Verdauung, verwendet werden, wie K2S2O8 den pH-Wert reduziert.
In den meisten Lösungen war die Extinktion auch im Einklang mit den Zielwert, auch wenn kein NaOH Dosierung angewendet wurde. Gelegentlich jedoch Abweichungen von diesem Wert aufgetreten ist, die möglicherweise das Fehlen von NaOH dazu geführt, dass das Optimum [H]+]: [Mo] Verhältnis war nicht gepflegt und somit die Farbe Komplex wurde instabil. Daher unabhängig von der Analyselösung, eine Dosis von 0,6 Mmol NaOH wird empfohlen, so, damit die Farbe komplexe erwies sich als die stabilste. Regeneration-Lösungen haben oft eine Konzentration von 1 M NaOH. Ein solcher Fall wird durch Matrix l abgedeckt. Hier zeigte sich, dass nur ein sehr enges Spektrum von H2SO4 Dosierung ist zulässig, was beweist, dass die Verwendung von einer pH-Elektrode zur Einstellung des pH-Wertes nach der Verdauung eine sicherere Verfahren hier sein kann.
Alle dunklen grünen Absorption Werte in Abbildung 7 (n = 12), umgewandelt in die Gesamtkonzentration von P nach der Kalibrierungslinie in Abbildung 6, geben einen durchschnittlichen Wert von 1,013 mg/L. Die Standardabweichung ist 0,014 mg/L. Die typische Abweichung vom Zielwert (1,000 mg/L) ist daher nur 0,11-2.67 % ((1,013––0,014 1.000) / 1.000 × 100 % = 0,11 %; (1,013 + 0,014–1.000) / 1.000 × 100 % = 2,67 %). Dies zeigt eine hohe Genauigkeit der ISO-Mini -Methode.
Diskussion
Die zunehmende Bedeutung von Phosphonaten erfordert Forschung für zuverlässige Methoden zur Entfernung von dieser Substanzen aus dem Abwasser, Kläranlagen oder aufnehmenden Gewässer zu schützen. Derzeit haben nur wenige Studien über die Beseitigung von Phosphonaten von Industrieabwässern5,11,12,13,14,16durchgeführt. Das Verfahren präsentiert hier zeigt, dass Untersuchungen über die Beseitigung von Phosphonaten durch Adsorption auf polar Eisenoxid, Materialien, insbesondere granular ferric Hydroxid enthalten sein können ausgeführt, schnell und zuverlässig wenn in Übereinstimmung mit den bestimmtes Protokoll.
Der entscheidende Punkt bei der Durchführung von Studien der Adsorption ist die Aufrechterhaltung des pH-Wertes. Dies kann nicht in rotierenden Zentrifuge Röhren ohne Verwendung eines Puffers. In diesem Artikel wurde gezeigt, dass gute Puffer eine akzeptable pH-Einstellung nur in einer Konzentration von 0,01 M ermöglichen und auch bei dieser Konzentration keinen signifikanten Einfluss auf die Adsorption von Phosphonaten auf GFH haben. Die Anwendung der guten Puffer ist auch der Grund, warum das hier vorgestellte Verfahren für Untersuchungen zur Adsorption von Phosphonaten auf eher unpolare Materialien wie Aktivkohle verwendet werden kann. Gute Puffer würde mit Phosphonaten kostenlos Adsorption Websites konkurrieren.
Da die direkte Analyse von Phosphonaten mittels HPLC22 oder IC-ICP-MS21 sehr aufwändig und teuer ist, schlägt die vorgestellte Methode, dass das Phosphonat nach Kontakt mit dem Adsorbens indirekt sollte, über die Bestimmung gemessen werden der gesamte P. Eine standardisierte Methode (ISO 687828) dient in der Regel für die gesamte P Bestimmung, in denen eine Verdauung erfolgt mittels H2SO4 und K2S2O8 auf einer Herdplatte der pH-Wert ist dann dargelegt, 3-10 über NaOH und eine blaue Farbe komplexe (die Farbintensität von denen ist linear proportional zur Phosphat-Konzentration) wird mit Hilfe von Ascorbinsäure und Molybdat Lösung gebildet. Diese standardisierte Methode ist sehr arbeitsintensiv und zeitaufwendig, weshalb eine schnellere Variante der ISO-Methode (ISOMini) entwickelt wurde. Die ISO-Mini -Methode reduziert das Gesamtvolumen auf ein Fünftel. Die Verdauung erfolgt bequem in einem Thermostat und die NaOH-Dosierung nach Verdauung behoben ist. Diese Methode ermöglicht eine große Anzahl von Phosphor Bestimmungen innerhalb kürzester Zeit durchgeführt werden und beeinträchtigt nicht die Genauigkeit im Vergleich zu den ISO-Methode.
Jeder Puffer hat eine andere COD. Darüber hinaus bedeutet die relativ hohen notwendigen Puffer-Konzentration von 0,01 M, um ausreichende Verdauung der Probe Bestandteile zu gewährleisten, müssen erheblich höhere Mengen an Oxidationsmittel dosiert werden, als es in der ISO-Methode festgelegt ist. Wenn die K2S2O8 Dosierung zu niedrig oder zu hoch, falsche Messergebnisse auftreten. In der ISO-Mini -Methode ist diese K2S2O8 Dosierung somit auf jeder Puffer individuell abgestimmt. Ein weiterer kritischer Punkt ist die Dosierung von NaOH. In der Regel haben Regeneration Lösungen NaOH Konzentrationen von > 0,1 M. Um zu vermeiden, dass die [H]+]: [Mo] Verhältnis für die Bildung der Farbe Komplex25,26 nicht eingehalten, eine angemessene Anpassung der H2 worden ist4 Menge vor der Verdauung ist daher erforderlich notwendig. Das Problem entsteht, wenn die Regenerationslösung wiederverwendet wird mehrere Male verändert dadurch seine pH-Wert und COD. Da eine zuverlässige und einfache pH-Messung nicht möglich in Schraubverschluss Fläschchen ist und eine geeignete pH-Einstellung ist nicht vorgesehen, stößt die ISO-Mini -Methode hier präsentierten, so an ihre Grenzen für Proben mit sehr hohen pH-Werten. Für Regeneration Lösungen empfiehlt es sich daher, die ISO-Methode verwenden.
Offenlegungen
Keine Interessenkonflikte erklärt.
Danksagungen
Die Autoren sind dankbar für die finanzielle Unterstützung durch die Willy-Hager-Stiftung, Stuttgart. Wir möchten auch die Mitarbeiter von Zschimmer & Schwarz Mohsdorf GmbH & Co. KG danken für die Bereitstellung von Phosphonat Proben.
Materialien
| Name | Company | Catalog Number | Comments |
| Sulfuric acid (H2SO4) | Merck (Darmstadt, Germany) | 1120802510 | 98% (p.a.) |
| Hydrochloric acid (HCl) | VWR Chemicals (Fontenay-sous-Bois, France) | 20254.401 | 32% (AnalaR NORMAPUR, p.a.) |
| Sodium hydroxide (NaOH) | Merck (Darmstadt, Germany) | 1064981000 | ≥99% (p.a.) |
| Acetic acid (AcOH) | VWR Chemicals (Fontenay-sous-Bois, France) | 20104.334 | 100% (p.a.) |
| 2-(N-morpholino)ethanesulfonic acid (MES) | SigmaAldrich (St. Louis, MO, USA) | M3671-250G | ≥99% |
| 3-(N-morpholino)propanesulfonic acid (MOPS) | SigmaAldrich (St. Louis, MO, USA) | M1254-250G | ≥99.5% |
| 4-(2-Hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | SigmaAldrich (St. Louis, MO, USA) | H3375-250G | ≥99.5% |
| 4-(2-Hydroxyethyl)-1-piperazinepropanesulfonic acid (EPPS) | SigmaAldrich (St. Louis, MO, USA) | E9502-250G | ≥99.5% |
| N-cyclohexyl-2-hydroxyl-3-aminopropanesulfonic acid (CAPSO) | SigmaAldrich (St. Louis, MO, USA) | C2278-100G | ≥99% |
| N-cyclohexyl-3-aminopropanesulfonic acid (CAPS) | SigmaAldrich (St. Louis, MO, USA) | C2632-250G | ≥98% |
| 2-Phosphonobutane-1,2,4-tricarboxylic acid (PBTC) | Zschimmer & Schwarz (Mohsdorf, Germany) | CUBLEN P 50 | 50% technical |
| 1-Hydroxyethane 1,1-diphosphonic acid monohydrate (HEDP·H2O) | SigmaAldrich (St. Louis, MO, USA) | 54342-50G | ≥95.0% |
| Nitrilotris(methylene phosphonic acid) (NTMP) | SigmaAldrich (St. Louis, MO, USA) | 72568-50G | ≥97.0% |
| Ethylenediamine tetra(methylene phosphonic acid) (EDTMP·1.4H2O) | Zschimmer & Schwarz (Mohsdorf, Germany) | - | |
| Diethylenetriamine penta(methylene phosphonic acid) (DTPMP·6H2O) | Zschimmer & Schwarz (Mohsdorf, Germany) | - | |
| Potassium dihydrogen phosphate (KH2PO4) | Merck (Darmstadt, Germany) | 1048731000 | ≥99.5% (p.a.) |
| Potassium peroxodisulfate (K2S2O8) | Merck (Darmstadt, Germany) | 1050920250 | ≥99.0% (p.a.) |
| L(+)-Ascorbic acid (C6H8O6) | Merck (Darmstadt, Germany) | 1004680500 | ≥99.7% (p.a.) |
| Ammonium heptamolybdate tetrahydrate ((NH4)6Mo7O24·4H2O) | Merck (Darmstadt, Germany) | 1011800250 | ≥99.0% (p.a.) |
| Granular ferric hydroxide (GFH) | Hego BioTec (Berlin, Germany) | - | FerroSorp RW |
| Syringe membrane filters | Sartorius Stedim Biotech GmbH (Göttingen, Germany) | 17765----------Q | Minisart RC Hydrophilic 25 mm 0.45 μm pore size |
| Single-use syringes for membrane filtration | Henke Sass Wolf (Tuttlingen, Germany) | 5200.X00V0 | 3-part Soft-Ject Luer 20 mL |
| Rotator | LLG Labware (Meckenheim, Germany) | 6.263 660 | uniROTATOR2 |
| Clamp for rotator | LLG Labware (Meckenheim, Germany) | 6.263 664 | Clamp for uniROTATOR2 |
| Screw cap vial | Glasgerätebau Ochs (Bovenden, Germany) | 135215 | Präparatenglas Duran, 16x100 mm, thread GL18, cap with PTFE seal |
| Micropipette | Eppendorf (Hamburg, Germany) | 3123000047 | eppendorf Research plus 10–100 µL |
| Micropipette | Eppendorf (Hamburg, Germany) | 3123000063 | eppendorf Research plus 100–1000 µL |
| Micropipette | Eppendorf (Hamburg, Germany) | 3123000071 | eppendorf Research plus 0.5–5 mL |
| Precision balance | Precisa Gravimetrics (Dietikon, Switzerland) | - | Precisa LX 220 A SCS |
| Thermostat | Hach (Berlin, Germany) | LTV077 | HT200S High Temperature Thermostat |
| Thermostat | Merck (Darmstadt, Germany) | 1712000001 | Spectroquant TR 320 |
| Spectrophotometer | Jasco Labor- u. Datentechnik (Groß-Umstadt, Germany) | - | UV/VIS Spectrophotometer Jasco V-550 |
| Centrifuge tube | Sarstedt (Nümbrecht, Germany) | 62.559.001 | Tube 50 mL, 115x28 mm, flat/conical base PP, assembled cap |
| pH probe | WTW (Weilheim, Germany) | 103635 | WTW pH-Electrode SenTix 41 |
| pH device | WTW (Weilheim, Germany) | - | WTW Multi 350i |
| COD determination | Hach (Berlin, Germany) | LCK514 | 100–2000 mg/L O2 |
| Sieve | Retsch (Haan, Germany) | 60.131.000500 | Test sieve 0.5 mm mesh (ISO 3310/1) stainless steel |
| Drying cabinet | Memmert (Schwabach, Germany) | - | Modell 600 |
Referenzen
- . Directive 2000/60/EC of the European Parliament and of the Council of 23 October 2000 establishing a framework for Community action in the field of water policy. Official Journal of the European Communities. , 327 (2000).
- Rott, E., Steinmetz, H., Metzger, J. W. Organophosphonates: A review on environmental relevance, biodegradability and removal in wastewater treatment plants. Science of the Total Environment. 615, 1176-1191 (2018).
- Grohmann, A., Der Horstmann, B. . Der Einsatz von Phosphonaten unter umwelttechnischen Gesichtspunkten (The use of phosphonates under environmental aspects). , (1989).
- Studnik, H., Liebsch, S., Forlani, G., Wieczorek, D., Kafarski, P., Lipok, J. Amino polyphosphonates-chemical features and practical uses, environmental durability and biodegradation. New Biotechnology. 32 (1), 1-6 (2015).
- Matthijs, E., de Oude, N. T., Bolte, M., Lemaire, J. Photodegradation of ferric ethylenediaminetetra(methylenephosphonic acid) (EDTMP) in aqueous solution. Water Research. 23 (7), 845-851 (1989).
- Nowack, B., Stone, A. T. Degradation of nitrilotris(methylenephosphonic acid) and related (amino)phosphonate chelating agents in the presence of manganese and molecular oxygen. Environmental Science & Technology. 34 (22), 4759-4765 (2000).
- Nowack, B., Stone, A. T. Adsorption of phosphonates onto goethite-water interface. J. Colloid Interface Science. 214 (1), 20-30 (1999).
- Nowack, B., Stone, A. T. The influence of metal ions on the adsorption of phosphonates onto goethite. Environmental Science & Technology. 33 (22), 3627-3633 (1999).
- Nowack, B., Stone, A. T. Competitive adsorption of phosphate and phosphonates onto goethite. Water Research. 40 (11), 2201-2209 (2006).
- Zenobi, M. C., Hein, L., Rueda, E. The effects of 1-hydroxyethane-(1,1-diphosphonic acid) on the adsorptive partitioning of metal ions onto γ-AlOOH. Journal of Colloid and Interface Science. 284 (2), 447-454 (2005).
- Rott, E., Minke, R., Steinmetz, H. Removal of phosphorus from phosphonate-loaded industrial wastewaters via precipitation/flocculation. Journal of Water Process Engineering. 17, 188-196 (2017).
- Klinger, J., Sacher, F., Brauch, H. J., Maier, D., Worch, E. Behaviour of phosphonic acids during drinking water treatment. Vom Wasser. 91, 15-27 (1998).
- Boels, L., Tervahauta, T., Witkamp, G. J. Adsorptive removal of nitrilotris(methylenephosphonic acid) antiscalant from membrane concentrates by iron-coated waste filtration sand. Journal of Hazardous Materials. 182 (1-3), 855-862 (2010).
- Boels, L., Keesman, K. J., Witkamp, G. J. Adsorption of phosphonate antiscalant from reverse osmosis membrane concentrate onto granular ferric hydroxide. Environmental Science & Technology. 46 (17), 9638-9645 (2012).
- Martínez, R. J., Farrell, J. Understanding Nitrilotris(methylenephosphonic acid) reactions with ferric hydroxide. Chemosphere. 175, 490-496 (2017).
- Chen, Y., Baygents, J. C., Farrell, J. Removing phosphonate antiscalants from membrane concentrate solutions using granular ferric hydroxide. Journal of Water Process Engineering. 19, 18-25 (2017).
- Good, N. E., Winget, G. D., Winter, W., Connolly, T. N., Izawa, S., Singh, R. M. M. Hydrogen ion buffers for biological research. Biochemistry. 5 (2), 467-477 (1966).
- Good, N. E., Izawa, S. Hydrogen ion buffers. Methods in Enzymology. 24, 53-68 (1972).
- Ferguson, W. J., et al. Hydrogen ion buffers for biological research. Analytical Biochemistry. 104 (2), 300-310 (1980).
- Goldberg, R. N., Kishore, N., Lennen, R. N. Thermodynamic quantities for the ionization reactions of buffers. Journal of Physical and Chemical Reference Data. 31 (2), 231-370 (2002).
- Schmidt, C. K., Raue, B., Brauch, H. J., Sacher, F. Trace-level analysis of phosphonates in environmental waters by ion chromatography and inductively coupled plasma mass spectrometry. International Journal of Environmental Analytical Chemistry. 94 (4), 385-398 (2014).
- Nowack, B. Determination of phosphonates in natural waters by ion-pair high-performance liquid chromatography. Journal of Chromatography A. 773 (1-2), 139-146 (1997).
- Murphy, J., Riley, J. P. A modified single solution method for the determination of phosphate in natural waters. Analytica Chimica Acta. 27, 31-36 (1961).
- Worsfold, P., McKelvie, I., Monbet, P. Determination of phosphorus in natural waters: A historical review. Analytica Chimica Acta. 918, 8-20 (2016).
- Going, J. E., Eisenreich, S. J. Spectrophotometric studies of reduced molybdoantimonylphosphoric acid. Analytica Chimica Acta. 70, 95-106 (1974).
- Pai, S. C., Yang, C. C., Riley, J. P. Effects of acidity and molybdate concentration on the kinetics of the formation of the phosphoantimonylmolybdenum blue complex. Analytica Chimica Acta. 229, 115-120 (1990).
- Eisenreich, S. J., Bannerman, R. T., Armstrong, D. E. A simplified phosphorus analysis technique. Environmental Letters. 9 (1), 43-53 (1975).
- . . ISO 6878:2004. Water quality-Determination of phosphorus-Ammonium molybdate spectrometric method. , (2004).
- Freundlich, H. Über die Adsorption in Lösungen (About the adsorption in solutions). Z. Physical Chemistry. 57, 385-470 (1907).
- Ho, Y. S., Porter, J. F., McKay, G. Equilibrium isotherm studies for the sorption of divalent metal ions onto peat: Copper, nickel and lead single component systems. Water Air & Soil Pollution. 141 (1-4), 1-33 (2002).
- Li, L., Zhang, S., Li, G., Zhao, H. Determination of chemical oxygen demand of nitrogenous organic compounds in wastewater using synergetic photoelectrocatalytic oxidation effect at TiO2 nanostructured electrode. Analytica Chimica Acta. 754, 47-53 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten