Method Article
実験で多年生の草の根、根、土壌微生物の分離と解析
要約
フィールドから植物の根の発掘だけでなく、土壌、根圏、endosphere に試料の加工は、DNA の抽出とデータ分析の方法を含め、詳細に説明します。本稿は、土壌、endosphere、および根圏内細菌叢解析の研究にこれらの技術を使用する他の研究室を有効にするのに設計されています。
要約
植物や土壌のマイクロバイ研究は理解役割微生物を農業生産性の再生にとって、ますます重要になっています。本稿の目的は、急速に土壌、根圏、およびレプリケートされたフィールド試験の endosphere のサンプルおよび微生物サンプルの種類、治療、および植物遺伝子型が原因で発生する可能性の変化を分析する方法の詳細を提供することです。これらのメソッドを示すために使用実験は、レプリケートされたフィールド プロットを含む 2 つの純粋な暖かい季節の草 (キビ virgatumとアンドロポゴン gerardii)と低多様性草の混合物 (a. gerardii, Sorghastrumカメムシタケ、とBouteloua curtipendula)。簡単に言えば、植物が出土、さまざまな根のカットしリン酸バッファーに置かれます、根圏を収集するを振っています。根は、氷と表面殺菌漂白剤とエタノール (エタノール) に研究室に運ばれます。根は濾過し、遠心分離によって集中されます。ルートボールの周りから土砂がビニール袋に置かれ、DNA の抽出のための少量の土の撮影場所の研究室に持って来られます。DNA は根、土壌と根から抽出および 16S rRNA 遺伝子の V4 の地域のためのプライマーで増幅し。Amplicons シーケンスし、バイオインフォマティクスのツールをオープン アクセスと分析します。これらのメソッドは、サンプルの種類、治療法、原因微生物群集の多様性と構成がどのように変化をテストする研究者を許可する、植物の遺伝子型。統計モデルと一緒にこれらのメソッドを使用して、代表的な結果を示す根、根、および土の微生物コミュニティの重要な違いがあります。紹介した方法フィールドのサンプルを収集、分離、抽出、定量化、増幅、DNA をシーケンスする方法についての完全なセットを提供し、微生物群集の多様性とレプリケートされたフィールド試験で組成を分析します。
概要
マイクロバイ研究理解し、栄養サイクリング、有機物の売り上げ高と、開発の抑制または土壌病原体1,2など生態系プロセスを操作するための重要な含意があります。この分野の調査はまた自然植物群落と農耕の生産性に土壌微生物の影響を理解するための大きな可能性を保持します。自然の生態系における土壌微生物相を当てている多くの研究、植物 endosphere と根圏微生物生態系3に焦点を当てたが少ない。ネブラスカ州の農業は農学上重要な作物が研究の重要なトピックを栽培されてこれらの土壌の研究を行った、国の大部分の風景を支配します。この方法の論文の目的は植物の根が根と endosphere、および最終的にまでの微生物コミュニティを変更する方法を決定するため、生態系の存在の微生物を記述するプロトコルの標準的なセットを研究者に提供するにはこれらの微生物は、土壌の健康と植物の生産性の再生機能を理解します。
ここで紹介した方法は排他的に内部ルートとどのように異なる微生物のルートのすぐ外側から4,5で本稿が微生物を学習を目指しているが他のユーザーによって使用される方法から若干異なります、根。本研究で使用される私アンプリコン シーケンス DNA サンプルで見つかった微生物分類群を識別し、研究者コミュニティがサンプルの種類や治療によって変更する方法を決定することができます。このプロトコルとランドバーグらによって使用される非常に同じようなプロトコルの主な違いの 1 つ6は、超音波処理、代わりにこのプロトコルを使用表面殺菌漂白剤とエタノールと根から根圏を削除します。他のユーザーは効果的に表面殺菌を使用も7,8,9,10。これらのメソッドは、わずかに異なるが、他の方法よりも有利ではありません。これらのメソッドは、十分な人々 と最大約 450 のサンプル土壌、根圏、endosphere に分割されている場合追加 1 日あたりの以上 150 のフィールド プロットを処理する可能性があるため大規模なフィールド実験のため特に適しています。この原稿は、詳細フィールドのサンプル、実験室で材料の処理、抽出し、DNA シーケンスに使用するメソッドについて説明し、結果のシーケンス データを分析する手順の概要について説明します。
プロトコル
1. フィールド サイトの説明
- コレクション期間中に実験サイトをについて説明します。フィールド (緯度、経度、高度) の位置を決定する GPS を使用しています。
- サンプリングの深さ、サンプリング時間、および土の質を記述します。
- 環境要因は、微生物群集を形作る上で重要な役割を果たす.年平均気温、降水量、過年度の輪作、耕起、施肥法と現場の歴史などの気象情報を記録します。自動気象観測所またはその他のデバイスは、成長の季節にわたって毎日の降雨量と温度を記録する便利です。
2. 収集と土、根、およびルート フィールド サンプルの処理
- 植物の発掘。
- ラベル、洗濯パンとバケット サンプリングする植物材料についての情報が含まれている付箋。プロット数などの情報を植物の遺伝子、植物種あります。プロット ラベルの付いたバケツを運ぶし、分野で確立されたワークステーションで洗濯パンを残してください。
- 根土で植物を保持のいずれかをカットする 30 cm の深さにシャベルで土に穴を開けます。大体の分量は 18 cm3です。ランダムに選択し、プロット内の異なる領域からプロットごとに 2 つの植物を収集します。
- シャベルを活用して植物の根を発掘し、ラベル付きのバケツに根のボールを配置します。フィールド内のワークステーションに出土した根のボールとラベルの付いたバケツを戻します。切断し、植物体地上部バイオマスを破棄します。
- 根と一括土のコレクションからの土の除去。
- 手動で土壌を削除または、根から土を取除くスペードか手持ちの耕うん機を使用する根を振る。根を揺れ非常に砂土での土壌を削除するのに十分です。手袋を着用し、処理場近くにルーツを置きます。
- 根を揺れ、土壌の大部分は洗濯パンになります。洗浄鍋の土を混合し、ハンドヘルド茎と任意の土壌土塊を破る。ラベルの付いた 17.7 x 19.5 cm ファスナー収納袋と涼しい場所、または氷の上に障害物がない土壌のサンプルを置きます。
- 根と根のコレクション。
- 70 で滅菌剪定はさみを使用して %etoh、消費税さまざまな根、植物ごとの 4 に 6 根と各ルートの長さ約 9-12 cm 約。35 mL のオートクレーブ、リン酸バッファーを含むラベル付きの 50 mL チューブに根 (カット、必要に応じて合わせて) を配置 (6.33 グラム/L の NaH2PO4、8.5 g/L の Na2HPO4無水、pH 6.5、200 μ l/L 界面活性剤)。
注: 界面活性剤 (材料の表を参照) 後に追加されたオートクレーブ滅菌リン酸緩衝。鉢と根長のボリュームは、植物と植物種によって異なります。 - 根の表面から根を解放する 2 分管を振る。70% で滅菌ピンセットで江藤、削除根管、簡単にしみからの紙タオル、および新しい、場所ラベル 50 mL のチューブ。両方の根と根氷の上を含む 1 つを含む管を配置します。
- 70 で滅菌剪定はさみを使用して %etoh、消費税さまざまな根、植物ごとの 4 に 6 根と各ルートの長さ約 9-12 cm 約。35 mL のオートクレーブ、リン酸バッファーを含むラベル付きの 50 mL チューブに根 (カット、必要に応じて合わせて) を配置 (6.33 グラム/L の NaH2PO4、8.5 g/L の Na2HPO4無水、pH 6.5、200 μ l/L 界面活性剤)。
3. フィールドの処理の実験室でサンプルします。
- フィールド コレクション後の根の表面殺菌。
注: フィールドから帰国後できるだけ早く表面殺菌を実行します。表面できない場合同じ日に根を消毒、保存処理されるまで 4 ° C で根。- 約 35 mL 0.01% + 50% の漂白剤のフィールドで収集した 50 mL の根管にトゥイーン 20 を追加します。30 〜 60 秒の 50 mL の管を振る。50% の漂白剤を注ぎ、35 ml 70% のエタノール。別の 30 〜 60 秒の横に振る。
- 70% オフを注ぐ EtOH、35 mL の滅菌、超高純度水を追加。1 分間振る。さらに 2 回水洗浄を繰り返します。
注: 私たちの表面殺菌治療が十分なように、我々 は最後のすすぎの水のサンプルをメッキし、(P. 王、未発表データ、2014) 細菌の増殖は認められなかった。他の研究者は、同様の方法9,10を使用してルート殺菌効率のテストしています。 - きれいなペーパー タオル根乾燥をしみ。サンプルごとに清潔なペーパー タオルを使用します。
注: 使用する前にペーパー タオル、消毒が可能します。私たちは私たちのペーパー タオルを滅菌しないでください。ただし、サンプルあたり 1 のペーパー タオルを使用し、使用されるまでラップ タオルを保ちます。 - 滅菌鉗子、剪定はさみ、約 5 mm の部分と場所に根をカットしてきれいで、ラベル付きの 15 mL の円錐管に根をカットしました。さらに加工されるまで-80 ° C でサンプルを格納します。
- 根圏のサンプルを処理します。
- サンプル全体を再懸濁しますフィールドから根サンプルを含む 50 の mL の管を振る。滅菌、100 μ m メッシュ セル ストレーナーを使用してフィルター (材料の表を参照)、新しい 50 mL のチューブに再懸濁のサンプル。
- 室温で 5 分間 3000 × g でチューブを遠心します。すぐを離れて注ぎ、上澄みを廃棄します。
- 氷の上の 50 の mL の管に根ペレットを配置します。根圏ペレットと中断する渦に滅菌リン酸緩衝 (界面活性剤) なしの 1.5 mL を追加します。
- きれいなラベル、2 mL および microfuge の管に懸濁液をピペットで移しなさい。常温で 2 分間 15,871 x g でチューブをスピンします。すぐに、上澄みを離れて注ぐし、きれいなペーパー タオルの管をドレインします。
- さらに加工されるまでの-20 ° C でペレットを格納します。
注: 手順 3.2.2 - 3.2.4 ストレージのサンプル チューブのサイズを減らすために行われます。50 mL チューブと比較して小さい 2 mL 管を保存する効率的なより多くのスペースです。
- DNA 抽出と土壌分析用の土壌サンプルを処理します。
- 滅菌金属へらを使用して、DNA の抽出のための土の約 3 g できれいで、ラベル付きの 2 mL 管を埋めます。小さな根の部分、破片を避けるため。-20 ° C でこの土壌サンプルを格納します。リンス金属ヘラ 70 %etoh 各サンプル間。
- クリーン洗浄鍋に空の袋小さいふるいの上に大きなふるいに積み上げふるい (材料の表を参照してください)、土壌、手動で両方のふるいを通して土をふるい。慎重にサンプル間ふるいをきれいにするのにブラシを使用します。
- 将来土壌物理化学・ テクスチャ解析の 17.7 x 19.5 cm のジッパー式バッグにふるわれた土壌の 100 に 125 g 置いておきます。短期的なストレージ 4 ° C で土の袋を配置します。
- 土壌水分の土壌サンプルを処理します。
- 風袋規模でラベル付けされた茶色の紙袋。茶色の紙袋にふるわれた土壌の 40 に 45 g を測定します。茶色の紙袋とデータ シート上の土の重量を記録し、55-60 ° c. に乾燥オーブンの場所バッグ セット
- 72 時間後に、乾燥炉から袋を削除します。少なくとも 30 分の冷却し、重量を量る土壌袋を許可します。
- 体重を記録するには、ゼロにスケールを風袋、スケールに茶色の紙袋。式を使用して各サンプルの土壌水分の割合を計算します。
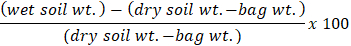
注: 土壌水分法はケロッグ生物駅長期生態調査 (KBS LTER) からです。KBS フィルターは、研究者は彼らのウェブサイト (https://Lter.kbs.msu.edu/) の確立したプロトコルの広い範囲を提供します。
4. 加工ルートの準備は、DNA の抽出のサンプルします。
- サンプルが均一なので、冷凍根材を挽きます。
- きれいな乳鉢と乳棒研削プロセス全体にわたって凍結サンプルを維持する、きれいなへらでプラスチック ビーカーに液体窒素を注ぐ。
- モルタルの凍結するティッシュを置き、微粉末に乳棒で粉をひきます。液体窒素凍結サンプルを維持するために研削中を継続的に追加します。
- ヘラを使用すると、きれいで、ラベル付きの 2 mL チューブに地上組織を配置します。-80 ° C でストア
5. 土壌と根圏 96 ウェル フォーマットのサンプルからの DNA の抽出
- 96 ウェル プレートに土壌サンプルを読み込みます。
- 70 %etoh, 1% の漂白剤の作業領域を拭いてください。これらの手順でラボの手袋を着用します。-20 ° C のストレージから土壌サンプルを削除、氷のバケツで解凍することができます。
- DNA 抽出キットで提供されている 96 ウェル抽出プレートからシール マット カバーを取り外します。使用しない間に清潔に保つため 2 ペーパー ワイパー間シール マット カバーを置きます。汚染を避けるために、接着剤 8 ウェル PCR を使用してストリップ 96 ウェル抽出プレートの 12 列をカバーします。
- 風袋滅菌計量-目標到達プロセス (SM サイズ) 規模で、200 に 250 mg 土壌の重量を量り。
注: これらの滅菌の目標到達プロセスは 1 つの側面に平坦化漏斗は規模できっかりので。漏斗は土壌と井戸に直接配置されます。このテクニックはサンプルの損失を回避、流出を最小限に抑える、交差汚染を防止します。 - 抽出プレートの最初の井戸を明らかにするには、適切な充填重量を量る漏斗の首もし、適切な井戸の中に土のサンプルをゆっくりとガイドの場所を付着力のストリップを慎重に持ち上げます。井戸をカバーする付着力のストリップを交換してください。
- プレートが塗りつぶされるまで各サンプルの新しい、滅菌漏斗の使用、プレートの各ウェルにこのプロセスを繰り返します。1 つは抽出ブランク コントロールとしても空のまま。
注: 1 つも空白のまま負の (空の) コントロールとして機能するすべての抽出プレートに。キット試薬11に存在する汚染物質を制御します。 - 抽出プレートにシール マット カバーを取り付けます、DNA の抽出の準備ができるまで、-20 ° C でプレートを保管します。
- 96 ウェル プレートに根のサンプルを読み込みます。
- -20 ° C のストレージから根サンプルを削除し、氷のバケツで解凍することができます。
- 5.1.2 DNA 抽出プレートを準備するために上記の手順に従ってください。
- 規模で、きれいなペーパー ワイプを配置し、スケールの滅菌金属のヘラを風袋します。慎重にいくつかのサンプル チューブから根ペレットをえぐり、ヘラを使用します。ヘラをスケールに戻り、根サンプルの 200 と 250 mg の間の重量を量る。
- 抽出プレートの最初の井戸を明らかにし、同様に塗りつぶされたヘラを角こすり根材料滅菌つまようじで適切な井戸の中に粘着テープを慎重に持ち上げます。
- 70% によって続かれる水に金属のヘラをリンス サンプル間のエタノール。1 つを抽出ブランク コントロールとしても空のまま、プレートがいっぱいなるまで、プレートの各ウェルにこのプロセスを繰り返します。
- 根と土、96 ウェル フォーマットのサンプルから DNA の抽出。
- 抽出土壌および根圏 DNA を使用してキットに最適土壌 (材料の表を参照)、次の製造元のプロトコル。
注: 我々 は独自の試薬のフミン酸、その他強力な PCR 阻害物質の土壌で発見を削除機能のため土壌および根圏 DNA を分離するのにこの特定のキットを使用します。
- 抽出土壌および根圏 DNA を使用してキットに最適土壌 (材料の表を参照)、次の製造元のプロトコル。
- DNA の定量化。
- 92 サンプルと標準キットを使用しての 4 濃度を数値化 (材料の表を参照してください標準が含まれて)、製造元のプロトコルに従って。
- キットを使用して 4 つの標準のための井戸に合わせて板から削除された残りの 4 サンプルの定量化 (材料の表を参照)、製造元のプロトコルに従って。
6. ルートからの DNA の抽出を、96 ウェル フォーマットでサンプリングします。
- 96 ウェルのプレートにルートのサンプルを読み込みます。
- 70 %etoh, 1% の漂白剤の作業領域を拭いてください。これらの手順の中に手袋を着用します。
- ドライアイスでバケツにサンプルを置くことによってすべての回で凍結地面ルート サンプルを保ちます。
- 液体窒素でプラスチック ビーカーを記入し、冷却するプラスチック ビーカーに帯電防止 microspatulas と滅菌計量-目標到達プロセス (XSM のサイズ) を配置します。
- キットに付属している 96 ウェル抽出ビーズ プレートからシール マット カバーを取り外して使用しない間に清潔に保つため 2 ペーパー ワイパー間に配置。
注: これらの DNA の抽出を行った時間以降にリリースされた、このキットの新しいバージョンは、抽出ビーズ プレートを供給するユーザーを必要があります。テーブルの材料、我々 はこれらの項目を注文するために必要なベンダー カタログ情報をリストアップしました。 - 汚染を避けるために、接着剤 8 ウェル PCR を使用してストリップ 96 ウェル抽出プレートの 12 列をカバーします。
- 冷凍井戸にサンプルを保つためにドライアイスに抽出ビーズ プレートを配置します。
- 抽出プレートの最初の井戸を発見、適切な井戸の中に充填重量を量る漏斗の首を配置し地上根組織の 3 ヘラのスクープを追加を付着力のストリップを慎重に持ち上げます。井戸をカバーする付着力のストリップを交換してください。
注: 土壌および根圏がフリーズ解除の重量を量る前に氷の上植物材料は計り分け冷凍に対し。冷凍植物組織、特に少量は融解せずスケールで重量を量りにくいです。重量を量る地面ルート組織をどのように多くのヘラ スクープされた十分なテストが行われました。キットのメーカー組織の正確な量を必要としないが、お勧めします約 50 mg。 別の植物サンプルの型が異なり、ユーザーが適切な量を決定する必要がありますに注意してください。 - プレートがいっぱいなるまで、プレートの各ウェルにこのプロセスを繰り返します。
- DNA の抽出の準備ができるまで、-20 ° C でプレートを格納します。
- 根組織の DNA の抽出。
- (材料の表を参照してください) の植物に最適化されたキットを使用して DNA を抽出メーカーのプロトコルに続きます。
注: ルート サンプルから最大収率を達成するために植物の組織のために特別に設計されているこのキットを使用してください。土壌、根圏とは異なりフミン酸および他の汚染物質は根組織のための問題のより少しします。
- (材料の表を参照してください) の植物に最適化されたキットを使用して DNA を抽出メーカーのプロトコルに続きます。
- ステップ 5.4 のように DNA を定量化します。
7. 増幅と隔離された DNA のシーケンスします。
- 校正のポリメラーゼで V4 地域 16 s 遺伝子の増幅 (材料の表を参照) Gohlらで説明されているよう異なるインデックス プライマー シーケンスの前にプールと12バーコード サンプル。Gohl ら12 2 段階 PCR を用いた V4 プライマー (補足ファイル 1) で説明した方法を使用してシーケンス。
メモ: メソッドの一部でこれらの手順を説明12,13,14の詳細を他の場所で、したがってここで説明するないです。ルートのサンプル、PNA ブロッカーが完全に記述されている15は、以前されて植物組織から増幅プラスチド DNA の量を減らすに追加されました。2 つのコントロールが含まれて抽出プレート空白のコントロール (5.1.5 の手順の後のメモを参照)、否定的な制御、シーケンスで使用されていた、細菌 DNA の知られている人口のモック コミュニティ正として役立った (材料の表を参照)コントロール。
注: ほとんどの場合、MiSeq 試薬キット v3 は、2 X 300 基本ペア終了モードで使用されます。この原稿のサンプル、イルミナ HiSeq 2500 250 対バックエンド (2 x 250) モードと高速モードで使用しています。すべてのサンプルは、同じレーンに配列されました。 - 微生物群集解析 (USEARCH v9.2.64、QIIME v1.9.1 RStudio v3.4.3 16) パイプラインを介してシーケンス データを処理します。
- USEARCH17を使用してシーケンス データを準備します。
注: USEARCH は、利用可能なオンライン完全な指示 (https://www.drive5.com/usearch/) です。 - インデックスの読み取りやバーコードを使用してイルミナ読み取りをサンプルに割り当てシーケンス データをデマルチプレックスします。
- コンセンサス シーケンスを取得するペアエンド リードをマージします。コマンドを使用します: usearch-fastq_mergepairs * R1*.fastq-@ - fastq_maxdiffs ラベル 10 - fastq_minmergelen 230 - fastq_maxmergelen - 320 fastq_pctid 80 - fastqout merged.fq。
注: パラメーターは、USEARCH の取扱説明書を参照するを介して設定されます。 - PCR の反作用によって引き起こされるかもしれないプライマー シーケンスで置換を避けるためにシーケンス データからプライマーを削除します。コマンドを使用します: usearch-fastx_truncate merge.fq - stripleft 19 stripright - 20 - fastqout stripped.fq。
- 低品質の読み取りを削除し、質の高い運用分類単位 (乙) シーケンスを保持シーケンス データをフィルター処理します。コマンドを使用します: usearch-fastq_filter stripped.fq-fastq_maxee 1.0 - fastaout filtered.fa。
- USEARCH17を使用してシーケンス データを準備します。
- USEARCH で OTUs を生成します。
- 乙シーケンスの一意のセットを識別するために dereplication を実行します。コマンドを使用します: usearch-fastx_uniques filtered.fa fastaout - uniques.fa - sizeout-Uniq のラベルを書き換えます。
- 97-100% ユニークな OTUs を指定する配列の類似性を持つ OTUs をクラスターします。コマンドを使用します: usearch-cluster_otus uniques.fa - minsize 2 - otus otus.fa-乙のラベルを書き換えます。
注: この手順は、クラスター化された OTUs からシングルトンの取り外しとシーケンス データからキメラの除去にも取り込んでいます。 - USEARCH で乙表を作成します。コマンドを使用します: usearch-usearch_global stripped.fq - db otus.fa-プラス - id 0.97 - otutabout otutable.txt 鎖。
注: このコマンドは、読み込み (カウント) すべて OTUs 各サンプルの数を持つテーブルを生成します。乙表は、差分豊富な解析や微生物の多様性解析など後工程に使用されます。補足図 2 に乙表の例を示します。 - QIIME v1.9.1 18真空分析を行います。
注: 真空曲線は乙テーブルを使用してシーケンス処理の深さが正しく微生物群集をサンプルかどうかを決定する計算されます。膨張曲線の例を図 3 の補足。 - アルファ多様性解析18を実施します。QIIME v1.9.1 で alpha_rarefaction.py を使用して、各サンプル内微生物群集の多様性を計算します。
注: この解析は、シャノン19、シンプソン20、Chao121など多様度指数を計算します。 - ベータ多様性解析18,22を実施します。Python スクリプトを使用して: QIIME v1.9.1 ブレイ-カーティス非類似度行列で beta_diversity_through_plots.py。
注: この分析は、サンプル間の群集組成を比較します。 - グループ間の統計的分析を行います。RStudio16でビーガン パッケージ23 v2.4.5 のアドニスと分散分析関数を使用して PERMONOVA の計算距離行列を使用します。ビーガン パッケージで capscale 関数を使用 (CAP) 主座標分析の標準的な分析を行います。RStudio ggplot2 パッケージ24 v2.2.1 を使用してデータを視覚化します。
結果
代表的な結果はこの原稿で提示来る 2012 年にミード近くネブラスカ大学リンカーン校農学部農場設置現場から、トウモロコシ大豆の回転として管理されたサイト、実験する前にね.研究サイトは、土の 3 種類に位置していたが、土質の変更をすべて課せられた治療に起因していたかのようにデータが行った。
現場 2 つ、純粋な含まれている、大きなブルーステム、indiangrass (S. カメムシタケ) および 'ビュート' sideoats grama (を含む低多様性草の混合物と同様、スイッチ グラス (P. virgatum cv 自由) と大きなブルーステム (A. gerardii) の略B. curtipendula)。3 つの暖かい季節の草のプロットは、3 回がレプリケートされたランダム化完全ブロック デザイン。3 つの異なった草のプロットにネストされたいた 56 (N1)、112 (N2) kg N ha、2 つの窒素 (N) 施肥治療尿素の-1 。生育期の終わりにマイクロバイ サンプリング時に、含まれている土 (平均 ± SD) 8.0 ± 1.1 ppm 硝酸塩プロットと受精 112 kg N ハ-1と 6.8 ± 0.7 (平均 + SD) プロットの ppm 硝酸塩と受精 56 kg N ハ-1。プロットは、年に一度受精されていた。プロットは主要なプロット (8000 m2)、N トリートメントとして示された暖かい季節の草は分割プロット (4000 m2).大きなブルーステム '大当たり' と '金鉱' の 50: 50 のブレンドとして種を取られた、Indiangrass 'スカウト' と '戦士' の 50: 50 のブレンドとしてシードだった。プロットは、2012 年に植えられた、最初の N アプリケーションが 2013 年春に発生しました。
土壌と根のサンプリングは、2014 年 9 月 15 日に実施されました。3 複製 (図 1) と分割プロット無作為化デザインとして設定されたフィールドに以下の作業を行った。Endosphere のサンプルは次のとおりすべての平均のシーケンス深さ: 4871 ± 5711 (平均 ± SD) 根: 40726 ± 14684、土: 38184 ± 9043。記載されている、メソッドを使用して、これらの実験の変化の最大の源の一つは、サンプルの種類 (図 2) の間にある微生物の違いです。この代表的なデータセット、根と土壌が (図 2 a) endosphere よりも互いに構成で類似する表示されます。しかし、そこがまた非常に重要な (p = 0.001) 根と土 (図 2 b) の群集組成の違い。サンプルの種類によって分析これらの実験で占めて全変動 26% であった。
アルファ多様性解析の結果、endosphere の微生物は、土壌および根圏 (図 3) と比べてサンプル多様性の低かった。あらゆるコンパートメントにおける草種の多様性の唯一の大きな違いは、大きなブルーステムの endosphere サンプルとスイッチ グラス、スイッチ グラスの有意に高い微生物種の多様性 (図 3) を有するとの間でした。相対的な豊富な分析 (図 4) は、プロテオ バクテリア続いてアクチノ バクテリアのすべてのサンプル タイプの優位性を強調表示します。Endosphere Bacteriodetesの大きな相対的な豊かさを持っていたに対し、土壌および根圏はアシドバクテリウム門とクロロフレクサス門によってまた支配されます。
この実験では、2 N 施肥量と生育、したがって治療の効果があったかどうかを判断するデータ分析を行った。治療効果は全変動の 12% を占めているが、叙階の 2 つの治療に見える異なる (図 5) 有意差は認められなかった。これは、これらのデータセットではなく目視検査や定性的な判断のための統計解析の重要性を強調表示します。
植物細胞および土壌のマイクロバイの植物影響の違いは、制約の調整法を用いた, 可視化されました。種などの特定の変数のサンプル間の大幅に異なる群集組成の結果かどうかをテストするのには PERMANOVA を用いた統計的な差異を調べた.すべてのサンプルの型を一緒に行った、非常に有意差が微生物群集組成 (図 6) の植物種のために発見されました。この実験では、植物種による変化量 6.7% であった。最後に、各サンプルの種類は、サンプルの種類は重要な植物種の効果を駆動する可能性がありますを決定する個別に行った。Endosphere でのみ有意差があった (p = 0.001) (図 7) の異なる植物の群集組成の間。その他のサンプルの種類、種の効果は個別に分析するとき重要なでした。それは根圏 (18%) と土 (15%) に低下したに対し、endosphere の種によるパーセント変動 27% であった。これはさらに、個別に各組織の種類の分析の重要性を強調表示します。
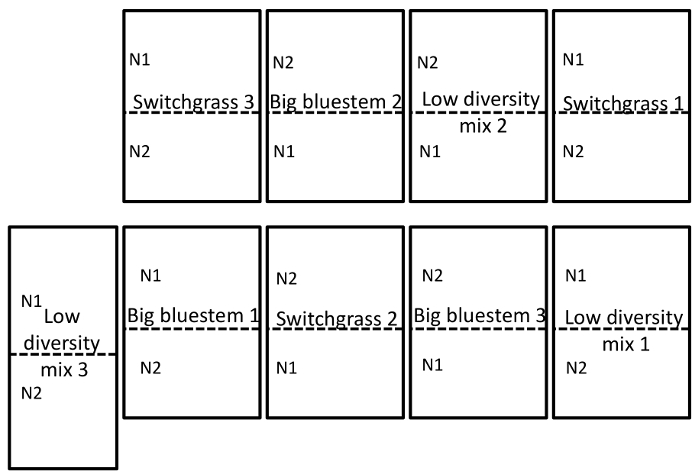
図 1: 実験設計の例です。ネブラスカ大学リンカーン校東ネブラスカ研究、ミード、ねー近くのエクス テンション センターにある現場の 3 通の無作為化の完全なブロック設計を示す実験的フィールド デザイン完全なサイトの説明は、結果を参照してください。N1 は低 (56 kg N ha-1尿素) と N2 (112 kg N ハ-1尿素) 適用されたより高い窒素率です。この図の拡大版を表示するのにはここをクリックしてください。
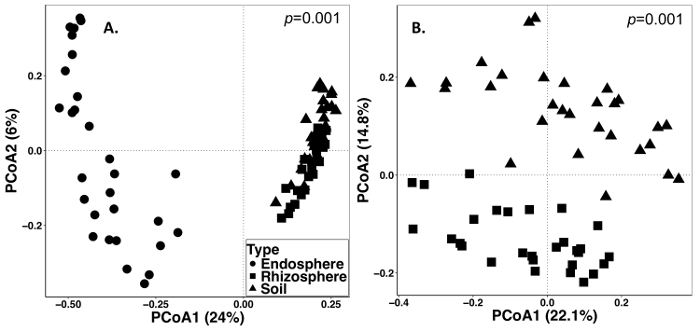
図 2: 2014 年の多年生の草のサンプリングからの土、根、endosphere を含む別のサンプル タイプで微生物の組成を比較するベータ多様性解析します。ブレイ カーティス非類似度行列を生成する QIIME1.9.1 の Python スクリプトを使用して分析を行った。ブレイ カーティス非類似度行列に基づく主座標分析 (PCoA) は RStudio で可視化しました。PCoA1 と PCoA2 は、PCoA の分析によって説明される最初と二番目に大きい分散を示します。PERMANOVA 統計的分析を行った、サンプル型の意義し、 p値は、右上隅に表示されます。数字の各シンボルは、各サンプルの全体の群集を表しています。(A) Endosphere、根と土壌サンプルの型が同時に分析されました。87 のすべてのサンプルは、サンプルあたり 486 シーケンスに希薄だった。(B)根と土のサンプルを同時に分析されました。59 のすべてのサンプルは、8231 シーケンスで希薄だった。この図の拡大版を表示するのにはここをクリックしてください。
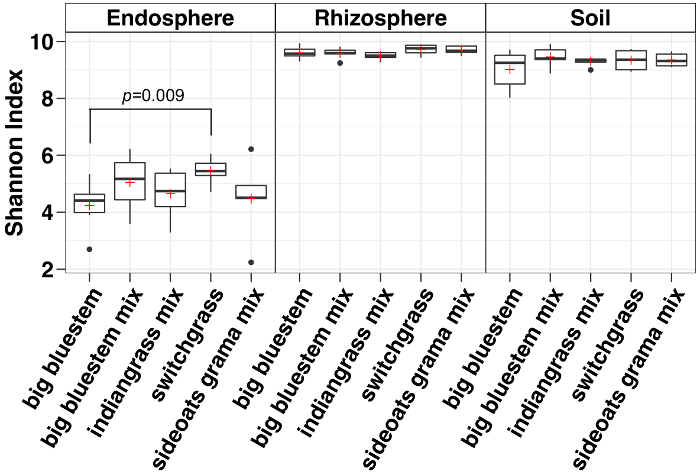
図 3: アルファ多様性解析と endosphere、根圏土壌にそれぞれの種にシャノン インデックスを使用します。分析は、Python スクリプトを使用して、QIIME1.9.1 で行った。真空は、endosphere、根、および土質サンプル サンプルあたり 486、17154 および 8231 シーケンスでそれぞれ行われていた。ボックスは 25 そして第 75 百分位数を示します (最初と第 3 四分位数)。ボックス内の水平の線は中央値と赤を表しますプラス平均を表示します。ひげの 1.5 倍以上四分位範囲に落ちた (黒いドットとして表示されます)、外れ値を除くデータの範囲を示す (n = sideoats grama ミックスどこを除いて各サンプルの 6 n = 5)。全 5 種、endosphere でのシャノン インデックスは根と土壌の両方よりも低かった。非パラメトリック ウィルコクソンの順位和検定を用いて種間の意義し、種の違いは箱の上に示されていた。この図の拡大版を表示するのにはここをクリックしてください。
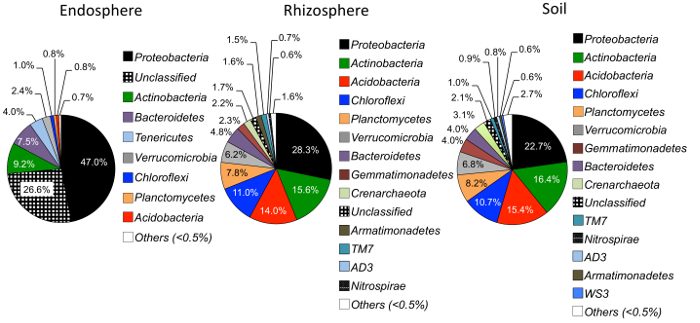
図 4: endosphere、根、および土の門レベルの相対的な豊かさ。種類の異なるサンプル間で微生物の門の豊かさを比較するサンプルを分析した (n = 29 サンプルの種類ごとに)。乙表から QIIME1.9.1 で Python スクリプトを使用して分析を行った。円グラフ内の異なる色を示す門。割合は、サンプルの種類ごとに各門の相対的な豊かさを示します。門情報はリボソームのデータベース プロジェクトの分類 (RDP)25を使用して注釈が付けられました。この図の拡大版を表示するのにはここをクリックしてください。
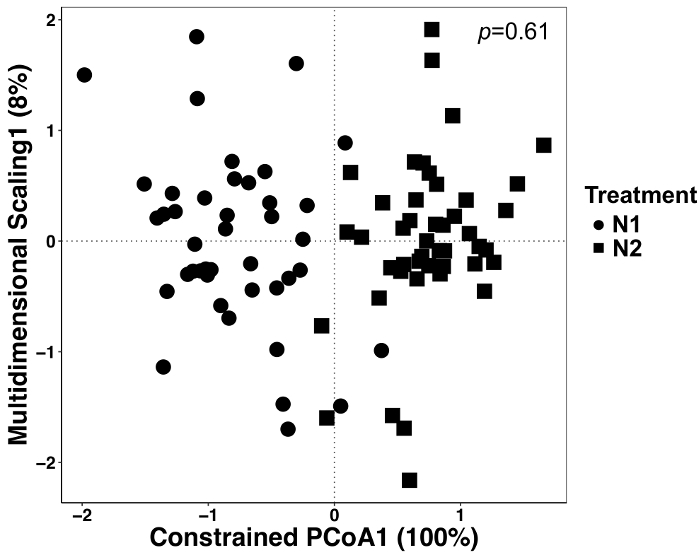
図 5: すべてのサンプル型の制約の要因と治療を用いた解析します。治療の間の群集組成の違いがあったかどうかを決定する (CAP) 主座標分析の標準分析を行った。N 治療法、 nの N1 = 42 (56 kg N ha-1) およびn = N2 の 45 (112 kg N ハ-1)。ブレイ カーティス非類似度行列は、QIIME1.9.1 で python スクリプトを使用して生成されました。ブレイ カーティス非類似度行列に基づくキャップは RStudio に要因として治療の制約によって行われました。治療の違いは有意し、 p値は、右上隅に表示されるかどうかを決定する PERMANOVA の解析を行った。この図の拡大版を表示するのにはここをクリックしてください。
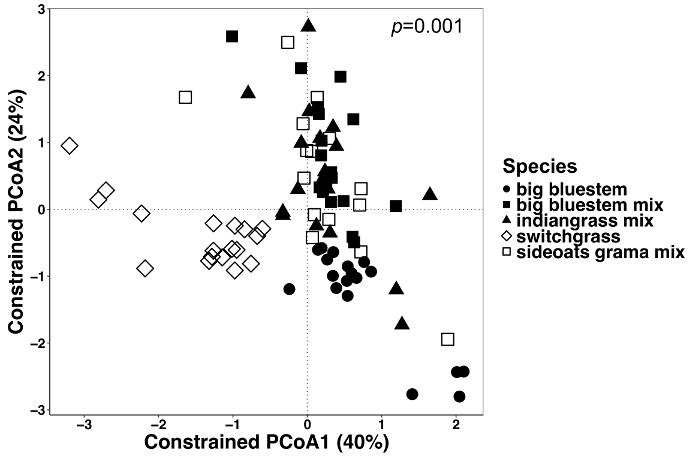
図 6: すべてのサンプル型の制約の要因としての植物種を用いた解析します。すべてのサンプル タイプの種の植物群集組成の違いがあったかどうかを決定する分析を行った。主座標調整とすべてのサンプル型 (endosphere、根、および土壌) のキャップの分析が行われたブレイ カーティス非類似度行列を使用します。ブレイ カーティス非類似度行列は QIIME1.9.1 で Python スクリプトを使用して生成されました。ブレイ カーティス非類似度行列に基づくキャップは RStudio の要因としての植物種の制約によって行われました。PERMANOVA 統計的分析を行った種の植物、意義し、P 値は、右上隅に表示されます。数字の各シンボルは、そのサンプルの全体の群集を表します。n = nを除くすべてのサンプル タイプにそれぞれの種に対して 18 = sideoats grama ミックス 15。この図の拡大版を表示するのにはここをクリックしてください。
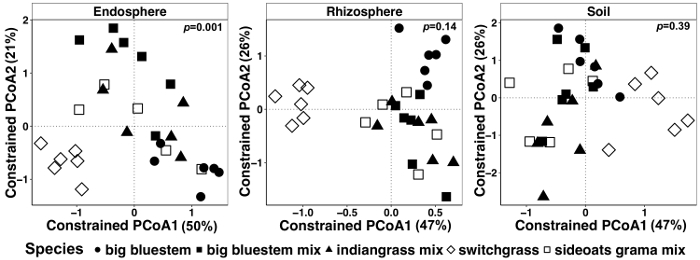
図 7: 制約の要因としてサンプルの種類ごとに個別に種を用いたキャップ解析の例です。主座標調整とキャップ各サンプル タイプ (endosphere、根、および土) 解析ブレイ カーティス非類似度行列を使用して。各サンプルの種類は、486、17154、それぞれ、endosphere、根圏土壌サンプル当たり 8231 読み取りし、希薄だった。種は、叙階を制約する要因として使用されました。PERMANOVA 統計的分析を行った各サンプル タイプにおける植物種の意義し、 p値は、右上隅に表示されます。図の各シンボルは、各サンプルの全体の群集を表します。サンプル サイズがn = 29 各サンプルの種類、 n = 6 sideoats grama ミックスを除く各サンプル タイプでそれぞれの植物種 (n = 5)。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
本稿で説明する方法は、科学者が簡単に土壌や植物のメタゲノミクスのフィールドを入力する有効にしてください。長年にわたってこの原稿に記載されている実験を実施して以来私たちの方法を精製しています。1 つの変更は、今、サンプルのフィールドに出かける前にチューブをあらかじめラベル我々 です。当研究室は、バーコード システムとラベル プリンタを使用します。ラベル プリンターだけでなく管がも、すべて追跡し、正しく人間の手書きの気まぐれなしサンプルを識別するために簡単にラベルを保存します。もう一つの重要なポイントは、我々 は、できるだけ早く戻ってフィールドからそれを持って後材料を処理しようです。DNA 分析に使用される土を凍結、滅菌し根を凍結し、フィルター、フィールドから帰国後 12 〜 36 時間以内の根の凍結を目指します。我々 は DNA の抽出のプロトコルのための時間に手を最小化し、導入することができるヒューマン エラーを低減するロボット (Flex のカワセミ、ThermoFisher) を購入したので、DNA 抽出手順は特に土壌と根圏のための多くの手順と時間のかかる方法別の一貫性の向上、土壌、根や根のバッチ処理されます。植物材料を操作するとき、勉強することや様々 な「代表的なサンプル」を取得するルートの種類ルート種類を決定する重要です。維持するルーツし、DNA の抽出を実施が重要である、サンプル抽出 DNA 96 ウェルの入力時間交差汚染がないことを確認は、冷凍状態のまま。考慮するもう一つの重要な要因は、フィールド実験を設計し、完全なを使用して可能な限りデザインを無作為に使用する複製の数26。高磁場変動に起因は、小さな違いを検出する複製の大きい数を持っている必要があります。最後に、私たちの経験からそれは根を掘るときに土が余りにぬれてないかどうかを確認することが欠かせません。土壌水と飽和している場合だけ、動作するように面倒ではないも根を定義し、根から土を削除する非常に困難です。
これらのメソッドの開発初期段階で作られた 1 つの変更ではなく、フィールドでの作業を容易にするためのガスの発電機によって供給 vortexers にアップグレードした根を解放する手でチューブを揺れ標準化されたの面で時間とマナーを各チューブが乱れた。私アンプリコン配列のアプローチの 1 つの制限は、結果の分類の解像度が多い多くの OTUs は科や属のレベルで不明なまたは唯一の知られていることです。データ分析結果の解像度を高めることができるため特に新しいと開発のアプローチを認識する上で重要な研究のこの分野は急速に進化します。
これらのプロトコル、細菌、古細菌、真菌ではなく勉強だけです。同じ DNA サンプル27,28を使用して真菌のコミュニティの調査のため増幅のため異なるプライマーの使用になります。これらのメソッドには、メソッドを単純化できるため大量の機器の購入は不要です。述べる方法ここでは、主に「誰が」、を決定するフィールドは散弾銃の配列方法分離を使用しての機能のテストに対処する可能性があります、関数に関する重要な質問にすぐに展開して微生物、またはシーケンス全体微生物ゲノム。
代表的な結果は、微生物コミュニティを説明する方法を使用して識別される可能性がありますの違いを強調します。データ解析22ベータ多様性アプローチを使用して、サンプルの型との間の組成の違いを示した。これらの違いは、土壌、根圏、endosphere がユニークな微生物群集3を含む他のほとんどの研究で明らかに観察されています。シャノン多様性指数は、豊かさと endosphere、根、および土に各植物種の存在の微生物種の均一性を決定する計算しました。本研究では、他の多くのように、アルファ多様性は土壌、根圏でやや減少していると、endosphere3,5,29の大幅な減少で最高。ここで説明する方法は、endosphere、根、および土の組成の変化を識別するのに適していることが示唆されました。
プロテオ バクテリアの優位性は、endosphere と土壌の30,31,32の研究の一般的な発見です。Endosphere は、プロテオ バクテリアのより高い相対的な豊富な微生物種の低い多様性を一般的には。これはもう一度ここで結果が文献の他の調査結果のものを強調します。本研究では治療効果が大幅に異なるなかったし、治療によって課せられた差は検出する十分な変化を生成するのに十分な大きさではなかったし、このサンプリングの終わりに行われていた、2 つの主要な理由があります、成長期、ときフィールド可能性があります十分な時間が描き下ろしの窒素と同様のレベルに今シーズン末で測られたものであります。時間の長い期間にわたって同様の受精率を使用して、別の研究だけは比較的、マイクロバイ組成の小変化測定33だった。他の研究は、窒素肥料34,35原因真菌と細菌の両方のコミュニティの変更を示しています。
その内細菌叢解析3,32,36の決定に役割を果たす知られている植物種と内で別の植物遺伝子型間群集変動の小さい相違を示されている、単一種37。本研究では種の植物群集組成に差が見つかりました。すべてのサンプル タイプのグラスは、最も明確な微生物組成を持っていたが、種の違いが、endosphere で統計的に有意なだけ登場。根群集組成可能性より複製された分析に利用できる場合があります。
結合されたフィールド、ラボ、およびここで説明されている分析のプロトコル ルート36の endosphere、根、土壌における微生物群集の組成方法別の要因の影響を研究するための強力な方法を提供します。さまざまな農業分野で特に内細菌叢解析を勉強の領域で行われる作業があります。土壌微生物相によって利回りを変更する方法についての重要な質問まだ完全に解明する必要があります。土壌微生物相、タイミングが、マイクロバイを変更する方法、どのように非生物的ストレスの輪作の影響に関する最も基本的な質問でも、マイクロバイを変更は、土壌の種類、マイクロバイを変更するこれらの要因との対話方法、およびあるかどうか特定の作物や米国の地域で普遍的な微生物は、すべての未解決の問題です。これらのメソッドは存在と病原性および有益な細菌の永続性を特定する疫学研究の役に立ちます。植物と微生物 RNA 代謝物データとここで説明する DNA 方法の統合を開始するこれらのメソッドの別の将来水平線になります。追加の改善とより多くの変数のテストは、これらのプロトコルの最適化を行うため重要になります。
開示事項
著者が明らかに何もありません。
謝辞
この原稿の開発は、ルートおよび Rhizobiome 技術革新賞イア 1557417 国立科学財団 EPSCoR センターによってサポートされます。データ コレクションはあったネブラスカ大学リンカーン校、農業研究および開発からの資金で米国農務省からハッチの助成金でサポートされています。我々 はまた、米国農務省-アルスからのサポートを認めるし、サポートが確立し、これらのフィールドを管理する米国農務省国立食品研究所や農業から農業と食品研究イニシアチブ競争グラント号 2011-68005-30411 によって提供されました。
資料
| Name | Company | Catalog Number | Comments |
| Dneasy PowerSoil HTP 96 Kit | Qiagen/MoBio | 12955-4 | Extraction kit for soil and rhizosphere |
| Dneasy PowerPlant HTP 96 Kit | Qiagen/MoBio | 13496-4 | Extraction kit for roots |
| D-Handle Digging shovel, 101 cm L | Fiskars | 9669 | |
| Rapid Tiller, 40 cm L | Truper | 34316 | |
| Ziploc Bags, 17.7 cm x 19.5 cm | Ziploc | NA | |
| Cooler | Any | NA | |
| Wash pan | Any | NA | |
| Plastic bucket | Any | NA | |
| Gloves (work and lab) | Any | NA | |
| 20 cm diameter Soil sieve #8, 2360 μm mesh size | Dual Manufacturing Co., Chicago IL | US8-8FS | |
| 20 cm diameter Soil Sieve #4, 4750 μm mesh size | Dual Manufacturing Co., Chicago IL | US8-4FS | |
| portable generator | Honda brand works well | NA | |
| Sterile cell strainers 100 μm mesh size | Fisher Scientific | 22-363-549 | |
| NaH2PO4·H2O | VWR | 0823 | |
| Na2HPO4 | VWR | 0404 | |
| Silwet L-77 | Lehman Seeds | VIS-30 | Surfactant |
| Autoclaves | Any | NA | |
| Drying Oven | Any | NA | |
| Scale | Any | Any | |
| Bleach | CLOROX - household strength | NA | |
| Tween 20 | Any | NA | |
| Liquid Nitrogen | Any | NA | |
| Dry Ice pellets | Any | NA | |
| Ethanol | Any | NA | |
| 11 cm precision fine point tweezers | Fisher | 17456209 | |
| 18 cm Straight point specimen forceps | VWR | 82027-436 | |
| 13.5 cm Pruning Scissors | Fiskars | 9921 | |
| 2 mL tube | Any | NA | |
| 15 mL PP conical tube | MIDSCI | C15B | |
| 50 mL PP conical tube | MIDSCI | C50B | |
| Ultrapure water | Millipore-sigma | Milli-Q Integral, Q-POD | |
| Qubit 2.0 fluorometer | Invitrogen | Q32866 | |
| Qubit dsDNA HS Assay Kit | Invitrogen | Q32854 | For DNA quantification of removed samples |
| QuantiFluor dsDNA System | Promega | E2670 | For DNA quantification |
| 96-Well Black with Clear Flat Bottom Plates | Corning | 3631 | |
| pPNA PCR Blocker | PNA Bio | PP01-50 | |
| mPNA PCR Blocker | PNA Bio | MP01-50 | |
| Genomic DNA from Microbial Mock Community B (Even Low Concentration) v5.1L, for 16s rRNA Gene sequencing | BEI Resources | HM782D | |
| Adhesive 8 well-strips for plates | VWR | 89134-434 | |
| Stainless steel beads, 3.2 mm dia | Next Advance | SSB32 | |
| 1 ml Assay block (DNA extraction plate for the Qiagen/MoBio Dneasy PowerPlant HTP Kit) | CoStar | 3959 | |
| antistatic PP weighing funnel, size small for soil/rhizosphere | TWD Tradewinds, INC | ASWF1SPK | |
| antistatic PP weighing funnel, size x-small for root/leaf | TWD Tradewinds, INC | ASWFXSCS | |
| Genie 2 Digital Vortex | Scientific Industries | SI-0236 | |
| Vortex adapter for 50 mL tubes | Scientific Industries | SI-H506 | |
| Mortar (100 mL) and pestle | Any | NA | |
| Metal micro-spatula | VWR | 80071-672 | |
| Disposable antistatic microspatulas | VWR | 231-0106 | |
| Brown Paper bag 2# (10.95 cm x 6.19 cm x 20 cm) | Duro | 18402 | |
| 5424 Centrifuge for 2 mL tube | Eppendorf | 22620461 | |
| Centrifuge for 96-well plate | Sigma4-16S | 81510 | |
| Centrifuge rotor for 50 mL tubes | Sigma4-16S | 12269 - Biosafe | |
| KAPA HiFi DNA polymerase | Kapa Biosystems |
参考文献
- Philippot, L., Raaijmakers, J. M., Lemanceau, P., vander Putten, W. H. Going back to the roots: the microbial ecology of the rhizosphere. Nature Reviews Microbiology. 11, 789-799 (2013).
- Fierer, N. Embracing the unknown: disentangling the complexities of the soil microbiome. Nature Review Microbiology. 15 (10), 579-590 (2017).
- Wang, P., et al. Shifts in microbial communities in soil, rhizosphere and roots of two major crop systems under elevated CO2 and O3. Scientific Reports. 7 (1), 15019(2017).
- White, L. J., Jothibasu, K., Reese, R. N., Brözel, V. S., Subramanian, S. Spatio Temporal influence of isoflavonoids on bacterial diversity in the soybean Rhizosphere. Molecular Plant-Microbe Interactions. 28 (1), 22-29 (2015).
- Edwards, J., et al. Structure, variation, and assembly of the root-associated microbiomes of rice. Proceedings of the National Academy of Science of the United States of America. 112 (8), E911-E920 (2015).
- Lundberg, D. S., et al. Defining the core Arabidopsis thaliana root microbiome. Nature. 488, 86-90 (2012).
- Bougoure, D. S., Cairney, J. W. Assemblages of ericoid mycorrhizal and other root-associated fungi from Epacris pulchella (Ericaceae) as determined by culturing and direct DNA extraction from roots. Environmental Microbiology. 7 (6), 819-827 (2005).
- Doty, S. L., et al. Diazotrophic endophytes of native black cottonwood and willow. Symbiosis. 47 (1), 23-33 (2009).
- Gottel, N. R., et al. Distinct microbial communities within the endosphere and rhizosphere of populus deltoides roots across contrasting soil types. Applied and Environmental Microbiology. 77 (17), 5934-5944 (2011).
- Xin, G., Glawe, D., Doty, S. L. Characterization of three endophytic, indole-3-acetic acid-producing yeasts occurring in Populus trees. Mycological Research. 113, 973-980 (2009).
- Salter, S. J., et al. Reagent and laboratory contamination can critically impact sequence-based microbiome analyses. BMC Biolology. 12, 87(2014).
- Gohl, D. M., et al. Systematic improvement of amplicon marker gene methods for increased accuracy in microbiome studies. Nature Biotechnology. 34 (9), 942-949 (2016).
- Kozich, J. J., Westcott, S. L., Baxter, N. T., Highlander, S. K., Schloss, P. D. Development of a dual-index sequencing strategy and curation pipeline for analyzing amplicon sequence data on the MiSeq Illumina sequencing platform. Applied Environmental Microbiology. 79 (17), 5112-5120 (2013).
- Caporaso, J. G., et al. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms. ISME Journal. 6 (8), 1621-1624 (2012).
- Lundberg, D. S., Yourstone, S., Mieczkowski, P., Jones, C. D., Dangl, J. L. Practical innovations for high-throughput amplicon sequencing. Nature Methods. 10 (10), 999-1002 (2013).
- RStudio, T. RStudio: Integrated Development for R. RStudio, Inc. , Available from: http://www.rstudio.com/ (2015).
- Edgar, R. C. UPARSE: highly accurate OTU sequences from microbial amplicon reads. Nature Methods. 10 (10), 996-998 (2013).
- Caporaso, J. G., et al. QIIME allows analysis of high-throughput community sequencing data. Nature Methods. 7 (5), 335-336 (2010).
- Shannon, C. A mathematical theory of communication. Bell System Technical Journal. 27, 379-423 (1948).
- Simpson, E. H. Measurement of diversity. Nature. 163, 688(1949).
- Chao, A. Non-parametric estimation of the number of classes in a population. Scandanavian Journal of Statistics. 11, 265-270 (1984).
- Legendre, P. Studying beta diversity: Ecological variation partitioning by multiple regression and canonical analysis. Journal of Plant Ecology. 1 (1), 3-8 (2008).
- Oksanen, J., et al. The vegan package. Community Ecology Package. 10, 631-637 (2007).
- Wickham, H. ggplot2: Elegant graphics for data analysis. Ggplot2: Elegant Graphics for Data Analysis. , Springer Nature. Switzerland. 1-212 (2009).
- Cole, J. R., et al. The Ribosomal Database Project (RDP-II): sequences and tools for high-throughput rRNA analysis. Nucleic Acids Research. 33, D294-D296 (2006).
- Wagner, M. R., et al. Host genotype and age shape the leaf and root microbiomes of a wild perennial plant. Nature Communications. 7, 12151(2016).
- O'Brien, H. E., Parrent, J. L., Jackson, J. A., Moncalvo, J. M., Vilgalys, R. Fungal community analysis by large-scale sequencing of environmental samples. Applied and Environmental Microbiology. 71 (9), 5544-5550 (2005).
- Taylor, D. L., et al. A first comprehensive census of fungi in soil reveals both hyperdiversity and fine-scale niche partitioning. Ecological Monographs. 84 (1), 3-20 (2014).
- Lebeis, S. L., et al. Salicylic acid modulates colonization of the root microbiome by specific bacterial taxa. Science. 349 (6250), 860-864 (2015).
- Ofek-Lalzar, M., et al. Niche and host-associated functional signatures of the root surface microbiome. Nature Commununications. 5, 4950(2014).
- Niu, B., Paulson, J. N., Zheng, X., Kolter, R. Simplified and representative bacterial community of maize roots. Proceedings of the National Academy of Science of the United States of America. 114 (12), E2450-E2459 (2017).
- Fitzpatrick, C. R., et al. Assembly and ecological function of the root microbiome across angiosperm plant species. Proceedings of the National Academy of Science of the United States of America. 115 (6), E1157-E1165 (2018).
- Ramirez, K. S., Lauber, C. L., Knight, R., Bradford, M. A., Fierer, N. Consistent effects of nitrogen fertilization on soil bacterial communities in contrasting systems. Ecology. 91 (12), 3463-3470 (2010).
- Paungfoo-Lonhienne, C., et al. Turning the table: Plants consume microbes as a source of nutrients. PLoS One. 5 (7), e11915(2010).
- Yeoh, Y. K., et al. The core root microbiome of sugarcanes cultivated under varying nitrogen fertilizer application. Environmental Microbiology. 18 (5), 1338-1351 (2016).
- Bulgarelli, D., Schlaeppi, K., Spaepen, S., Ver Loren van Themaat, E., Schulze-Lefert, P. Structure and functions of the bacterial microbiota of plants. Annual Review of Plant Biology. 64, 807-838 (2013).
- Peiffer, J. A., et al. Diversity and heritability of the maize rhizosphere microbiome under field conditions. Proceedings of the National Academy of Science of the United States of America. 110 (16), 6548-6553 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved