このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ナトリウム酢酸添加剤と水溶性鉛フロー電池の寿命を拡張します。
要約
どのナトリウム酢酸メタンスルホン電解質、添加剤としての供給は、拡張寿命と溶解性鉛フロー電池の建設のためのプロトコルが表示されます。
要約
このレポートでは、拡張サイクル寿命と溶解性鉛フロー電池 (SLFB) の建設のための方法を紹介します。電解液に酢酸ナトリウム (NaOAc) の十分な量を供給、長期定電流充電/放電実験を介してSLFBs の 50% 以上のサイクル寿命を発揮します。肯定的な電極で PbO2めっきの高品質がインデックス (TI) 測定を投げることによって NaOAc 追加電解質の定量的検証されます。走査電子顕微鏡 (SEM) による画像 NaOAc 追加電解質と、SLFB を操作したときにもより統合された PbO2表面形態を示します。この作品は、電解質の変更が経済的に大規模なエネルギー貯蔵の SLFBs を有効にする説得力のあるルートをできることを示します。
概要
太陽光などを含む再生可能エネルギー源と風が何十年も開発されているが、その断続的な性質の課題が素晴らしい。組み込まれる再生可能エネルギーで将来の電力グリッド、グリッドの安定化と負荷平準化に欠かせないし、エネルギー ストレージを統合することによって達成することができます。レドックス フロー電池 (RFBs)、スケール グリッドのエネルギー貯蔵のための有望な選択肢の一つです。伝統的な RFBs を含むイオン選択性膜の陽極と陰極; 分離たとえば、すべてバナジウム RFB を高効率で動作するように示している、長いサイクル寿命1,2。ただし、エネルギー ストレージとして市場シェアは非常に高価な構成材料と効果的でないイオン選択性膜のために一部に限られました。シングル フロー溶解性鉛フロー電池 (SLFB) が Plectcherらによって提示される一方で、1,2,3,4,5.、SLFB は、それは 1 つだけアクティブな種、ビラミッド イオン膜レス。ビラミッド イオンがめっきの肯定的な電極 PbO2負の電極として Pb として同時に充電中に、放電中にビラミッド戻って変換します。SLFB はこのように、一つの循環ポンプと 1 つの電解液貯蔵タンクのみ、順番減少資本と従来の RFBs に比較して運用コストにつながる可能性を必要があります。ただし、SLFBs の公開サイクル寿命は通常のフロー条件6,7,8,9,10の下でより小さい 200 サイクルまでところです。
短い SLFB サイクル寿命につながる要因は予め PbO2肯定的な電極の成膜/解散に関連付けられます。充電/放電過程に深い、または反復サイクル11、増加した電解酸性と陽子は非化学量論組成 PbOx12,の不活性化層の生成を誘導するために提案されます。13. SLFB 劣化に関わる別の現象は、PbO2を流します。2粒子は可逆的であり、もはや利用できる PbO を流した。SLFBs のクーロン効率 (CE) は、不均衡な電気化学的反応として両電極で蓄積された電析のため結果的に低下します。SLFBs、pH の安定化のサイクル寿命を延ばすため、変動およびめっき構造が重要です。最近の論文では、強化されたパフォーマンスとメタンスルホン電解質11(NaOAc) 酢酸ナトリウムを添加した SLFBs の拡張サイクル寿命を示します。
ここでは、SLFBs のメタンスルホン電解液への添加剤として NaOAc を採用するため詳細なプロトコルが記述されています。SLFB の性能を強化する示すし、NaOAc 無添加 SLFBs と比較して 50% 以上によって寿命を拡張できます。さらに、電析における添加効果の定量的な比較を目的としてインデックス (TI) 測定を投げるための手順を示します。最後に、SLFB 電極めっきの走査型電子顕微鏡 (SEM) 試料作製法が記述され、めっきの添加剤の影響、取得した画像で明らかに。
プロトコル
1. ナトリウム酢酸添加剤と SLFB ビーカー細胞の構造
注: 長期サイクリング実験用添加剤と SLFB ビーカー セルを構築する手順を説明します。プロトコルには、電解質の準備そして添加剤、電極前処理、セル ・ アセンブリ、および効率の計算なしが含まれています。
-
メタンスルホン酸鉛 (1 L、例として 1 M) の準備
- ヒューム フードの攪拌棒で攪拌ビーカーにメタンスルホン酸 (MSA、70%) の 274.6 g を追加します。300 ml の純水 (DI) の MSA を溶解します。
- 酸化鉛 (II) (98%) の 223.2 g を準備し、準備された鉛酸化物を完全に溶解するまで前述のビーカーに単位で追加。
- 任意不溶鉛酸化物を分離する 70 mm セルロースろ紙を Büchner 漏斗をフィルター処理します。
- 3 回には、この手順を繰り返します。総量が 1 L に到達する DI 水を追加します。
-
添加剤 (300 mL) なく電解質の作製
- MSA (70%) の 20.595 g をビーカーに追加します。同じビーカーに準備された 1 M リード メタンスルホン酸の 150 mL を追加します。
- 合計 300 mL に到達し、0.5 M MSA と 0.5 M リード メタンスルホン酸のソリューションの結果を混合した固体まで均一に混合、攪拌・ ディ ・水を加えます。
-
準備ナトリウムのアセテート (300 mL) と電解質の
- MSA (70%) の 20.595 g をビーカーに追加します。同じビーカーに準備された 1 M リード メタンスルホン酸の 150 mL を追加します。
- ビーカーに添加剤として 1.23 グラム NaOAc (98%) を追加します。
- 総量が 300 mL に達するまで均一に混合、0.5 M リード メタンスルホン酸、0.5 M メタンスルホン酸と酢酸ナトリウム 50 ミリメートルのソリューションの結果が電解液を攪拌し DI 水を追加します。
-
正極・負極の前処理
- 繰り返し陽性 (商業炭素複合材) を磨くし、負の (ニッケル) 目に見える不純物がないまでサンドペーパー (酸化アルミニウム、P100) と電極が残っているし、DI 水で電極をすすぎ。
- 200 mL ・ ディ ・水に塩化水素 (35%) の 20.83 g を追加、塩化水素のすべてが解散したときまでソリューションをかき混ぜます。
- 準備 1 M 塩化水素ソリューションで一晩電極の表面に不純物を除去する全体の肯定的な電極を浸します。
- DI 水で徹底的に肯定的な電極をすすいで、繊細なタスク ワイパーで電極を乾燥します。電極の反対側をあらわにしながらポリテトラフルオロ エチレン (PTFE) テープを使用した各電極の片側をテープします。
- 3.03 g カリウム硝酸塩 (99%) の別のソリューションを準備と 300 mL ・ ディ ・水を 0.1 M 硝酸カリウムの溶液になります。
- 各電極に直面して露出面に 0.1 M 硝酸カリウムでプラスとマイナスの電極を浸します。
- 5 分間の肯定的な電極に 1.80 V対銀/塩化銀の潜在性を適用します。その後、-1.0 V の電位を適用対銀/塩化銀を 2 分間肯定的な電極に。
-
組み立てる、SLFB ビーカー セル
- 前処理のプラスとマイナスの電極を固定電極の距離を自家製電極の位置決めボードに取り付けます。一緒に電極位置決めボード図 1に模式的に示すようビーカー内に置きます、浸漬の指定したレベルまで電解液をビーカーに追加します。
- ビーカーに磁性攪拌器を置いて、ホット プレート上のビーカーの位置、攪拌の回転速度を制御します。電極にバッテリー テスターを接続し、蒸発を防ぐためにプラスチック製のラップとビーカーのセルをカバーします。
-
バッテリー効率を計算します。
- 定電流充電と放電後、次としてバッテリーの効率を計算します。
クーロン効率: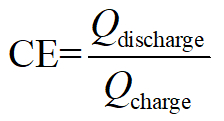
電圧効率: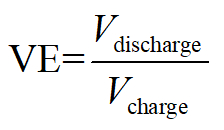
エネルギー効率:
ここでは、 Qは同等の電子の充電/放電、 V適用/出力電圧と電子のクーロン格納されて消費される総エネルギーを表します。
- 定電流充電と放電後、次としてバッテリーの効率を計算します。
2. インデックス測定を投げる
注: SLFB 細胞における肯定的な電極めっきの投げインデックス (TI) を測定する手順を説明します。プラスとマイナスの電極の役割を反転の TI 結果他のセットを提供します。ここでは、図 2に模式的に描かれている自家製ヘリング ブルーム セルを用いた TI を調べた。
-
測定
- 重さし、実験前にそれぞれ 2 つの肯定的な電極を記録します。
- ヘリング ブルーム セルと 1 否定的な電極からの距離の比率で 1 つの肯定的な電極の中心にマイナスの電極を配置します。否定的な電極 (図 2の例として取る 6) から別の距離比で 2 番目の正極を配置します。
- 2 つの肯定的な電極および表面積を持つ同じ浸漬 (2 cm2ここで) 興味の電解質とヘリング ブルームのセルに 1 つの否定的な電極を浸します。
- 電極で制御された電流密度 (20 mA·cm-2ここ) を適用するには、バッテリー テスターを使用します。一定の時間 (30 分ここ) の定電流充電を行います。
- めっき後, DI 水で 2 つの肯定的な電極をすすいで室温で一晩乾かします。
- 重量を量る、それぞれ 2 つの肯定的な電極を記録し、以下の式に従って金属分布比 (MDR) を計算します。
- 様々 な直線距離比 (LR) (ここで 1 に 6 変化) TI 図を取得する 2 番目の肯定的な電極を配置することによって、前述の実験を繰り返します。
-
計算
- 例として、関心の電極としてアノードを考慮し、測定 MDRとLR で TI 図の各データを決定する次のように計算されます。
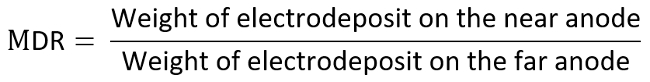
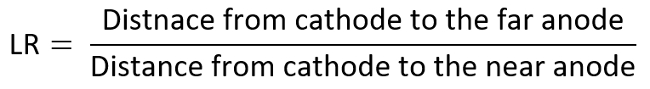
- 例として、関心の電極としてアノードを考慮し、測定 MDRとLR で TI 図の各データを決定する次のように計算されます。
3. SEM 試料
- DI 水で黒鉛電極をすすいで、めっき後室温で乾燥します。
- ダイヤモンドによって必要なサンプル サイズにスライス黒鉛電極を注意して見た。風邪は電極サンプルをマウントし、機械的にそれを磨く 14、8、3 μ m シリコン カーバイド砂論文とその後。
- 1 μ m ダイヤモンド懸濁液および 0.05 μ m Al2O3サンプルをさらに磨きます。プラチナで寒さに取り付けられたサンプルを入金、SEM 観察のための伝導性を確保するために銅テープで取り付けます。
結果
SLFBs のサイクル寿命を延ばす、NaOAc は電解液添加剤として提供されます。並行して、検査されるサイクリング NaOAc 添加の有無にかかわらず SLFBs のパフォーマンスと結果を図 3に示します。サイクル寿命の簡単に定量的な比較、その CE が連続定電流充電/放電下で 80% より低い場合として SLFB の「死」を定義します。図 3aと
ディスカッション
本稿では SLFBs のサイクル寿命を延ばすための経済的な方法: 電解液添加剤 NaOAc エージェントを用いた。新鮮な黒鉛電極、ニッケル プレートのバッチは長期循環試験の前にステップ 1 で、前述で前処理されました。商業炭素電極間の矛盾は、SLFBs のパフォーマンスの偏差を引き起こす可能性があります、ために、手順 1.4 の物理的/化学的前処理表面残基を削除することが欠かせません。手順 1...
開示事項
何を開示する必要があります。
謝辞
この作品は科学技術、NSC 102 の資金調達の番号の下の台湾省によって支えられた-2221-E-002 - 146-、ほとんど 103-2221-E-002 - 233 - とほとんどの 104-2628-E-002-016-MY3。
資料
| Name | Company | Catalog Number | Comments |
| 70 mm cellulose filter paper | Advance | ||
| Autolab | Metrohm | PGSTA302N | |
| BT-Lab | BioLogic | BCS-810 | |
| commercial carbon composite electrode | Homy Tech,Taiwan | Density 1.75 g cm-3, and electrical conductivity 330 S cm-1 | |
| Diamond saw | Buehler | ||
| Hydrochloric Acid | SHOWA | 0812-0150-000-69SW | 35% |
| Lead (II) Oxide | SHOWA | 1209-0250-000-23SW | 98% |
| Lutropur MSA | BASF | 50707525 | 70% |
| nickel plate | Lien Hung Alloy Trading Co., LTD., Taiwan, | 99% | |
| Potassium Nitrate | Scharlab | 28703-95 | 99% |
| Scanning electron microscopy | JEOL | JSM-7800F | at accelerating voltage of 15 kV |
| Sodium Acetate | SHOWA | 1922-5250-000-23SW | 98% |
| water purification system | Barnstead MicroPure | 18.2 MΩ • cm |
参考文献
- Soloveichik, G. L. Flow batteries: current status & trends. Chemical Reviews. 115 (20), 11533-11558 (2015).
- Ravikumar, M. K., Rathod, S., Jaiswal, N., Patil, S., Shukla, A. The renaissance in redox flow batteries. Journal of Solid State Electrochemistry. 21 (9), 2467-2488 (2017).
- Hazza, A., Pletcher, D., Wills, R. A novel flow battery: A lead acid battery based on an electrolyte with soluble lead (II) Part I. Preliminary studies. Physical Chemistry Chemical Physics. 6 (8), 1773-1778 (2004).
- Pletcher, D., Wills, R. A novel flow battery: A lead acid battery based on an electrolyte with soluble lead (II) Part II. Flow cell studies. Physical Chemistry Chemical Physics. 6 (8), 1779-1785 (2004).
- Pletcher, D., Wills, R. A novel flow battery-a lead acid battery based on an electrolyte with soluble lead (II). III. The influence of conditions on battery performance. Journal of Power Sources. 149, 96-102 (2005).
- Hazza, A., Pletcher, D., Wills, R. A novel flow battery-a lead acid battery based on an electrolyte with soluble lead (II). IV. The influence of additives. Journal of Power Sources. 149, 103-111 (2005).
- Pletcher, D., Zhou, H., Kear, G., Low, C. T. J., Walsh, F. C., Wills, R. G. A. A novel flow battery-A lead-acid battery based on an electrolyte with soluble lead (II). V. Studies of the lead negative electrode. Journal of Power Sources. 180 (1), 621-629 (2008).
- Pletcher, D., Zhou, H., Kear, G., Low, C. T. J., Walsh, F. C., Wills, R. G. A. A novel flow battery-A lead-acid battery based on an electrolyte with soluble lead (II). Part VI. Studies of the lead dioxide positive electrode. Journal of Power Sources. 180 (1), 630-634 (2008).
- Li, X., Pletcher, D., Walsh, F. C. A novel flow battery: a lead acid battery based on an electrolyte with soluble lead (II). Part VII. Further studies of the lead dioxide positive electrode. Electrochimica Acta. 54 (20), 4688-4695 (2009).
- Krishna, M., Fraser, E. J., Wills, R. G. A., Walsh, F. C. Developments in soluble lead flow batteries and remaining challenges: An illustrated review. Journal of Energy Storage. 15, 69-90 (2018).
- Lin, Y. -. T., Tan, H. -. L., Lee, C. -. Y., Chen, H. -. Y. Stabilizing the electrodeposit-electrolyte interphase in soluble lead flow batteries with ethanoate additive. Electrochimica Acta. 263, 60-67 (2018).
- Oury, A., Kirchev, A., Bultel, Y., Chainet, E. PbO2/Pb2+ cycling in methanesulfonic acid and mechanisms associated for soluble lead-acid flow battery applications. Electrochimica Acta. 71, 140-149 (2012).
- Oury, A., Kirchev, A., Bultel, Y. Potential response of lead dioxide/Lead (II) galvanostatic cycling in methanesulfonic acid: a morphologico-kinetics interpretation. Journal of The Electrochemical Society. 160 (1), A148-A154 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved