Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Prolonger la durée de vie des piles d’écoulement plomb Soluble avec un additif de l’acétate de Sodium
Dans cet article
Résumé
Un protocole pour la construction d’une batterie plomb soluble de débit avec une durée de vie prolongée, en laquelle sodium acétate est fourni dans l’électrolyte méthanesulfonique comme additif, est présenté.
Résumé
Dans ce rapport, nous présentons une méthode pour la construction d’une batterie au plomb soluble flux (SLFB) avec une cycle de longue vie. En fournissant une quantité suffisante d’acétate de sodium (NaOAc) à l’électrolyte, une prolongation de la vie cycle de plus de 50 % est démontrée pour SLFBs par expériences de charge/décharge des galvanostatique à long terme. Une meilleure qualité de la PbO2 electrodeposition à l’électrode positive est quantitativement validée pour électrolyte Acona ajoutée en levant les mesures de l’indice (TI). Images acquises par microscopie électronique (MEB) présentent également plus intégrée PbO2 morphologie de surface lorsque le SLFB fonctionne avec l’électrolyte Acona ajoutée. Ce travail indique que la modification d’électrolyte peut être une voie plausible pour permettre économiquement SLFBs pour le stockage de l’énergie à grande échelle.
Introduction
Vent et des énergies renouvelables notamment l’énergie solaire ont été développés depuis des décennies, mais leur nature intermittente pose de grands défis. Une grille de future puissance avec des sources d’énergie renouvelables intégrées, stabilisation de la grille et le nivellement de charge sont critiques et peuvent être réalisés en intégrant le stockage de l’énergie. Batteries de flux redox (ORP) sont l’une des options prometteuses pour le stockage de l’énergie à l’échelle de la grille. ORP traditionnels contiennent des membranes sélectives qui sépare anolyte et catholyte ; par exemple, la RFB all-vanadium a montré pour fonctionner avec une grande efficacité et un long cycle de vie1,2. Toutefois, leur part de marché comme stockage d’énergie est très limitée en partie à cause de matériaux comprenant coûteux et inefficaces membranes sélectives. En revanche, une batterie de débit de flux unique plomb soluble (SLFB) est présentée par Plectcher et al. 1 , 2 , 3 , 4 , 5. le SLFB est sans membrane car elle n’a qu’une seule espèce active, les ions pb (ii). Les ions pb sont galvanisées à l’électrode positive comme PbO2 et l’électrode négative comme Pb simultanément pendant le chargement et reconvertir en PB (ii) au cours de l’exercice. Un SLFB doit donc un circulateur et un électrolyte réservoir seulement, qui peut conduire à son tour au capital réduit et les coûts opérationnels par rapport aux ORP classiques. La vie de cycle publiée de SLFBs, cependant, est jusqu’ici limitée à moins de 200 cycles de flux normal des conditions6,7,8,9,10.
Facteurs menant à une vie de cycle courte SLFB sont préalablement associées aux dépôts/dissolution de PbO2 à l’électrode positive. Au cours du processus de charge/décharge, l’acidité de l’électrolyte se trouve à augmenter au cours de cycles profonds ou répétée11et protons sont suggérés pour induire la production d’une couche de passivation de non-stoechiométriques PbOx12, 13. l’effusion de PbO2 est un autre phénomène lié à la dégradation SLFB. Hangar de PbO2 particules sont irréversibles et peuvent ne plus être utilisés. L’efficacité coulombienne (EC) du SLFBs décline en conséquence en raison de réactions électrochimiques déséquilibrées comme electrodeposits accumulés sur les deux électrodes. Pour prolonger la vie de cycle de SLFBs, stabiliser le pH, fluctuation et electrodeposition structure sont essentiels. Une étude récente montre une amélioration des performances et le cycle prolongé la vie de SLFBs avec addition d’acétate de sodium (NaOAc) méthanesulfonique électrolyte11.
Ici, un protocole détaillé pour employer NaOAc comme additif à l’électrolyte méthanesulfonique dans SLFBs est décrite. La performance de SLFB s’est avérée être améliorée et la durée de vie peut être prolongée de plus de 50 % par rapport à SLFBs sans additifs NaOAc. En outre, des procédures pour lancer la mesure de l’indice (TI) sont illustrées aux fins d’une comparaison quantitative des effets additifs sur électrodéposition. Enfin, on décrit une méthode de préparation échantillon de microscopie électronique (MEB) balayage pour electrodeposition sur des électrodes de SLFB et l’effet additif sur electrodeposition se manifeste dans les images acquises.
Protocole
1. construction d’une cellule de bécher SLFB avec un additif de l’acétate de Sodium
Remarque : Cette section décrit la procédure pour construire une cellule SLFB de bécher avec un additif pour expérience cycliste à long terme. Le protocole inclut la préparation de l’électrolyte avec et sans additif, prétraitement de l’électrode, ensemble de cellule et des calculs de rendement.
-
Préparation de plomb méthanesulfonate (1 L, 1 M, à titre d’exemple)
- Sous la hotte, ajouter 274,6 g d’acide méthanesulfonique (MSA, 70 %) dans un Becher, en remuant avec une barre de remuer. Dissoudre la MSA avec 300 mL d’eau désionisée de (DI).
- Préparer 223,2 g d’oxyde de plomb (II) (98 %) et ajouter en incréments dans le bécher susmentionné jusqu'à dissolution complète de l’oxyde de plomb préparé.
- Filtrer à travers l’entonnoir Büchner avec 70 mm filtre papier pour séparer tout oxyde de plomb non dissous.
- Répétez cette procédure pour 3 fois. Ajouter de l’eau distillée pour atteindre 1 L de volume total.
-
Préparation de l’électrolyte sans additif (300 mL)
- Ajouter 20,595 g de MSA (70 %) dans un bécher. Ajouter 150 mL de méthanesulfonate de plomb préparé 1 M dans le bécher de même.
- Ajouter de l’eau distillée pour atteindre 300 mL volume total et remuer l’électrolyte jusqu'à ce que le mélange uniformément, ce qui entraîne une solution de 0,5 M méthanesulfonate de plomb mélangé à 0,5 M MSA.
-
Préparation d’électrolyte avec l’acétate de sodium (300 mL)
- Ajouter 20,595 g de MSA (70 %) dans un bécher. Ajouter 150 mL de méthanesulfonate de plomb préparé 1 M dans le bécher de même.
- Ajouter 1,23 g de NaOAc (98 %) dans le bécher comme agent additif.
- Ajouter de l’eau distillée pour atteindre 300 mL volume total et remuer l’électrolyte jusqu'à ce qu’uniformément mélangé, qui se traduit par une solution de 0,5 M plomb methanesulfonate acide méthanesulfonique 0,5 M et acétate de sodium de 50 mM.
-
Prétraitement des électrodes positives et négatives
- Polir le positif (composite carbone commercial) et négatif (nickel) à plusieurs reprises les électrodes avec un papier de verre (oxyde d’aluminium, P100) jusqu'à pas d’impuretés visibles sont à gauche et puis rincer les électrodes avec de l’eau distillée.
- Ajouter 20,83 g de chlorure d’hydrogène (35 %) dans de l’eau 200 mL DI et remuer la solution jusqu'à ce que tout le chlorure d’hydrogène se dissout.
- Plonger l’électrode positive entière dans la 1 M du chlorure d’hydrogène solution préparée pendant la nuit pour enlever les impuretés à la surface de l’électrode.
- Rincez l’électrode positive avec de l’eau distillée et sécher l’électrode à balai tâche délicate. Ruban adhésif d’un côté de chacune des électrodes à l’aide de ruban de polytétrafluoroéthylène (PTFE) lors de l’exposition de l’autre côté des électrodes.
- Préparer une autre solution avec 3,03 g de nitrate de potassium (99 %) et d’eau de 300 mL DI, qui se traduit par une solution de nitrate de potassium 0,1 M.
- Plonger les électrodes positives et négatives en nitrate de potassium 0,1 M avec la surface exposée face à chaque électrode.
- Appliquer un potentiel de 1.80 V vs Ag/AgCl à l’électrode positive pendant 5 min. Par la suite, appliquez un potentiel de -1,0 V vs Ag/AgCl à l’électrode positive pendant 2 min.
-
Assembler le Cellules de gobelet SLFB
- Fixer les électrodes positives et négatives prétraités à un Conseil de positionnement électrode artisanale sur une distance fixe d’électrode. Placer le Conseil positionnement avec électrodes dans un bécher comme schématiquement illustré à la Figure 1 et ajouter des électrolytes dans le bécher jusqu’au niveau désigné d’immersion.
- Placer un agitateur magnétique dans le bol, placer le bécher sur une plaque chauffante et commande la vitesse de rotation de l’agitateur. Brancher le testeur de batterie aux électrodes et couvrir la cellule bécher d’une pellicule plastique pour éviter l’évaporation.
-
Calculer l’efficacité de la batterie
- Après galvanostatique charge et décharge, calculer l’efficacité de la batterie de la façon suivante :
Efficacité de Coulomb :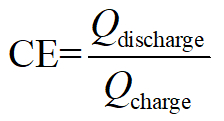
Rendement de tension :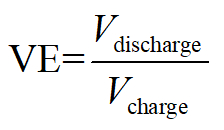
Efficacité énergétique :
Ici, Q est le symbole coulombs de charge/décharge des électrons équivalents, V la tension de sortie/appliquer et E la stocké/consommation d’énergie totale.
- Après galvanostatique charge et décharge, calculer l’efficacité de la batterie de la façon suivante :
2. lancer la mesure de l’Index
Remarque : Cette section décrit la procédure pour mesurer l’indice lancer (TI) de l’electrodeposition à électrodes positives dans les cellules SLFB. Inversant le rôle des électrodes positives et négatives fournit l’autre jeu de résultats de TI. Ici, TI est étudiée à l’aide d’une cellule de Haring-Blum artisanale comme schématiquement représentée à la Figure 2.
-
Mesure
- Pesez et consignez les deux électrodes positives respectivement avant les expériences.
- Placer l’électrode négative au milieu d’une cellule de Haring-Blum et une électrode positive à un rapport de la distance de 1 de l’électrode négative. Placer l’électrode positive deuxième à un autre rapport de distance de l’électrode négative (take 6 à titre d’exemple dans la Figure 2).
- Plonger les deux électrodes positives et une électrode négative avec la même zone de surface immergée (ici 2 cm2 ) dans la cellule Haring-Blum avec l’électrolyte d’intérêt.
- S’applique à une densité de courant contrôlée (20 mA·cm-2 ici) les électrodes à l’aide d’un testeur de piles. Effectuer la charge galvanostatique pour une certaine durée (30 min ici).
- Après ensemencement, rincer les deux électrodes positives avec l’eau distillée et les faire sécher à température ambiante pendant la nuit.
- Peser et enregistre deux électrodes positives encore respectivement et on calcule le ratio de distribution métallique (MDR) selon l’équation ci-dessous.
- Répéter les expériences précitées en plaçant l’électrode positive deuxième à divers rapports de distance linéaire (LR) pour acquérir le schéma TI (varié de 6 à 1 ici).
-
Calcul
- À titre d’exemple, considérons l’anode comme électrode d’intérêt et déterminer chaque donnée sur le diagramme de TI par le mesurée MDR contre LR, qui sont calculés comme suit :
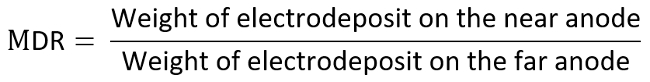
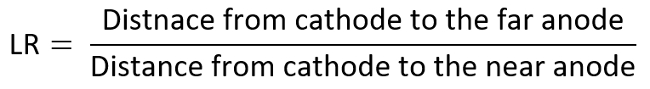
- À titre d’exemple, considérons l’anode comme électrode d’intérêt et déterminer chaque donnée sur le diagramme de TI par le mesurée MDR contre LR, qui sont calculés comme suit :
3. préparation des échantillons de SEM
- Rincez l’électrode de graphite avec l’eau distillée et sécher à température ambiante après dépôt électrolytique.
- Tranche des électrodes de graphite dans la taille de l’échantillon souhaité par le diamant a vu avec soin. Froid, monter l’échantillon de l’électrode et puis mécaniquement le polir avec 14, 8 et 3 papiers de carbure de silicium sable μm, par la suite.
- Outre polonais les échantillons avec suspension de diamant 1 μm et 0,05 μm Al2O3. Déposer l’échantillon froid-monté avec platine et fixez-la avec des bandes en cuivre pour assurer la conductivité pour l’observation de la SEM.
Résultats
Pour prolonger la vie de cycle de SLFBs, NaOAc est fourni comme électrolyte additif. Vélo de performance de SLFBs avec et sans additif de NaOAc sont examinés en parallèle et résultats sont présentés à la Figure 3. Pour faciliter la comparaison quantitative du cycle de vie, nous définissons la « mort » d’un SLFB comme quand sa CE est inférieur à 80 % sous galvanostatique continu charge/décharge. Figure 3 a et
Discussion
Cet article décrit une méthode économique pour prolonger la durée de cycle de SLFBs : en employant NaOAc agent comme électrolyte additif. Un lot d’électrodes de graphite fraîches et plaques de nickel sont prétraités comme susmentionné à l’étape 1 avant les expériences de cyclisme à long terme. Incohérence entre les électrodes de carbone commercial pourrait provoquer un écart de performance des SLFBs, le prétraitement physico-chimiques à l’étape 1.4 est essentiel pour éliminer les résidus de s...
Déclarations de divulgation
Nous n’avons rien à divulguer.
Remerciements
Ce travail a été soutenu par le ministère de la Science and Technology, R.D.C., sous le numéro de financement du NSC 102-2221-E-002 - 146-, la plupart des 103-2221-E-002 - 233 - et la plupart 104-2628-E-002-016-MY3.
matériels
| Name | Company | Catalog Number | Comments |
| 70 mm cellulose filter paper | Advance | ||
| Autolab | Metrohm | PGSTA302N | |
| BT-Lab | BioLogic | BCS-810 | |
| commercial carbon composite electrode | Homy Tech,Taiwan | Density 1.75 g cm-3, and electrical conductivity 330 S cm-1 | |
| Diamond saw | Buehler | ||
| Hydrochloric Acid | SHOWA | 0812-0150-000-69SW | 35% |
| Lead (II) Oxide | SHOWA | 1209-0250-000-23SW | 98% |
| Lutropur MSA | BASF | 50707525 | 70% |
| nickel plate | Lien Hung Alloy Trading Co., LTD., Taiwan, | 99% | |
| Potassium Nitrate | Scharlab | 28703-95 | 99% |
| Scanning electron microscopy | JEOL | JSM-7800F | at accelerating voltage of 15 kV |
| Sodium Acetate | SHOWA | 1922-5250-000-23SW | 98% |
| water purification system | Barnstead MicroPure | 18.2 MΩ • cm |
Références
- Soloveichik, G. L. Flow batteries: current status & trends. Chemical Reviews. 115 (20), 11533-11558 (2015).
- Ravikumar, M. K., Rathod, S., Jaiswal, N., Patil, S., Shukla, A. The renaissance in redox flow batteries. Journal of Solid State Electrochemistry. 21 (9), 2467-2488 (2017).
- Hazza, A., Pletcher, D., Wills, R. A novel flow battery: A lead acid battery based on an electrolyte with soluble lead (II) Part I. Preliminary studies. Physical Chemistry Chemical Physics. 6 (8), 1773-1778 (2004).
- Pletcher, D., Wills, R. A novel flow battery: A lead acid battery based on an electrolyte with soluble lead (II) Part II. Flow cell studies. Physical Chemistry Chemical Physics. 6 (8), 1779-1785 (2004).
- Pletcher, D., Wills, R. A novel flow battery-a lead acid battery based on an electrolyte with soluble lead (II). III. The influence of conditions on battery performance. Journal of Power Sources. 149, 96-102 (2005).
- Hazza, A., Pletcher, D., Wills, R. A novel flow battery-a lead acid battery based on an electrolyte with soluble lead (II). IV. The influence of additives. Journal of Power Sources. 149, 103-111 (2005).
- Pletcher, D., Zhou, H., Kear, G., Low, C. T. J., Walsh, F. C., Wills, R. G. A. A novel flow battery-A lead-acid battery based on an electrolyte with soluble lead (II). V. Studies of the lead negative electrode. Journal of Power Sources. 180 (1), 621-629 (2008).
- Pletcher, D., Zhou, H., Kear, G., Low, C. T. J., Walsh, F. C., Wills, R. G. A. A novel flow battery-A lead-acid battery based on an electrolyte with soluble lead (II). Part VI. Studies of the lead dioxide positive electrode. Journal of Power Sources. 180 (1), 630-634 (2008).
- Li, X., Pletcher, D., Walsh, F. C. A novel flow battery: a lead acid battery based on an electrolyte with soluble lead (II). Part VII. Further studies of the lead dioxide positive electrode. Electrochimica Acta. 54 (20), 4688-4695 (2009).
- Krishna, M., Fraser, E. J., Wills, R. G. A., Walsh, F. C. Developments in soluble lead flow batteries and remaining challenges: An illustrated review. Journal of Energy Storage. 15, 69-90 (2018).
- Lin, Y. -. T., Tan, H. -. L., Lee, C. -. Y., Chen, H. -. Y. Stabilizing the electrodeposit-electrolyte interphase in soluble lead flow batteries with ethanoate additive. Electrochimica Acta. 263, 60-67 (2018).
- Oury, A., Kirchev, A., Bultel, Y., Chainet, E. PbO2/Pb2+ cycling in methanesulfonic acid and mechanisms associated for soluble lead-acid flow battery applications. Electrochimica Acta. 71, 140-149 (2012).
- Oury, A., Kirchev, A., Bultel, Y. Potential response of lead dioxide/Lead (II) galvanostatic cycling in methanesulfonic acid: a morphologico-kinetics interpretation. Journal of The Electrochemical Society. 160 (1), A148-A154 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon