Method Article
膜をターゲットとした Ca2 +インジケーターによる培養細胞のローカル Ca2 +シグナルの解剖
要約
ここで Ca2 +イメージング ニューロンとグリア細胞内 Ca2 +シグナル細胞レベル下の解像度での解剖を可能にするためのプロトコルを提案する.このプロセスは、遺伝子にエンコードされた Ca2 +インジケーターの式をできるようにするすべてのセル型に適用されます。
要約
カルシウム イオン (Ca2 +) は、多様な生物の出力につながる複数のシグナル伝達経路を駆動する普遍的な細胞内メッセンジャー分子です。2 つの Ca2 +シグナル ソースの調整-「Ca2 +流入」から細胞外 Ca2 +からの解放は「細胞内 ca 2 + ストア小胞体 (ER) と -Ca の多様な時空間的パターン根底にある2 +細胞に複数の生物学的機能を引き起こす信号。このプロトコルの目的は、Ca2 +のイメージング手法により「Ca2 +流入"と"Ca2 +リリース"の瞬間を監視するを説明します。小田急電鉄 GCaMP6f は、遺伝子にエンコードされた Ca2 +インジケーター (GECI) 小胞体の外膜を対象に GCaMP6f を構成します。小田急電鉄 GCaMP6f は、従来の GCaMP6f よりも高い時間分解能で Ca2 +放出を監視できます。プラズマ膜ターゲット GECIs と組み合わせると、時空の Ca2 +シグナル パターンは細胞レベル下の解像度で記述できます。対象と細胞内 Ca2 +インジケーターここで説明は、原則として、すべてのセルで使用できますも生体内で結像のため線虫ニューロンの。このプロトコルでセル行, ニューロン, とグリア細胞解離の初代培養から細胞内 Ca2 +イメージングを紹介し、ラット大脳皮質ニューロンの冷凍ストックの準備を記述します。
概要
Ca2 +シグナルは、細胞内 Ca2 +濃度の上昇を表しています。Ca2 +は真核細胞に普遍的な二次メッセンジャーです。Ca2 +を使用して、セルは多様な細胞内シグナル伝達経路を介して機能し、さまざまな生物学的出力を誘発します。たとえば、ニューロン、シナプス前終末でシナプス小胞の放出核、および、postsynapse におけるシナプスの可塑性の誘導における遺伝子発現の正確に有効適切な個別の Ca2 +シグナルによって規制されて正確なタイミング1と右のサイトで下流の酵素。
Ca2 +シグナルの時空間パターンの特定には、特定の下流の酵素が有効にします。Ca2 +シグナルの 2 つの異なる Ca2 +ソース間の調整によって生成される: 細胞外空間、細胞内 Ca 2 +となる小胞体 (ER) からの Ca2 +放出からの Ca2 +流入を格納します。意味のある時空間 Ca2 +シグナル パターン特定の細胞機能を誘導するためには 10-100 μ M Ca2 +細胞膜や小胞体膜2上の Ca2 +チャネル近傍に生成されたナノドメインでもサポートされます。重要なは、Ca2 +シグナルのソースは、下流の生物学的出力を決定する最も重要な要因の 1 つです。ニューロンの Ca2 +流入し、Ca2 +放出があるガンマ-アミノ酪酸 (GABA)の受容体 (GABAAR) gaba 作動性シナプスでのクラスタ リングに対する効果の反対の阻止に責任があります。神経細胞の興奮3。Ca2 +流入大規模な神経興奮に伴うシナプス GABAAR クラスターの分散を誘導する、永続的な Ca2 +小胞体から放出に対しシナプス GABAARs のクラスタ リングを促進します。他のグループはまた成長円錐のチューニングの方向が Ca2 +シグナルの元に大きく依存することを報告している: Ca2 +流入 Ca2 +放出は神経の成長の魅力をガイドしながら、反発を誘発します。コーン4。したがって、完全に理解、Ca2 +シグナル伝達経路の特定細胞出力の基になる、する、Ca2 +シグナルで細胞レベル下の解像度を記述することによって Ca2 +シグナルのソースを識別するために重要です。
このプロトコルでは Ca2 +イメージングを報告するメソッド、Ca2 +シグナル ソース (図 1) の推定を可能にする細胞レベル下の解像度で Ca2 +シグナルをについて説明します。Ca2 +ミクロ ドメインの膜のすぐ下には、遺伝子にエンコードされた Ca2 +インジケーター (GECIs) 細胞膜局在化シグナル Src 内 Lck の添付ファイルを介して細胞膜を対象としたによって監視される正常にGECIs5の N 末端キナーゼ。よく空間的で、一時的な解決で ER 近傍 Ca2 +信号パターンを検出するため最近 OER-GCaMP6f で培って GCaMP6f6ターゲット ER 外膜、小胞体膜貫通型タンパク質を使用します。小田急電鉄 GCaMP6f は、Ca2 +と GECIs の拡散を避けることによって COS 7 細胞7 HEK293 細胞8、従来の標的 GCaMP6f よりもより良い時空間解像度で小胞体からの Ca2 +放出を報告できる敏感に.小田急電鉄 GCaMP6f によって報告された培養海馬アストロ サイトの自発的 Ca2 +上昇が別の時空間パターンを示したことをまた確認した膜をターゲットとした GCaMP6f では監視と比較して (Lck GCaMP6f)7 ,9, Ca2 +イメージング OER GCaMP6f Lck GCaMP6f との組み合わせでは、Ca2 +シグナルのソースを識別するために細胞レベル下の解像度での郭清に寄与することを示します。
現在、我々 は HeLa 細胞とニューロン ・ グリア ガラス coverslips にメッキ文化の混合で Ca2 +シグナル解剖のプロトコルを詳しく説明します。Ca2 +イメージング技法 GECIs は Lck GCaMP6f、プラズマ膜ターゲット RCaMP210 (Lck RCaMP2)、ここに示す、これら GECIs を表現できるすべてのセルに適用される小田急電鉄 GCaMP6f (図 1)。
プロトコル
ここで説明したすべての実験は、文部科学省によって発行されたガイドラインによると理化学研究所安全委員会および動物実験委員会によって承認されました。
1. 細胞の調製
- ポリ (エチレンイミン) の準備-coverslips をコーティング
注:ポリエチレンイミン (PEI) コーティングをガラス器具の推奨しますニューロンとアストロ サイトの開発を妨げることがなく、coverslips にしっかりと接続することができます。ただし、他のコーティング方法 (例えば、ポリ オルニチン、ポリ L-リジン, ラミニン コーティング) もあり、ガラス底培養皿のため必要な場合。- 12 ウェル プレートの各ウェルに、18 mm 径のガラス基板を配置します。滅菌水を使用して 0.04 %pei ソリューション (12.5 mL/12 ウェル プレート) を準備します。
- 各ウェルに 0.04 %pei 溶液 1 mL を追加します。Coverslips 下に気泡がないことを確認します。
- 37 ° C で一晩 CO2インキュベーターの版を孵化させなさい
- 次の日、洗浄コーティング coverslips 3 x 1 ml の滅菌水。ヒメアリ PEI ソリューションを削除各ウェルに 1 mL の滅菌水を追加して、12 ウェル プレートを振る、coverslip とプレートの間ペイ ソリューション徹底的に洗浄することができます。同様に残りのペイは細胞のために有毒を確認水後最終的な洗浄が完全に吸気します。
- 乾燥し、紫外線 (UV) 少なくとも 15 分光フード内側 coverslips を滅菌します。ペイ コート皿は、2 ヶ月の 4 ° C で保存できます。ちょうど使用する前に 15 分間紫外線を料理を照らします。
- 培地の蒸発を防ぐために井戸の間のスペースに 5 mL の滅菌蒸留水を追加します。
- セルラインをめっき
注:このプロトコルは、HeLa 細胞など COS 7 細胞の哺乳類細胞から細胞へのトランスフェクションのちょうど 1 つの例を提供します。ユーザーは、彼らの実験用に最適化されたその他のトランスフェクション プロトコルを適用できます。このセクションでは COS 7 細胞 HeLa 細胞培養のプロトコルについて述べる.- 70-90% の合流点に達するまで、トランスフェクション前日に 10 cm 培養皿の細胞を培養します。
- 培養液を prewarm (材料の表を参照) を 37 ° C
- 2 セルを洗浄せず Ca2 +と Mg2 + (PBS [-]) リン酸緩衝生理食塩水で x。
- 吸引、PBS(-)、0.5% トリプシン エチレンジアミン四 edta 溶液の 1 mL を追加し、37 ° C、90 で細胞をインキュベート s 円形に達するまで。
- Prewarmed 培地、trypsinization を停止の 9 つの mL を追加します。1:6 の比率で培養培地で細胞を希釈します。
- シード 12 ウェル プレートでペイ コート coverslips に希薄化後のセルの 1 つの mL です。
- ラットやマウスの海馬ニューロン ・ グリアの混合文化の準備
注:セクション 1.3 と 1.4 最初確認する必要が制度的ケアおよび使用委員会によって承認され、ケアと実験動物の使用のための正式に承認された手順に従う必要があります。神経細胞培養のプロトコルのフローチャートを図 2に示します。- 層流フードの下ですべての試薬を準備します。場所ダルベッコ変法イーグル培地 (DMEM) に 2 つの 100 mm 冷蔵庫内にある (およそ 20 mL/料理) 料理を文化します。
- DMEM と 20 mM 4-(2-hydroxyethyl)-1-piperazineethanesulfonic 酸 (HEPES) 成る郭清培地の 50 mL を準備 (材料の表を参照してください) 3 60 mm 培養皿 (約 7 mL/料理) と 8 35 ミリメートルに培地を分注、培養皿 (約 2 mL/料理)。別の冷蔵庫に料理を配置します。
- 20 mM HEPES (材料の表を参照) を添加したハンクス バランスの取れた塩溶液から成る、インキュベーション食塩水 50 mL を準備し、氷の上の 15 mL の円錐管に 8 mL の生理食塩水を配置します。
- 最小必須培地 (MEM) で、めっき培 B-27、グルタミン、ペニシリン ・ ストレプトマイシン (材料の表を参照) を準備します。この培地で室温 (20-28 ° C) を維持します。
- 70% エタノールで手術器具を滅菌します。
- ふたとイソフルランの 1 mL のガラス瓶に紙タオルを置きます。1 分の蒸発イソフルランをしましょう。
- 1.3.6 のステップにしたがって調製された jar の妊娠ラットまたはマウスを配置し、深くに麻酔がかかるまで瓶の中動物を維持 (約 30 秒 〜 1 分)。
- 瓶から麻酔下の動物を取るし、70% エタノールでそれらを噴霧して動物と解剖機器を消毒します。標準的な解剖はさみとピンセットと腹側正中線を切り取って子宮を妊娠ラットまたはマウスから抽出します。
- 麻酔下の雌ラットまたはマウス、繊細な解剖はさみを使用しての子宮から E18-19 胚を抽出し、冷たい麻酔 10 cm 皿に冷たい DMEM にリング鉗子で抽出された胚を配置します。
- 細かい解剖はさみで胎児の首をはねるし、10 cm 皿に冷たい DMEM に頭を配置します。
- 13 センチ Semken 鉗子、鉗子罰金のヒントとそれぞれの胚から脳を抽出します。60 mm ディッシュに冷たい解剖中に脳をしてください。
- 35 mm 料理冷たい解剖中の罰金のヒント 2 つの鉗子を使用して、なったを削除し、氷の上の 15 mL の円錐管にインキュベーション生理食塩水の分離のティッシュの維持します。
- インキュベーション生理食塩水となったを洗浄し、37 ° C で 5 分間インキュベーション生理食塩水でトリプシン (1.25 mg/mL) と DNase 私 (0.25 mg/mL) インキュベート推奨培養量は培養生理食塩水、ストック トリプシン x 20 の 150 μ L と 20 x の在庫 DNase の 150 μ L 2.7 mL (材料の表を参照してください)。
- なった 3 を洗って冷たい培養生理食塩水で x。
- インキュベーション生理食塩水を吸引し、DNase を含むめっき培地 1 mL を加える私 (原液の 10 μ L;材料の表を参照してください)。ピペッティング以上 20 x で組織を中断し、細胞カウンターとトリパン ブルーの試金を使用して、実行可能なセルの密度を測定します。
- 1.4 倍 105実行可能な細胞/ml ラット用と 2.5 105実行可能な細胞/ml マウスの倍の密度に海馬の細胞を希釈します。12 ウェル培養皿でペイ被覆カバーガラス上希薄細胞懸濁液の 1 mL の種子します。
- 2-3 日の CO2 インキュベーターで 37 ° C で細胞を維持します。
- メッキ媒体を削除します。細胞の乾燥をさせてください。慎重かつ迅速に追加 prewarmed 維持培地 (材料の表を参照してください)。
- ラット大脳皮質ニューロン ・ グリア混合培養・凍結細胞冷凍文化の復活の準備
注:大脳皮質細胞の凍結保存方法は記述されていた previously11 だったここでは、大脳皮質細胞がする少なくとも 3 ヶ月間-80 ° C で保存ことができます修正されたプロトコルが提供されます。このプロトコルのフローチャートを図 2に示します。- めっき中の手順 1.3.1–1.3.4 と材料表のとおりで、培養生理食塩水、解剖中 DMEM を準備します。
- DMEM、熱不活化牛胎児血清、ペニシリン ・ ストレプトマイシン (材料の表を参照) で構成され洗浄メディアの準備、必要に応じて。
- 麻酔下の雌ラットまたはマウス、繊細な解剖はさみを使用しての子宮から E18-19 胚を抽出し、冷たい麻酔冷たい DMEM にそれぞれの抽出された胚を配置するリング鉗子を使用します。
- 胚から脳を外し、冷たい解剖中でそれらを保ちます。見出せなかったを削除し、氷の上の 15 mL の円錐管にインキュベーション生理食塩水でそれらを維持します。
- 皮質培養生理食塩水での洗浄し、トリプシン (1.25 mg/mL) と DNase 皮質を孵化させなさい私は 37 ° C で 5 分間インキュベーションを生理食塩水で (0.25 mg/mL)12 皮質の推奨培養量は 5.4 mL、インキュベーション生理食塩水ストック トリプシン x 20 の 300 μ L 300 μ L 20 x の在庫 DNase の私。
- 3 皮質を洗って冷たい培養生理食塩水で x。
- 上澄みを除去し、めっき中の 2 mL はマイク在庫 DNase の 150 μ L で補足を追加します。未満 20 ストロークをピペッティングにより細胞を分離し、70 μ m の細孔径を持つセル ストレーナーを使用してセルをフィルターします。
- メッキめっき中の 20 ml のセル ストレーナーを洗浄します。凍結細胞の在庫の準備のため洗浄を 20 mL 洗浄中のセル (材料の表を参照)
- 細胞カウンターとトリパン ブルー色素法を用いた幹細胞の密度を測定します。
- 1.4 倍の 105実行可能な細胞/ml メッキ媒体の密度に皮質細胞を希釈し、12 ウェル培養皿でペイ コート coverslips に希釈した細胞懸濁液の 1 mL を追加します。
- 2-3 日間の CO2インキュベーターで 37 ° C で細胞を維持し、維持培地を培養液に変更します。
- 1.4.9 のステップの後 3 分、スイングのローターを使用しての 187 x gで細胞を遠心分離によって冷凍皮質細胞の在庫を準備します。
- 上清を吸引し、凍結保存培地は 1 × 107セル/mL の細胞密度を得るため 4 ° C で保管 (材料の表を参照) を追加します。クライオ チューブに細胞懸濁液の分注 1 mL。
- -80 ° C の温度に達するまでに凍結率-1 ° C/分でコンテナーを凍結細胞にチューブを置き、-80 ° C のフリーザー冷凍コンテナーに転送します。セルは-80 ° C で少なくとも 3 ヶ月間に保存できます。
- 凍結細胞を復活させる洗浄中 (各の極低温の管のおよそ 13 mL) と (材料表参照) 冷凍の大脳皮質細胞の培地を prewarm します。
- 37 の ° C の水浴中で急速に凍結細胞を解凍します。
- Prewarmed 洗浄中で軽く解凍細胞を希釈します。187 x gスイング ローターを使って、3 分で細胞を遠心します。
- 洗浄中の 1 mL にペレットを中断し、実行可能な細胞密度を測定します。
- 3.0 x 10 の5実行可能なセル/mL、およびシード ペイ コート 12 ウェル プレートに細胞懸濁液の 1 mL の細胞密度をもたらす冷凍皮質細胞維持培地で細胞を希釈します。
2. 膜ターゲット GECIs の式
-
細胞のトランスフェクション
- 250 を追加 (すなわち、Lck GCaMP6f、Lck-RCaMP2、または CMV プロモーターと OER GCaMP6f) GECI プラスミドの ng 減少血清中の 100 μ L を7,8,9 (材料表参照) ウェルあたり。Lck RCaMP2 と OER-GCaMP6f、減少血清各ウェル中の 100 μ L のそれぞれのプラスミッドの使用 250 ng の失うかの。
- トランスフェクション試薬の 0.5 μ L を追加 (材料表参照) プラスミッド減らされた血清媒体混合物によくあたり。Lck RCaMP2 と OER GCaMP6f 失うか、0.5 μ L/ウェルのトランスフェクション試薬を追加します。
- 30 分間室温 (20-28 ° C) の混合物を孵化させなさい。
- 伝的に各 coverslip に 100 μ L の混合物を追加します。
- CO2インキュベーター、GECIs の式を許可する 37 ° c で 48-72 時間細胞を孵化させなさい。
-
トランスフェクションと海馬や大脳皮質ニューロンのアデノ随伴ウイルス感染
注:3-5 日間の in vitro トランスフェクション (DIV) 神経細胞のトランスフェクション率で起因します。6-8 DIV でトランスフェクションが GECIs のアストロ サイトでの最適な表現に適しています。9 DIV 後分散培養神経細胞における GECIs の発現、アデノ随伴ウイルス (AAV) ベクター感染は優れた表現の有効性を提供します。Lck GCaMP6f、Lck-RCaMP2、OER-GCaMP6f プロモーターが前述のように準備された EF1a の下の表現のための AAV のベクトルは12を細胞 HEK293 を使用して (材料の表を参照してください)。- 3-8 日めっき後の transfection のためラベル 2 管、プラスミド DNA と他のトランスフェクション試薬のための 1 つ。
- 減らされた血清中の 50 μ L を追加 (材料表参照) 各管にもあたり。
- プラスミド DNA チューブにウェルあたり 0.5 μ g のプラスミド DNA coverslip あたりと (材料表参照) 神経細胞のトランスフェクション試薬を伴うサプリメントの 1 μ L を追加します。Lck RCaMP2 と OER GCaMP6f 失うかの各プラスミドの 0.5 μ g とサプリメントの 1 μ L は、50 μ L/ウェル減少血清中ので混合されます。
- トランスフェクション試薬の 1 μ L を追加 (材料表参照) トランスフェクション試薬の井戸あたり。トランスフェクション試薬の同じ量は、失うかに使用されます。
- 両方の渦管 1-2 s。
- (ステップ 2.2.3) から DNA の混合物に (ステップ 2.2.4) からトランスフェクション試薬の混合物を追加します。軽くピペッティングして混合し、室温で 5 分間混合物 (coverslip あたり 100 μ L) を孵化させなさい。
- 伝の方法でセルにこの混合物をロードします。
- CO2インキュベーター内のセル マーカー蛋白質を表現するまで 2-3 日間インキュベートします。
- AAV 感染症混合ニューロン ・ グリア文化に AAV の 3 μ L/ウェルを追加します。皿をロッキングで優しく混ぜます。Lck RCaMP2 と OER GCaMP6f のダブル感染症各 AAV の 3 μ L を導入するには、ウェルあたり.GECIs を発現する細胞数が十分ではない場合に感染症のため最適な AAV 量は決定する必要があります。
- 1-2 週間、GECIs が表現されるまでの文化を維持します。
3. Ca2 +イメージング
-
Lck RCaMP2 と OER GCaMP6f を発現する細胞の同時イメージング
注:同時にレコード Lck RCaMP2 と OER GCaMP6f 信号、画像分割光学系が必要です。光学系には、RCaMP2 と GCaMP6f の分離とカメラ (図 3 a) の同じ写真フレームの射影が有効にします。(1) 光源励起 (450-490 nm) の青色光を同時に出力できる必要があります同時イメージングも、顕微鏡の緑 (500-560 nm) スペクトル (2) ダブル バンド フィルター、ダイクロイック ミラーを設定し、RCaMP2 用フィルター (3) 排出量とGCaMP6f。詳細については、材料の表を参照してください。- イメージング デバイスと録音する前にコンピューターに少なくとも 30 分を入れます。37 ° c. に商工会議所を加熱顕微鏡を prewarm します。デバイスの画像分割、フィルター、および光源を設定します。カメラのビューの同じフィールドが表示されるように画像分割光学系を合わせます。適切な対物レンズを選択 (材料の表を参照してください)。
- Lck RCaMP2 をトランスフェクトしたマウント セルを含む coverslip と録音室で OER GCaMP6f 室で、適切なイメージング媒体またはバッファー (18 mm coverslips に 400 μ L) を追加し、顕微鏡ステージ上に置きます。培地の蒸発を避けるためにレコーディング室に蓋を配置します。
- 蛍光イメージングによる Lck RCaMP2 と OER GCaMP6f を発現している細胞を探します。退色、光毒性を防ぐために励起光強度を最小化します。
- 蓋を外し、10 Hz でコマ撮り録画を開始します。この録音中に Ca2 +応答 (例えば、COS 7 細胞の ATP HeLa 細胞のヒスタミン) を換起する商工会議所にアゴニストを追加します。
- ハード ディスク ドライブ (HDD) の時間経過のデータを保存します。
- 画像解析ソフトを使用してデータを分析します。
-
Lck RCaMP2 と OER GCaMP6f を表現するアストロ サイトの自発活動の記録
注:画像分割光学系なし細胞膜と小胞体の周りで Ca2 +シグナルは同じセルで監視できます。ここでは、同じのアストロ サイトで Lck RCaMP2 と OER GCaMP6f の逐次記録を説明しています。1.3 より大きい開口数と油浸対物は自発的 Ca2 +活動のため勧めします。- オンに、顕微鏡、カメラ、光源、および顕微鏡加熱室内楽録音する前に、少なくとも 30 分。
- Lck RCaMP2 と録音室で OER GCaMP6f transfected セルを含む coverslip をマウントし、画像中の 400 μ L を追加します。商工会議所の上に蓋を置きます。
- GCaMP6f と光源のフィルター セットを選択 (青色励起光、例えば 470– 490 nm;材料表を参照ください)。小田急電鉄 GCaMP6f を表現するアストロ サイトを探します。
- RCaMP2 のフィルター セットと光源を選択 (例: 510-560 nm 励起光を緑;材料の表を参照してください)、Lck RCaMP2 が同じのアストロ サイトで表現されるかどうかを確認します。退色を防ぐために光源への長い露出を避けてください。
- 2 分の 2 Hz で Lck RCaMP2 のコマ撮り画像を記録は、HDD に画像データを保存します。
- GCaMP6f に設定するフィルターを変更します。2 分の 2 Hz で、同じフィールドのビューで OER GCaMP6f のコマ撮り画像を記録は、HDD にデータを保存します。
- 画像解析ソフトを使用してデータを分析します。
-
ニューロンの自発神経活動と誘導 Ca2 +上昇を記録
注:神経イメージングのための顕微鏡のセットアップは、セクション 3.2 で説明したのと同じです。ここでは、Lck GCaMP6f 時自発的 Ca2 +上昇と Ca2 +上昇により小田急電鉄 GCaMP6f mGluR 活性化によるイメージングを説明しています。- 自発神経活動を記録するには、記録室で Lck GCaMP6f を発現している細胞を含む coverslip をマウントし、画像中の 400 μ L を追加します。商工会議所の上に蓋を置きます。
- GCaMP6f のためのそれらにフィルターと光源 (青色励起、例えば 470-790 nm;材料の表を参照) を設定します。Lck GCaMP6f を表現し、自発的な活動を示すニューロンを見つけます。
- 2 hz またはより高速のイメージを取得します。HDD にデータを保存します。
- 画像解析ソフトを使用してデータを分析します。
- 誘導 Ca2 +上昇を記録するマウント coverslips 400 と OER GCaMP6f を発現している細胞を含む培地をイメージング μ L。商工会議所の上に蓋を置きます。
- フィルターを使用して GCaMP6f の設定は、OER GCaMP6f を表現するニューロンを見つけます。
- ふたを取り外します。2 hz またはより高速の時間経過の録音を開始します。記録中追加 Gq タンパク質共役受容体のアゴニスト (例えば、mGluR5 アゴニスト [の RS] - 3, 5 - dihydroxyphenylglycine [DHPG]) 小胞体からの Ca2 +放出を換起します。
- HDD にコマ撮りの画像を保存し、データを分析します。
結果
Lck RCaMP2 と OER GCaMP6f HeLa 細胞に表現され、同時に画像分割光学系、(図 3 aとビデオ 1) トランスフェクション後 24 h を使用して両方の信号が記録されました。画像は、10 hz ヒスタミン (彼、1 μ M)、小胞体からの Ca2 +放出を誘導する、録音中に追加された、買収されました。彼の申請には、Lck RCaMP2 と OER GCaMP6f の信号強度の増加、ΔF/f0 の初期の蛍光強度 (図 3 b) からの変更を表す擬似カラー表示で示すように。Lck RCaMP2 と OER GCaMP6f によって報告された Ca2 +上昇 (ΔF/F0) の時間コースは、利益率 (ROI) (図 3) の同じ地域で比較しました。ΔF/F0 の値は、異なる表現のレベルと分布を持つ 2 つの異なる GECIs 時間コース比較するためピーク値に正規化されました。両方のセンサーは振動のような Ca2 +上昇を報告しました。Lck RCaMP2 と OER GCaMP6f 5 つの細胞のタイプ間の 2 つのセルで Ca2 +上昇の同じ時間経過を示した (図 3、投資収益率 1 と 3) を検討しました。しかし、Ca2 +標高 Lck RCaMP2 によって示されているは、OER GCaMP6f (図 3 C、投資収益率 2、4、および 5) で示すと比較してより高いレベルにとどまっています。終了以前 ER の周り彼の刺激による Ca2 +信号源である一方、プラズマ膜近傍 Ca2 +上昇を延長することが示唆されました。
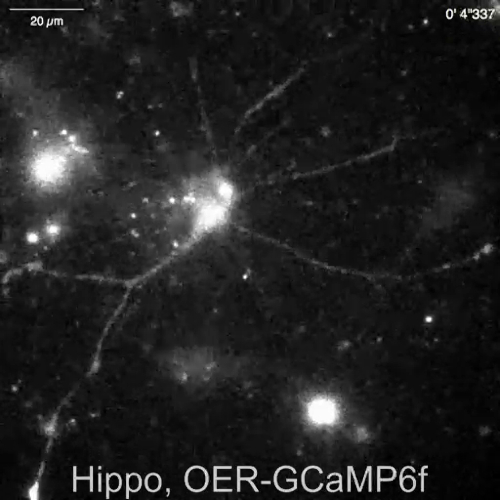
自発的 Ca2 +ニューロン ・ グリア (図 4 a) ラットなったから文化を混合アストロ サイトからの信号は、Lck RCaMP2 と OER GCaMP6f (図 4、ビデオ 2、ビデオ 3 によって示されていた皮質 (図 4 b)、動画 4、動画 5)。皮質の文化は、このプロトコルで説明されているように準備された凍結ストックから復活しました。Lck RCaMP2 および小田急電鉄 GCaMP6f 信号は同じ細胞から 2 Hz で順番に記録されました。3 ・ ロワは、各 GECI で Ca2 +上昇を示した領域で選択され、ΔF/F基本(すなわち、蛍光強度) の時間コースが全体の録音期間 (F基本中に平均蛍光強度から変更).ベースラインの蛍光は安定するいると、Ca2 +標高がそれほど頻繁に Ca2 +上昇イベントを検出する有用な基準に F基本なります。自発的 Ca2 +標高はアストロ サイトのプロセスは細胞体ではなく、表示されていた。この結果は他 GECIs 可視化体外13体内14によるアストロ サイトの自発的 Ca2 +信号前のレポートに一貫しました。海馬と皮質アストロ サイトの Ca2 +標高 Lck RCaMP2 (トップ) で示されていた OER GCaMP6f によって示されているよりも頻繁。この結果 Lck GCaMP6f によるアストロ サイトの Ca2 +高度が小田急電鉄 GCaMP6f7のためのそれらよりも多く検出されたこと私達の前のデモンストレーションと一貫性のある、この概念もに適用可能であることを示唆している、単一セルのレベル。
自発的 Ca2 +標高 Lck GCaMP6f による幼若ラット海馬ニューロン (10 部) では、2 Hz (図 5 aとビデオ 6) で見られました。これらの Ca2 +上昇が細胞内ドメインにローカルに限られている 5 つの異なる Roi の ΔF/F0 の時間コースがお勧めします。図 5B(動画 7) は、Ca2 +応答成熟マウス海馬ニューロン (30 部) に小田急電鉄 GCaMP6f 発現 AAV ベクターに感染を示しています。100 μ m の Ca2 +放出を誘発する代謝型グルタミン酸受容体のアゴニストである DHPG は、ニューロンが刺激されました。DHPG による OER GCaMP6f による Ca2 +放出が検出されました。
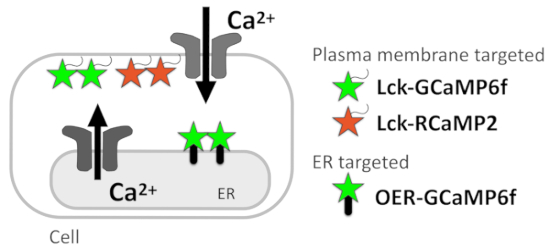
図 1: 図膜ターゲット GECIs 。プラズマ膜ターゲット GECIs (Lck GCaMP6f および Lck RCaMP2) と外側の ER の模式図膜ターゲットと GCaMP6f (OER-GCaMP6f)。
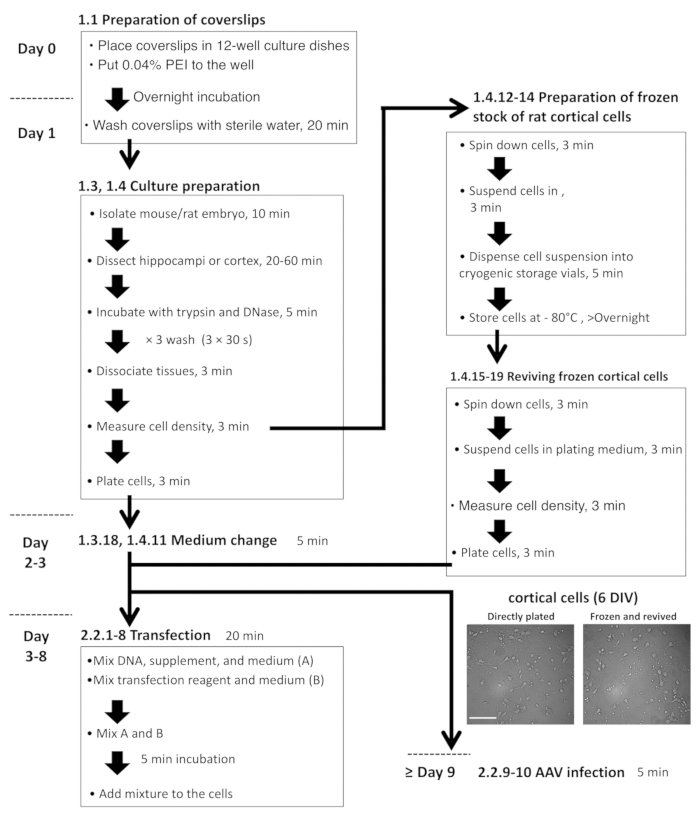
図 2: 海馬と大脳皮質細胞の準備、プラスミド トランスフェクション AAV 感染にフローチャート。顕微鏡の画像は代表、たてメッキ DIV 6 大脳皮質細胞 (左)、(右) 凍結ストックから細胞を復活します。スケールバー = 100 μ m.この図の拡大版を表示するのにはここをクリックしてください。
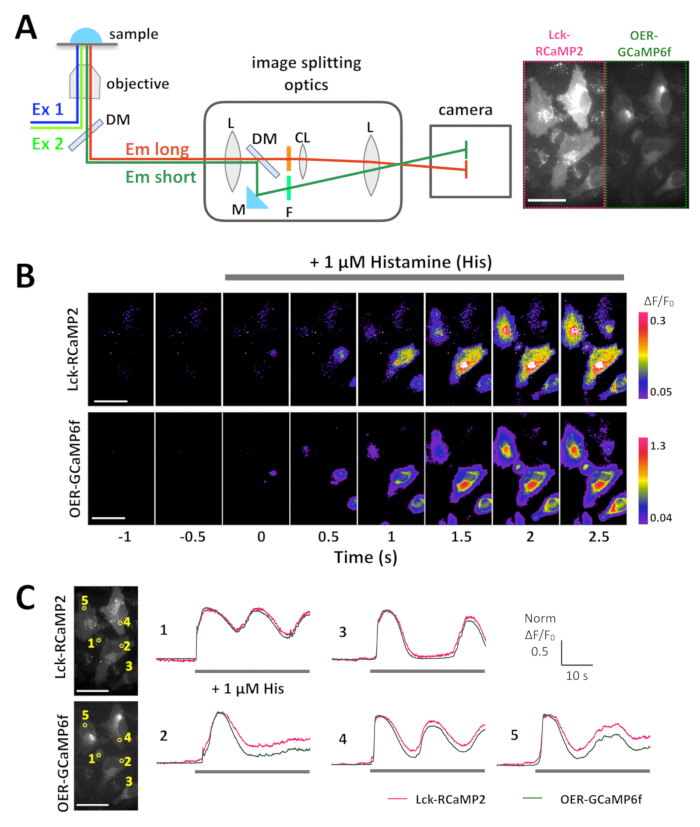
図 3: Lck RCaMP2 と HeLa 細胞で OER GCaMP6f の同時可視化の例です。画像分割光学系と信号分離の模式図 (A)。Lck RCaMP2 と OER GCaMP6f のためのビューの同じフィールドは、カメラに同時に投影されます。ビデオ 1、CMOS カメラが 10 Hz で取得した代表的な記録は、この録音の 1 つのフレームは (右) パネルAに表示されます。(B) ΔF/F0 Lck GCaMP2 (トップ) と小田急電鉄 GCaMP6f (下) のための擬似カラー画像。(彼、1 μ M) ヒスタミンは、Lck GCaMP2 (マゼンタ) と小田急電鉄 GCaMP6f (緑) の正規化された ΔF/F0 時間コース 0, (C) 代表に追加されました。データは、各プロットの最大の ΔF/F0 値を正規化されました。グレーのバーは、アプリケーションのタイミングを示します。データは、カスタムメイドのソフトウェア TI ワークベンチ15と分析されました。スケールバー = 50 μ m (顕微鏡画像)。 この図の拡大版を表示するのにはここをクリックしてください。
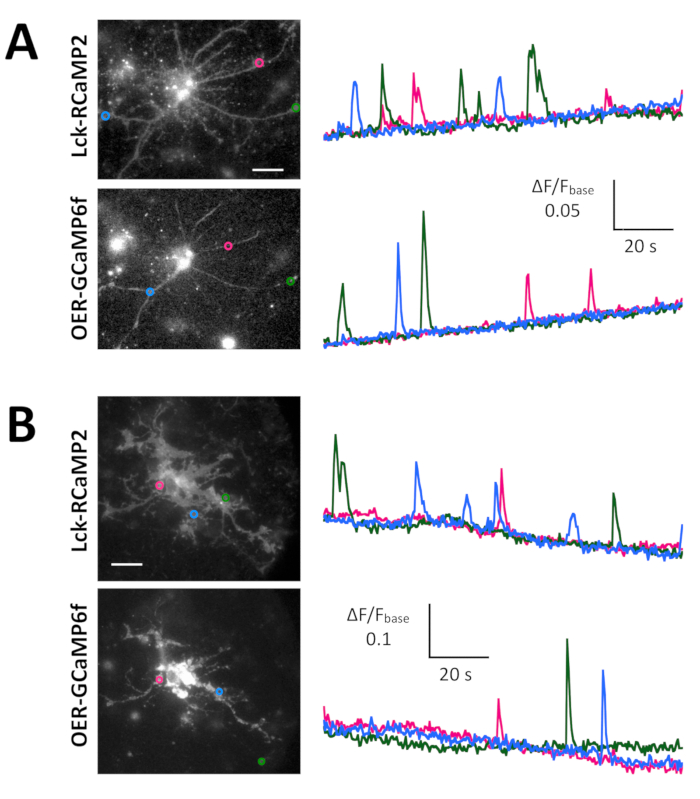
図 4: 自発的 Ca2 +標高 Lck RCaMP2 と OER GCaMP6f 式の監視アストロ サイトにします。(A) 代表海馬と (B) 皮質アストロ サイト Lck RCaMP2 (トップ) と小田急電鉄 GCaMP6f (下) をトランスフェクトしました。大脳皮質細胞は、冷凍ストック文化から復活しました。Lck RCaMP2 と OER GCaMP6f 画像順次 EM CCD カメラで 2 Hz で同じセルに買収されました。ΔF/Fbase の時間コースを Roi の測定左ショーのプロットは、顕微鏡画像で示されます。データは、TI ワークベンチと分析されました。実際の映画は動画 2動画 3、 動画 4動画 5を提供しています。スケール バー = 20 μ m (顕微鏡画像)。ベースラインのドリフトでは、セルにグローバルの Ca2 +レベルの変化を示唆しています。 この図の拡大版を表示するのにはここをクリックしてください。
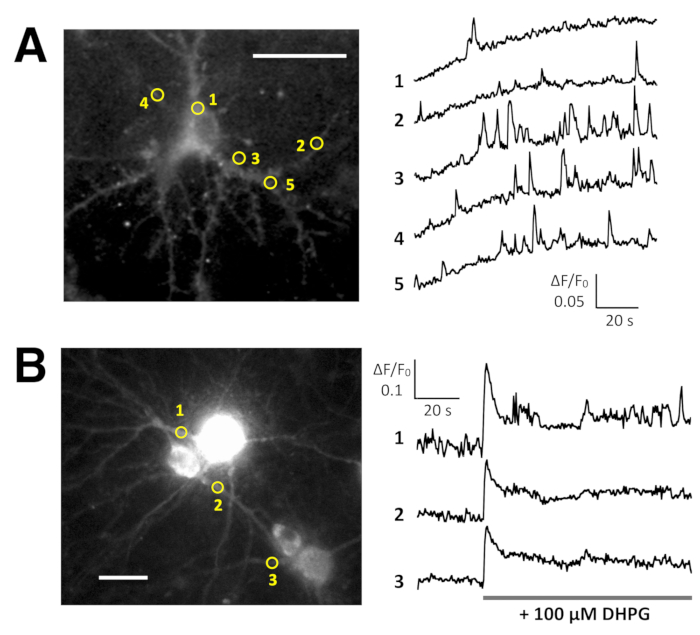
図 5: Lck GCaMP6f と OER GCaMP6f ニューロンの Ca2 +イメージングの例。(A) 代表的なラット海馬ニューロンの DIV 10 (左) と (右) イメージの ΔF/F0 ・ ロワ (黄色の円) 単位のコースを示している時間を示すプロットで Lck GCaMP6f を表現します。時間コース内の数字は画像の ROI の番号に対応します。メモ Ca2 +上昇の時系列パターンは興味の様々 な地域の間で異なる。ベースラインのドリフトは、このニューロンの Ca2 +のグローバル レベルの増加を示唆しています。(B) 成熟マウス海馬ニューロン (DIV 30) 小田急電鉄 GCaMP6f 式 AAV のベクトルを (左) に感染しているの例。ΔF/f0 測定コース プロットを示します 100 μ M の Ca2 +応答時間 (RS) - 3, 5 - dihydroxyphenylglycine (DHPG) は、灰色のバーが表示されるタイミングで適用されます。黄色の丸は、時間経過が得られた陰影の位置を示します。冷却 CCD カメラ(パネル)または EM CCD カメラ (パネルB) 画像 2 hz ・ TI ワークベンチで分析します。スケール バー = 20 μ m (顕微鏡画像)。この図の拡大版を表示するのにはここをクリックしてください。
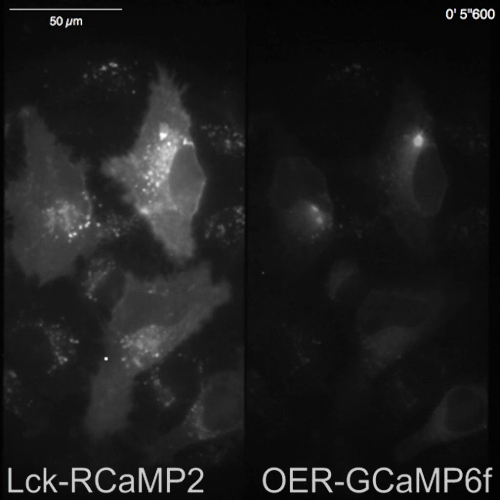
ビデオ 1: Lck RCaMP2 と HeLa 細胞で OER GCaMP6f の同時可視化の例です。代表的な録音は、10 Hz で取得し、図3。スケールバー = 50 μ m。 このビデオをダウンロードするにはここをクリックしてください。

ビデオ 2: 自発的 Ca2 +過渡観察 Lck RCaMP2 海馬アストロ サイトにします。2 Hz (図 4 a) で取得した代表的な録音は、ビデオ 3としてのビューの同じフィールドに記録されます。スケール バー = 20 μ m.このビデオをダウンロードするにはここをクリックしてください。
ビデオ 3: 自発的 Ca2 +過渡観察 OER GCaMP6f 海馬アストロ サイトにします。代表的な記録ビデオ 2としてのビューの同じフィールドで 2 Hz (図 4 a) で取得しました。スケール バー = 20 μ m.このビデオをダウンロードするにはここをクリックしてください。
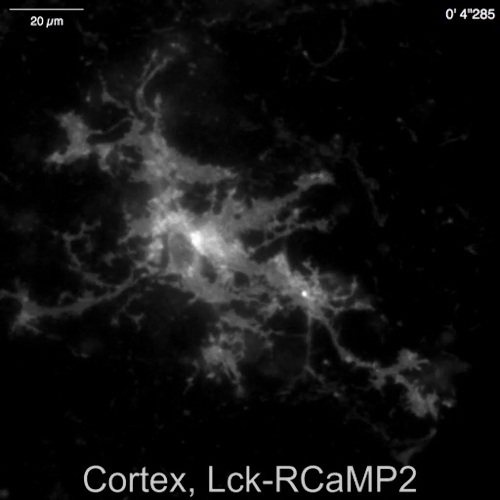
ビデオ 4: 自発的 Ca2 +のトランジェントを Lck RCaMP2 皮質アストロ サイトで観測されたビデオ 5としてのビューの同じフィールドで 2 Hz (図 4 b) で取得した代表的な記録を記録しました。スケール バー = 20 μ m.このビデオをダウンロードするにはここをクリックしてください。
ビデオ 5: 自発的 Ca2 +過渡観察 OER GCaMP6f 皮質アストロ サイトにします。代表的な記録ビデオ 4としてのビューの同じフィールドで 2 Hz (図 4 b) で取得しました。スケール バー = 20 μ m.このビデオをダウンロードするにはここをクリックしてください。
ビデオ 6: Lck GCaMP6f によるラットの海馬ニューロン (DIV 10) における Ca2 +イメージングの例です。2 Hz (図 5 a) で記録された信号を神経細胞 Ca2 +の例。スケール バー = 20 μ m.このビデオをダウンロードするにはここをクリックしてください。
ビデオ 7: 小田急電鉄 GCaMP6f を表現するマウス海馬ニューロン (DIV 30) で Ca2 +リリース。小田急電鉄 GCaMP6f 式 AAV のベクトル (図 5 b) に感染したマウスの海馬ニューロンでニューロンの Ca2 +信号の例を記録しました。ニューロン刺激 100 μ M dihydroxyphenylglycine (DHPG) 30 で適用される小胞体からの Ca2 +放出を換起します。スケール バー = 20 μ m.このビデオをダウンロードするにはここをクリックしてください。
ディスカッション
多様な生物の出力は、Ca2 +シグナルによって開始されます。Ca2 +は多彩な細胞内シグナル伝達メッセンジャーです。基本的な生物学的質問をされている特定の出力を換起する Ca2 +信号をデコードし、Ca2 +信号の多様性を記述する Ca2 +イメージング技術が必要です。現在詳細なプロトコルは、細胞膜と小胞体 (図 3および図 4) とローカル Ca2 +ミクロ相分離構造 (図 4および図 5) セル内で異なる Ca2 +信号を検出できます。これは細胞内 Ca2 +シグナルの多様性を記述するのに貢献します。Ca2 +の時間分解能信号も Ca2 +と自分自身、GECIs 三次元拡散の影響を避けることができ、それを検出する可能性がありますので、細胞膜や小胞体 GECIs をターゲットに改善されました、Ca2 +流入や Ca2 +の膜が発生するリリースのまさにその瞬間。
プロトコルには、いくつかの制限があります。検出信号は「Ca2 +流入やリリースの瞬間」の和であることに注意してください"Ca2 +拡散うち Ca2 +元から「大規模な Ca2 +シグナルの特にと。たとえば、HeLa 細胞の彼の刺激を呼び起こす Ca が2 +からのリリース ER、その結果の Ca2 +シグナルは ER 対象 OER GCaMP6f だけでなく、プラズマ膜ターゲット Lck RCaMP2 (図 3) も検出されます。別の制限は、Ca2 +シグナルの時空間パターンの Ca2 +シグナルの出力の唯一の決定要因をできない場合があります。下流エフェクター蛋白質の分布 (Ca2 +など-依存型キナーゼとホスファターゼ)2の決定要因があります。細胞内 Ca2 +シグナルを完全にデコードするには、このプロトコルでは扱いません、下流の酵素の動作の解析が不可欠です。
成功した Ca2 +イメージングのための最も重要な側面の 1 つは、イメージングのセットアップおよびイメージの取得条件、その他ライブ イメージング研究は同様。我々 は以前、期間および励起の強度と暴露時間と取得周波数16を含むイメージ取得条件付きで、細胞内 Ca2 +応答が強く依存していることを示した。励起光パワーは、光毒性と GECIs の変質を引き起こす可能性が最も重要な要因です。露光時間、周波数、励起光の強度、および録音の期間の記録の記録条件を最適化して、実験の目的に合わせてください。露出時間、退色とセルに光毒性を避けるために可能な限り、励起光の強度を減らすことをお勧めします。記録の頻度および記録の期間興味の Ca2 +上昇イベントをカバーするために十分なはずですがも退色と光毒性を避けるために可能な限り低きます。最初記録の頻度と期間を決定して、GECIs の変質を最小限になるよう、光の強さと露光時間を最適化することをお勧めします。もう一つの重要な要因は、GECIs の表現レベルです。GECIs がある Ca2 +-緩衝効果彼らは、Ca2 +-結合蛋白質。したがって、GECIs の過剰発現は、生理学的、細胞に必要な Ca2 +、バッファリングの結果します。GECI 発現量は、GECIs を多量に発現するイメージング細胞を避けるために最小限に抑える必要があります。
結論としては、Ca2 +シグナル細胞レベル下の解像度での郭清は、出力の生物学的現象を決定する細胞内の Ca2 +信号をデコードするための最も重要な手順の 1 つです。このプロトコルは、Ca2 +シグナルこれらの信号間の多様性を記述するための解剖のための新しい方法を提供します。現在、この手法は in vitro 実験で制限されています。しかし、Lck GCaMP6f は in vivo Ca2 +イメージング マウス17で既に使用されている、小田急電鉄 GCaMP6f は、Ca2 +を監視する線虫7 VD 運動ニューロンにおける生体内で信号を確認しました。したがって、細胞レベル下コンパートメントに GECIs をターゲットと、in vivo イメージング、将来、したがって有効にする Ca2 +解離体内に拡張する可能性があります。
開示事項
著者が明らかに何もありません。
謝辞
この作業は次の補助金によってサポートされて: 日本科学技術振興機構 (JST)/前兆研究萌芽期の科学と技術 (プレスト) (JPMJPR15F8、日本);日本学術振興会 (JSPS) 科学研究 (科研費) (JP18H05414、JP17H05710、JP16K07316)、助成財団助成金/。著者 RCaMP2 とアーサー J.Y. 黄尾藤晴彦 (東京大学) に感謝し、トーマス McHugh (理化学研究所 CBS) の AAV のベクトルを提供と指示について AAV の準備。著者は、ビデオ撮影と編集の可視化実験のジャーナル編集者に感謝するも思います。
資料
| Name | Company | Catalog Number | Comments |
| (RS)-3,5-Dihydroxyphenylglycine (DHPG) | Tocris | #0342 | |
| 0.5% DNase I stock solution | Sigma-Aldrich | #11284932001 | Prepare 0.5% DNase I (w/v) in Hanks' Balanced Salt Solution supplemented with 120 mM MgSO4. Prepare 160 µL aliquots and store at -30 °C. |
| 0.5% Trypsin-EDTA solution | Thermo Fisher Scientific | #25300054 | |
| 100 mM L-glutamine (×100 stock) | Thermo Fisher Scientific | #25030081 | Preparing small aliquots of 250-750 µL and store at -30 °C. |
| 100 mM Sodium pyruvate (×100 stock) | Thermo Fisher Scientific | #11360070 | Aliquots (10 mL) can be stored at -20 °C. After thawing, the solution can be maintained at 4 °C for 2 months. |
| 12-Well multiwell culture plates with low-evaporation lid | Falcon | #353043 | Low-evaporation lid is critical for culturing neuron-glia mixed culture. For cell line cells, alternative culture dishes can be used. |
| 18 mm diameter circular coverslips | Karl Hecht "Assistent" | #41001118 | Thickness 1, 18 mm diameter circular coverslips; alternative coverslips can be used. |
| 1 M HEPES | Thermo Fisher Scientific | #15630080 | pH 7.2-7.6 |
| 2.5% Trypsin stock solution (×20 stock) | Sigma-Aldrich | #T4674 | Prepare 150 µL aliquot and store at -30 °C. |
| 50% Poly(ethyleneimine) (PEI) solution | Sigma-Aldrich | #P3143 | Prepare 2% (V/V) PEI stock solution (×50) with distilled water sterilized by filtration. Store stock solution at -30 °C after preparing small aliquots of 250-750 µL. Prepare 0.04% PEI solution with distilled water on the day of coverslip coating. |
| 70% Ethanol | Kept in a spray bottle to be used for surface disinfection. | ||
| Adeno-associated virus (AAV) for Lck-GCaMP6f, Lck-RCaMP2, and OER-RCaMP2 expression under the direction of the EF1a promoter | AAV can be prepared using AAV Helper Free System (Agilent Technologies) and HEK293 cells, or alternative methods. pAAV.EF1a.Lck-GCaMP6f, pAAV.EF1a.Lck-RCaMP2, and pAAV.EF1a.OER-GCaMP6f are available upon request. | ||
| B-27 supplement (×50 stock) | Thermo Fisher Scientific | #17504044 | This can be replaced by B-27 plus supplement (Thermo Fisher Scientific; #A3582801) or MACS NeuroBrew-21 (Miltenyi Biotec, Bergisch Gladbach, Germany; #130-093-566). |
| B57BL/6 | Japan SLC, Inc. | ||
| Camera for microscopic image recording | The following cameras were available for use: cooled-CCD camera (e.g., Hamamatsu Photonics, OECA-ER), EM-CCD camera (e.g., Hamamatsu Photonics, ImagEM; Andor, iXon) or CMOS camera (e.g., Hamamatsu Photonics ORCA-Flash4.0) | ||
| Cell freezing container | Sarstedt K.K. | #95.64.253 | Alternative cell freezing container can be used. |
| Cell strainer | Falcon | #352350 | |
| CO2 incubator | Maintain at 37 °C, 5% CO2. | ||
| Cryogenic tube | Corning | #430661 | Alternative cryogenic tubes can be used. |
| Cryopreservation medium | Zenoaq | "CELLBANKER1" | |
| Culture medium (for HeLa cells) | Dulbecco's modified Eagle's medium (DMEM) supplemented with 10% heat-inactivated fetal bovine serum, and penicillin-streptomycin solution (final concentration: Penicillin 100 U/mL and Streptomycin 100 µg/mL) | ||
| Dissection medium | One milliliter of 1 M HEPES (final concentration 20 mM) to 49 mL DMEM | ||
| DMEM | Nacalai | #08456-65 | Alternative DMEM can be used. |
| DMEM | Nacalai | #08456-65 | Low glucose |
| DNA transfection reagent | Sigma-Aldrich | #6366244001 | "X-tremegene HP DNA transfection reagent" Alternative transfection reagents can be used. |
| Glass jar with a lid | 500 mL jar (for mouse) or 1,500 mL jar (for rat) to anesthetize the animal | ||
| HBSS | Thermo Fisher Scientific | #14170161 | HBSS free of calcium and magnesium |
| Heat inactivated bovine serum | Thermo Fisher Scientific | #10100147 | |
| HeLa cells | RIKEN BioResource Center | #RCB0007 | |
| Histamine | Sigma-Aldrich | #H7125 | |
| Image analysis software | Such as Metamorph (Molecular Devices), ImageJ (NIH), and TI Workbench14 (custom made) | ||
| Image splitting optics | Hamamatsu Photonics | #A12801-01 | W-view GEMINI |
| Image splitting optics dichroic mirror | Semrock | #FF560-FDi01-25×36 | For separation of green fluorescent protein/red fluorescent protein (GFP/RFP) signal |
| Image splitting optics emission filters | Semrock | #FF01-512/25-25, #FF01-630/92-25 | For emission of GFP/RFP signal, respectively |
| Imaging medium and buffer | Use optimal medium or buffer for the experiment. When medium is used, medium without phenol red is desirable to reduce background fluorescence. Add 20 mM HEPES to maintain pH outside of CO2 incubator. | ||
| Incubation saline | Add 1 mL of 1 M HEPES (20 mM) to 49 mL HBSS | ||
| Inverted fluorescence microscope | Such as IX73 (Olympus) or Eclipse TI (Nikon Instech) | ||
| Isoflurane | Pfizer | Used for anesthesia | |
| Maintenance medium (for 4 × 12 well dishes) | 48.5 mL Neurobasal-A medium supplemented with 1 mL B-27, 500 µL of L-glutamine stock and 25 µL Penicillin-Streptomycin solution. | ||
| Maintenance medium for frozen cortical cells (for 1 × 12 well dishes) | 12.2 mL Neurobasal plus medium supplemented with 250 µL B-27, 125 µL of L-glutamine stock and 6.2 µL Penicillin-Streptomycin solution. | ||
| MEM (Minimum Essential Medium) | Thermo Fisher Scientific | #11090-081 | |
| Microscope filter set for GCaMP6f imaging | Appropriate filter for GFP (excitation, 480 ± 10 nm; emission, 530 ± 20 nm) | ||
| Microscope filter set for RCaMP2 imaging | Appropriate filter for RFP (excitation, 535 ± 50 nm; emission, 590 nm long pass) | ||
| Microscope filter sets for double imaging of RCaMP2 and GCaMP6f | Semrock | #FF01-468/553-25, #FF493/574-FDi01-25×36, #FF01-512/630-25 | Dual excitation filter, Dual dichroic mirror, and emission filter for GFP/RFP imaging. |
| Microscope heating system | A heating system to maintain cells at 37 °C during the imaging. To avoid drift caused by thermal expansion, heating systems covering the entire microscope itself (e.g., Tokai Hit, Thermobox) are recommended. | ||
| Microscope light source for excitation | Mercury lamp (100 W), xenon lamp (75 W), Light-emitting diode (LED) illumination system (e.g., CoolLED Ltd., precisExcite; Thorlabs Inc., 4-Wavelength LED Source; Lumencor, SPECTRA X light engine). In case of mercury lump and xenon lamp, use ND filter to reduce the excitation intensity. | ||
| Microscope objective lens | Plan-Apochromat oil immersion objective with numerical aperture higher than 1.3 is highly recommended for the recording of spontaneous Ca2+ activity in neurons and astrocytes. | ||
| Neurobasal plus medium | Thermo Fisher Scientific | #A3582901 | |
| Neurobasal-A Medium | Thermo Fisher Scientific | #10888022 | Neurobasal plus medium (Thermo Fisher, A3582901) can be used instead of Neurobasal-A medium. |
| PBS(-): Phosphate-buffered saline free of Ca2+ and Mg2+ | Fujifilm Wako Pure Chemical Cooperation | #164-23551 | The absence of Ca2+ and Mg2+ is critical not to inhibit the trypsin activity. An alternative to PBS(-) can be used. |
| PC and image acquisition software | Such as Metamorph (Molecular Devices); Micromanager; TI Workbench14. | ||
| Penicillin-Streptomycin solution | Thermo Fisher Scientific | #15140122 | Penicillin 10,000 U/mL and Streptomycin 10,000 µg/mL |
| Plasmid for Lck-GCaMP6f, Lck-RCaMP2, and OER-RCaMP2 expression under cytomegalovirus promoter 7-9 | Available upon request | ||
| Plating medium (for 4 × 12 well dishes) | 48 mL MEM supplemented with 1 mL B-27 supplement, 500 µL L-glutamine stock (final concentration: 2 mM), 500 µL of sodium pyruvate stock (1 mM) and 25 µL Penicillin-Streptomycin solution (penicillin 5 U/mL, streptomycin 5 µg/mL). This concentration of Penicillin-Streptomycin, which is 1/20 of the concentration recommended by the manufacturer, is critical for neuronal survival. | ||
| Recording chamber | Elveflow | Ludin Chamber | This recording chamber is for 18 mm diameter round coverslips. |
| Reduced serum media | Thermo Fisher | #11058021 | Opti-MEM |
| Stereomicroscope | Used to dissect hippocampi. Olympus SZ60 or equivalent stereomicroscopes are available. | ||
| Surgical instruments | Standard dissecting scissors to cut the abdomen of a mouse or a rat, tweezers to pinch the uterus, delicate dissecting scissors to cut the uterus and the head of embryo, ring forceps to pinch the embryos, 13 cm curved Semken forceps (Fine Science Tools #11009-13) to extract brains, 3 forceps with fine tips (Dumont Inox #5) | ||
| Transfection reagent for neuron | Thermo Fisher Scientific | #L3000008 | "Lipofectamine 3000" reagent. It is composed of the the "supplement (P3000)" that should be mixed with plasmid DNA in the step 2.2.3, and the "transfection reagent (lipofectamine 3000)" used in the step 2.2.4. |
| Trypan blue (0.4%) | Thermo Fisher Scientific | #15250061 | |
| Wash medium for frozen cortical cells | 25 mL DMEM, supplemented with 250 µL heat-inactivated fetal bovine serum + 12.5 µL Penicillin Streptomycin. | ||
| Wistar rats | Japan SLC, Inc | Pregnant rats (E18) |
参考文献
- Clapham, D. E. Calcium signaling. Cell. 131 (6), 1047-1058 (2007).
- Bagur, R., Hajnoczky, G. Intracellular Ca(2+) Sensing: Its Role in Calcium Homeostasis and Signaling. Molecular Cell. 66 (6), 780-788 (2017).
- Bannai, H., et al. Bidirectional Control of Synaptic GABAAR Clustering by Glutamate and Calcium. Cell Reports. 13 (12), 2768-2780 (2015).
- Tojima, T., Hines, J. H., Henley, J. R., Kamiguchi, H. Second messengers and membrane trafficking direct and organize growth cone steering. Nature Reviews Neuroscience. 12 (4), 191-203 (2011).
- Shigetomi, E., Kracun, S., Sofroniew, M. V., Khakh, B. S. A genetically targeted optical sensor to monitor calcium signals in astrocyte processes. Nature Neuroscience. 13 (6), 759-766 (2010).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Niwa, F., et al. Dissection of local Ca(2+) signals inside cytosol by ER-targeted Ca(2+) indicator. Biochemical and Biophysical Research Communications. 479 (1), 67-73 (2016).
- Vervliet, T., et al. Basal ryanodine receptor activity suppresses autophagic flux. Biochemical Pharmacology. 132, 133-142 (2017).
- Sakuragi, S., Niwa, F., Oda, Y., Mikoshiba, K., Bannai, H. Astroglial Ca2+ signaling is generated by the coordination of IP3R and store-operated Ca2+ channels. Biochemical and Biophysical Research Communications. 486 (4), 879-885 (2017).
- Inoue, M., et al. Rational design of a high-affinity, fast, red calcium indicator R-CaMP2. Nature Methods. 12 (1), 64-70 (2015).
- Quasthoff, K., et al. Freshly frozen E18 rat cortical cells can generate functional neural networks after standard cryopreservation and thawing procedures. Cytotechnology. 67 (3), 419-426 (2015).
- Boehringer, R., et al. Chronic Loss of CA2 Transmission Leads to Hippocampal Hyperexcitability. Neuron. 94 (3), 642-655 (2017).
- Arizono, M., et al. Receptor-selective diffusion barrier enhances sensitivity of astrocytic processes to metabotropic glutamate receptor stimulation. Science Signaling. 5 (218), ra27 (2012).
- Kanemaru, K., et al. In vivo visualization of subtle, transient, and local activity of astrocytes using an ultrasensitive Ca(2+) indicator. Cell Reports. 8 (1), 311-318 (2014).
- Inoue, T. TI Workbench, an integrated software package for electrophysiology and imaging. Microscopy (Oxford, UK). 67 (3), 129-143 (2018).
- Miyamoto, A., Bannai, H., Michikawa, T., Mikoshiba, K. Optimal microscopic systems for long-term imaging of intracellular calcium using a ratiometric genetically-encoded calcium indicator. Biochemical and Biophysical Research Communications. 434 (2), 252-257 (2013).
- Srinivasan, R., et al. New Transgenic Mouse Lines for Selectively Targeting Astrocytes and Studying Calcium Signals in Astrocyte Processes In Situ and In Vivo. Neuron. 92 (6), 1181-1195 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved