Method Article
生きたマウスにおける後部海馬CA1の縦方向2光子イメージング
要約
この方法は、生きているマウスの海馬への光学的アクセスを可能にする慢性的な調製を記述する。この調製は、数週間の期間にわたって神経構造可塑性および活性誘発細胞可塑性の縦方向光学イメージングを行うために使用することができる。
要約
2光子顕微鏡は、細胞下からネットワークレベルに至るまでの空間スケールで生きた動物の脳の調査を可能にし、ミリ秒から数週間の時間的スケールで生きている動物の脳の調査を可能にする神経科学の基本的なツールです。さらに、2光子イメージングは、脳機能と行動の因果関係を探索するために、様々な行動タスクと組み合わせることができます。しかし、哺乳類では、光の浸透と散乱が限られているため、主に表面的な脳領域に対する2光子のインビタルイメージングが制限され、海馬などの深脳領域の縦方向の調査が妨げられています。海馬は、空間ナビゲーションとエピソード記憶に関与し、健康と病気の両方で、学習とリコールのために重要な細胞だけでなく、認知プロセスを研究するために使用される長年のモデルです。ここで、生きているマウスにおける後部海馬への慢性的な光学アクセスを可能にする調製方法について詳しく説明する。この調製は、頭部固定における細胞および細胞内分解能における2光子光学イメージングと組み合わせることができ、数週間にわたって生きたマウスを麻酔した。これらの技術は、後部海馬CA1のニューロンの数十から数百のニューロンでニューロン構造または活性誘発可塑性の繰り返しイメージングを可能にします。さらに、この慢性的な調製物は、微小内視鏡検査、ヘッドマウントワイドフィールド顕微鏡、3フォトン顕微鏡などの他の技術と組み合わせて使用することができ、したがって、関与する細胞およびネットワークプロセスを研究するためにツールボックスを大幅に拡大学習と記憶の中で。
概要
哺乳類では、海馬はエピソード記憶の符号化とリコール、ならびに空間ナビゲーション1、2、3、4のための主要な脳領域である。このため、海馬は、脳が記憶5、6、7をエンコードして記憶を呼び出したり、環境8をナビゲートすることを可能にする基本的なメカニズムを研究するための非常に重要なモデルです。 、9報酬を収集し、危険を回避します。さらに、海馬形成は、げっ歯類10、11、およびおそらくヒト12、13の生涯を通じて新しいニューロンが生成される脳領域の一つである。最後に、海馬形成の変性または障害は、アルツハイマー病14を含む神経学的および精神疾患に関連している。
マウスでは、海馬は脳表面15の約1mm下に位置する。その位置は、無傷の脳内の光学アクセスを妨げ、その結果、海馬ダイナミクスの縦方向の研究は、主に磁気共鳴(MR)イメージング、電気生理学、およびex vivoイメージング分析に依存してきました。MRイメージング法は、同じ動物における生物学的プロセス(例えば、遺伝子発現変化16)を複数日にわたって追跡することを可能にするが、単一ニューロンを判別する空間分解能を欠いている。生体内電気生理学的技術の古典的なは、膜電位の変化に非常に高い時間分解能と絶妙な感度を提供します。しかし、空間分解能は限られており、長期間にわたって同じセルを確実に追跡する能力がありません。光学イメージングは、その高い時間的および空間的分解能のおかげで、より多様なプロセスを研究することができます。しかし、ex vivoイメージングは進行中のプロセスのスナップショットのみを提供するため、動物が情報を学習してリコールする縦方向の研究には適していません。
インビボ光学イメージングは、MRイメージングと電気生理学のいくつかの利点と光学イメージングの利点を兼ね備えています。したがって、マウスの脳のダイナミクスと行動の縦方向および相関解析に非常に適しています。これは、非常に速い(ミリ秒から秒)または非常に遅い(数日から数週間)時間スケールを持つ生物学的プロセスの研究に関連しています。神経科学に関連するそのようなプロセスの例は、膜電圧ダイナミクス、Ca2+過渡、細胞可塑性および構造変化であり、これらはすべて記憶形成およびリコールにとって非常に重要であると考えられている。異なる方法は、後部海馬18、19、20、21、22に生体内イメージングで拡張されています。急性製剤は、ピラミッド型ニューロン(PN)活性ならびにその樹状突起および樹状脊椎の追跡を数時間20、22時間可能にした。しかし、この時間的な時間枠では、段階的な学習の根本にある長期的な構造変化を研究することはできません。慢性的な製剤 - マイクロ内視鏡23、24または長い作業距離(WD)標準顕微鏡目標21との組み合わせで- いくつかの上の後部海馬の繰り返しイメージングを可能にしました週間。
ここでは、永久に挿入されたイメージングカニューレを用いて生きているマウスの後部海馬のCA1サブフィールドへの再発光学アクセスを提供する慢性的な製剤について説明する。この準備は機能的妨害なしでCA1への繰り返しアクセスを可能にし、生命体の2光子(2P)または広視野のエピ蛍光イメージングのために適している。生きたマウスの背部CA1における2P深部脳慢性イメージングの2つの例は、樹状構造の縦方向イメージングと樹状脊椎ダイナミクスおよび活性誘発可塑性の縦方向イメージングである。この手法の顕著な利点と制限について説明します。
プロトコル
記載されているすべての方法は、アッパーバイエルン州政府(ライセンス2016_ROB-55.2Vet-2532.Vet_02-16-48)とスタンフォードとマックスプランクフロリダ研究所の実験室動物ケアに関する神経科学行政パネルによって承認されています。
1. イメージングカニューレの調製
- 可動定規テーブルに付属のドリルスタンドに精密ドリルを保持します。
- 3.0 mm の直径のステンレス鋼チューブを可動定規テーブルにクランプします。
- チューブを長さ1.6mmの金属リングに切り取る。切断後にリングの端が鈍くない場合は、凹凸をファイルします。
- 金属リングと円形の4mm径ガラスカバーを100%アセトンですすり、5分間乾燥させます。
- 金属リングとガラスカバーをステレオスコープの下の滑らかで均一で清潔な作業場所に置きます。
- ペトリ皿などの滑らかな表面にUV硬化光学接着剤の滴を置きます。針またはへらを使用して接着剤を広げるのは、薄い(<0.5 mm)層を形成します。
- 金属リングの片側を接着剤に浸すには鉗子を使用します。リングの内側を密封しないように特に注意してください。この場合は、針を使用してリングの光学接着剤を壊します。
- ステレオスコープを使用して、ガラスカバーの中央に金属リングを配置し、カバースリップに触れる接着剤で覆われたリングの側面にスリップします。接着剤の薄いリングは、金属リングとカバースリップの間の界面で形成する必要があります。カバースリップの中心に接着剤が広がらないようにしてください。
- UV硬化LEDドライバユニットの電源を入れ、光光(365nm)を1分間点灯します。
注意:紫外線は皮膚の火傷を引き起こし、変異型の薬剤である。紫外線を防ぐメガネを着用し、手袋とラボコートで手や腕を覆い、皮膚への露出を避けます。 - 接着剤を均等に硬化させるには、光源の方向を変更してリングのすべての側面が均等に照らされていることを確認します。
- 接着剤を少なくとも2時間、好ましくは一晩硬化させます。
- 金属リングの開いた端からカニューレをヘモスタットでしっかりと保持します。回転ファイルを取り付け、ステレオスコープの下で作業する歯科用ドリルを使用して、リングの側面と同じになるまで余分なガラスカバースリップをオフにファイルします(図1A)。
2. 後部海馬上のイメージングカニューレの移植
- 設備の準備とセットアップ
- すべての外科用器具が清潔で無菌であることを確認してください。殺菌にガラスビーズ殺菌器を使用する場合は、器具をきれいにし、使用前に10分間殺菌器(250°Cに設定)に入れます。または、使用前に機器をオートクレーブします。
- 手術に必要なすべての材料と手術器具を準備し、容易に到達できるようにします。
- 鎮痛剤や抗炎症薬などの十分な新しく調理された薬があることを確認してください。
- 手術の全期間(手術につき約1時間)に十分なイソファランがあることを確認してください。
- 加熱カーペットの電源を入れ、麻酔下で動物の温度を安定させるために37°Cに設定します。
- イソファランの清掃システムが機能していることを確認します。
- 酸素の流れの弁を開く。
- 麻酔誘導と動物固定
- マウスを麻酔誘導室に3%のイソファルランを1L/min O2に入れ、意識を失うまで待ちます。つま先ピンチ反射試験を用いて麻酔を評価する。
- 動物の体重を量る。
- 抗炎症剤(メロキシカム、1mg/Kg)および疼痛キラー(ベタルギン、200mg/kg)薬を皮下に塗布する。
- 暖房カーペットの上にマウスを置きます。熱火傷を避けるために、動物が暖房カーペットと直接接触していないことを確認してください。
- 頭部を立体装置に固定し、鼻を覆うノーズコーンを置きます。麻酔を維持するために、イソファルランを1.5-2%に減少させる。手術を通して、呼吸を視覚的に監視し、つま先のピンチ反射をテストすることによって、マウスの状態を監視します。必要に応じてイソファランのパーセンテージを調整します。
- 脱水症状や潜在的な失明を防ぐために、眼科のチントを目に当ててください。
注:麻酔や動物の薬のために、代替方法と薬物が可能です。動物免許と相対文献をご参照ください。
- 光学カニューレ注入
- 光ファイバ光源をオンにします。
- 毛を取り除き、マウスの頭の上に皮膚を消毒します。
- はさみと鉗子を使用して、マウスの頭皮を取り除きます。ラムダに近い位置に頭皮に小さなカットを行うことによって開始します。両側に頭皮を開いて続けます。まず耳の方向に横方向に移動し、次いで、眼窩の方向に、矢状軸上に三角形を形成し、約4mmのrostralをブレグマにする。耳や目に近づきすぎないように注意してくださいが、ブレグマとラムダ、頭蓋骨と前頭骨の後半分を露出します。
- 頭蓋骨にリドカイン1滴(アルコール中28.9%v/v)を塗布する。
- 骨膜を取り除き、綿棒を使って頭蓋骨を乾かします。
- イヤーバーを置き、マウスヘッドを固定します。
- 0.5 mm 幅のバリを持つマイクロドリルを使用して、小さな開頭術を行います。画像化された海馬の反対側の前頭骨に穴を開け、矢状縫合糸から約1.5mm、冠状縫合糸から2mm離れた位置に配置します。
- 幅 0.86 mm のステンレス鋼の骨ねじを頭蓋骨の穴にねじ込みます。
- 必要に応じて、破片をきれいにし、頭蓋骨を乾燥させます。
- 迅速な接着剤セメントの混合物の調製
- 小さなスプーン(直径4.5mm)を使用して、L粉末の1-1.5レベルのスクープを混合によく分配します。
- クイックベースの3-4滴を井戸に分配します。
- ユニバーサル触媒を1滴の井戸に分配します。
- 精密アプリケーターを使用して5-10sのミックスをかき混ぜます。
注:代替セメントが利用可能です。製造元の指示を参照してください。
- 精密アプリケーターを使用して、頭蓋骨、ネジ、周囲の皮膚の上に迅速な接着剤セメントを適用します。30~1分間乾燥させます。
- 直径3.0mmのトレフィンドリルを使用して、頭頂部骨に開頭術を施します。矢状縫合糸から約1.5mm離れた穴と、ラムドイド縫合糸から2mm離れた穴を配置します。
- 骨のフラップを慎重に取り外します。
- カニューレを使用して開頭術のサイズを確認し、それが適合することを確認します。必要に応じて、0.5 mm または 0.9 mm 幅のマイクロドリルを使用して、頭蓋を拡大します。
- デュモン鉗子を使用して髄膜を取り除く。
- 皮質物質をアブレートし、外部カプセルに到達する。真空ポンプに接続された直径0.9mm(19ゲージ)の鈍い針を使用します。露出した組織の脱水を避け、出血が解決した後に残留血液を洗い流すために生理食生理食を用いて灌漑する。皮質組織をゆっくりと吸引し、一度に≥50〜100μm、皮質がカプセルから切り離されるまで、皮質またはコーパスカロスムの繊維を露出させる。目詰まりを防ぐために、針を頻繁に交換してください。
- 繊維は主に3方向に伸びる(図1B)。最も深い繊維(海馬の静脈)が露出するまで、背面繊維を慎重に剥離します。
- 生理生理生理で組織をすすいで下す。薄い鉗子を使用して、底のカニューレを生理生理生理に浸し、頭蓋骨の穴の上に置きます。カニューレと組織は、カニューレと組織の間の気泡を捕捉しないように生理食生によって密封されなければならない。
- ガラスカバースリップが繊維に接触するまで、カニューレを頭蓋骨(図1C)に押し込みます。
- 吸収三角形、綿棒および/または真空ポンプを使用して頭蓋骨をよく乾燥させます。
- 迅速な接着剤セメントの混合物の調製(手順 2.3.10 を参照してください)。
- 頭蓋骨の上に迅速な接着剤セメントを適用するために精密アプリケータを使用してください。カニューレの縁にも接着剤を塗布します。接着剤がカニューレに流れ込まないよう注意してください。30~1分間乾燥させます。
- ステレオタックスアームを使用して、頭蓋骨に接触してカニューレの上にヘッドホルダープレートを配置します。
- 歯科アクリルの混合物の調製
- スプーン(直径9mm)を使用して、粉末の1レベルスクープ(1部)をよく混合します。
- 同じ井戸に液体の2-3部分を分配します。粉末全体を液体で覆います。
- へらを使って1分間かき混ぜる。
注:代替アクリルが利用可能です。製造元の指示を参照してください。
- 頭蓋骨全体にアクリルを適用するには、へらや精密アプリケーターを使用してください。露出した頭蓋骨、ネジ、開いている皮膚全体を歯科用アクリルで覆います。これにより、準備が安定します。アクリルは、首、耳、目を実行させないようにしてください。
- アクリルを乾燥させ、約15分間硬化させます。
- 取り外し可能な粘着フィルムをヘッドホルダープレートに貼り付け、破片がカニューレに入るのを防ぎます。フィルムサイズはプレートのサイズと一致することをお勧めします。
- イソフランの流れをオフにし、定位装置から動物を取り除き、麻酔から目を覚ます間、生理体温を維持するために加熱板の上に置きます。
- それは胸骨の回復を維持するために十分な意識を取り戻すまで、動物を監視します。
- 完全に回復した場合にのみ、他の動物の会社に手術を受けた動物を返却してください。
3. 術後ケア
- 体重と一般的な行動を監視することにより、手術後2日間のマウスの状態を確認します。
- 抗炎症剤(メロキシカム、1mg/Kg)および疼痛キラー(Vetalgin、200mg/kg)を手術後2日間皮下に塗布する
注:代替モニタリング手順、薬物および投与量は術後ケアのために可能である。動物免許と相対文献をご参照ください。
4. イメージングセッションの準備
- 事前にイメージング設定をオンにし、必要に応じてレーザーをウォームアップして安定させましょう。
- マウスを麻酔する(ステップ2.2.1を参照)。
- 鉗子を使用して、ヘッドホルダープレートから粘着フィルムを慎重に取り外します。マウスを手に持ち、ヘッドホルダープレートを指で持ちます。フィルムを穏やかに取り外し、調製を損なうことを避ける。
- 顕微鏡の下にマウスを置き、加熱カーペットの上に置き、ヘッドプレートをホルダー(図1D)に固定します。
- 鼻を覆う鼻を覆うノーズコーンを置き、イソファランを1.5-2%に減らす。
- マウスの目に眼科のチントを適用します。
- 脱イオン水で洗い流してイメージングカニューレをきれいにします。注射器と細い針を使用してカニューレと真空ポンプに水を落とし、それを取り除きます。
5. イメージングセッション
- 低倍率、長時間の作業距離の目標を使用して、カニューレの残留水、汚れ、完全性、蛍光の有無を視覚的に確認します。
- ヘッドホルダーアームの角度を調整して、カニューレを視視軸に合わせます。
- 25X 1.0 NA、4 mm WD または 40X 0.8 NA、3 mm WD、水浸しの目的に切り替えます。カニューレを満たし、カニューレの上に余分な水を維持するのに十分な脱イオン水を追加します。気泡の形成を避けてください。
- 2P励起信号と画像蛍光信号を使用します。
注: イメージング プロトコルは、イメージ化する時間と空間スケールに大きく依存します。この記事に示すイメージの作成に使用したイメージング設定の詳細については、代表的な結果と説明を参照してください。
結果
カニューレはCA1に背部だけ置かれるので、CA1の背部の側面は、腹部のものと比較した場合、顕微鏡に近位である。静脈は、最も近位構造であり、層オリエンス(SO)、層ピラミッド(SP)、層ラジエーテル(SR)および層ラクノサム分子(SLM)、最も遠位層(図1B) 、C)。細胞内分解能を有する神経構造の縦2Pイメージングと細胞分解能を有する活性誘発可塑性を代表的な結果として提示する。蛍光色素の緑色蛍光タンパク質(GFP)、d2VenusおよびTurboFP635を励起するために、フェムト秒パルスTi:サファイアレーザーを920nmに調整し、サンプルで平均レーザーパワーを5〜25mWに調整します。異なる発光波長は、発光フィルタと異なる光増数管を使用して分離されます。
樹状構造および樹状脊椎ダイナミクスの縦方向イメージング。
海馬PNをまばらに標識し、その構造を可視化するために、Thy1-GFPトランスジェニックマウスライン(Mライン)を使用する。Thy1-GFPマウスは、PN25のまばらでランダムな集団におけるThy1プロモーターの制御下で細胞質増強GFPを発現する。 一般に、CA1 PN の主軸は XY イメージング平面とほぼ垂直です (図 1B、図 2A、補足ムービー1)。基礎デンドライトはSOで、ソマからカニューレに向かって伸びるのに対し、頂点と頂点のタフトデンドライトはカニューレに遠く及び、反対方向に広がる(補足ムービー1)。製剤は、静脈の最も深い繊維をそのまま残すので、カニューレのすぐ下にある視野を横断するいくつかの蛍光繊維が、目に見えるはずである(図2Aおよび図1)。調製により、脊椎分解能を持つPNデンドライトのイメージングが可能になります(図2 A-C)。画像デンドライトおよび樹状脊椎には、25X 1.0 NA、4 mm WD、水浸漬商業用対物レンズが使用される。
縦方向追跡のために、カニューレの視野内のいくつかの脳領域は、最初のイメージングセッション中に定義される。各領域は、約 240 x 240 μm の面積に対応し、1 ~ 7 の樹状セグメントを含みます (図 2B)。これらの領域は、イメージングカニューレの下の体積におけるGFP発現のパターンを示す低倍率の3次元スタックに手動でマッピングされる(図2A)。次に、CA1 PN基底デンドライトの1μm zステップ画像スタックが、約14日間(図2C)までの異なる時間間隔(24時間〜3日)で取得される。より長いイメージング期間および間隔は可能である26.各イメージングセッションは約60~90分です。ほとんどの画像はSOでは樹状脊椎であるが、SRの斜めの樹脊椎(図2D-F)で樹状脊椎を画像化することも可能である。脊椎密度に加えて、この方法は、生存、利得および損失率26、27、28、29、30を定量化することにより、脊椎ダイナミクスの研究を可能にする。31歳,32. 樹状脊椎をスコア付けして追跡するには (図 2C)、カスタム MATLAB インターフェイスが使用されます。これにより、異なる時点で取得された画像スタックの位置合わせが可能になり、樹状の長さと脊椎位置を時間26で追跡しながら、デンドライトと脊椎の手動ラベリングをサポートします。重要なのは、この方法を使用して、既存の樹状脊椎と新生児の樹状脊椎を区別するために(最初のものを除く)。.樹状脊椎の異なるクラスは、メモリの取得と保持33で異なる役割を持っていると考えられているので、これは重要です。
活性誘発可塑性の縦方向イメージング.
CA1 PNにおける画像活性誘発可塑性を、円弧内のシナプス活性応答性素子(E-SARE)の増強形態を介して緑色蛍光不安定化d2Venusを発現するウイルスベクターを注入する。ePGKプロモーター34を介してエンハンサー/プロモーターおよび赤色蛍光TurboFP635。これにより、各動物35における数百のCA1 PNの活性誘発可塑性のイメージングレベルを可能にする。PNの非常に密な標識を考えると、一般にCA1 PNのデンドライトを解決することは不可能です(補足ムービー2)。
CA1 PNのソマタを画像化するために、40X 0.8 NA、3mm WD、水浸漬対物レンズを使用する。縦方向の追跡では、最初のイメージングセッション中にマウスごとに1~9の脳領域が定義されます。 各領域は約 300 x 300 μm の領域に対応し、50 ~ 150 セルが含まれています (図 3A)。これらの領域は、低倍率で表示される局所組織のランドマークに手動でマッピングされます。次いで、3μm zステップ画像スタックが取得され、CA1 PNのSP(図3Aおよび補足ムービー2)を、最大約30日間(24時間から6日間)の異なる時間間隔で包含する。各イメージングセッションは、新しい環境または濃縮環境(EE、図3B)にさらされ、数日の間に崩壊した後、約6〜90分続きます。したがって、我々は一般的に経験後6〜8時間を画像化し、イメージングセッション35の間に5日間を可能にする。
d2VenusおよびTurboFP635蛍光値を定量化するために、細胞ソマを中心とした神経細胞体よりも小さい直径4.64μmの円形領域が描かれます。次に、次の時点に進み、同じセルの相馬を同じ方法でスコア付けし、縦方向データセット内のすべての時点およびすべての可視セルに対してこの手順を反復化します。各ニューロン(活性依存)d2Venus放出の平均値は、その平均(活性非依存)TurboFP635放出によって正規化される。この方法は、CA1 PN35(図3C)のアンサンブル可塑性の長期ダイナミクスの調査を可能にする。
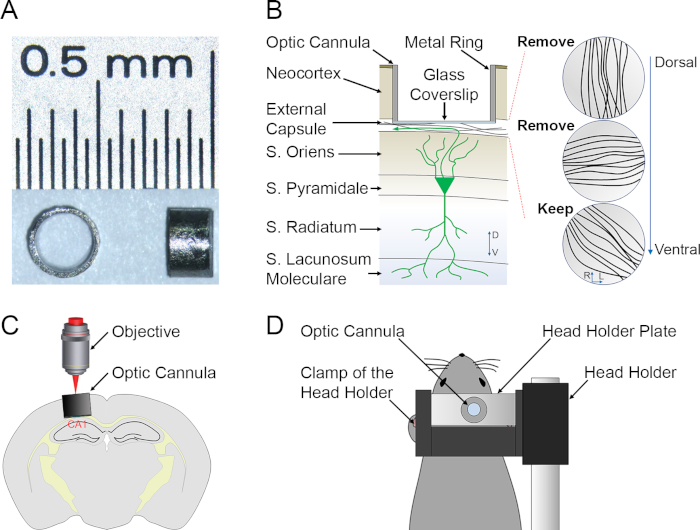
図1:生体内深層脳光学イメージングの準備(A) 上(左)と側面(右)の図をイメージ化します。イメージングカニューレは海馬への光学アクセスを可能にするために透明なガラス底を備えています。(B)撮像カニューレの相対位置を強調する調製物の概略的記述は、CA1 PNおよび背部から腹部までの繊維の3層である。(C, D)イメージングセッション中のイメージングセットアップ(C)および動物固定(D)の概略的記述。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 2:樹状構造および樹状脊椎ダイナミクスの縦方向イメージング。(A)2P画像スタック(最大強度投影(MIP)59の画像平面、2μm z間隔)のニューロンおよびデンドライトは、ライブThy1-GFPマウスでGFPによって標識された。(B) 高倍率(53の画像面のMIP、1 μm z間隔)は、SOに位置する基底デンドライトを詳細にする。(C)14日間にわたって画像化された樹状セグメントのタイムラプス画像シーケンス。矢印は、14日間にわたって追跡された樹状脊椎を示します。(D, E)ライブThy1-GFPマウスでGFPによって標識されたニューロンとデンドライトの2P画像スタック;(D) ZY 投影 (31 イメージプレーン、3 μm Z 間隔) および (E) XY 投影 (17 イメージプレーン、3 μm Z 間隔)(F)SR.アローヘッドに位置する頂点樹線および樹状脊椎を詳細にする高倍率(単一画像平面)は樹状脊椎を示す。励起:920 nm;放出ピーク:510 nm。スケールバー: A, 50 μm;B, 10 μm;C, 2 μm;D と E, 15 μm;F, 4 μm.この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 3:活性誘発可塑性の縦方向イメージング。(A) ライブマウスからの2P画像(単一画像)で、ベースライン日0と1日目のEE後に同じセルを示す。 (B) 2P 画像スタック(4-6 画像平面の MIP、3 μm z 間隔)は、環境 A (1 日目、19 日目、25 日目) および環境 B (7 日目および 13 日目) に固有の E-SARE 活性化パターンを示す。緑:d2金星蛍光。赤:ターボFP635蛍光。励起:920 nm;d2ヴィーナス発光ピーク:530 nm;ターボFP635発光ピーク:635nm。スケールバー: A, 20 μm;B, 10 μmこの数字は、Attardo et al., 201835から変更されています。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 4:3光子(3P)顕微鏡を用いて海馬DGにおける神経構造のイメージング(A-H)。CA1および(F-H)顆粒細胞におけるライブThy1-GFPマウス詳細(A-E)PNにおけるGFPによって標識されたニューロンおよびデンドライトの3P画像(単一画像平面)。励起:1400 nm;放出ピーク:510 nm。スケールバー: 40 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
補足ムービー 1: ライブ Thy1-GFP マウスでの画像化視野。カニューレの底部からSLMに伸びる生きたThy1-GFPマウスにおいて、GFP(白色)で標識されたニューロンおよびデンドライトの2P画像スタック(83画像平面、7μm Z間隔)。深さの増加に伴う蛍光信号の減衰を考慮して、光増数管のゲインの非線形グラデーションを使用しました。このファイルをダウンロードするには、ここをクリックしてください。
補足ムービー2:活性誘発可塑性のイメージング。SP.グリーンを包含する生マウスにおけるIEG発現のE-SAREレポーターを発現するニューロンの2P画像スタック(28画像平面、3μm z間隔):d2Venus蛍光。赤:ターボFP635蛍光。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここで、生きているマウスにおける後部CA1の2P撮像を繰り返す手順について説明する。手術後、マウスは通常2日以内に回復する。手順は、最小限のアストログリオシス26、43を誘発する。手術後に起こる出血および上皮は、通常10〜14日以内に再吸着される。一般に、移植後14日目以降の調製物は、インビタルイメージングを行うのに十分に明らかである。外科の成功は無菌の環境で働くにかかっている。しかし、手術に関連する感染症による合併症を避けるためには、高い衛生状態を維持することが重要です。これは、手術の前後に手術器具を細心の注意を払って洗浄し、各使用の直前に熱殺菌することによって得られます(ステップ2.1.1)。光学カニューレはきれいな、殺菌された容器に保たれ、注入の直前に無菌生理生理ですすいですすいだ。手の消毒と外科ステーションのクリーニングの一般的な外科的慣行を行うことも非常に重要です。調製は安定したままで、数週間26、35の細胞および細胞内分解能イメージングを可能にする。
重要な手順、変更、トラブルシューティング。
最も深い繊維が露出するまで、外部カプセルを剥離することが重要です。3-または4mm WDで商用目的を使用する場合、PNのソマに焦点を当てることができない場合や、解像度の低下画像樹状脊椎に焦点を当てることができない可能性があります。この目的のために、0.9 mmの直径の針を使用してネオコルテックスを非常にゆっくりとアブレートし、最も後部繊維を取り除くとき吸引のより細かい制御のための0.3-0.5 mmの直径(24-29ゲージ)の針に切り替えると有用である。あるいは、微細鉗子は、繊維曝露36後に残りの皮質を除去するために使用されてもよい。
手術中の出血は、血液が視界を妨げるので、問題を引き起こす可能性があります。血栓が形成され、残りの血液を洗い流すために生理生理生ですすいでお勧めします。必要に応じて繰り返します。
カニューレと開頭術の間にぴったりフィットは、特にカニューレの外縁が頭蓋骨と同じである場合は、セメントの塗布前にカニューレを所定の位置に保つことによって、調製の安定性を高めるのに役立ちます。トレフィンドリルとカニューレのサイズが一致しているため、カニューレの側面の凹凸(ステップ2.3.14を参照)または不規則な開頭術を必要とするカニューレの側面の凹凸のために緩いフィット感が生じる可能性があります。カニューレの不規則性は(ステップ1.3および1.12)オフに提出しなければならず、トレフィンは頭蓋切開が完了するまで頭蓋骨に垂直に保持されなければならない(ステップ2.3.12)。頭蓋切開術が完了する前に頭蓋骨からトレフィンを取り除くと、不規則な頭蓋切開が起こり得る。
制限事項 -調製の侵襲性および安定性。
皮質切除の効果を評価することは困難であり、直接的および間接的に影響を受ける領域を正確に定義することは困難です。一般に、手術は頭頂皮質の一部および視覚および後肢感覚皮質21の一部を取り除く。海馬に直接突出する皮質と海馬組織は触れられず、負傷もしない。重要なことに、イメージングカニューレの移植は海馬機能を大きく変えないことが示されており、特に海馬依存型学習21、36、37、38、 39.それでも、カニューレとインプラントの外部(ヘッドホルダープレートと歯科アクリルキャップ)の両方がコルチコステロン血中濃度と副腎体重を評価することによって慢性的なストレッサーであるかを定量化することが重要です。未移植マウス。
準備は一般的に週から数ヶ月26まで安定したままです.長期的には、皮膚および骨の成長は、アクリルキャップを置き換え、イメージング製剤の不安定性を増加させる傾向がある。
光学的な制限。
従来の2P顕微鏡検査は、新生物組織40、41に深さ約1mmまでのイメージングを可能にする。これと一致して、SR(図2D-F)またはSLM36に位置する樹状脊椎および樹状脊椎を画像化することができる。しかし、カニューレを介したイメージングは、有効なNAに制限をもたらす。最大解像度を達成するためには、イメージングカニューレの直径と深さは、より小さな直径と長い深さが高いNA目的の光をクリップするように、イメージングNAと一致する必要があります。例えば、1.6mmの長さのカニューレを通して1.0 NAの水浸しの目的でイメージを撮影する場合、完全なNAを維持するために3.65 mmの内径が必要です。しかし、この直径のカニューレを使用すると海馬の圧縮が増加し、組織の健康に影響を与える可能性があり、このため、我々は、より小さな直径を持つカニューレを使用します。長さ1.6mmのカニューレを通して0.8 NAの水浸漬目的でイメージングする場合、内径は2.5mmで完全なNAを維持するのに十分です。しかし、0.8 NAの水浸しの目的は、SPでの焦点を合わせるのを防ぐことができる短いWD(私たちの場合は3ミリメートル)を持っています。
これらの計算は、カニューレの下部にある視野の中心に適用されます。しかし、画像化視野をカニューレの縁に近づけるか、組織に深く焦点を合わせると、カニューレのガラス表面から遠く離れた場所に移動すると、焦点面での有効なNAがさらに低下し、解像度が低下します。これは、画像化された組織の異なる容積にわたって非均質な分解能につながり、特に2P-STED顕微鏡検査42などの超分解能技術を使用する場合、細胞内分解能での定量イメージングの懸念となりうる。これらの問題は、細胞分解能でイメージングする場合にはそれほど重要ではありません。
ティッシュモーション。
麻酔動物の呼吸と心拍に起因する組織内の運動は、イメージングカニューレからの距離が増加すると、より重篤になる傾向がある。これは、イメージングカニューレが脳に機械的圧力を加え、カニューレ付近の運動の一部を打ち消す(新生児製剤と同様に)ためである。したがって、SRおよびSLMでは樹状脊椎のイメージングが可能であるが、我々の手の中では、カニューレの表面から最大200μmまでのSOに対して最も堅牢な背部である。動きを補正するために、共振スキャナとオフライン平均を使用します。Z スタックのイメージ プレーンごとに、使用可能な最大速度 (30 フレーム/秒) で複数の画像 (4 ~ 6 回の繰り返し) が取得されます。各Z平面のすべての繰り返しは、(商用ソフトウェア、AutoQuantを使用して)デコンボルブされ、登録(ImageJを使用)、単一の画像26に平均化される。ソマタのイメージングでは、麻酔35では運動が無視されることが多く、2つの平均値が運動アーティファクトを補正するのに十分であることがよくあります。
メソッドの将来のアプリケーションまたは方向.
調製物は、マイクロ内視鏡26、43と組み合わせることができる。マイクロ内視鏡は、深部組織18との間で光を導くために勾配屈折率(GRIN)マイクロレンズを使用する剛性光学プローブです。マイクロ内視鏡の使用はより小さい直径のカニューレ、あるいは全くカニューレを可能にする。しかし、市販のマイクロ内視鏡は、光学収差に対してあまりよく補正され、商業的な目的よりもNAが低い。現在のプローブは、横および軸の解像度に達します ≥0.6-1 μm, ≥10-12 μm, それぞれ17,18,44.マイクロ内視鏡の使用はまた頭部取付けされた統合された広視野顕微鏡45、46、47とのこの準備の組合せを可能にする。
この方法は、非麻酔マウスにおいても使用するように自ら貸し出し、および覚醒ヘッド固定マウス21、37、48、49におけるCa2+センサを用いて細胞活動を調製するために使用されている。これらの場合、蛍光変化の速い時間スケールのために、ライン登録50を実施することをお勧めします。また、歯状ジャイル(DG)39、51、52などの他の海馬サブ領域の撮像のための調製物を適応させることも可能である。この調製物を3P励起53、54、1MHz周波パルスレーザーで1400nmに調整し、分子層、顆粒細胞層及び造粒細胞層及び及び1400nmに到達する海馬形成をより深く画像化することができた。オーバーレイ CA1 を取り外すことなく DG (図4) の hilus。
結論として,後部海馬への光学的アクセスを提供し,海馬の構造と活動のダイナミクスの縦方向および相関的研究を可能にする方法を提示する.この技術は、生理的および病理学的条件下での海馬機能の分析の可能性を拡張する。
開示事項
著者は何も開示していない。
謝辞
U. A. F. はシュラム財団によって支援されています。C.W. T. P. と W. G. はマックス・プランク・ソサエティによって支援されています。L.Y.とR.Y.は、マックスプランク協会と国立衛生研究所(R01MH080047、1DP1NS096787)によってサポートされています。A. C. 欧州研究評議会、ERANETおよびI-COREプログラム、イスラエル保健省のチーフサイエンティストオフィス、連邦教育省、ロベルトとレナータ・ルーマン、ブルーノとシモーネ・リッチからのFP7助成金によってサポートされています。ネラとレオン・ベノジヨ神経疾患センター、ヘンリー・チャノック・クレンター生物医学イメージング・ゲノミクス研究所、イスラエル科学財団パールマン・ファミリー、アデリス、マーク・ベセン、プラット、アーヴィング・I・モスコウィッツ財団。A. A. マックス・プランク・ソサエティ、シュラム財団、ドイツ・フォルシュンゲミンシャフト(DFG)が支援しています。3P画像は、マックスプランクフロリダ神経科学研究所の神経イメージング技術の高度なコース中に取得されました.神経イメージング技術の高度なコースは、マックスプランク協会、フロリダ州マックスプランク科学フェローシッププログラムとマックスプランクフロリダ研究所株式会社パートナーシッププログラムによってサポートされています。コース中に2P/3Pイメージングシステムのサポートと機器を提供してくださったThorlabs、コヒーレント、スペクトル物理学に感謝します。また、ヘンリー・ヘーバールとメリッサ・エバールがコース中にシステムを支援してくれたことに感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| Professional drill/grinder IBS/E | Proxxon GmbH | 28481 | Pecision drill |
| MICROMOT drill stand MB 200 | Proxxon GmbH | 28600 | Movable ruler table |
| MICRO compound table KT 70 | Proxxon GmbH | 27100 | Movable ruler table |
| Machine vice MS 4 | Proxxon GmbH | 28132 | Movable ruler table |
| Stainless steel tube Ø 3,0 x 0,25 mm (Inner Ø 2,5 mm ) L = 500 mm | Sawade | R00303 | Stainless steel tube for the cannula metal ring |
| Microscope Cover glass (4 mm round) | Engelbrecht Medizin and Labortechnik | Glass coverslips for the cannula glass | |
| Schlusselfeilensatz 6-tgl. Im Blechetui | Hoffmann Group | 713750 160 | Manual files |
| Präzisions-Nadelfeile Gesamtlänge 140 mm 4 | Hoffmann Group | 527230 4 | Manual files |
| UV-Curing Optical Adhesives | Thorlabs | NOA81 | UV-curing adhesive |
| UV Curing LED System, 365 nm | Thorlabs | CS2010 | UV-curing LED driver unit |
| Stemi 305 | Zeiss | Stereoscope | |
| Presto II | NSK-Nakanishi Germany | Z307015 | Dental drill |
| Diamantbohrer FG (5 St.), Zylinder flach, 837-014 fein | MF Dental | F837.014.FG | Files for the dental drill |
| Diamantbohrer FG (5 St.), Zylinder flach, 837-014 grob | MF Dental | G837.014.FG | Files for the dental drill |
| Graefe Forceps - Straight / Serrated | Fine Science Tools | 11050-10 | Forceps for the surgery |
| Burrs for Micro Drill | Fine Science Tools | 19008-05 | 0.5 mm width burr for the micro-drill |
| Burrs for Micro Drill | Fine Science Tools | 19008-09 | 0.9 mm width burr for the micro-drill |
| MicroMotor mit Handstück | DentaTec | MM11 | Micro-drill for the craniotomy |
| Dumont #3 Forceps | Fine Science Tools | 11231-30 | Dumont forceps for the surgery |
| Fine Scissors - ToughCut | Fine Science Tools | 14058-09 | Scissors for the surgery |
| Trephine | MW Dental | 229-020 | Trephine drill - 3.0 mm diameter; for the micro-drill |
| Stainless Steel Self-Tapping Bone Screws | Fine Science Tools | 19010-10 | 0.86 mm width bone screws |
| Stereotaxic apparatus | Kopf | Stereotaxic apparatus | |
| 3-D-Gelenkarm | Hoffmann Group | 442114 | Stereotaxic arm and plate holder |
| Aufnahme 2SM | Hoffmann Group | 442100 2SM | Stereotaxic arm and plate holder |
| Hot Bead Sterilizers | Fine Science Tools | 18000-45 | Glass beads sterilizer |
| Isofluran CP, Flasche 250 ml | Henry Schein VET GmbH | 798932 | Liquid isoflurane for anesthesia |
| Harvard Apparatus Isoflurane Funnel-Fill Vaporizer | Harvard Apparatus GmbH | 34-1040 | Isoflurane vaporizer |
| Lab Active Scavenger | Gropper Medizintechnik | UV17014 | Isoflurane scavenger system |
| Metacam 0,5% Injektionslsg. (Hund / Katze), Flasche 20 ml | Henry Schein VET GmbH | 798566 | Meloxicam, anti-inflammatory |
| Vetalgin 500 mg/ml | MSD Tiergesundheit | Vetalgin, pain killer | |
| CMA 450 Temperature Controller | Hugo Sachs Elektronik - Harvard Apparatus GmbH | 8003770 | Heating blanket |
| Bepanthen Augen- und Nasensalbe | Bayer AG | Ophtalmic ointment | |
| KL 1500 LCD | Schott | Fiber optic light source | |
| Xylocain Pumpspray | AstraZeneca GmbH | Lidocain, local anesthetic | |
| Absorption Triangles - Unmounted | Fine Science Tools | 18105-03 | Absorption triangles for the surgery |
| Parkell C&B Metabond clear powder L | Hofmeester dental | 013622 | Quick adhesive cement |
| Parkell C&B Metabond Quick Base B | Hofmeester dental | 013621 | Quick adhesive cement |
| Parkell C&B Metabond Universal Catalyst C | Hofmeester dental | 013620 | Quick adhesive cement |
| Adjustable Precision Applicator Brushes | Parkell | S379 | Precision applicators for the surgery |
| Blunt needles 0.9x23 mm | Dentina | 0441324 | Blunt needles |
| Blunt needles 0.5x42 mm | Dentina | 0452155 | Blunt needles |
| Blunt needles 0.3x23 mm | Dentina | 0553532 | Blunt needles |
| Kallocryl A/C | Speiko | 1615 | Acrylic liquid component |
| Kallocryl | Speiko | 1609 | Acrylic powder |
| Hydrofilm transparent roll | Hartmann | Adhesive film | |
| Head plates | Custom made | 30 mm x 10 mm size; 8 mm diameter hole, titanium | |
| Head plate clamp | Custom made | Head plate holder | |
| Pedestal post holders | Thorlabs | PH20E/M | Head plate holder |
| Stainless steel post | Thorlabs | TR30/M | Head plate holder |
| Stainless steel post | Thorlabs | TR75/M | Head plate holder |
| Stainless steel post | Thorlabs | TR150/M | Head plate holder |
| Post connector clamps | Custom made | Head plate holder | |
| Aluminum Breadboard, 300 mm x 450 mm x 12.7 mm, M6 Taps | Thorlabs | MB3045/M | Microscope stage |
| 7" x 4" Lab Jack | Thorlabs | L490/M | Microscope stage |
| Low profile face mask small mice | Emka Technologies | VetFlo-0801 | Anesthesia facemask holder |
| RS4000 Tuned Damped Top Performance Optical Table | Newport | Floating table | |
| S-2000A Top Performance Pneumatic Vibration Isolators with Automatic Re-Leveling | Newport | Floating table | |
| Power Meter Model 1918-R | Newport | Power meter | |
| X-Cite 120Q | Excelitas Technologies | Fluorescence lamp | |
| Two-photon microscope | Bruker | Ultima IV | Two-photon microscopes |
| Two-photon microscope | Thorlabs | Bergamo | Two-photon microscopes |
| Plan N 4x/0.10 ∞/-/FN22 | Olympus | Objectives | |
| Plan N 10x/0.25 ∞/-/FN22 | Olympus | Objectives | |
| LMPlan FLN 20x/0.40 ∞/-/FN26.5 | Olympus | Objectives | |
| XLPlan N 25x/1.00 SVMP ∞/0-0.23/FN18 | Olympus | Objectives | |
| Ultafast tunable laser for 2P excitation | Spectraphysics | Mai Tai Deep See | Excitaiton lasers |
| Ultafast tunable laser for 2P excitation | Spectraphysics | InSight DS+ Dual beam | Excitaiton lasers |
| Ultafast tunable laser for 3P excitation | Coherent | Monaco | Excitaiton lasers |
参考文献
- O’Keefe, J., Nadel, L. The hippocampus as a cognitive map. , Clarendon Press; Oxford University Press. (1978).
- Zola-Morgan, S., Squire, L. R. Memory Impairment in Monkeys Following Lesions Limited to the Hippocampus. Behavioral Neuroscience. 100 (2), 155-160 (1986).
- Squire, L., Zola-Morgan, S. The medial temporal lobe memory system. Science. 253 (5026), 1380-1386 (1991).
- Leutgeb, S., Leutgeb, J. K., Barnes, C. A., Moser, E. I., McNaughton, B. L., Moser, M. B. Independent codes for spatial and episodic memory in hippocampal neuronal ensembles. Science. 309 (5734), 619-623 (2005).
- Silva, A. J., Zhou, Y., Rogerson, T., Shobe, J., Balaji, J. Molecular and cellular approaches to memory allocation in neural circuits. Science. 326 (5951), 391-395 (2009).
- Tonegawa, S., Pignatelli, M., Roy, D. S., Ryan, T. J. Memory engram storage and retrieval. Current Opinion in Neurobiology. 35, 101-109 (2015).
- Poo, M., et al. What is memory? The present state of the engram. BMC Biology. 14, (2016).
- O’Keefe, J., Dostrovsky, J. The hippocampus as a spatial map. Preliminary evidence from unit activity in the freely-moving rat. Brain Research. 34 (1), 171-175 (1971).
- Moser, M. B., Moser, E. I. Functional differentiation in the hippocampus. Hippocampus. 8 (6), 608-619 (1998).
- Altman, J. Autoradiographic investigation of cell proliferation in the brains of rats and cats. Anatomical Record. 145, 573-591 (1963).
- Kuhn, H., Dickinson-Anson, H., Gage, F. Neurogenesis in the dentate gyrus of the adult rat: age-related decrease of neuronal progenitor proliferation. The Journal of Neuroscience. 16 (6), 2027-2033 (1996).
- Sorrells, S. F., et al. Human hippocampal neurogenesis drops sharply in children to undetectable levels in adults. Nature. 555 (7696), 377-381 (2018).
- Boldrini, M., et al. Human hippocampal neurogenesis persists throughout aging. Cell Stem Cell. 22 (4), 589-599 (2018).
- Polanco, J. C., et al. Amyloid-β and tau complexity — towards improved biomarkers and targeted therapies. Nature Reviews Neurology. 14 (1), 22-39 (2017).
- Rosene, D. L., Van Hoesen, G. W., et al. The hippocampal formation of the primate brain. in Cerebral Cortex. Jones, E. G., et al. Chapter 9, Plenum Press. New York. 345-456 (1987).
- Klohs, J., Rudin, M. Unveiling molecular events in the brain by noninvasive imaging. The Neuroscientist. 17 (5), 539-559 (2011).
- Wilt, B. A., et al. Advances in light microscopy for neuroscience. Annual Reviewof Neuroscience. 32, 435-506 (2009).
- Jung, J. C., Schnitzer, M. J. Multiphoton endoscopy. Optics Letters. 28 (11), 902(2003).
- Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P., Webb, W. W. In vivo multiphoton microscopy of deep brain tissue. Journal of Neurophysiology. 91 (4), 1908-1912 (2004).
- Mizrahi, A., Crowley, J. C., Shtoyerman, E., Katz, L. C. High-Resolution in vivo imaging of hippocampal dendrites and spines. The Journal of Neuroscience. 24 (13), 3147-3151 (2004).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nature Neuroscience. 13 (11), 1433-1440 (2010).
- Busche, M. A., et al. Critical role of soluble amyloid- for early hippocampal hyperactivity in a mouse model of Alzheimer’s disease. Proceedings of the National Academy of Science. 109 (22), 8740-8745 (2012).
- Jung, J. C., Mehta, A. D., Aksay, E., Stepnoski, R., Schnitzer, M. J. In vivo mammalian brain imaging using one- and two-photon fluorescence microendoscopy. Journal of Neurophysiology. 92 (5), 3121-3133 (2004).
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. The Journal of Neuroscience. 26 (41), 10380-10386 (2006).
- Feng, G., et al. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-51 (2000).
- Attardo, A., Fitzgerald, J. E., Schnitzer, M. J. Impermanence of dendritic spines in live adult CA1 hippocampus. Nature. 523 (7562), 592-596 (2015).
- Trachtenberg, J. T., et al. Long-term in vivo imaging of experience-dependent synaptic plasticity in adult cortex. Nature. 420 (6917), 788-794 (2002).
- Zuo, Y., Yang, G., Kwon, E., Gan, W. B. Long-term sensory deprivation prevents dendritic spine loss in primary somatosensory cortex. Nature. 436 (7048), 261-265 (2005).
- Holtmaat, A. J. G. D., et al. Transient and persistent dendritic spines in the neocortex in vivo. Neuron. 45 (2), 279-291 (2005).
- Xu, T., et al. Rapid formation and selective stabilization of synapses for enduring motor memories. Nature. 462 (7275), 915-919 (2009).
- Yang, G., Pan, F., Gan, W. B. Stably maintained dendritic spines are associated with lifelong memories. Nature. 462 (7275), 920-924 (2009).
- Gu, L., et al. Long-term in vivo imaging of dendritic spines in the hippocampus reveals structural plasticity. The Journal of Neuroscience. 34, 13948-13953 (2014).
- Fu, M., Zuo, Y. Experience-dependent structural plasticity in the cortex. Trends in Neurosciences. 34 (42), 177-187 (2011).
- Kawashima, T., et al. Functional labeling of neurons and their projections using the synthetic activity-dependent promoter E-SARE. Nature Methods. 10 (9), 889-895 (2013).
- Attardo, A., et al. Long-term consolidation of ensemble neural plasticity patterns in hippocampal area CA1. Cell Reports. 25 (3), 640-650 (2018).
- Schmid, L. C., et al. Dysfunction of somatostatin-positive interneurons associated with memory deficits in an Alzheimer’s disease model. Neuron. 92 (1), 114-125 (2016).
- Kaifosh, P., Lovett-Barron, M., Turi, G. F., Reardon, T. R., Losonczy, A. Septo-hippocampal GABAergic signaling across multiple modalities in awake mice. Nature Neuroscience. 16 (9), 1182-1184 (2013).
- Lovett-Barron, M., et al. Dendritic inhibition in the hippocampus supports fear learning. Science. 343 (6173), 857-863 (2014).
- Hainmueller, T., Bartos, M. Parallel emergence of stable and dynamic memory engrams in the hippocampus. Nature. 558 (7709), 292-296 (2018).
- Beaurepaire, E., Oheim, M., Mertz, J. Ultra-deep two-photon fluorescence excitation in turbid media. Optics Communications. 188, 25-29 (2001).
- Theer, P., Hasan, M. T., Denk, W. Two-photon imaging to a depth of 1000 mm in living brains by use of a Ti:Al2O3 regenerative amplifier. Optics Letters. 28 (12), 1022-1024 (2003).
- Pfeiffer, T., et al. Chronic 2P-STED imaging reveals high turnover of dendritic spines in the hippocampus in vivo. eLife. 7, e34700(2018).
- Barretto, R. P. J., et al. Time-lapse imaging of disease progression in deep brain areas using fluorescence microendoscopy. Nature Medicine. 17 (2), 223-228 (2011).
- Barretto, R. P. J., Messerschmidt, B., Schnitzer, M. J. In vivo fluorescence imaging with high-resolution microlenses. Nature Methods. 6 (7), 511-512 (2009).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Ziv, Y., et al. Long-term dynamics of CA1 hippocampal place codes. Nature Neuroscience. 16 (3), 264-266 (2013).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- Sheffield, M. E. J., Dombeck, D. A. Calcium transient prevalence across the dendritic arbour predicts place field properties. Nature. 517 (7533), 200-204 (2015).
- Basu, J., et al. Gating of hippocampal activity, plasticity, and memory by entorhinal cortex long-range inhibition. Science. 351 (6269), aaa5694(2016).
- Kaifosh, P., Zaremba, J. D., Danielson, N. B., Losonczy, A. SIMA: Python software for analysis of dynamic fluorescence imaging data. Frontiers in Neuroinformatics. 8, (2014).
- Gonçalves, J. T., et al. In vivo imaging of dendritic pruning in dentate granule cells. Nature Neuroscience. 19 (6), 788-791 (2016).
- Danielson, N. B., et al. Distinct contribution of adult-born hippocampal granule cells to context encoding. Neuron. 90 (1), 101-112 (2016).
- Hell, S. W., et al. Three-photon excitation in fluorescence microscopy. Journal of Biomedical Optics. 1 (1), 71(1996).
- Horton, N. G., et al. In vivo three-photon microscopy of subcortical structures within an intact mouse brain. Nature Photonics. 7 (3), 205-209 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved