Method Article
Продольные двухфотонное изображение дорсального гиппокампа CA1 в живых мышах
В этой статье
Резюме
Этот метод описывает хронический препарат, который позволяет оптический доступ к гиппокампу живых мышей. Этот препарат может быть использован для выполнения продольных оптических изображений нейрональной структурной пластичности и активности вызванных клеточной пластичности в течение нескольких недель.
Аннотация
Двухфотонная микроскопия является фундаментальным инструментом для нейронауки, поскольку она позволяет исследует мозг живых животных на пространственных масштабах, начиная от субклеточного до сетевого уровня и в временных масштабах от миллисекунд до недель. Кроме того, двухфотонная визуализация может быть объединена с различными поведенческими задачами для изучения причинно-следственных связей между функцией мозга и поведением. Однако, у млекопитающих, ограниченное проникновение и рассеяние света ограничили двухфотонные интражизненной визуализации в основном поверхностных областей мозга, тем самым исключая продольные исследования глубоких областей мозга, таких как гиппокамп. Гиппокамп участвует в пространственной навигации и эпизодической памяти и является давней моделью, используемой для изучения клеточных, а также когнитивных процессов, важных для обучения и отзыва, как в области здоровья и болезней. Здесь подробно описан препарат, позволяющий хронический оптический доступ к псальскому гиппокампу у живых мышей. Этот препарат можно комбинировать с двухфотонных оптических изображений при клеточном и субклеточном разрешении в головке фиксированной, обезображенных живых мышей в течение нескольких недель. Эти методы позволяют повторное изображение нейронной структуры или активности вызванных пластичности в десятках до сотен нейронов в пневса гиппокампа CA1. Кроме того, этот хронический препарат может быть использован в сочетании с другими методами, такими как микро-эндоскопия, головная микроскопия широкой поля или трехфотонная микроскопия, тем самым значительно расширяя набор инструментов для изучения клеточных и сетевых процессов в обучении и памяти.
Введение
У млекопитающих гиппокамп является ключевой областью мозга для кодирования и отзыва эпизодических воспоминаний,а также для пространственной навигации 1,2,3,4. По этой причине, гиппокамп был - и до сих пор - очень важная модель для изучения основных механизмов, которые позволяют мозгу кодировать и вспомнить воспоминания5,6,7 или для навигации в среде8 ,9 сбор наград и избежать опасностей. Кроме того, формирование гиппокампа является одним из областей мозга, где новые нейроны генерируются на протяжении всей жизни грызунов10,11 и, возможно, людей12,13. Наконец, дегенерация или нарушение формирования гиппокампа связаны с неврологическими и психическими расстройствами, включая болезнь Альцгеймера14.
У мышей гиппокамп расположен примерно на 1 мм ниже поверхности мозга15. Его положение предотвратило оптический доступ в нетронутый мозг и, следовательно, продольные исследования гиппокампа динамики опирались в основном на магнитно-резонансную (Mr) визуализации, электрофизиологии и экс-vivo анализа изображений. Методы мризображения позволяют отслеживать биологические процессы (например, экспрессия генов изменяет16) у одного и того же животного в течение нескольких дней, но не имеют пространственного разрешения для дискриминации отдельных нейронов. Классические электрофизиологические методы in vivo предлагают очень высокое временное разрешение и изысканную чувствительность к изменениям мембранного потенциала. Тем не менее, они имеют ограниченное пространственное разрешение, и они не имеют возможности надежно отслеживать те же клетки в течение более длительных периодов времени. Оптическая визуализация позволяет изучать более разнообразные процессы в силу своих высоких временных и пространственных разрешений. Тем не менее, ex vivo изображений только предоставляет снимки текущих процессов, и, таким образом, он не подходит для продольных исследований, в ходе которых животные узнать и вспомнить информацию.
Оптическая визуализация In vivo сочетает в себе некоторые преимущества МР-изображения и электрофизиологии с преимуществами оптической визуализации. Поэтому он очень хорошо подходит для продольного и корреляционного анализа динамики и поведения мозга мыши. Это имеет отношение к исследованиям биологических процессов с очень быстрыми (миллисекундами до секунд) или очень медленными (от дней до недель) временных масштабах. Примерами таких процессов, которые актуальны для нейробиологии, являются динамика мембранного напряжения, переходные капоты Ca2 ,, клеточная пластичность и структурные изменения, которые, как полагают, очень важны для формирования памяти и отзыва. Различные методы распространились в vivo изображений на дорсальный гиппокамп18,19,20,21,22. Острые препараты позволили отслеживать активность пирамидальных нейронов (PN), а также их дендритов и дендритных шипов в течение нескольких часов20,22. Однако эти временные рамки не позволяют изучить долгосрочные структурные изменения, которые могут лежать в основе поэтапного обучения. Хронические препараты - в сочетании с микроэндоскопами23,24 или с длинными рабочими расстояниями (WD) стандартные цели микроскопа21 - позволили повторно еле-изображения дорсального гиппокампа в течение нескольких Недель.
Здесь мы описываем хронический препарат, который обеспечивает периодический оптический доступ к CA1 подполе содварки гиппокампа живых мышей с помощью постоянно вставленной канюли изображений. Этот препарат позволяет повторно получить доступ к CA1 без функциональных нарушений и подходит для интравитальной двухфотон (2P) или широкоугольной эпифлюоресценции изображения. Подробно описаны два примера 2P глубокой магнитной визуализации в дорсаль-центре CA1 живых мышей: продольная визуализация дендритной структуры и дендритной динамики позвоночника и продольная визуализация пластичности, вызванной активностью. Обсуждаются основные преимущества и ограничения методики.
протокол
Все описанные методы были одобрены правительством Верхней Баварии (лицензия 2016-ROB-55.2Vet-2532.Vet-02-16-48) и Стэнфордским и Максом Планком Флорида Институтом неврологии административных панелей по лабораторным животным.
1. Подготовка канюли изображений
- Держите точность сверла на стенде сверла поставляется с подвижным таблице йилика.
- Зажимайте трубку диаметром 3,0 мм из нержавеющей стали на подвижный стол.
- Вырежьте трубку до металлического кольца длиной 1,6 мм. Если края кольца не тупые после резки, файл из неровностей.
- Промыть металлическое кольцо и круговой 4 мм диаметр стеклянной крышкой в 100% ацетон и оставить высохнуть в течение 5 мин.
- Поместите металлическое кольцо и стеклянный покрывало на гладкое, ровное и чистое рабочее место, под стереоскопом.
- Поместите каплю ультрафиолетового оптического клея на гладкую поверхность, например, блюдо Петри. Используйте иглу или шпатель для распространения клея, чтобы сформировать тонкий слой (0,5 мм).
- Используйте щипцы, чтобы окунуть одну сторону металлического кольца в клей. Обратите особое внимание, чтобы не запечатать внутри кольца. Если это произойдет, используйте иглу, чтобы сломать оптический клей в кольце.
- Используя стереоскоп, положение металлическое кольцо в центре стеклянного покрытия со стороны кольца, покрытого клей трогательно крышкой. Тонкое кольцо клея должно образовываться на стыке между металлическим кольцом и крышкой. Избегайте какого-либо клей распространяется в центре coverslip.
- Включите ультрафиолетовый светодиодный блок драйвера и сияйте светом (365 нм) в течение 1 мин.
ВНИМАНИЕ: УФ-излучение провоцирует ожоги кожи и является мутагенным агентом. Носите УФ-защитные очки и покрывайте руки и руки перчатками и лабораторным пальто, чтобы избежать воздействия кожи. - Чтобы вылечить клей равномерно, убедитесь, что все стороны кольца одинаково освещены, изменив направление источника света.
- Пусть клей затвердеть, по крайней мере 2 ч, предпочтительно, на ночь.
- Твердо удерживайте канюли от открытого конца металлического кольца с помощью гемостата. Использование стоматологического сверла оснащен вращающимся файлом и работает под стереоскопом, файл от избыточного стекла крышкой до заподлицо со сторонами кольца(Рисунок 1A).
2. Имплантация канюли изображений над содваченным гиппокампом
- Подготовка оборудования и установка
- Убедитесь, что все хирургические инструменты чистые и стерильные. При использовании стеклянного стерилизатора из бисера для стерилизации очистите инструменты и поместите их в стерилизатор (установлено до 250 градусов по Цельсию) в течение 10 минут, до использования. Кроме того, автоклав приборы перед использованием.
- Подготовьте все материалы, необходимые для операции, а также хирургические инструменты, так что они могут быть легко достигнуты.
- Убедитесь, что есть достаточно свежеприготовленных лекарств, таких как обезболивающие или противовоспалительные препараты.
- Убедитесь, что есть достаточно изолюран на протяжении всей операции (примерно 1 ч за операцию).
- Включите отопительный ковер и установите его до 37 градусов по Цельсию, чтобы сохранить температуру животных стабильной в то время как под наркозом.
- Убедитесь, что система очистки изофруран функционирует.
- Откройте клапан потока кислорода.
- Индукция анестезии и фиксация животных
- Поместите мышь в индукционную камеру анестезии на 3% изофлуран в 1 л /мин O2 и ждать, пока она теряет сознание. Оцените анестезию с помощью рефлекторного теста на щепотку ног.
- Взвесьте животное.
- Применение противовоспалительных (Meloxicam, 1 мг/кг) и болеутоляющее (Vetalgin, 200 мг/кг) препараты подкожно.
- Расположите мышь на нагревательном ковре. Убедитесь, что животное не находится в непосредственном контакте с нагревательным ковром, чтобы избежать термических ожогов.
- Защитите голову к стереотактическому аппарату и поместите носовой конус, чтобы покрыть морду. Для поддержания анестезии снижение изолюрани до 1,5-2%. На протяжении всей операции, контролировать состояние мыши, визуально контролируя дыхание и путем тестирования ног щепотку рефлекс. При необходимости регулируйте процент изофлуран.
- Нанесите офтальмологическую мазь на глаза, чтобы предотвратить обезвоживание и потенциальную слепоту.
ПРИМЕЧАНИЕ: Для анестезии и животных лекарства, альтернативные методы и препараты возможны. Пожалуйста, обратитесь к вашей лицензии на животных и относительной литературе.
- Имплантация оптической канюли
- Включите волоконно-оптический источник света.
- Удалите волосы и дезинфицировать кожу над головой мыши.
- Используя ножницы и щипцы, удалите кожу головы мыши. Начните с небольшого разреза на коже головы в положении, близком к лямбдой. Продолжить, открыв кожу головы с двух сторон. Сначала двигайтесь боково в направлении ушей, затем ростически, в направлении глазных орбит, образуйте треугольник на сагиттальной оси, примерно на 4 мм рострал в брегму. Обратите внимание, чтобы не резать слишком близко к ушам и глазам, но подвергать брегма и лямбда, а также теменные кости и задней половины лобных костей.
- Нанесите на череп одну каплю (10 мг) лидокаина (28,9% v/v в алкоголе).
- Очистить периостеум и высушить череп с помощью ватного тампона.
- Расположите ушные прутья, чтобы зафиксировать голову мыши.
- Сделайте небольшую краниотомию, используя микро-дрель с шириной 0,5 мм. Расположите отверстие в лобной кости напротив изображенного гиппокампа, примерно 1,5 мм от сагитального шва и 2 мм на расстоянии от коронального шва.
- Винт 0,86 мм шириной нержавеющей стали кости винт в отверстие черепа.
- При необходимости очистите мусор и высушите череп.
- Приготовление смеси быстрого клея цемента
- Используя небольшую ложку (диаметром 4,5 мм), распределяйте 1-1,5 мерные ложки L-порошка в хорошо перемешивание.
- Распределите 3-4 капли быстрой базы в колодец.
- Распределите 1 каплю универсального катализатора в колодец.
- Перемешать смесь для 5-10 с с помощью точного аппликатора.
ПРИМЕЧАНИЕ: Альтернативные цементы доступны. Пожалуйста, обратитесь к инструкциям их производителя.
- Используйте точные аппликаторы для нанесения быстрого клея цемента на череп, винт и окружающую кожу. Дайте ему высохнуть в течение 30 с до 1 мин.
- Используйте трифин диаметром 3,0 мм, чтобы сделать краниотомию в теменной кости. Позиция отверстие примерно 1,5 мм удалены от sagittal шов и 2 мм далеко от лямбда шов.
- Аккуратно удалите костной лоскут.
- Проверьте размер краниотомии с помощью канюли, чтобы убедиться, что она подходит. Используйте микро-дрель шириной 0,5 мм или 0,9 мм, чтобы при необходимости увеличить краниотомию.
- Удалите оленя с помощью щипцы Дюмона.
- Ablate корковой материи, чтобы достичь внешней капсулы. Используйте тупую иглу диаметром 0,9 мм (19 калибровочных), подключенную к вакуумным насосом. Орошать с сольнием, чтобы избежать обезвоживания подвергаются ткани и смыть остаточной крови после кровотечения решена. Сосать корковой ткани медленно, 50-100 мкм за один раз, пока кора отделяется от капсулы, подвергая волокна цингула или корпус мозоли. Изменение иглы часто, чтобы предотвратить засорение.
- Волокна распространяются в основном в трех направлениях(рисунок 1B). Тщательно очистить пищевые волокна до тех пор, пока глубокие волокна(альвеус гиппокампа) подвергаются.
- Промыть ткань сольным раствором. Используйте тонкие щипцы, чтобы окунуть нижнюю канюльу в солин и расположить его над отверстием черепа. Каннула и ткани должны быть запечатаны соленом, чтобы избежать захвата пузырьков воздуха между канюлей и ткани.
- Нажмите канюли в череп(Рисунок 1C) до тех пор, пока стеклянный покрывало находится в контакте с волокнами.
- Сухой череп хорошо с помощью поглощения треугольников, ватные тампоны и / или вакуумный насос.
- Приготовление смеси быстрого клея цемента (обратите сью 2.3.10).
- Используйте точные аппликаторы для нанесения быстрого клея цемента над черепом. Нанесите клей также на край канюли. Будьте осторожны, чтобы не позволить клей запустить в канюле. Дайте ему высохнуть в течение 30 с до 1 мин.
- Используйте стереотаксической руки, чтобы положение пластины держателя головы над канюлей, в контакте с черепом.
- Приготовление смеси зубного акрила
- Используя ложку (диаметр ю 9 мм), распределите 1 уровень мерной ложки (1 часть) порошка в смешивания хорошо.
- Распределите 2-3 части жидкости в том же колодце. Обложка весь порошок с жидкостью.
- Перемешать в течение 1 мин с помощью шпателя.
ПРИМЕЧАНИЕ: Альтернативные акриловые доступны. Пожалуйста, обратитесь к инструкциям их производителя.
- Используйте шпатель или точность аппликатора для нанесения акрила по всему черепу. Обложка весь открытый череп, винт и открытая кожа с зубным акрилом. Это делает подготовку стабильной. Не позволяйте акрилово бежать по шее, ушам и глазам.
- Дайте акриловому высохнуть и затвердевайте около 15 мин.
- Нанесите съемную клейкую пленку на пластину держателя головы, чтобы предотвратить попадание мусора в канюлу. Рекомендуется, чтобы размер пленки соответствовал размеру пластины.
- Выключите изофлюранический поток, удалите животное из стереотаксического аппарата и положите его на нагревательную пластину для поддержания физиологической температуры тела во время пробуждения от наркоза.
- Мониторинг животного, пока он не пришел в себя достаточно сознания для поддержания строгого recumbency.
- Вернуть животное, перенесшее операцию, в компанию других животных только после полного выздоровления.
3. Послеоперационный уход
- Проверьте состояние мыши в течение 2 дней после операции, путем мониторинга веса и общего поведения.
- Применение противовоспалительных (Мелоксикам, 1 мг/кг) и обезболивающее (Веталгин, 200 мг/кг) препараты подкожно в течение 2 дней после операции
ПРИМЕЧАНИЕ: Альтернативные процедуры мониторинга, лекарства и дозы возможны для послеоперационного ухода. Пожалуйста, обратитесь к вашей лицензии на животных и относительной литературе.
4. Подготовка сеанса визуализации
- Включите настройки изображения заранее, и пусть лазер, чтобы разогреть и стабилизировать, если это необходимо.
- Анестезия мыши (относится к шагу 2.2.1).
- Используйте щипцдляние тщательно удалить клей пленки с пластины держателя головы. Держите мышь в руке и пластину держателя для головы пальцами. Снимите пленку осторожно, чтобы избежать повреждения препарата.
- Расположите мышь под микроскопом, над ковром отопления и закрепите головную пластину к держателю(рисунок 1D).
- Расположите носовой конус, чтобы покрыть морду и уменьшить изолюран до 1,5-2%.
- Нанесите офтальмологическую мазь на глаза мышки.
- Очистите канюль изображения путем промывки деионизированной водой. Используйте шприц и тонкую иглу, чтобы бросить воду в канюльу и вакуумный насос, чтобы удалить его.
5. Сеанс визуализации
- Используйте низкое увеличение, большие рабочие расстояния целей для визуальной проверки канюли для остаточной воды, грязи, целостности и наличие флуоресценции.
- Выровняйте канюлу к оптической оси, регулируя углы рукояток держателя головы.
- Переключитесь на 25X 1.0 NA, 4 мм WD или 40X 0.8 NA, 3 мм WD, цели погружения воды. Добавить достаточно деионизированной воды, чтобы заполнить канюлю и поддерживать избыток воды на вершине канюли. Избегайте образования пузырьков воздуха.
- Используйте 2P возбуждение и флуоресцентные сигналы изображения.
ПРИМЕЧАНИЕ: Протокол визуализации сильно зависит от времени и пространственных масштабов для изображения. Пожалуйста, обратитесь к репрезентативным результатам разделов и обсуждению для получения подробной информации о настройках изображений, которые мы использовали для создания изображений, показанных в этой статье.
Результаты
Так как канюля помещается только дорсальный CA1, дорсальный аспект CA1 является более проксимальным к микроскопу по сравнению с брюшной. Альвеус является наиболее проксимальной структурой, за которой следуют в порядке слой oriens (SO), прослойка пирамидале (SP), слой радиата (SR) и слой lacunosum молекулярной (SLM), наиболее дистальный слой (Рисунки 1B , C). Продольная 2P-изображение нейронной структуры с субклеточным разрешением и вызванной активностью пластичности с клеточным разрешением представлены как репрезентативные результаты. Для возбуждения флюорофоров используется зеленый флуоресцентный белок (GFP), d2Venus и TurboFP635, фемтосекундный импульсный Ti:Sapphire лазер, настроенный до 920 Нм, и средняя мощность лазера в образце регулируется до 5-25 мВт. Различные длины волн выбросов разделены с помощью фильтров выбросов и различных фотомультипликаторных труб.
Продольная визуализация дендритной структуры и дендритной динамики шипов.
Для того чтобы разреженно обозначить Hippocampal PNs и визуализировать их структуру, thy1-GFP трансгенная линия мыши (линия M) использована. Thy1-GFP мышей выразить цитоплазматических расширенной GFP под контролем промоутерth Thy1 в разреженной, случайной популяции PNs25. Как правило, основная ось CA1 PNs примерно перпендикулярно плоскости XY-изображения(рисунки 1B, Рисунок 2A и Дополнительный фильм 1). Базальные дендриты простираются в SO, от сомы к канюле, в то время как акциальные и акциальные пучки дендриты распространяются distally к канюле, в противоположном направлении (Дополнительный фильм 1). Так как препарат оставляет глубокие волокна альвея нетронутыми, несколько флуоресцентных волокон, пересекающих поле зрения, чуть ниже канюли, должны быть видны (Рисунок2A и фильм 1). Препарат позволяет визуать PN дендриты с разрешением позвоночника(рисунок 2 A-C). Для изображения дендритов и дендритных шипов используется 25X 1.0 NA, 4 мм WD, коммерческое объективное объектив погружения воды.
Для продольного слежения, несколько областей мозга в поле зрения канюли определяются во время первого сеанса изображения. Каждая область соответствует площади примерно 240 х 240 мкм и содержит от 1 до 7 дендритных сегментов(рисунок 2B). Эти регионы вручную отображаются в трехмерном стеке с низким увеличением, показывающем узор выражения GFP в объеме ниже канюли изображений(рисунок 2A). Затем, 1 мкм z-шаг изображения стеки CA1 PN базальных дендритов приобретаются с разными интервалами времени (от 24 ч до 3 дней) на срок до 14 дней(рисунок 2C). Более длительные продолжительности изображения и интервалы возможны26. Каждый сеанс визуализации длится примерно от 60 до 90 минут. Хотя большинство изображений дендритных шипов в SO, это также можно изображение дендритных шипов в косых дендритов SR (Рисунки 2D-F). В дополнение к плотности позвоночника, этот метод позволяет изучать динамику позвоночника путем количественной оценки их выживания, выгоды и потери26,27,28,29,30, 31 год , 32. Для оценки и отслеживания дендритных шипов с течением времени(рисунок 2C), пользовательский интерфейс MATLAB используется. Это позволяет выравнивание изображений стеки, приобретенные в разных точках времени и поддерживает ручную маркировку дендритов и шипов при отслеживании дендритных длин и позвоночника позиции с течением времени26. Важно отметить, что этот метод может быть использован для различения (в каждой точке времени, за исключением первого) между уже существующими и новорожденных дендритных шипов. Это важно, поскольку различные классы дендритных шипов, как полагают, имеют различные роли в приобретении памяти и удержании33.
Продольное изображение активности вызываемых пластичности.
Для изображения активности вызванных пластичности в CA1 PNs, дорсальный CA1 гиппокампа области вводится с вирусным вектором, выражающим зеленый флуоресцентный дестабилизированных d2Venus через расширенную форму синаптической активности-ответный элемент (E-SARE) в дуге усилитель /промоутер и красный флуоресцентный TurboFP635 через промоутер ePGK 34. Это позволяет для визуализации уровней активности вызванных пластичности сотни CA1 PNs в каждом животном35. Учитывая очень плотную маркировку PNs, как правило, не представляется возможным решить дендриты CA1 PNs(Дополнительный фильм 2).
Для изображения соматы CA1 PNs используется 40X 0.8 NA, 3 мм WD, объектив объективного погружения воды. Для продольного слежения, от 1 до 9 областей мозга определяются на мышь во время первого сеанса изображения. Каждая область соответствует площади около 300 х 300 мкм и содержит от 50 до 150 клеток(рисунок 3A). Эти области вручную отображаются на локальных вехах тканей, видимых при более низком увеличении. Затем приобретаются 3 мкм z-шаг изображения, которые охватывают СП CA1 PNs(рисунок 3A и дополнительный фильм2) с различными временными интервалами (от 24 ч до 6 дней) на срок до 30 дней. Каждая сессия визуализации длится примерно от 60 до 90 минут. E-SARE пики активации от 6 до 8 ч после воздействия новой или обогащенной среды (EE, Рисунок 3B) и распадается в течение нескольких дней. Таким образом, мы обычно изображение 6 до 8 ч после опыта и позволяют в течение 5 дней между сеансами изображения35.
Для количественной оценки значений флуоресценции d2Venus и TurboFP635 нарисована круговая область-интерес 4,64 мкм в диаметре, что меньше, чем нервно-клеточное тело, сосредоточенное на клеточной сомы. Затем мы переходим к следующей точке времени, оценка сомы одной и той же клетки таким же образом, и итерировать эту процедуру для всех точек времени и всех видимых клеток в продольном наборе данных. Среднее значение выбросов (зависящих от активности) каждого нейрона d2Venus нормализуется его средним (независимым от активности) выбросом TurboFP635. Этот метод позволяет исследует долгосрочную динамику пластичности ансамбля CA1 PNs35 (рисунок 3C).
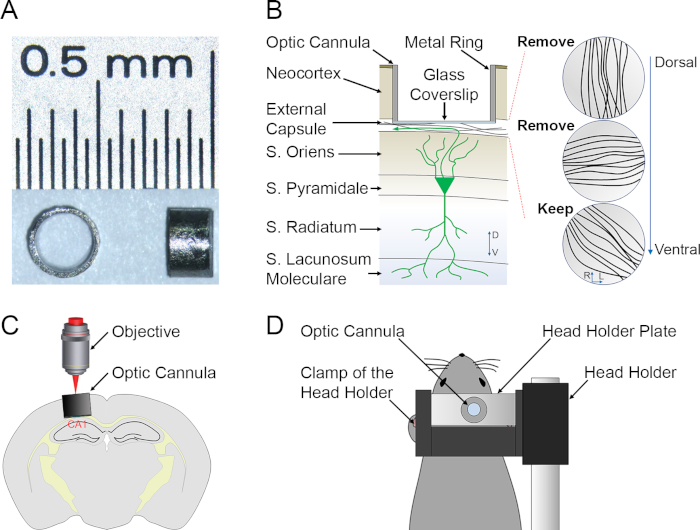
Рисунок 1: Подготовка к инвиво глубокой оптической визуализации мозга. (A). Верхний (слева) и боковые (правые) представления примера изображений cannuals. Изображения канюли имеют прозрачное стеклянное дно, чтобы оптический доступ к гиппокампу. (B). Схематическое описание препарата, подчеркивающее относительное положение канюли изображений, CA1 PN и трех слоев волокон от дорсального до вентрала. (C, D). Схематическое описание установки изображений (C) и фиксации животных (D ) во время сеанса визуализации. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Продольная визуализация дендритной структуры и дендритной динамики шипов. (A) 2P стек изображения (Максимальная проекция интенсивности (MIP) из 59 плоскостей изображения, 2 мкм z-spacing) нейронов и дендритов помечены GFP в живой мыши Thy1-GFP. (B). Высшее увеличение (MIP из 53 плоскостей изображения, 1 мкм z-spacing) подробно базальных дендритов, расположенных в SO. (C). Time-lapse последовательности изображения дендритного сегмента изображения в течение 14 дней. Стрелы указывают на дендритные шипы, отслеживаемые в течение 14 дней. (D, E). 2P стек изображения нейронов и дендритов помечены GFP в живой thy1-GFP мыши; (D) Y проекции (31 плоскости изображения, 3 мкм z-интервал) и (E) XY прогнозы (17 плоскостей изображения, 3 мкм z-интервалов). (F). Высшее увеличение (одиночный плоскости изображения) подробно априальных дендритов и дендритных шипов, расположенных в SR. Arrowheads указывают на дендритные шипы. Возбуждение: 920 нм; пик выбросов: 510 нм. Шкала баров: A, 50 мкм; B, 10 мкм; C, 2 мкм; D и E, 15 мкм; F, 4 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Продольное изображение активности вызываемых пластичности. (A. 2P изображения (одиночные плоскости изображения) от живой мыши, показывая те же клетки на базовый день 0 и после EE на день 1. (B) 2P стеки изображений (MIPs 4-6 плоскостей изображения, 3 мкм z-spacing) показывая E-SARE шаблоны активации специфические для среды A (Дни 1, 19 и 25) и окружающей среды B (Дни 7 и 13). Зеленый цвет: фторесценция d2Venus. Красный: TurboFP635 флуоресценции. Возбуждение: 920 нм; пик выбросов d2Venus: 530 нм; Пик выбросов TurboFP635: 635 нм. Шкала баров: A, 20 мкм; B, 10 мкм. Эта цифра была изменена с Attardo et al., 201835. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Изображение нейрональной структуры в Гиппокампе DG с помощью трехфотон (3P) микроскопии. (A-H). 3P изображения (однообразные плоскости изображения) нейронов и дендритов помечены GFP в живой Thy1-GFP мыши подробно (A-E) PNs в CA1 и (F-H) гранулы клеток в DG. Возбуждение: 1400 нм; пик выбросов: 510 нм. Шкала бар: 40 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Дополнительный фильм 1: Изображение поля зрения в живой thy1-GFP мыши. 2P стек изображения (83 плоскости изображения, 7 мкм z-spacing) нейронов и дендритов помечены GFP (белый) в живой Thy1-GFP мыши простирается от нижней части канюли до SLM. Для учета распада сигнала флуоресценции с увеличением глубины мы использовали нелинейный градиент прироста фотомультипликаторных труб. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный фильм 2: Изображение активности вызванных пластичности. 2P стек изображения (28 плоскостей изображения, 3 мкм z-spacing) нейронов, выражающих E-SARE репортер выражения IEG в живой мыши, охватывающей SP. Зеленый: d2Venus флуоресценции. Красный: TurboFP635 флуоресценции. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Здесь описывается процедура повторного 2P изображения дорсального CA1 у живых мышей. После операции мышь обычно восстанавливается в течение 2 дней. Процедура вызывает минимальный астроглиоз26,43. Кровоизлияние и отеки, которые могут последовать за операцией, как правило, повторно адсорбируется в течение 10 до 14 дней. Как правило, начиная с 14 дней после имплантации препарат достаточно ясен для выполнения интравитальная визуализация. Успех операции не зависит от работы в стерильной среде. Тем не менее, очень важно поддерживать высокий уровень гигиены, чтобы избежать осложнений из-за связанных с хирургическим вмешательством инфекций. Это происходит путем тщательной очистки хирургических инструментов до и после операции и путем их теплостерилизацию непосредственно перед каждым использованием (шаг 2.1.1). Оптическая канюля хранится в чистом, стерилизованный контейнер и промывается стерильным сольнием непосредственно перед имплантацией. Выполнение общей хирургической практики дезинфекции рук и очистки хирургической станции также очень важно. Препарат остается стабильным и позволяет клеточного и субклеточного разрешения изображений в течение нескольких недель26,35.
Критические шаги, изменения и устранение неполадок.
Важно очистить внешнюю капсулу до тех пор, пока не будут выставлены самые глубокие волокна. Неспособность разоблачить альвеус может привести к неспособности сосредоточиться на соом PNs, или в уменьшенном разрешении изображения дендритных шипов, при использовании коммерческих целей с 3- или 4-мм WD. Для этой цели полезно очень медленно абляции неокортекса с помощью иглы диаметром 0,9 мм, а затем переключиться на иглу диаметром 0,3-0,5 мм (24-29 калибровочных) для более тонкого контроля всасывания при удалении наиболее престритов. Кроме того, тонкие щипцы могут быть использованы для удаления оставшейся коры после воздействия волокна36.
Кровотечение во время операции может быть проблематичным, так как кровь препятствует обзору. В ожидании сгустка, чтобы сформировать, а затем полоскания сольников, чтобы смыть остаточной крови рекомендуется. Повторите по мере необходимости.
Уютное соответствие между канюлей и краниотомии помогает повысить стабильность препарата, сохраняя канюли на месте перед нанесением цемента, особенно если внешний край канюли заподлицо с черепом. В виду того что размеры сверла трефина и канюли сопрягаются, свободная пригонка может возникнуть из-за неровностей на стороне cannula - которые требуют немножко более больших краниотомии для того чтобы приспосабливать (см. шаг 2.3.14) - или от скачками краниотомии. Любые нарушения канюли должны быть поданы покинуть (шаги 1.3 и 1.12) и трефин должен быть проведен перпендикулярно черепу до тех пор, пока краниотомия не будет завершена (шаг 2.3.12). Удаление трефина из черепа до завершения краниотомии может привести к нерегулярным краниотомии.
Ограничения- Инвазивность и стабильность препарата.
Трудно оценить эффект корковой абляции, так как трудно точно определить области, непосредственно и косвенно затронутые. В целом, операция удаляет часть теменной коры и часть зрительной и задней сенсорной коры21. Абляция коры не имеет прямого проекта к гиппокампа и гиппокампа ткани ни коснулся, ни повреждены. Важно отметить, что было показано, что имплантация изображения канюли не грубо изменить функции гиппокампа и, в частности, гиппокампа зависит от обучения21,36,37,38, 39. Тем не менее, было бы важно количественно в какой степени как канюля и внешняя часть имплантата (пластина держателя головы и зубной акриловой колпачок) являются хроническими стрессорами, оценивая уровень кортикостерона в крови и вес надпочечников по сравнению с неимплантированных мышей.
Препарат обычно остается стабильным от недель до месяцев26. В долгосрочной перспективе, рост кожи и костей, как правило, вытесняют акриловую шапку и увеличить нестабильность подготовки изображений.
Оптические ограничения.
Обычная 2P микроскопия позволяет изображения до 1 мм глубоко в неокортикальной ткани40,41. В соответствии с этим, можно изображение дендритов и дендритных шипов, расположенных в SR(рисунок 2D-F) или SLM36. Тем не менее, изображение через канюли создает ограничения для эффективного NA. Для достижения максимального разрешения диаметр и глубина канюли изображений должны быть сопоставлены с изображением NA, так как меньшие диаметры и большие глубины будут обрезать свет высоких целей NA. Например, при визуализации с целью погружения воды 1.0 NA через канюли длиной 1,6 мм, внутренний диаметр 3,65 мм необходим для поддержания полного NA. Однако, используя канюлю этого диаметра увеличит сжатие гиппокампа и может повлиять на здоровье ткани, по этой причине, мы используем канюлю с меньшим диаметром. При визуализации с целью погружения в воду 0,8 NA через канюли длиной 1,6 мм, внутреннего диаметра 2,5 мм было бы достаточно, чтобы сохранить полную NA. Тем не менее, 0,8 NA воды погружения целей имеют более короткий WD (3 мм в нашем случае), что может помешать фокусировки на SP.
Эти расчеты применяются к центру поля зрения в нижней части канюли. Тем не менее, перемещение поля изображения зрения боком - ближе к краям канюли - или фокусировки глубже в ткани - дальше от стеклянной поверхности канюли - еще больше уменьшает эффективное NA в фокусной плоскости и, таким образом, уменьшает разрешение. Это приведет к неоднородному разрешению различных объемов изображений ткани и может быть предметом озабоченности для количественной визуализации при субклеточном разрешении, особенно при использовании супер-разрешение методов, таких как 2P-STED микроскопии42. Эти вопросы менее важны при визуализации при сотовом разрешении.
Ткань движения.
Движение в ткани - происходящих от дыхания и сердцебиения у обезболенных животных - как правило, становятся более серьезными с увеличением расстояния от изображения канюли. Это возможно потому, что изображение канюли применяет механическое давление на мозг, таким образом, противодействуя некоторые движения в непосредственной близости от канюли (подобно неокортикальной подготовки). Таким образом, хотя визуализация дендритных шипов возможно в SR и SLM, в наших руках, это наиболее надежный спинной к SO до 200 мкм от поверхности канюли. Чтобы компенсировать движение, мы используем резонансные сканеры и усреднение в автономном режиме. Несколько изображений (от 4 до 6 повторений) приобретаются на плоскость изображения z-стека с максимальной доступной скоростью (30 кадров/с). Все повторения для каждого z-плана затем deconvolved (с использованием коммерческого программного обеспечения, АвтоКвант), зарегистрированы (с помощью ImageJ) и усреднены в одно изображение26. Для визуализации соматы, движение часто незначительно при анестезии35 и два средних часто достаточно, чтобы компенсировать движения артефактов.
Будущие приложения или направления метода .
Препарат можно комбинировать с микроэндоскопами26,43. Микро-эндоскопы являются жесткими оптическими зондами, которые используют градиентрея рефракционных индекса (GRIN) микролинзы для руководства светом и из глубокой ткани18. Использование микроэндоскопов позволяет канюли меньшего диаметра или даже не канюли на всех. Тем не менее, коммерческие микроэндоскопы менее хорошо корректируются для оптических аберраций и имеют более низкую NA, чем коммерческие цели. Текущие зонды достигают бокового и осевого разрешения 0,6-1 мкм, 10-12 мкм, соответственно17,18,44. Использование микроэндоскопов также позволяет сочетать этот препарат с головными встроенными широкоугольными микроскопами45,46,47.
Метод поддается также использовать в неанестезиированных мышей, и он был использован для исследования клеточной активности с помощью датчиков Ca2 "в проснулся головой фиксированной мышей21,37,48,49. В этих случаях, в связи с быстрыми временной шкалой изменений флуоресценции, рекомендуется внедрить линию регистрации50. Также можно адаптировать препарат для визуализации других гиппокампа субрегионов, таких как зубная извилина (DG)39,51,52. Сочетание этого препарата с 3P возбуждение53,54 с частотой 1 МГц импульсный лазер настроен до 1400 нм, мы смогли изображение глубже в гиппокампа формирования достижения молекулярного слоя, гранулы клеточного слоя и hilus ГД(рисунок 4) без удаления наложения CA1.
В заключение мы представляем метод, который обеспечивает оптический доступ к содварке гиппокампа и позволяет продольные и коррелятивные исследования динамики гиппокампа структуры и деятельности. Этот метод расширяет возможности анализа функции гиппокампа в физиологических и патологических условиях.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
U. A. F. поддерживается фондом Шрама; C.-W. T. P. и W. G. поддерживаются Обществом Макса Планка; L.Y. и R.Y. поддерживаются Обществом Макса Планка и Национальным институтом здравоохранения (R01MH080047, 1DP1NS096787); A. C. поддерживается грантом FP7 от Европейского исследовательского совета, программ ERANET и I-CORE, Главного научного управления Министерства здравоохранения Израиля, Федерального министерства образования и исследований, Роберто и Рената Рухман, Бруно и Симоне Лич, Нелла и Леон Бенозийо Центр неврологических заболеваний, Институт биомедицинской визуализации и геномики Генри Чаноха Крентера, Израильский научный фонд семьи Перлман, Аделис, Марк Бесен, Прэтт и Ирвинг И. Московиц; А. А. поддерживается Обществом Макса Планка, фондом Шрама и Deutsche Forschungsgemeinschaft (DFG). 3P изображения были приобретены во время Расширенный курс по нейровизуализации Методы в Институте Макса Планка Флорида для неврологии. Расширенный курс по нейровизуализации Методы поддерживается Общество Макса Планка, штата Флорида Макс Планк Научной программы стипендий и Макс Планк Флорида Институт Корпорации Партнерства программы. Мы хотели бы поблагодарить Thorlabs, Coherent и SpectraPhysics за поддержку и оборудование для системы визуализации 2P / 3P в течение курса. Мы также благодарны Генри Хэберле и Мелиссе Эберле за помощь в системе в ходе курса.
Материалы
| Name | Company | Catalog Number | Comments |
| Professional drill/grinder IBS/E | Proxxon GmbH | 28481 | Pecision drill |
| MICROMOT drill stand MB 200 | Proxxon GmbH | 28600 | Movable ruler table |
| MICRO compound table KT 70 | Proxxon GmbH | 27100 | Movable ruler table |
| Machine vice MS 4 | Proxxon GmbH | 28132 | Movable ruler table |
| Stainless steel tube Ø 3,0 x 0,25 mm (Inner Ø 2,5 mm ) L = 500 mm | Sawade | R00303 | Stainless steel tube for the cannula metal ring |
| Microscope Cover glass (4 mm round) | Engelbrecht Medizin and Labortechnik | Glass coverslips for the cannula glass | |
| Schlusselfeilensatz 6-tgl. Im Blechetui | Hoffmann Group | 713750 160 | Manual files |
| Präzisions-Nadelfeile Gesamtlänge 140 mm 4 | Hoffmann Group | 527230 4 | Manual files |
| UV-Curing Optical Adhesives | Thorlabs | NOA81 | UV-curing adhesive |
| UV Curing LED System, 365 nm | Thorlabs | CS2010 | UV-curing LED driver unit |
| Stemi 305 | Zeiss | Stereoscope | |
| Presto II | NSK-Nakanishi Germany | Z307015 | Dental drill |
| Diamantbohrer FG (5 St.), Zylinder flach, 837-014 fein | MF Dental | F837.014.FG | Files for the dental drill |
| Diamantbohrer FG (5 St.), Zylinder flach, 837-014 grob | MF Dental | G837.014.FG | Files for the dental drill |
| Graefe Forceps - Straight / Serrated | Fine Science Tools | 11050-10 | Forceps for the surgery |
| Burrs for Micro Drill | Fine Science Tools | 19008-05 | 0.5 mm width burr for the micro-drill |
| Burrs for Micro Drill | Fine Science Tools | 19008-09 | 0.9 mm width burr for the micro-drill |
| MicroMotor mit Handstück | DentaTec | MM11 | Micro-drill for the craniotomy |
| Dumont #3 Forceps | Fine Science Tools | 11231-30 | Dumont forceps for the surgery |
| Fine Scissors - ToughCut | Fine Science Tools | 14058-09 | Scissors for the surgery |
| Trephine | MW Dental | 229-020 | Trephine drill - 3.0 mm diameter; for the micro-drill |
| Stainless Steel Self-Tapping Bone Screws | Fine Science Tools | 19010-10 | 0.86 mm width bone screws |
| Stereotaxic apparatus | Kopf | Stereotaxic apparatus | |
| 3-D-Gelenkarm | Hoffmann Group | 442114 | Stereotaxic arm and plate holder |
| Aufnahme 2SM | Hoffmann Group | 442100 2SM | Stereotaxic arm and plate holder |
| Hot Bead Sterilizers | Fine Science Tools | 18000-45 | Glass beads sterilizer |
| Isofluran CP, Flasche 250 ml | Henry Schein VET GmbH | 798932 | Liquid isoflurane for anesthesia |
| Harvard Apparatus Isoflurane Funnel-Fill Vaporizer | Harvard Apparatus GmbH | 34-1040 | Isoflurane vaporizer |
| Lab Active Scavenger | Gropper Medizintechnik | UV17014 | Isoflurane scavenger system |
| Metacam 0,5% Injektionslsg. (Hund / Katze), Flasche 20 ml | Henry Schein VET GmbH | 798566 | Meloxicam, anti-inflammatory |
| Vetalgin 500 mg/ml | MSD Tiergesundheit | Vetalgin, pain killer | |
| CMA 450 Temperature Controller | Hugo Sachs Elektronik - Harvard Apparatus GmbH | 8003770 | Heating blanket |
| Bepanthen Augen- und Nasensalbe | Bayer AG | Ophtalmic ointment | |
| KL 1500 LCD | Schott | Fiber optic light source | |
| Xylocain Pumpspray | AstraZeneca GmbH | Lidocain, local anesthetic | |
| Absorption Triangles - Unmounted | Fine Science Tools | 18105-03 | Absorption triangles for the surgery |
| Parkell C&B Metabond clear powder L | Hofmeester dental | 013622 | Quick adhesive cement |
| Parkell C&B Metabond Quick Base B | Hofmeester dental | 013621 | Quick adhesive cement |
| Parkell C&B Metabond Universal Catalyst C | Hofmeester dental | 013620 | Quick adhesive cement |
| Adjustable Precision Applicator Brushes | Parkell | S379 | Precision applicators for the surgery |
| Blunt needles 0.9x23 mm | Dentina | 0441324 | Blunt needles |
| Blunt needles 0.5x42 mm | Dentina | 0452155 | Blunt needles |
| Blunt needles 0.3x23 mm | Dentina | 0553532 | Blunt needles |
| Kallocryl A/C | Speiko | 1615 | Acrylic liquid component |
| Kallocryl | Speiko | 1609 | Acrylic powder |
| Hydrofilm transparent roll | Hartmann | Adhesive film | |
| Head plates | Custom made | 30 mm x 10 mm size; 8 mm diameter hole, titanium | |
| Head plate clamp | Custom made | Head plate holder | |
| Pedestal post holders | Thorlabs | PH20E/M | Head plate holder |
| Stainless steel post | Thorlabs | TR30/M | Head plate holder |
| Stainless steel post | Thorlabs | TR75/M | Head plate holder |
| Stainless steel post | Thorlabs | TR150/M | Head plate holder |
| Post connector clamps | Custom made | Head plate holder | |
| Aluminum Breadboard, 300 mm x 450 mm x 12.7 mm, M6 Taps | Thorlabs | MB3045/M | Microscope stage |
| 7" x 4" Lab Jack | Thorlabs | L490/M | Microscope stage |
| Low profile face mask small mice | Emka Technologies | VetFlo-0801 | Anesthesia facemask holder |
| RS4000 Tuned Damped Top Performance Optical Table | Newport | Floating table | |
| S-2000A Top Performance Pneumatic Vibration Isolators with Automatic Re-Leveling | Newport | Floating table | |
| Power Meter Model 1918-R | Newport | Power meter | |
| X-Cite 120Q | Excelitas Technologies | Fluorescence lamp | |
| Two-photon microscope | Bruker | Ultima IV | Two-photon microscopes |
| Two-photon microscope | Thorlabs | Bergamo | Two-photon microscopes |
| Plan N 4x/0.10 ∞/-/FN22 | Olympus | Objectives | |
| Plan N 10x/0.25 ∞/-/FN22 | Olympus | Objectives | |
| LMPlan FLN 20x/0.40 ∞/-/FN26.5 | Olympus | Objectives | |
| XLPlan N 25x/1.00 SVMP ∞/0-0.23/FN18 | Olympus | Objectives | |
| Ultafast tunable laser for 2P excitation | Spectraphysics | Mai Tai Deep See | Excitaiton lasers |
| Ultafast tunable laser for 2P excitation | Spectraphysics | InSight DS+ Dual beam | Excitaiton lasers |
| Ultafast tunable laser for 3P excitation | Coherent | Monaco | Excitaiton lasers |
Ссылки
- O’Keefe, J., Nadel, L. . The hippocampus as a cognitive map. , (1978).
- Zola-Morgan, S., Squire, L. R. Memory Impairment in Monkeys Following Lesions Limited to the Hippocampus. Behavioral Neuroscience. 100 (2), 155-160 (1986).
- Squire, L., Zola-Morgan, S. The medial temporal lobe memory system. Science. 253 (5026), 1380-1386 (1991).
- Leutgeb, S., Leutgeb, J. K., Barnes, C. A., Moser, E. I., McNaughton, B. L., Moser, M. B. Independent codes for spatial and episodic memory in hippocampal neuronal ensembles. Science. 309 (5734), 619-623 (2005).
- Silva, A. J., Zhou, Y., Rogerson, T., Shobe, J., Balaji, J. Molecular and cellular approaches to memory allocation in neural circuits. Science. 326 (5951), 391-395 (2009).
- Tonegawa, S., Pignatelli, M., Roy, D. S., Ryan, T. J. Memory engram storage and retrieval. Current Opinion in Neurobiology. 35, 101-109 (2015).
- Poo, M., et al. What is memory? The present state of the engram. BMC Biology. 14, (2016).
- O’Keefe, J., Dostrovsky, J. The hippocampus as a spatial map. Preliminary evidence from unit activity in the freely-moving rat. Brain Research. 34 (1), 171-175 (1971).
- Moser, M. B., Moser, E. I. Functional differentiation in the hippocampus. Hippocampus. 8 (6), 608-619 (1998).
- Altman, J. Autoradiographic investigation of cell proliferation in the brains of rats and cats. Anatomical Record. 145, 573-591 (1963).
- Kuhn, H., Dickinson-Anson, H., Gage, F. Neurogenesis in the dentate gyrus of the adult rat: age-related decrease of neuronal progenitor proliferation. The Journal of Neuroscience. 16 (6), 2027-2033 (1996).
- Sorrells, S. F., et al. Human hippocampal neurogenesis drops sharply in children to undetectable levels in adults. Nature. 555 (7696), 377-381 (2018).
- Boldrini, M., et al. Human hippocampal neurogenesis persists throughout aging. Cell Stem Cell. 22 (4), 589-599 (2018).
- Polanco, J. C., et al. Amyloid-β and tau complexity — towards improved biomarkers and targeted therapies. Nature Reviews Neurology. 14 (1), 22-39 (2017).
- Rosene, D. L., Van Hoesen, G. W., Jones, E. G. The hippocampal formation of the primate brain. in Cerebral Cortex. Chapter 9, 345-456 (1987).
- Klohs, J., Rudin, M. Unveiling molecular events in the brain by noninvasive imaging. The Neuroscientist. 17 (5), 539-559 (2011).
- Wilt, B. A., et al. Advances in light microscopy for neuroscience. Annual Reviewof Neuroscience. 32, 435-506 (2009).
- Jung, J. C., Schnitzer, M. J. Multiphoton endoscopy. Optics Letters. 28 (11), 902 (2003).
- Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P., Webb, W. W. In vivo multiphoton microscopy of deep brain tissue. Journal of Neurophysiology. 91 (4), 1908-1912 (2004).
- Mizrahi, A., Crowley, J. C., Shtoyerman, E., Katz, L. C. High-Resolution in vivo imaging of hippocampal dendrites and spines. The Journal of Neuroscience. 24 (13), 3147-3151 (2004).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nature Neuroscience. 13 (11), 1433-1440 (2010).
- Busche, M. A., et al. Critical role of soluble amyloid- for early hippocampal hyperactivity in a mouse model of Alzheimer’s disease. Proceedings of the National Academy of Science. 109 (22), 8740-8745 (2012).
- Jung, J. C., Mehta, A. D., Aksay, E., Stepnoski, R., Schnitzer, M. J. In vivo mammalian brain imaging using one- and two-photon fluorescence microendoscopy. Journal of Neurophysiology. 92 (5), 3121-3133 (2004).
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. The Journal of Neuroscience. 26 (41), 10380-10386 (2006).
- Feng, G., et al. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-51 (2000).
- Attardo, A., Fitzgerald, J. E., Schnitzer, M. J. Impermanence of dendritic spines in live adult CA1 hippocampus. Nature. 523 (7562), 592-596 (2015).
- Trachtenberg, J. T., et al. Long-term in vivo imaging of experience-dependent synaptic plasticity in adult cortex. Nature. 420 (6917), 788-794 (2002).
- Zuo, Y., Yang, G., Kwon, E., Gan, W. B. Long-term sensory deprivation prevents dendritic spine loss in primary somatosensory cortex. Nature. 436 (7048), 261-265 (2005).
- Holtmaat, A. J. G. D., et al. Transient and persistent dendritic spines in the neocortex in vivo. Neuron. 45 (2), 279-291 (2005).
- Xu, T., et al. Rapid formation and selective stabilization of synapses for enduring motor memories. Nature. 462 (7275), 915-919 (2009).
- Yang, G., Pan, F., Gan, W. B. Stably maintained dendritic spines are associated with lifelong memories. Nature. 462 (7275), 920-924 (2009).
- Gu, L., et al. Long-term in vivo imaging of dendritic spines in the hippocampus reveals structural plasticity. The Journal of Neuroscience. 34, 13948-13953 (2014).
- Fu, M., Zuo, Y. Experience-dependent structural plasticity in the cortex. Trends in Neurosciences. 34 (42), 177-187 (2011).
- Kawashima, T., et al. Functional labeling of neurons and their projections using the synthetic activity-dependent promoter E-SARE. Nature Methods. 10 (9), 889-895 (2013).
- Attardo, A., et al. Long-term consolidation of ensemble neural plasticity patterns in hippocampal area CA1. Cell Reports. 25 (3), 640-650 (2018).
- Schmid, L. C., et al. Dysfunction of somatostatin-positive interneurons associated with memory deficits in an Alzheimer’s disease model. Neuron. 92 (1), 114-125 (2016).
- Kaifosh, P., Lovett-Barron, M., Turi, G. F., Reardon, T. R., Losonczy, A. Septo-hippocampal GABAergic signaling across multiple modalities in awake mice. Nature Neuroscience. 16 (9), 1182-1184 (2013).
- Lovett-Barron, M., et al. Dendritic inhibition in the hippocampus supports fear learning. Science. 343 (6173), 857-863 (2014).
- Hainmueller, T., Bartos, M. Parallel emergence of stable and dynamic memory engrams in the hippocampus. Nature. 558 (7709), 292-296 (2018).
- Beaurepaire, E., Oheim, M., Mertz, J. Ultra-deep two-photon fluorescence excitation in turbid media. Optics Communications. 188, 25-29 (2001).
- Theer, P., Hasan, M. T., Denk, W. Two-photon imaging to a depth of 1000 mm in living brains by use of a Ti:Al2O3 regenerative amplifier. Optics Letters. 28 (12), 1022-1024 (2003).
- Pfeiffer, T., et al. Chronic 2P-STED imaging reveals high turnover of dendritic spines in the hippocampus in vivo. eLife. 7, e34700 (2018).
- Barretto, R. P. J., et al. Time-lapse imaging of disease progression in deep brain areas using fluorescence microendoscopy. Nature Medicine. 17 (2), 223-228 (2011).
- Barretto, R. P. J., Messerschmidt, B., Schnitzer, M. J. In vivo fluorescence imaging with high-resolution microlenses. Nature Methods. 6 (7), 511-512 (2009).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Ziv, Y., et al. Long-term dynamics of CA1 hippocampal place codes. Nature Neuroscience. 16 (3), 264-266 (2013).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- Sheffield, M. E. J., Dombeck, D. A. Calcium transient prevalence across the dendritic arbour predicts place field properties. Nature. 517 (7533), 200-204 (2015).
- Basu, J., et al. Gating of hippocampal activity, plasticity, and memory by entorhinal cortex long-range inhibition. Science. 351 (6269), aaa5694 (2016).
- Kaifosh, P., Zaremba, J. D., Danielson, N. B., Losonczy, A. SIMA: Python software for analysis of dynamic fluorescence imaging data. Frontiers in Neuroinformatics. 8, (2014).
- Gonçalves, J. T., et al. In vivo imaging of dendritic pruning in dentate granule cells. Nature Neuroscience. 19 (6), 788-791 (2016).
- Danielson, N. B., et al. Distinct contribution of adult-born hippocampal granule cells to context encoding. Neuron. 90 (1), 101-112 (2016).
- Hell, S. W., et al. Three-photon excitation in fluorescence microscopy. Journal of Biomedical Optics. 1 (1), 71 (1996).
- Horton, N. G., et al. In vivo three-photon microscopy of subcortical structures within an intact mouse brain. Nature Photonics. 7 (3), 205-209 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены