Method Article
ネイティブ自己蛍光に基づくsFLIMによる植物切片における蛍光プローブとリグニン間の相互作用の測定
要約
このプロトコルは、ロダミンベースの蛍光プローブとリグニンポリマー間のフェルスター共鳴エネルギー移動(FRET)を厚い植物切片で直接評価するために、スペクトルと蛍光寿命の測定値を組み合わせたオリジナルのセットアップについて説明します。
要約
リグノセルロース系バイオマス(LB)では、酵素の活性は、基質から遠く離れた酵素を維持する加水分解過程におけるリグニンとの非特異的相互作用の出現によって制限される。したがって、これらの複雑な相互作用の特性評価は、LBなどの複雑な基板において課題である。ここでの方法は、フルオロフォアタグ付け分子と天然自己蛍光リグニンとの間の分子相互作用を測定し、フェルスター共鳴エネルギー移動(FRET)によって明らかにされる。2つの除近性蛍光色素を用いた生細胞におけるFRET測定とは対照的に、リグニンを用いた植物におけるFRET測定は、その複雑な自己蛍光のために些細なものではありません。蛍光の2つの相補的な特性(蛍光発光と寿命)の相関観察を伴う独自の取得および分析パイプラインを開発しました。sFLIM(スペクトルおよび蛍光生涯イメージング顕微鏡)は、これらの相互作用を高感度で定量化し、生体分子とリグニンの間の異なる相互作用レベルを明らかにする。
概要
リグノセルロースをグルコースなどの単量体糖に加水分解するには酵素が必要です。それらの活性は、酵素とリグニン1、2との間の非特異的相互作用の確立によって抑制されることが知られており、後者は疎水性ポリマーであり、リグノセルロース3の主要な構成成分である。従って、このような相互作用を細胞スケールで直接定量的に測定することは、酵素触媒活性およびリグノセルロース前処理4を最適化するために対処しなければならない課題である。
フェルスター(または蛍光)共鳴エネルギー移動(FRET)測定は、生体分子相互作用をその場所でアススする方法である。この非放射エネルギー移動は、ドナーとアクエクターフルオロフォアの間で異なる条件を満たす場合に起こり得る。ドナー放出スペクトルは、少なくとも部分的に、アクセプタ励起スペクトルと重なっていなければならない。したがって、蛍光体の選択は、このような実験のために重要です。そして、移動効率は、距離5の6乗で低下し、両方の分子が近く(通常はナノメートルの範囲)にある場合にのみ生じる。他の不測の事態は、双極子双極子配向などの伝達効率を変化させる可能性がありますが、蛍光熱管に柔軟性がある場合は軽減されます。
FRETは、異なる技術によって測定することができ、詳細な説明は文献6、7で見つけることができます。簡単に言えば、主な方法は:i)アクセプタ発光蛍光の変動に従い、主に定性的な結果を提供する感作放出に依存しています。ii)ドナー発光蛍光がアクセプタ光脱白の前後に測定されるアクセプタ光漂白(この場合、より正確なFRET推定値は達成できるが、固定サンプルに適用される強力なレーザーパワーを必要とする)。およびiii)アクセプタの存在下でドナーに対して減少する生涯測定。この方法は、特定の機器を必要とし、蛍光体間の正確で敏感な相互作用測定を可能にします。蛍光プローブとリグノセルロース間のFRET測定を考慮すると、主な難点は、リグノセルロースが単一のよく特徴付けられた蛍光色素ではないということです:それは主にリグニンに由来する強いネイティブおよびスペクトル幅の自己蛍光を有し、バイオマス種8、9に依存する。
本論文では、木材/植物試料の切片に適応した新しいオリジナルの手順を提案する。このsFLIMベースの方法は、天然のリグノセルロースサンプルにおける蛍光プローブとリグニン間の定量的FRET測定への道を開きます。
プロトコル
1. サンプル調製
注 : サンプルを準備するための一連の手順を図 1に示します。
- 植物サンプル調製
- 木製のトランクや断片から、その構造を損なうことなく、カミソリの刃で1センチの長いサンプルをカットします。
- ポリエチレングリコール(PEG)培地にサンプルを埋め込み、100%PEGに達するまで水中で希釈したPEG濃度を増加させる連続溶液に浸漬する。
- 真空下にサンプルを置き、水を除去します。
- 30% v/v PEG でサンプルを 24 時間軽くかき混ぜます。
- 50% v/v PEG でサンプルを 24 時間軽くかき混ぜます。
- 70°Cで24時間100%PEGでサンプルを穏やかに撹拌します(純粋なPEGは室温で固体です)。
- 70°C(ホットプレート上)のカプセルにサンプルを入れ、室温に達するまで徐々に温度を下げます。
- ミクロトームと使い捨てブレードを使用して、これらのPEGブロックから慎重に30-60μmの厚さのフラットセクションを準備します。
- セクションからPEGを除去するために5分間水の3つの連続した浴室でセクションを収集し、洗浄します。
- 蛍光プローブ調製
- pH 6.0で30mMリン酸の緩衝液を調製します。
- PEGランデキストランローダミンプローブパウダーを計量します。
- 0.1g/Lの最終濃度で暗闇中で1時間、ガラスバイアルで連続的に攪拌しながらプローブ粉末を緩衝液に溶解する。
- 植物試料染色
- 500 μLの蛍光プローブ(1.2.3を参照)を備えた切片を、暗闇の中のプラスチックチューブ(チューブあたり3セクション以下)で72時間(攪拌なし)にします。
- ブラシでセクションをピックアップし、クリーンシートでバッファを吸い込み(セクションの乾燥を避ける)、カバーガラスと#1.5Hカバースリップの間にインキュベートされたセクションを取り付けます。
2. 蛍光寿命とスペクトル測定システムキャリブレーション
注: sFLIM 測定の完全なワークフローを図 2に示します。
- sFLIM検出器のスペクトルウィンドウ幅を決定します。
- 0.17μmのガラス底のカルチャーボックスに尿素結晶を入れます。
- 培養ボックスを顕微鏡サンプルホルダーに置き、20倍の目的を選択します。
- 波長900nm、パワー2%のTi:Saレーザーを選択し、スキャンをオンにします。
- sFLIM検出器の2番目の高調波信号を収集します。
注:第2の高調波信号は、450 nmの励起波長のちょうど半分で放出されます。瞬時に、この測定はまた、システムの機器応答機能を提供します。 - 第2のスペクトルチャネル(462.5 nm)で第2の高調波信号が収集されるまで、レーザー励起波長を900から980nmまで徐々に調整します。
- スペクトル ウィンドウの長さ (12.5 nm) を決定します。
- スペクトル範囲が予想と異なる場合は、次の手順に従ってトラブルシューティングを行います。
- レーザーを910 nmに調整します。
- スクロールホイールでグレーティング位置を移動し、最初のチャンネルのみの第2高調波信号を測定します(第1チャンネル境界)。
- レーザーを935 nmに調整します。
- スクロールホイールで格子位置を移動し、第1チャンネルのみの第2高調波信号を測定します(第2チャンネル境界)。
- 全体的な分光計チャネルの口径測定
- 顕微鏡の段階に鏡を挿入します。
- 可視連続レーザー(458 nm、1%電力)を選択します。
- sFLIM検出器の反射信号を収集し、フォトンが適切なスペクトルチャネルで測定されているかどうかを確認します。
- 使用可能なすべての連続レーザー(514 nm、561 nm、633 nm)を使用して、手順 2.2.2 および 2.2.3 を繰り返します。
- スペクトルチャネルが予想と異なる場合は、スクロールホイールでグレーティング位置を移動し、手順2.1と2.2を繰り返します。
3. サンプル蛍光特性評価
- フィルムホルダーアクセサリー(例えば、Jasco FP-8500器具)を装備した分光フルオロメータに、植物断面試料(蛍光プローブでインキュベートしない)を入れます。
- 通常、300~600 nmの範囲で蛍光発光を測定し、サンプルを通常は250~550 nmの範囲で励起します。
- 蛍光強度と励起波長と発光波長をプロットして、3D 蛍光マップを描画します。
- プロットから最大励起/放出領域を決定します。
4. スペクトルFRET測定
- 自己蛍光キャリブレーション
- 目的 20x (NA: 0.8) を選択します。
- 2光子レーザー励起を750nmに設定します。
- スライドとカバースリップの間に小麦ストロー(WS)単独の植物セクションを置きます。
- ソフトウェアに次のパラメータを適用します。ラムダ モードに切り替えます。9.7 nmの分解能を持つスペクトル検出器ChSを選択します。スペクトル範囲を 420 ~ 722 nm で選択します。
- 画像を取得します。
- ドナー放出ピーク(この設定で470 nm)を決定します。
- アクセプタのキャリブレーション
- ローダミンベースの蛍光プローブを、0.17μmのガラス底のカルチャーボックスに入れます。
- 同じ設定で画像を取得します。
- アクセプタの放出ピーク(この設定では570 nm)を確認します。
- 最大の「WS単独」信号でスペクトル範囲を決定し、sFLIM測定のドナーのみの放出としてアクセプタ信号を持たない(この設定では460-490 nm)。
- サンプル測定
- ステンドプラントセクションをスライドとカバースリップの間に置きます。
- 同じ設定で画像を取得します。
- lsm ファイルを保存します。
- 強力なFRET事象を、「WS単独試料」と比較したドナー放出ピークの減少とローダミン試料と比較したアクセプタ放出ピークの増加と定性的に関連付ける。
5. sFLIM測定
注: sFLIM セットアップでは、使用されるシステムは、前の10で説明したように、時間ドメイン sFLIM セットアップです。直立顕微鏡と様々な時間相関単一光子計数カードと共焦点顕微鏡メーカーを使用することができ、プロトコルはそれに応じて適合する必要があります。
- システムを sFLIM モードに切り替えます。
- 4.1.1 および 4.1.2 の説明に従って共焦点顕微鏡を設定します。
- ソフトウェアの非デスキャンモードに切り替えて、sFLIM検出器に蛍光光子を送信します。
- sFLIM 取得をイネーブルモードに設定して、SPC150 でフォトンカウントを許可します。
- SPC150 で 30 s 時間コレクションを選択します。
- CFD が 1 x 105から 1 x 106の間であることを確認します。
注意: TCSPC カードで測定されるフォトンの数が常にレーザー励起周波数の 1% 未満であることを確認します(この設定では、レーザー励起周波数は 80 Mhz で、検出レートはどのピクセルでも 800 kHz を超え、積み重ね効果11を回避できません)。
- スライドとカバースリップの間に「WS単独」プラントセクションを配置します。
- レーザースキャンを許可するには、ソフトウェアを連続モードに設定します。
- サンプルの測定領域を選択します。
- SPC150 で[開始] をクリックします。
- sdt ファイルを保存します。
- 条件ごとに少なくとも 10 個のサンプルに対してこのプロセスを繰り返します。
- ステンドプラントセクションをスライドとカバースリップの間に置きます。
- 手順 5.2.1 ~ 5.2.5 を繰り返します。
6. sFLIM分析
- 「WS単独」でsFLIMデータ取得ファイルを選択し、ファイル |インポート:
- フィットパラメータを選択します。
- 開始オプション |[モデル] で、[不完全な多指数: 12.5 ns] を選択します。
- 開始オプション |環境設定で、[インストゥルメンタルレスポンスを自動的に計算]を選択します。
- メインパネルの右メニューから、2つの指数適合モデルを選択します。
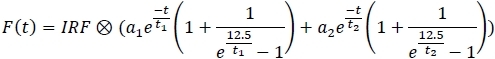
- 各チャネルに適合モデルを適用し、適合パラメータをスプレッドシートに保存します(1、a2、t1、t2)。
- チャネルと実験の比較のために、スプレッドシート内の平均蛍光寿命(Tm)を計算します。
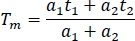
- すべてのチャネルのすべてのサンプル(少なくとも10)の平均寿命を計算します。
- ドナーチャンネル(チャンネル1~3:460-490 nm)でTmを分析し、最も高いフォトン番号を示し、リグニンの最大放出に対応する専用チャンネル(467.5 ~480 nmに対応するチャンネル2)を決定します。チャネル 2 の値は、ステップ 6.7 で使用する必要があります。
- 染色された WS 上の sFLIM データ取得ファイルを選択し、SPCImage ソフトウェアにインポートします。
- 手順 6.1 ~ 6.4 を繰り返します。
- 前に選択したチャネルWS単独(TmD)および染色された植物サンプル(TmDA)のドナーのためのFRET効率EFRETを計算する:
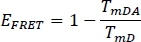
- WS とサンプルの間で sFLIM 値と EFRET値を比較します。
- WSとサンプルとの間の均質な寿命減少に関連する陽性EFRETをFRET事象として分析することを検討する(詳細については、Spriet et al.12およびTerryn et al.10による代表的な結果および作品を参照)。
- FRET とリグニンの圧縮レベルの組み合わせによるものと異なる方法で分布する寿命の減少を考慮し、分子相互作用として解釈しません。
- 測定可能なFRETシグナルの欠如として生涯の変更を考慮しないが、リグニンとの相互作用の欠如として考慮しない
結果
リグニンと蛍光タグ付けされた分子間の分子相互作用を解剖するsFLIM能力を実証するために、まず3つの異なるサンプル(図3):天然の小麦ストロー(WS)、ロダミン(PR10)でタグ付けされたPEGでインキュベートされた天然小麦ストロー、およびロダミン(DR10)でタグ付けされたデキストランを含む天然の小麦ストローを使用しました。PR10はリグニンと相互作用することが知られており、DR10は不活性13、14、15であると考えられている。sFLIM曲線(図3、上)は、参照サンプル(WS)と2つの相互作用ケース(DR10およびPR10)の間で達成できるいくつかの変更を示す。実際、ローダミン発光範囲に対応するスペクトル領域の蛍光増加に最初に容易に気付くことができる。3つの最初のチャネル光子減衰曲線を注意深く観察すると、PR10よりもDR10の方が強い変曲が明らかになります。フォトン減衰曲線をフィットさせ、各チャネル平均蛍光寿命を計算すると、FRET シグネチャがより明らかになります (図 3、下)。実際、WSサンプルの蛍光スペクトルに沿って蛍光寿命が代替的に増加および減少する一方で、PR10とDR10の両方について明確なFRETシグネチャが観察され、1)ドナーのみの発光チャネル(3つの最初のチャネル、青色)における一定の寿命値が観察されます。2)高寿命ドナーフルオロフォアの寄与の増加に対応するスペクトルチャネルにおける蛍光寿命の増加。
明確なFRETが決定されると、リグニン蛍光寿命(チャネル2)の比較は、WS(0.47 ns)、DR10(0.42ns)とPR10(0.36ns)の間の寿命減少の定量化を可能にし、したがって、リグニンとリグニンとの間の分子相互作用を明らかにするPR10とDR10の両方に対して、PR10に対する親和性が高くなっています。
異なる相互作用レベルを定量化するこの方法の関連性を説明するために、酸処理WS(AWS)と5kDaと20 kDa(PR5およびPR20)の2つの対照的な分子量のPRと組み合わせて、処理された植物サンプルに対する酵素のアクセシビリティを模倣する3つのサンプルを選択します。sFLIM シグネチャを注意深く検査した後、リグニン蛍光寿命が抽出されます (図 4)。前述したように、リグニン蛍光寿命は、その環境16、17によって変更され得る。酸処理後、AWS(0.28 ns)の蛍光寿命測定値はWS(0.47 ns)で以前に測定されたものよりも低くなり、寿命の明確な解釈のためのsFLIM手順の要件と、テストされた各条件に対する負のコントロールの必要性が確認されます。予想どおり、リグニンと対話しながら AWS に PR を追加すると、強力な寿命の減少が見られます。さらに、PR20(0.16ns)と比較してPR5(0.14ns)との相互作用は、流体力学的半径測定(それぞれPR5およびPR20の2.3nmおよび4.8 nm)と一致し、異なる立体制約を誘発し、したがってリグニンに対するPR5のより高いアクセシビリティを誘導する。
両方の実験は、酵素とのリグニン相互作用を細かく評価するこの方法の関連性を実証し、その大きさと植物サンプルの前処理に応じて。

図1:サンプルの異なる調製ステップ。小麦ストロー(WS)(A)は、まずPEG培地(C)に埋め込まれるサイズ(B)を小さくする。ブロックは使い捨てブレード(D)を装備したミクロトームを使用してカットされます。洗浄後、得られたセクション(E)は、PEGまたはデキストランタグ付きロダミン溶液(F)でインキュベーションするために配置される。ラベル付きセクションは、sFLIM測定用に取り付けられています(G)。スケールバーは2cm(A)、1cm(BおよびC)、200μm(EおよびG)です。この図の大きなバージョンを表示するには、ここをクリックしてください。
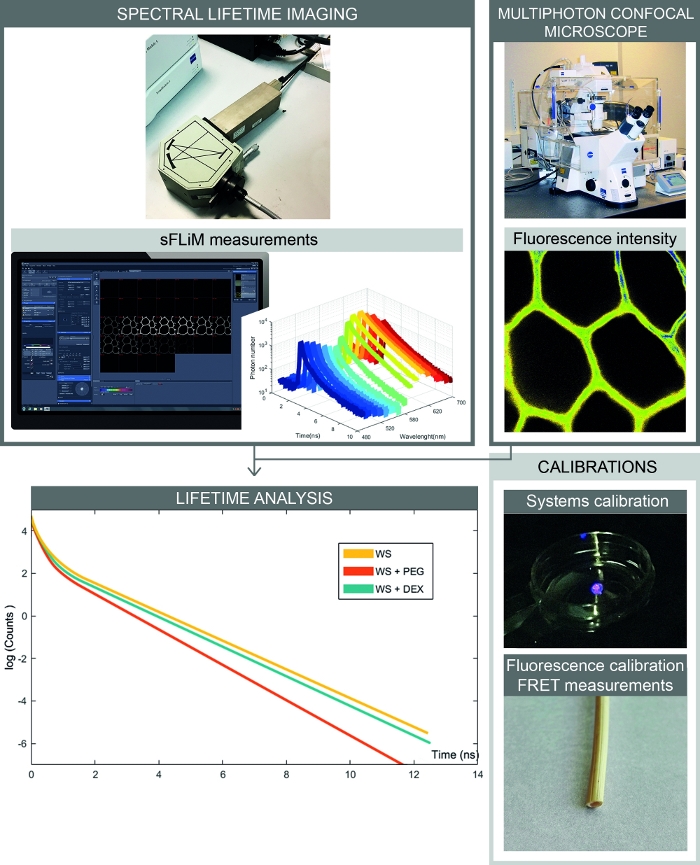
図2:スペクトルFRETベースの相互作用測定の完全なワークフロー図は、スペクトル蛍光強度と寿命測定を組み合わせたセットアップを示しています。スペクトル蛍光画像は共焦点顕微鏡で取得し、各スペクトル範囲の順次蛍光寿命はsFLIM検出器で測定されます。光子崩壊曲線の分析により、目的のサンプルと分子間の相互作用を正確に測定できます。キャリブレーションは、アーティファクトを避けるために処理する必要があります。まず、sFLIM検出器をスペクトルキャリブレーションする必要があり、その器械応答関数をチェックする必要があります。第二に、複雑な自己蛍光信号は、アクセプタ分子を添加する前に各チャネルの蛍光寿命を決定するために、各サンプルに対して正確に較正されなければならない。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:代表的なsFLIM測定値。sFLIM曲線(トップパネル)は、天然の小麦ストロー(WS)で取得し、WSはロダミン(WS+PEG)でタグ付けされたPEGと、ロダミン(WS+DEX)でタグ付けされたデキストランで天然の小麦ストローでインキュベートしました。各サンプルについて、sFLIM曲線に二指数減衰モデルを取り付け、平均蛍光寿命を各チャネル(下部パネル)について計算した。WS+PEGおよびWS+DEXサンプルは、自己蛍光とローダミンの混合発光に対応するチャネルの寿命増加に関連する自己蛍光のみに対応するチャネル(3つの最初のバー)における蛍光寿命の減少を示す。この挙動は、リグニンとロダミンタグ分子の間のFRET事象の特徴である。この図の大きなバージョンを表示するには、ここをクリックしてください。
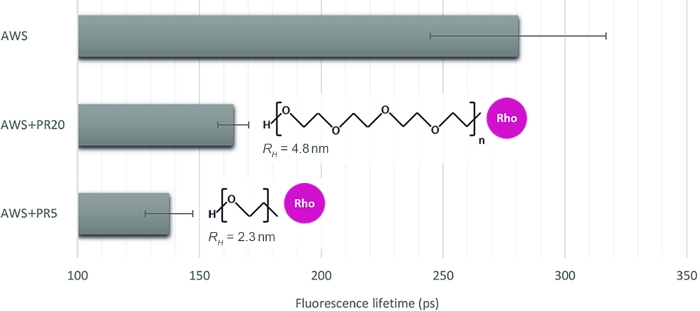
図4:リグニン自己蛍光に対応するチャネルの蛍光寿命分析。sFLIM シグネチャに基づいて FRET イベントを検証した後、平均蛍光寿命を酸処理 WS(AWS)で測定し、PR5 または PR20 (それぞれ 5 kDa および 20 kDa) と組み合わせて測定した。両方のPRサンプルは寿命の減少を示すが、小さい方はより強い寿命減少によって特徴付され、リグニンとのより強い分子相互作用を明らかにする。したがって、このメソッドは、両方を区別するのに十分に敏感です (平均値と標準誤差は、条件ごとに n>10 を表します)。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
蛍光寿命と発光スペクトル測定を相関させることで、両方の方法の利点を組み合わせることができる。確かに、スペクトル測定だけでは感度が欠如し、定性的なままです。一方、蛍光寿命は従来の定量的FRET測定に選択する方法であるが、リグニンの自己蛍光はリグニン組成および環境16によって異なる可能性があることが実証された。したがって、アクセプタまたはリグニン構造変化とのリグニン相互作用は、いずれも生涯の減少をもたらすため、判別できません。実証したように、開発された方法は、植物切片におけるリグニンとアクセプタ分子間の相互作用の明確で、敏感で定量的な測定を提供する。方法の異なるステップが厳密に最適化された場合でも、以下の点については特に注意が必要です。
サンプルに関しては、植物セクションの品質は、焦点の中でのイメージングを確保するために重要です。PEG 埋め込みのさまざまな手順に厳密に従う必要があります。最終的な洗浄工程は、サンプル中に残っているPEGからの干渉を防ぐために不可欠です。さらに、任意の変化は蛍光特性に強い影響を与えることができるので、バッファー濃度とpHは、すべての測定で厳密に同一に保つ必要があります。
寿命測定も繊細です。ドナーの蛍光寿命は、例えば励起が高いために不安定になることがある。このような場合は、レーザーパワーとズームを調整すると問題を解決できます。TCSPC測定におけるアーティファクトのもう一つのよく知られた源は、フォトンパルスの積み重ねである。実際、TCSPC は、同じ 2 つのレーザー パルス間で放出される 2 つのフォトンの速度を測定できません。植物サンプルは高度に構造化されていますが、蛍光は均質ではなく、隠れたパルス積み重ね効果につながる可能性があります。1 秒あたりのフォトンの数は 1% 励起制限を下回ったままですが、一部のサンプル領域では高くなる可能性があります。積み重ね実験を行わないように、異なる光子フラックスでのドナー蛍光寿命の測定を検討することができる。フラックスが減少する間に寿命が長くなると、パイルアップ効果が測定値を変更します。最適な光子フラックスはドナーの生涯安定性と達する。
sFLIM減衰曲線解析に関しては、モデルが測定を正確に記述できるように、個々の曲線フィットに依存することをお勧めします。そうでない場合は、まず、前述のアーティファクトのいずれもデータを破損していないことを確認します。次に、ステップ 2.1.4 は、システムのインストゥルメンタル応答関数 (IRF) を提供します。IRF に異常がある場合は、光パスを最適化して最小化します。ステップ6.2の間に合う測定されたIRFはまた使用することができる。最後に、継手モデルの自由度をステップ 6.2 で 3 指数減衰に増やすことができます。ただし、個々の寿命と比率の決定に必要なフォトンの数は多いため、手順 6.4 からより安定した平均寿命を達成するためにのみ使用することをお勧めします。FLIMに関するより網羅的な情報は、その特徴付け18、sFLIM及びその適用12、特にリグニン10に対して、文献に記載されている。
困難ですが、ネイティブ自己蛍光を用いた植物組織におけるFRET測定はいくつかの利点を示しています。生体分子間の相互作用研究がしばしば本質的な蛍光マーカーを発現するために遺伝子工学を必要とする生体組織に対して行われるFRET測定と比較して、ここで提示されるものとして、組織化された植物組織は、自然を提供する自己蛍光、および外因性パートナーの蛍光プローブを簡単に追加できるため、時間を大幅に節約できます。しかし、分析された植物種や可能な前処理に応じて、自己蛍光が改変される可能性が高いので、プローブとして使用する蛍光を注意深く特徴付け、蛍光色素を適応させる必要がある場合があります。
sFLIM法は、触媒活性を欠く蛍光プローブ(PEGおよびデキストラン)に適用されなければならない。植物リグノセルロース加水分解のフレームでは、種々のバイオマス試料中の酵素の相互作用が行われ、相互作用強度に対する局在化(細胞および組織)の影響の決定をもたらす可能性がある。次の最適化ステップは、分析ステップの自動化です。実際、十分な分析データがあれば、機械学習ベースの分析手順を自動表現型分析用に展開することができ、酵素バイオマス効率の高速スクリーニングに対する制素性が向上します。さらに、sFLIMは試料の固定化を必要とせず、動的酵素-リグニン相互作用研究に容易に適用することができる。このようなユニークな方法は、リグノセルロースのバロリゼーションを最適化するために、酵素工学戦略とバイオマス前処理を導く可能性が高い。
開示事項
著者たちは何も開示する必要はない。
謝辞
ファニー・ローラン(FARE)は、フィギュアの準備に温かく感謝しています。研究連盟FRABio(リール大学、CNRS)は、この作業を達成するための技術的な環境を提供するために認めされています。資金はフランス国立研究機関(LIGR-14-CE05-0026)から得られました。
資料
| Name | Company | Catalog Number | Comments |
| Confocal microscope | ZEISS | LSM 710 NLO | for confocal imaging |
| fine brush | to collect sections | ||
| glass vials | for incubations | ||
| high precision microscope cover glasses 170+/-5µm n°1,5# | Marienfeld | 0107032 | saled by Dutscher s.a in France |
| Infra-red pulsed laser | COHERENT | CHAMELEON VISION | For sample excitation |
| Micropipette Research Plus monocanal 20-200µL | Eppendorf | with corresponding tips | |
| Micropipette Research Plus monocanal 2-20µL | Eppendorf | with corresponding tips | |
| Microscope slides ca. 76 x 26 mm ground edges frosted end | Thermo Fisher Scientific | LR45D | |
| microtome blades disposable (pack of 50) | Agar Scientific | T5024 | saled by Oxford Instruments in France |
| mPEG-Rhodamine, 10 kDa | Creative Peg Works | PSB-2263 | |
| mPEG-Rhodamine, 20 kDa | Creative Peg Works | PSB-22642 | |
| mPEG-Rhodamine, 5 kDa | Creative Peg Works | PSB-2264 | |
| nail polish | for mounting | ||
| pH meter five easy plus | Mettler toledo | FEP20 | with electrode |
| poly (ethylene Glycol) average mol wt 1450 | Merck (sigma-Aldrich) | P5402-1kg | for sample embedding |
| razor blades, single edges blades, stainless steel, box of 100 | Agar Scientific | T586 | for fragments preparation saled by Oxford Instruments in France |
| rotary microtome | Microm Microtech | HM 360 | |
| sFLim detector | BECKER-HICKL | SPC 150 | for lifetime acquisition |
| sodium dihydrogen phosphate dihydrate NaH2PO4, 2H2O | Merck (sigma-Aldrich) | 71500 | for buffer solution |
| sodium phosphate dibasic dihydrate Na2HPO4,2H2O | Merck (sigma-Aldrich) | 30435-1kg | for buffer solution, old reference, the new one is 71643-1kg |
| tetramethyl rhodamine isothiocyanate-dextran 10 k Da | Merck (sigma-Aldrich) | R8881-100mg |
参考文献
- Inouye, H., et al. Multiscale deconstruction of molecular architecture in corn stover. Scientific Reports. 4, 3756(2014).
- Li, X., Zheng, Y. Lignin-enzyme interaction: Mechanism, mitigation approach, modeling, and research prospects. Biotechnology Advances. 35 (4), 466-489 (2017).
- Vogel, J. Unique aspects of the grass cell wall. Current Opinion in Plant Biology. 11 (3), 301-307 (2008).
- Lynd, L. R. The grand challenge of cellulosic biofuels. Nature Biotechnology. 35, 912(2017).
- Clegg, R. M. Fluorescence resonance energy transfer. Current Opinion in Biotechnology. 6, 103-110 (1995).
- Ishikawa-Ankerhold, H. C., Ankerhold, R., Drummen, G. P. C. Advanced fluorescence microscopy techniques-FRAP, FLIP, FLAP, FRET and FLIM. Molecules. 17 (4), 4047-4132 (2012).
- Pietraszewska-Bogiel, A., Gadella, T. W. J. FRET microscopy: from principle to routine technology in cell biology. Journal of Microscopy. 241 (2), 111-118 (2011).
- Herbaut, M., et al. Multimodal analysis of pretreated biomass species highlights generic markers of lignocellulose recalcitrance. Biotechnology for Biofuels. 11, 52(2018).
- Chabbert, B., et al. Fluorescence techniques can reveal cell wall organization and predict saccharification in pretreated wood biomass. Industrial Crops and Products. 123, 84-92 (2018).
- Terryn, C., Paës, G., Spriet, C. FRET-SLiM on native autofluorescence: a fast and reliable method to study interactions between fluorescent probes and lignin in plant cell wall. Plant Methods. 14 (1), 74(2018).
- Jovin, T. M., Arndt-Jovin, D. J. Cell Structure and Function by Microspectrofluorometry. Kohen, E. , Academic Press. 99-117 (1989).
- Spriet, C., et al. Correlated fluorescence lifetime and spectral measurements in living cells. Microscopy Research and Technique. 70 (2), 85-94 (2007).
- Donaldson, L. A., Newman, R. H., Vaidya, A. Nanoscale interactions of polyethylene glycol with thermo-mechanically pre-treated Pinus radiata biofuel substrate. Biotechnology and Bioengineering. 111 (4), 719-725 (2014).
- Herbaut, M., Zoghlami, A., Paës, G. Dynamical assessment of fluorescent probes mobility in poplar cell walls reveals nanopores govern saccharification. Biotechnology for Biofuels. 11 (1), 271(2018).
- Paës, G., Chabbert, B. Characterization of arabinoxylan / cellulose nanocrystals gels to investigate fluorescent probes mobility in bio-inspired models of plant secondary cell wall. Biomacromolecules. 13, 206-214 (2012).
- Donaldson, L. A., Radotic, K. Fluorescence lifetime imaging of lignin autofluorescence in normal and compression wood. Journal of Microscopy. 251 (2), 178-187 (2013).
- Auxenfans, T., Terryn, C., Paës, G. Seeing biomass recalcitrance through fluorescence. Scientific Reports. 7, 8838(2017).
- Waharte, F., Spriet, C., Héliot, L. Setup and characterization of a multiphoton FLIM instrument for protein-protein interaction measurements in living cells. Cytometry A. 4, 299-306 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved