Method Article
Floresan Problar ve Lignin Bitki Kesitlerinde Doğal Otofloresan Dayalı SFLIM Ile Etkileşimlerinin Ölçülmesi
Bu Makalede
Özet
Bu protokol, förster rezonans enerji transferini (FRET) rhodamine bazlı floresan problar ve lignin polimeri arasında doğrudan kalın bitki bölümlerinde değerlendirmek için spektral ve floresan ömür ölçümlerini birleştiren orijinal bir kurulum tanımlamaktadır.
Özet
Lignoselülozik biyokütlede (LB), enzimlerin aktivitesi hidroliz işlemi sırasında lignin ile non-spesifik etkileşimlerin görünümü ile sınırlıdır, hangi enzimler uzak onların substrat korur. Bu karmaşık etkileşimlerin karakterizasyonu bu nedenle LB gibi karmaşık yüzeylerde bir meydan okumadır. Buradaki yöntem, Förster rezonans enerji transferi (FRET) tarafından ortaya çıkarılan florofor etiketli moleküller ve yerli otofloresan lignin arasındaki moleküler etkileşimleri ölçer. İki eksojen florofor kullanarak canlı hücrelerde FRET ölçümlerinin aksine, lignin kullanan bitkilerdeki FRET ölçümleri karmaşık otofloresansnedeniyle önemsiz değildir. Floresan'ın iki tamamlayıcı özelliğinin ilişkili gözlemi ile orijinal bir satın alma ve analiz boru hattı geliştirdik: floresan emisyon ve ömür. sFLIM (spektral ve floresan yaşam boyu görüntüleme mikroskobu) biyomoleküller ve lignin arasındaki farklı etkileşim düzeylerini ortaya koyarak, yüksek duyarlılık ile bu etkileşimlerin niceliğini sağlar.
Giriş
Glikoz gibi monomerik şekerler içine lignoselüloz hidrolize enzimler gerektirir. Onların aktivitesi enzimler ve lignin arasında non-spesifik etkileşimlerin kurulması ile ölçülü olduğu bilinmektedir1,2,ikinci bir hidrofobik polimer ve lignoselüloz önemli bir bileşeni olan3. Bu nedenle, bu tür etkileşimleri doğrudan hücresel ölçekte kantitatif olarak ölçmek enzim katalitik aktivitesini optimize etmek ve lignoselüloz tedavi öncesi4'üoptimize etmek için ele alınması gereken bir sorundur.
Förster (veya floresan) rezonans enerji transferi (FRET) ölçümü biyomoleküllerin etkileşimini yerinde değerlendirmek için tercih edilir bir yöntemdir. Bu olmayan Radyatif enerji transferi farklı koşulları yerine getirmeleri halinde bir donör ve bir alıcı florofor arasında oluşabilir. Donör emisyon spektrumu, en azından kısmen, kabul eden uyarma spektrumu örtüşmelidir. Bu nedenle florofor seçimi bu tür deneyler için çok önemlidir. Daha sonra, aktarım verimliliği onların mesafe5 altıncı güç ile azalır ve sadece her iki molekül yakın yakın (genellikle nanometre aralığında) oluşur. Dipol-dipol oryantasyonu gibi transfer verimliliğini diğer acil durumlar değiştirebilir, ancak floroforların esnekliği varsa azaltılır.
FRET farklı tekniklerle ölçülebilir veliteratürdedetaylı açıklamalar bulunabilir 6,7. Kısacası, ana yöntemler emisyonu temel: i) hangi kabul veya emisyon floresan varyasyon takip edilir ve esas olarak nitel sonuçlar sağlar duyarlı emisyon; ii) donör emisyon floresanının kabul edilen den önce ve sonra ölçüldüğü kabul veya fotobeyazrlama (Bu durumda, daha hassas FRET tahminleri elde edilebilir ancak sabit numunelere uygulanan güçlü lazer gücü gerektirir); ve iii) kabul edenin varlığında donör için azalan yaşam boyu ölçümü. Bu yöntem belirli aletler gerektirir ve floroforlar arasında hassas ve hassas etkileşim ölçümleri sağlar. Floresan problar ve lignoselüloz arasındaki FRET ölçümü göz önüne alındığında, ana zorluk lignoselüloz tek bir iyi karakterize florofor değildir: güçlü bir yerli ve spectrally-geniş otofloresans vardır, esas olarak lignin kaynaklanan, ve biyokütle türlerine bağlı8,9.
Bu yazıda, ahşap/bitki örneklerinin bölümlerine uyarlanmış yeni ve özgün bir prosedür öneriyoruz. Bu sFLIM bazlı yöntem, yerli lignoselüloz örneklerinde floresan problar ve lignin arasındaki nicel FRET ölçümlerinin yolunu açar.
Protokol
1. Örnek hazırlama
NOT: Örnekleri hazırlamak için ardışık adımlar Şekil 1'deaçıklanmıştır.
- Bitki numunesi hazırlama
- Ahşap gövdelerden veya parçalardan, 1 cm uzunluğundaki numuneleri, yapılarına zarar vermeden jiletlerle kesin.
- Numuneleri %100 PEG'e ulaşana kadar suda seyreltilmiş PEG konsantrasyonunun art arda çözeltilere batırarak polietilen glikol (PEG) ortamına yerleştirin.
- Suyu çıkarmak için numuneyi vakumun altına yerleştirin.
- Numuneleri %30 v/v PEG'de 24 saat boyunca hafifçe karıştırın.
- Örnekleri %50 v/v PEG'de 24 saat boyunca hafifçe karıştırın.
- 70 °C'de 24 saat boyunca %100 PEG'de numuneleri hafifçe karıştırın (saf PEG oda sıcaklığında katıdır).
- Numuneleri 70 °C'de (sıcak plakaüzerine) kapsüllere yerleştirin ve oda sıcaklığına ulaşıncaya kadar sıcaklığı kademeli olarak düşürün.
- Bir mikrotom ve tek kullanımlık bıçaklar kullanarak bu PEG bloklardan 30-60 μm kalınlığında düz kesitleri dikkatlice hazırlayın.
- Peg'i bölümlerden çıkarmak için 5 dk boyunca art arda üç banyoda bölümleri toplayın ve yıkayın.
- Floresan sonda hazırlama
- 30 mM fosfat tampon çözeltisini pH 6.0'da hazırlayın.
- PEG rhand dextran rhodamine prob tozu tartın.
- 0,1 g/L'lik son konsantrasyonda karanlıkta 1 saat boyunca cam bir şişede sürekli karıştırarak sonda tozunu tampona çözün.
- Bitki numunesi boyama
- Karanlıkta plastik bir tüpte (tüp başına en fazla 3 bölüm) 72 saat (karıştırma yok) için 500 μL floresan probu (bkz. 1,2,3) ile kuluçka bölümleri.
- Bir fırça ile bir bölüm pick-up, temiz bir levha ile tampon adsorb (bölümü kurutma önlemek), ve sonra bir kapak cam ve #1.5H coverslip arasında kuluçka bölümleri monte.
2. Floresan sayılyıç ömrü ve spektral ölçüm sistemi kalibrasyonu
NOT: SFLIM ölçümü için tam iş akışı Şekil 2'desunulmuştur.
- sFLIM dedektörünün spektral pencere genişliğini belirleyin.
- 0,17 μm cam alt ile bir kültür kutusuna üre kristalleri koyun.
- Kültür kutusunu bir mikroskop örnek tutucuya yerleştirin ve 20x hedefini seçin.
- 900 nm dalga boyuna ve %2 güce sahip bir Ti:Sa lazerseçin ve taramayı açın.
- SFLIM dedektöründeki ikinci harmonik sinyali toplayın.
NOT: İkinci harmonik sinyal 450 nm tam yarım uyarma dalga boyunda yayılır; anlık iken, bu ölçü aynı zamanda sistemin enstrümantal yanıt fonksiyonu sağlar. - İkinci spektral kanalda (462,5 nm) ikinci harmonik sinyal toplanana kadar lazer uyarma dalga boyunu 900'den 980 nm'ye kademeli olarak ayarlayın.
- Spektral pencere uzunluğunu (12,5 nm) belirleyin.
- Spektral aralık beklenenden farklıysa, aşağıdakileri yaparak sorun giderme.
- Lazeri 910 nm'ye ayarlayın.
- Sadece ilk kanaldaki ikinci harmonik sinyali ölçmek için ızgara konumunu kaydırma tekerleği ile hareket ettirin (ilk kanal sınırı).
- Lazeri 935 nm'ye ayarlayın.
- Sadece birinci kanaldaki ikinci harmonik sinyali ölçmek için ızgara konumunu kaydırma tekerleği ile hareket ettirin (ikinci kanal sınırı).
- Genel spektrometre kanallarının kalibrasyonu
- Aynayı mikroskop aşamasına yerleştirin.
- Görünür sürekli lazeri seçin (458 nm, %1 güç).
- SFLIM dedektöründeki yansıma sinyalini toplayın ve fotonların uygun spektral kanalda ölçülüp ölçülmedigini kontrol edin.
- Tüm mevcut sürekli lazerlerle (514 nm, 561 nm ve 633 nm) 2.2.2 ve 2.2.3 adımlarını tekrarlayın.
- Spektral kanal beklenenden farklıysa, kaydırma tekerleği ile ızgara konumunu hareket ettirin ve 2.1 ve 2.2 adımlarını tekrarlayın.
3. Örnek floresan karakterizasyonu
- Film tutucu aksesuarı (örneğin, Jasco FP-8500 cihazı) ile donatılmış bir spektroflorometrede, bitki kesiti örneğini yerleştirin (floresan prob ile kuluçkaya yatırılamaz).
- Floresan emisyonungenellikle 300-600 nm aralığında ölçün, numuneyi ise genellikle 250-550 nm aralığında heyecanlandırın.
- Floresan şiddetini uyarma ve emisyon dalga boylarına karşı çizin ve 3B floresan haritasını çizin.
- Çizimden maksimum uyarma/emisyon alanını belirleyin.
4. Spektral FRET ölçümü
- Otofloresan kalibrasyon
- Hedef 20x'i seçin (NA: 0.8).
- 750 nm iki foton lazer uyarma ayarlayın.
- Buğday saman (WS) tek başına bitki bölümü slayt ve coverslip arasında yerleştirin.
- Yazılımda aşağıdaki parametreleri uygulayın. Lambda moduna geçin. 9,7 nm çözünürlüğe sahip spektral dedektör ChS'yi seçin. 420 ile 722 nm arasındaki spektral aralığı seçin.
- Görüntüyü edinin.
- Donör emisyon tepe noktasını (bu kurulumla 470 nm) belirleyin.
- Acceptor kalibrasyonu
- 0,17 μm cam alt ile bir kültür kutusuna rhodamine bazlı floresan problar yerleştirin.
- Görüntüyü aynı ayarda edinin.
- Kabul eden emisyon tepe noktasını (bu kurulumla 570 nm) belirleyin.
- SFLIM ölçümleri için donör sadece emisyon (bu kurulum ile 460-490 nm) olarak maksimum "WS tek başına" sinyali ve hiçbir kabul sinyali ile spektral aralığı belirleyin.
- Örnek ölçümü
- Lekeli bitki bölümünü slayt ve kapak lı kayma arasına yerleştirin.
- Görüntüyü aynı ayarda edinin.
- LSM dosyasını kaydedin.
- Güçlü bir FRET olayını "WS tek başına numune" ile karşılaştırıldığında donör emisyon zirvesinde ki azalma ve rhodamine örneğine kıyasla kabul edici emisyon zirvesinde ki artışla ilişkilendirin.
5. sFLIM ölçümleri
NOT: sFLIM kurulumu için kullanılan sistem, daha önce10olarak açıklandığı gibi bir zaman etki alanı sFLIM kurulumudur. Dik mikroskop ve çeşitli zaman ilişkili tek foton sayma kartları ve konfokal mikroskop üreticileri kullanılabilir ve protokol buna göre uyarlanmalıdır.
- Sistemi sFLIM moduna geçin.
- Konfokal mikroskobu 4.1.1 ve 4.1.2'de açıklandığı şekilde ayarlayın.
- Floresan fotonları sFLIM dedektörüne göndermek için yazılımdaki Descanned olmayan moduna geçin.
- SPC150'de foton sayılmasına izin vermek için sFLIM edinimi etkinleştir metodunu etkinleştir metodunu ayarlayın.
- SPC150'de 30 s zaman koleksiyonunu seçin.
- CFD'nin 1 x 105 ile 1 x 106arasında olup olmadığını kontrol edin.
DİkKAT: TCSPC kartında ölçülen foton sayısının lazer uyarma frekansının her zaman %1'inden az olduğundan emin olun (Bu kurulumda lazer uyarma frekansı 80 Mhz'dir ve algılama oranı herhangi bir pikselde 800 kHz'yi geçemez ve bir yığın etkisinden kaçınmak için11).
- "TEK BAŞıNA" bitki bölümünü slayt ve kapak kayması arasına yerleştirin.
- Lazer tetkikini sağlamak için yazılımı Sürekli moduna ayarlayın.
- Örnekteki ölçüm alanını seçin.
- SPC150'ye Başlat'ı tıklatın.
- sdt dosyasını kaydedin.
- Koşul başına en az 10 örnek için işlemi tekrarlayın.
- Lekeli bitki bölümünü slayt ve kapak lı kayma arasına yerleştirin.
- Adımları 5.2.1 - 5.2.5'i tekrarlayın.
6. sFLIM analizi
- "Yalnızca WS"de edinilen sFLIM verilerini seçin ve Dosyayı kullanarak SPCImage yazılımına aktarın | İthalat.
- Sığdırama parametrelerini seçin.
- Seçenekten | Model, Eksik çoküstel seçin: 12,5 ns.
- Seçenekten | Tercihler, Enstrümantal Yanıtı otomatik olarak hesapla'yıseçin.
- Ana panelin sağ menüsünden 2 üstel sığdırmayı seçin:
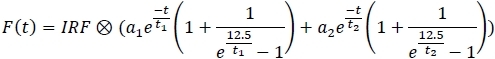
- Her kanal için montaj modelini uygulayın ve uygun parametreleri elektronik tabloya kaydedin(1, a2, t1, t2).
- Kanallar ve deneyler arasında karşılaştırma için, bir elektronik tablodaki ortalama floresan ömrünü hesaplayın (Tm):
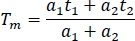
- Tüm kanallardaki tüm örneklerin (en az 10) ortalama kullanım ömrünü hesaplayın.
- Donör kanallarda Tm'yi analiz edin (kanal 1'den 3:460-490 nm'ye kadar) ve en yüksek foton numarasını gösteren ve lignin maksimum emisyonuna karşılık gelen özel kanalı (Kanal 2 467,5 - 480 nm'ye karşılık gelen) belirleyin. Kanal 2'deki değerler adım 6.7'de kullanılmalıdır.
- Lekeli WS'de edinilen sFLIM verilerini seçin ve Bunları SPCImage yazılımına aktarın.
- Adımları 6.1-6.4'e tekrarlayın.
- Önceki seçilen kanal WS Alone (TmD)ve lekeli bitki numunesi (TmDA)donör için FRET verimliliği EFRET hesaplayın:
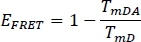
- WS ve örnek arasında sFLIM ve EFRET değerlerini karşılaştırın.
- WS ile örnek arasında homojen bir yaşam boyu azalma ile ilişkili pozitif bir EFRET'in fret olayı olarak analiz edilmesi gerektiğini düşünün (ayrıntılar için Spriet ve ark.12 ve Terryn ve ark.10'un temsili sonuçları ve çalışmalarına bakın).
- FRET ve lignin sıkıştırma seviyesinin bir karışımına bağlı olarak farklı dağılmış bir ömür boyu düşüşü düşünün ve moleküler etkileşimler olarak yorumlamayın.
- Ölçülebilir FRET sinyalinin yokluğu olarak hiçbir ömür boyu değişiklik düşünün, ancak lignin ile etkileşim eksikliği olarak değil
Sonuçlar
Lignin ve floresan etiketli moleküller arasındaki moleküler etkileşimleri parçalama sFLIM yeteneğini göstermek için, ilk olarak üç farklı örnek kullandık(Şekil 3):yerli buğday samanı (WS), peg ile kuluçkaya yatan yerli buğday samanı rhodamine (PR10) ve eşkenar izam ile etiketlenmiş yerli buğday samanı (DR10). DR10 inert olması gerekiyordu pr10 lignin ile etkileşime olduğu bilinmektedir13,14,15. sFLIM eğrileri(Şekil 3, üstte) referans örnek (WS) ve iki etkileşim olgusu (DR10 ve PR10) arasında elde edilebilen bazı değişiklikler gösterir. Gerçekten de, bir ilk kolayca rhodamine emisyon aralığına karşılık gelen spektral bölgelerde floresan artış fark edebilirsiniz. Üç ilk kanal foton bozunma eğrileri dikkatli gözlem de PR10 için daha DR10 için daha güçlü bir çekim ortaya koymaktadır. Foton bozunma eğrileri takılmıŠve her kanal ortalama floresan yıllık hesaplaÅ tıktan sonra FRET imzası daha belirgin hale gelir(Şekil 3, alt). Gerçekten de, floresan ömrü alternatif olarak artar ve WS örnek için floresan spektrum boyunca azalır iken, açık bir FRET imza ile hem PR10 ve DR10 için gözlenir: 1) donör sadece emisyon kanalında sabit bir ömür boyu değer (3 ilk kanallar, mavi); ve 2) spektral kanal da artan bir floresan ömrü yüksek ömür boyu donör florofor artan bir katkıkarşılık.
Net FRET belirlendikten sonra, lignin floresan ömür müddeti (kanal 2) karşılaştırılması, WS (0,47 ns), DR10 (0,42 ns) ve PR10 (0,36 ns) arasındaki yaşam boyu azalmanın nicelleştirilmesini sağlar ve böylece lignin ile hem PR10 hem de DR10, PR10'a daha güçlü bir yakınlık la karşı.
Farklı etkileşim düzeylerini ölçmek için bu yöntemin alaka düzeyini göstermek için, işlenmiş bitki örnekleri üzerine enzim erişilebilirliğini taklit eden üç örnek daha seçiyoruz: 5 kDa ve 20 kDa (PR5 ve PR20) iki kontrastmoleküler molekül ağırlığının PR'ı ile birlikte asitle tedavi edilmiş WS (AWS). SFLIM imzalarının dikkatli bir şekilde incelenmesinden sonra lignin floresan ömrü ayıklanır (Şekil 4). Daha önce belirtildiği gibi, lignin floresan ömrü çevresi tarafından değiştirilebilir16,17. Asit tedavisinden sonra, AWS'deki floresan yaşam boyu önlemleri (0,28 ns) WS (0,47 ns) için önceden ölçülenden daha düşük olur ve bu da yaşam boyu azalmanın kesin yorumlanması ve test edilen her durum için negatif kontrol gereksinimini doğrular. Beklendiği gibi, lignin ile etkileşimde iken AWS pr eklerken güçlü bir yaşam boyu azalma gözlenir. Ayrıca, etkileşim PR5 ile daha güçlüdür (0.16 ns) PR20 (0.16 ns), hangi onların hidrodinamik yarıçap ölçümü ile tutarlı (2.3 nm ve 4.8 nm PR5 ve PR20 için, sırasıyla), farklı steric kısıtlamaları indükleyen ve böylece lignin PR5 daha yüksek erişilebilirlik.
Her iki deney de, lignin enzimlerle olan etkileşimlerini, boyutlarına ve bitki örneklerine göre tedavi öncesi olarak ince bir şekilde değerlendirmek için bu yöntemin alaka durumunu göstermektedir.

Şekil 1: Örneklerin farklı hazırlama adımları. Buğday saman (WS) (A) ilk boyutu azalır(B) PEG orta gömülü olmak (C). Blok tek kullanımlık bıçaklar(D)ile donatılmış bir mikrotom kullanılarak kesilir. Yıkandıktan sonra, ortaya çıkan kesitler (E) PEG veya dextran etiketli-rodazin çözeltisi (F)kuluçka için yerleştirilir. Etiketli bölümler sFLIM ölçümleri için monte edilmiştir (G). Pul çubukları 2 cm (A), 1 cm (B ve C), 200 μm (E ve G'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
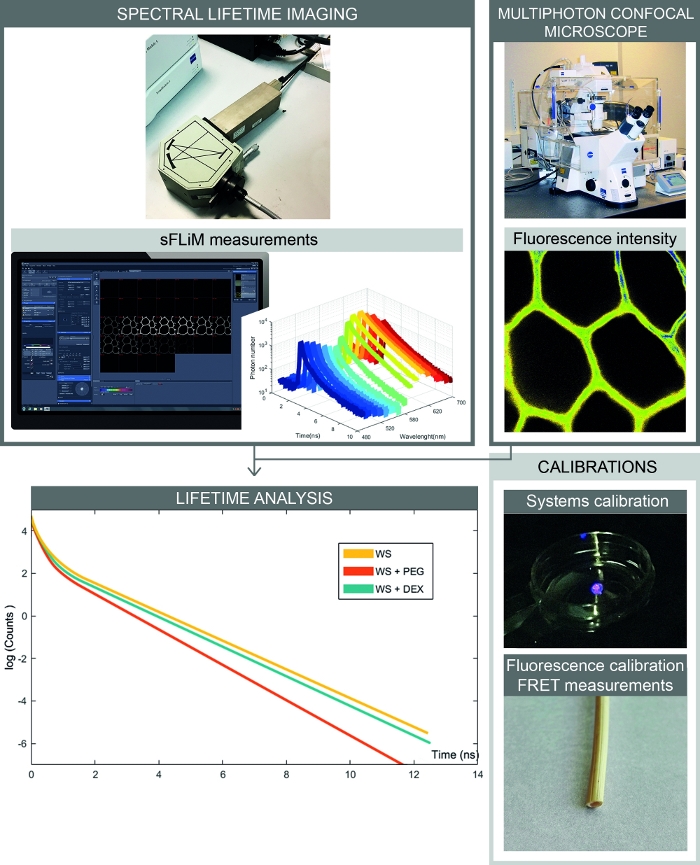
Şekil 2: Spektral FRET tabanlı etkileşim ölçümlerinin tam iş akışı. Şekil spektral floresan yoğunluğu ve ömür boyu ölçümleri birleştiren kurulum sunar. Spektral floresan görüntüleri konfokal mikroskop ile elde edilir ve her spektral aralık için sırayla floresan ömürleri sFLIM dedektörü ile ölçülür. Foton bozunma eğrilerinin analizi, numune ile ilgi molekülleri arasındaki etkileşimlerin doğru belirlenmesini sağlar. Kalibrasyonlar eserlerden kaçınmak için işlenmeli. İlk olarak, sFLIM dedektörü spectrally kalibre edilmesi ve enstrümantal tepki fonksiyonu kontrol edilmelidir. İkinci olarak, karmaşık otofloresan sinyali, bir kabul leyici molekül üneklenmesinden önce her kanaldaki floresan ömrünü belirlemek için her numune için tam olarak kalibre edilmelidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Temsilci sFLIM ölçümleri. sFLIM eğrileri (üst panel) yerli buğday samanı (WS), WS PEG rhodamine (WS +PEG) ve dextran rhodamine (WS +DEX) ile etiketlenmiş yerli buğday saman ile kuluçka ya da dekstran ile inkübe edilmiştir. Her örnek için, sFLIM eğrileri iki üstel bozunma modeli ile donatılmıştır ve ortalama floresan ömrü her kanal için hesaplanmıştır (alt panel). WS+PEG ve WS+DEX örnekleri, otofloresan ve rodaminin karışık emisyonuna karşılık gelen kanalda ömür boyu artışla ilişkili olarak yalnızca otofloresansa (üç ilk çubuk) karşılık gelen kanalda floresan ömründe bir azalma sunar. Bu davranış lignin ve rhodamine etiketli moleküller arasındaki bir FRET olayının karakteristik özelliğidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
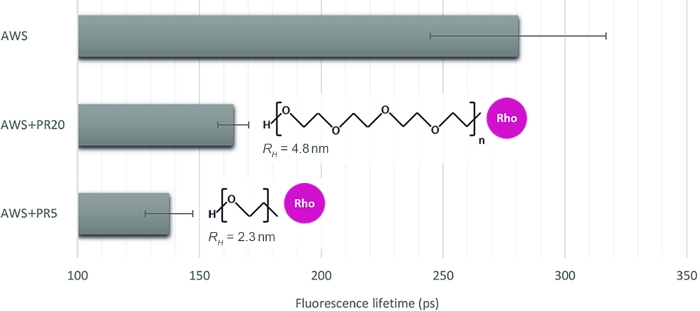
Şekil 4: Kanalın lignin otofloresansına karşılık gelen floresan yaşam boyu analizi. SFLIM imzaya dayalı bir FRET olayı nın doğrulanmasından sonra ortalama floresan ömrü asitle işlenmiş WS (AWS) ile pr5 veya PR20 (sırasıyla 5 kDa ve 20 kDa) ile birlikte ölçüldü. Her iki PR örnekleri ömür boyu azalma mevcut iken, küçük lignin ile daha güçlü bir moleküler etkileşim ortaya, daha güçlü bir ömür boyu azalma ile karakterizedir. Yöntem böylece her ikisi arasında ayrım yapmak için yeterince hassastır (ortalama değer ve standart hata temsil edilir, durum başına n>10). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Floresan ömrü ve emisyon spektrum ölçümleri ilişkilendirilmesi her iki yöntemin avantajlarının birleştirilmesine olanak sağlar. Gerçekten de, spektral ölçümler tek başına duyarlılık eksikliği ve nitel kalır. Öte yandan, floresan ömür geleneksel kantitatif FRET ölçümleri için tercih edilen yöntemdir, ancak lignin otofloresans lignin kompozisyonve çevre16bağlı olarak değişebilir gösterilmiştir . Bu nedenle, bir kabul veya lignin yapısal değişiklikler ile lignin etkileşimleri her ikisi de bir ömür boyu azalma ile sonuçlanan bu yana ayrımcılık olamaz. Bilindiği gibi, geliştirilen yöntem bitki kesitlerinde lignin ve kabul edici moleküller arasındaki etkileşimlerin kesin, hassas ve nicel ölçümsağlar. Yöntemin farklı adımları titizlikle optimize edilmiş olsa bile, özellikle aşağıdaki noktalar için dikkatli olunmalıdır.
Numuneler ile ilgili olarak, tesis bölümünün kalitesi odak içi görüntüleme sağlamak için çok önemlidir. PEG katıştırma için farklı adımlar kesinlikle takip edilmelidir. Son yıkama adımı, numunelerde PEG'in herhangi bir girişiminin kalmamasını sağlamak için gereklidir. Ayrıca, herhangi bir değişiklik floresan özellikleri üzerinde güçlü bir etkiye sahip olabilir, tampon konsantrasyonu ve pH tüm ölçümler için kesinlikle aynı tutulmalıdır.
Yaşam boyu ölçümü de hassas olabilir. Donörün floresan ömrü, örneğin yüksek uyarma nedeniyle kararsız olabilir. Böyle bir durumda, lazer gücü ve zoom atoalma sorunu çözebilir. TCSPC ölçümlerinde bulunan bir diğer tanınmış eser kaynağı da foton darbe kazıklarıdır. Nitekim, TCSPC aynı iki lazer darbeleri arasında yayılan iki foton hızını ölçemez. Bitki örnekleri son derece yapılandırılmış olsa da, floresan homojen değildir ve gizli bir darbe kazık etkisine yol açabilir. Saniyede fotonların sayısı %1 uyarma sınırının altında kalırken, bazı örnek alanlarda daha yüksek olabilir. Hiçbir kazık deneyi sağlamak için, farklı bir foton akısı donör floresan ömrü ölçme düşünülebilir. Akı azalırken yaşam süresi artarsa, bir yığın etkisi ölçümleri değiştirir. Donörün yaşam boyu stabilitesi ile optimum foton akışına ulaşılır.
sFLIM bozunma eğrisi analizi ile ilgili olarak, modelin ölçümleri doğru bir şekilde açıkladığından emin olmak için her bir eğriye güvenmenizi öneririz. Durum böyle değilse, öncelikle daha önce bahsedilen eserlerin hiçbirinin verileri bozmadığını sağlayın. Daha sonra, adım 2.1.4 sistemin enstrümantal yanıt işlevini (IRF) sağlar. IRF bazı anomaliler sunuyorsa, bunları en aza indirmek için optik yolu optimize edin. Adım 6.2 sırasında montaj için ölçülen bir IRF de kullanılabilir. Son olarak, montaj modelinin özgürlük dereceleri adım 6.2'de üç üstel çürümeye yükseltilebilir. Ancak, bireysel yaşam süresi ve oran tayini için gerekli foton sayısı yüksektir ve bu nedenle sadece adım 6.4 daha istikrarlı bir ortalama ömür elde etmek için bunları kullanarak tavsiye edilir. FLIM hakkında daha ayrıntılı bilgi, karakterizasyonu18, sFLIM ve uygulaması12 özellikle lignin10, literatürde bulunabilir.
Zorlu olsa da, yerli otofloresans kullanarak bitki dokularında FRET ölçümü bazı avantajlar göstermektedir. Biyomoleküller arasındaki etkileşim çalışmalarının genellikle içsel floresan belirteçleri ifade etmek için genetik mühendisliği gerektirdiği canlı dokular üzerinde yapılan FRET ölçümlerine kıyasla, burada sunulanlar gibi lignified bitki dokuları doğal otofloresan ve dışsal ortak floresan problar kolayca eklenebilir, çok zaman tasarrufu. Ancak, analiz edilen bitki türlerine ve yapılan olası ön tedavilere bağlı olarak, otofloresansın değiştirilmesi olasıdır, bu nedenle dikkatli bir şekilde karakterize edilmesi ve prob olarak kullanılan floroforun adapte edilmesi gerekebilir.
SFLIM yöntemi katalitik aktivitesi olmayan floresan problara (PEG ve dekstran) uygulanmalıdır. Bitki lignoselüloz hidrolizi çerçevesinde, çeşitli biyokütle örneklerindeki enzimlerin etkileşimleri gerçekleştirilebilir ve muhtemelen lokalizasyonun (hücre ve dokular) etkileşim gücü üzerindeki etkisinin belirlenmesiyle sonuçlanabilir. Bir sonraki optimizasyon adımı analiz adımının otomasyonu olacaktır. Gerçekten de, yeterli analiz veri ile, bir makine öğrenme tabanlı analiz prosedürü otomatik fenotip analizi için dağıtılabilir, hangi hızlı enzim-biyokütle verimliliği tarama onun amenability artıracaktır. Ayrıca, sFLIM numunenin fiksasyon gerektirmez ve kolayca dinamik enzim-lignin etkileşim çalışmaları uygulanabilir. Böyle eşsiz bir yöntem lignoselüloz valorizasyonu optimize etmek için enzim mühendisliği stratejisi ve biyokütle ön arıtma rehberlik muhtemeldir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Fanny Laurent (FARE) sıcak rakamlar hazırlanması için teşekkür edilir. Araştırma Federasyonu FRABio (University of Lille, CNRS) bu işi başarmak için elverişli teknik ortam sağlamak için kabul edilmektedir. Finansman Fransız Ulusal Araştırma Ajansı (LIGNOPROG projesi ANR-14-CE05-0026) elde edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Confocal microscope | ZEISS | LSM 710 NLO | for confocal imaging |
| fine brush | to collect sections | ||
| glass vials | for incubations | ||
| high precision microscope cover glasses 170+/-5µm n°1,5# | Marienfeld | 0107032 | saled by Dutscher s.a in France |
| Infra-red pulsed laser | COHERENT | CHAMELEON VISION | For sample excitation |
| Micropipette Research Plus monocanal 20-200µL | Eppendorf | with corresponding tips | |
| Micropipette Research Plus monocanal 2-20µL | Eppendorf | with corresponding tips | |
| Microscope slides ca. 76 x 26 mm ground edges frosted end | Thermo Fisher Scientific | LR45D | |
| microtome blades disposable (pack of 50) | Agar Scientific | T5024 | saled by Oxford Instruments in France |
| mPEG-Rhodamine, 10 kDa | Creative Peg Works | PSB-2263 | |
| mPEG-Rhodamine, 20 kDa | Creative Peg Works | PSB-22642 | |
| mPEG-Rhodamine, 5 kDa | Creative Peg Works | PSB-2264 | |
| nail polish | for mounting | ||
| pH meter five easy plus | Mettler toledo | FEP20 | with electrode |
| poly (ethylene Glycol) average mol wt 1450 | Merck (sigma-Aldrich) | P5402-1kg | for sample embedding |
| razor blades, single edges blades, stainless steel, box of 100 | Agar Scientific | T586 | for fragments preparation saled by Oxford Instruments in France |
| rotary microtome | Microm Microtech | HM 360 | |
| sFLim detector | BECKER-HICKL | SPC 150 | for lifetime acquisition |
| sodium dihydrogen phosphate dihydrate NaH2PO4, 2H2O | Merck (sigma-Aldrich) | 71500 | for buffer solution |
| sodium phosphate dibasic dihydrate Na2HPO4,2H2O | Merck (sigma-Aldrich) | 30435-1kg | for buffer solution, old reference, the new one is 71643-1kg |
| tetramethyl rhodamine isothiocyanate-dextran 10 k Da | Merck (sigma-Aldrich) | R8881-100mg |
Referanslar
- Inouye, H., et al. Multiscale deconstruction of molecular architecture in corn stover. Scientific Reports. 4, 3756(2014).
- Li, X., Zheng, Y. Lignin-enzyme interaction: Mechanism, mitigation approach, modeling, and research prospects. Biotechnology Advances. 35 (4), 466-489 (2017).
- Vogel, J. Unique aspects of the grass cell wall. Current Opinion in Plant Biology. 11 (3), 301-307 (2008).
- Lynd, L. R. The grand challenge of cellulosic biofuels. Nature Biotechnology. 35, 912(2017).
- Clegg, R. M. Fluorescence resonance energy transfer. Current Opinion in Biotechnology. 6, 103-110 (1995).
- Ishikawa-Ankerhold, H. C., Ankerhold, R., Drummen, G. P. C. Advanced fluorescence microscopy techniques-FRAP, FLIP, FLAP, FRET and FLIM. Molecules. 17 (4), 4047-4132 (2012).
- Pietraszewska-Bogiel, A., Gadella, T. W. J. FRET microscopy: from principle to routine technology in cell biology. Journal of Microscopy. 241 (2), 111-118 (2011).
- Herbaut, M., et al. Multimodal analysis of pretreated biomass species highlights generic markers of lignocellulose recalcitrance. Biotechnology for Biofuels. 11, 52(2018).
- Chabbert, B., et al. Fluorescence techniques can reveal cell wall organization and predict saccharification in pretreated wood biomass. Industrial Crops and Products. 123, 84-92 (2018).
- Terryn, C., Paës, G., Spriet, C. FRET-SLiM on native autofluorescence: a fast and reliable method to study interactions between fluorescent probes and lignin in plant cell wall. Plant Methods. 14 (1), 74(2018).
- Jovin, T. M., Arndt-Jovin, D. J. Cell Structure and Function by Microspectrofluorometry. Kohen, E. , Academic Press. 99-117 (1989).
- Spriet, C., et al. Correlated fluorescence lifetime and spectral measurements in living cells. Microscopy Research and Technique. 70 (2), 85-94 (2007).
- Donaldson, L. A., Newman, R. H., Vaidya, A. Nanoscale interactions of polyethylene glycol with thermo-mechanically pre-treated Pinus radiata biofuel substrate. Biotechnology and Bioengineering. 111 (4), 719-725 (2014).
- Herbaut, M., Zoghlami, A., Paës, G. Dynamical assessment of fluorescent probes mobility in poplar cell walls reveals nanopores govern saccharification. Biotechnology for Biofuels. 11 (1), 271(2018).
- Paës, G., Chabbert, B. Characterization of arabinoxylan / cellulose nanocrystals gels to investigate fluorescent probes mobility in bio-inspired models of plant secondary cell wall. Biomacromolecules. 13, 206-214 (2012).
- Donaldson, L. A., Radotic, K. Fluorescence lifetime imaging of lignin autofluorescence in normal and compression wood. Journal of Microscopy. 251 (2), 178-187 (2013).
- Auxenfans, T., Terryn, C., Paës, G. Seeing biomass recalcitrance through fluorescence. Scientific Reports. 7, 8838(2017).
- Waharte, F., Spriet, C., Héliot, L. Setup and characterization of a multiphoton FLIM instrument for protein-protein interaction measurements in living cells. Cytometry A. 4, 299-306 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır