Method Article
네이티브 오토플루임션을 기반으로 sFLIM에 의한 식물 섹션의 형광 프로브와 리그닌 간의 상호 작용 측정
요약
이 프로토콜은 스펙트럼 및 형광 수명 측정을 결합하여 로다민 기반 형광 프로브와 리그닌 폴리머 사이의 Förster 공명 에너지 전달(FRET)을 두꺼운 식물 섹션에서 직접 평가하는 원래 의설정에 대해 설명합니다.
초록
리그노셀룰로오스 바이오매스(LB)에서 효소의 활성은 가수분해 과정 동안 리그닌과 비특이적 상호작용의 출현에 의해 제한되며, 이는 효소를 기질로부터 멀리 떨어진 곳에서 유지한다. 따라서 이러한 복잡한 상호 작용의 특성화는 LB와 같은 복잡한 기판에서 도전과제입니다. 여기서 이 방법은 Förster 공명 에너지 전달(FRET)에 의해 밝혀질 형광 태그 분자와 네이티브 자가형광 리그닌 사이의 분자 상호 작용을 측정합니다. 두 개의 외인성 형광을 사용하는 살아있는 세포에서의 FRET 측정과는 달리, 리그닌을 사용하는 식물의 FRET 측정은 복잡한 자가 형광으로 인해 사소한 것이 아닙니다. 우리는 형광의 두 가지 상보적 특성인 형광 방출과 수명의 상관 관계를 관찰하는 최초의 수집 및 분석 파이프라인을 개발했습니다. sFLIM (스펙트럼 및 형광 일생 화상 진찰 현미경 검사법)는 생체 분자와 리그닌 사이 다른 상호 작용 수준을 드러내는 높은 감도를 가진 이 상호 작용의 정량화를 제공합니다.
서문
포도당과 같은 단모설탕으로 분해하는 것은 효소를 필요로 합니다. 이들의 활성은 효소와 리그닌1,2,후자는 소수성 중합체 및 리그노셀룰로오스3의주요 성분 사이의 비특이적 상호작용의 확립에 의해 억제되는 것으로 알려져 있다. 따라서, 이러한 상호작용을 세포 척도에서 직접 정량적으로 측정하는 것은 효소 촉매 활성 및 리그노셀룰로오스전처리전처리를 최적화하기 위해 해결해야 하는 과제이다.
Förster (또는 형광) 공명 에너지 전달 (FRET) 측정은 그(것)에서 생체 분자 상호 작용을 어설션하는 선택의 방법입니다. 이 비 방사성 에너지 전송은 다른 조건을 충족하는 경우 기증자와 수용자 불소 사이에 발생할 수 있습니다. 공여자 방출 스펙트럼은 적어도 부분적으로, 수용자 여기 스펙트럼과 겹쳐야 한다. 형광단의 선택은 그러한 실험에 매우 중요합니다. 그런 다음, 전송 효율은 그들의 거리5의 여섯 번째 힘으로 감소하고 두 분자가 가까운 부근에있는 경우에만 발생 (일반적으로 나노 미터 범위에서). 다른 비상 사태는 다이폴-다이폴 방향과 같은 전달 효율을 변경할 수 있지만 형광단이 유연성을 가지고 있으면 완화됩니다.
FRET는 상이한 기술로 측정될 수 있으며 상세한 설명은 문헌6,7. 간단히 말해서, 주요 방법에 의존: i) 수용자 방출 형광의 변화가 따르고 주로 질적 인 결과를 제공하는 감작 방출; ii) 공여체 발광 형광이 수용체 광표백 전후에 측정되는 수용기 광표백(이 경우 보다 정밀한 FRET 추정치를 달성할 수 있지만 고정 된 샘플에 적용된 강력한 레이저 전력이 필요합니다); 및 iii) 수락자가 있는 경우 기증자에 대해 감소하는 평생 측정. 이 방법은 특정 계측기와 형광단 간의 정밀하고 민감한 상호 작용 측정을 허용합니다. 형광 프로브와 리그노셀룰로오스 사이의 FRET 측정을 고려할 때, 주요 어려움은 리그노셀룰로오스가 단일 잘 특징적인 불소가 아니라는 것입니다: 주로 리그닌에서 유래하고 바이오매스 종8,9에의존하는 강한 고유 및 스펙트럼 전체의 자가형광을 가지고 있습니다.
이 백서에서는 목재/식물 샘플 섹션에 맞게 조정된 새롭고 독창적인 절차를 제안합니다. 이 sFLIM 기반 방법은 네이티브 리그노셀룰로오스 샘플에서 형광 프로브와 리그닌 사이의 정량적 FRET 측정을 위한 길을 열어줍니다.
프로토콜
1. 견본 준비
참고: 샘플을 준비하기 위한 연속적인 단계는 그림 1에설명되어 있습니다.
- 식물 샘플 준비
- 나무 줄기 나 파편에서, 자신의 구조를 손상시키지 않고 면도날로 1cm 긴 샘플을 잘라.
- 폴리에틸렌 글리콜 (PEG) 배지에 샘플을 포함, 100 % PEG에 도달 할 때까지 물에 희석 PEG 농도를 증가의 연속 솔루션에 담그여.
- 샘플을 진공 아래에 놓고 물을 제거합니다.
- 30% v/v PEG로 24시간 동안 샘플을 부드럽게 저어줍니다.
- 50% v/v PEG로 시료를 24시간 동안 부드럽게 저어줍니다.
- 70°C에서 24시간 동안 100% PEG에서 샘플을 부드럽게 저어줍니다(순수 한 PEG는 실온에서 고체입니다).
- 샘플을 70°C(핫 플레이트)에서 캡슐에 넣고 실온에 도달할 때까지 온도를 점진적으로 줄입니다.
- 마이크로토메 와 일회용 블레이드를 사용하여 이러한 PEG 블록에서 30-60 μm 두께의 평평한 섹션을 신중하게 준비하십시오.
- 섹션에서 못을 제거하기 위해 5 분 동안 3 개의 연속 된 물 욕조에서 섹션을 수집하고 씻으하십시오.
- 형광 프로브 준비
- pH 6.0에서 30 mM 인산염의 완충액을 준비합니다.
- PEG rhand dextran 로다민 프로브 분말을 계량합니다.
- 0.1 g/L의 최종 농도에서 암흑 속에서 1시간 동안 유리 병으로 연속 교반하여 프로브 파우더를 완충액에 용해시고.
- 식물 샘플 염색
- 형광 프로브의 500 μL로 인큐베이션 섹션 (1.2.3 참조) 72 시간 동안 (교반 없음) 어둠 속에서 플라스틱 튜브 (튜브 당 3 개 이하의 섹션 없음).
- 브러쉬로 섹션을 픽업하고 깨끗한 시트로 버퍼를 흡착한 다음 (섹션을 건조하지 마십시오), 커버 유리와 #1.5H 커버 슬립 사이에 배양 된 섹션을 장착하십시오.
2. 형광 수명 및 스펙트럼 측정 시스템 교정
참고: sFLIM 측정을 위한 전체 워크플로우는 그림 2에표시됩니다.
- sFLIM 검출기의 스펙트럼 창 너비를 확인합니다.
- 0.17 μm 유리 바닥의 배양 상자에 우레아 결정을 넣습니다.
- 배양 상자를 현미경 샘플 홀더에 놓고 20x 목표를 선택합니다.
- 900 nm 파장과 2 % 전력으로 Ti : Sa 레이저를 선택하고 스캐닝을 켭니다.
- sFLIM 검출기에서 두 번째 고조파 신호를 수집합니다.
참고 : 두 번째 고조파 신호는 450 nm의 정확히 절반 여기 파장에서 방출됩니다. 이 측정은 즉각적이지만 시스템의 도구 응답 기능도 제공합니다. - 제2 스펙트럼 채널(462.5 nm)에서 제2 고조파 신호가 수집될 때까지 레이저 여기 파장을 900에서 980 nm로 점진적으로 조정한다.
- 스펙트럼 창 길이(12.5 nm)를 결정합니다.
- 스펙트럼 범위가 예상과 다른 경우 다음을 수행하여 문제를 해결합니다.
- 레이저를 910 nm로 조정합니다.
- 스크롤 휠로 격자 위치를 이동하여 첫 번째 채널에서만 두 번째 고조파 신호를 측정합니다(첫 번째 채널 경계).
- 레이저를 935 nm로 조정합니다.
- 스크롤 휠로 격자 위치를 이동하여 첫 번째 채널에서만 두 번째 고조파 신호를 측정합니다(두 번째 채널 경계).
- 전체 분광계 채널 의 교정
- 현미경 단계에 거울을 삽입합니다.
- 눈에 보이는 연속 레이저(458nm, 1% 전력)를 선택합니다.
- sFLIM 검출기에서 반사 신호를 수집하고 광자가 적절한 스펙트럼 채널에서 측정되었는지 확인합니다.
- 사용 가능한 모든 연속 레이저(514 nm, 561 nm 및 633 nm)를 사용하며 2.2.2 및 2.2.3 단계를 반복합니다.
- 스펙트럼 채널이 예상과 다른 경우 스크롤 휠을 이어 격자 위치를 이동하고 2.1 및 2.2 단계를 반복합니다.
3. 견본 형광 특성화
- 필름 홀더 액세서리(예: Jasco FP-8500 기기)가 장착된 분광광광계에서 식물 섹션 샘플을 배치합니다(형광 프로브로 배양되지 않음).
- 일반적으로 300-600 nm 범위에서 형광 방출을 측정하면서 전형적으로 250-550 nm 범위에서 샘플을 흥미진진시다.
- 3D 형광 맵을 그리려면 광도 및 방출 파장을 비교하여 형광 강도를 플로팅합니다.
- 플롯에서 최대 여기/방출 면적을 결정합니다.
4. 스펙트럼 FRET 측정
- 자동형광 교정
- 목표 20x(NA: 0.8)를 선택합니다.
- 2 광자 레이저 흥분을 750 nm로 설정합니다.
- 밀짚(WS) 단독 식물 섹션을 슬라이드와 커버슬립 사이에 놓습니다.
- 소프트웨어에 다음 매개 변수를 적용합니다. 람다 모드로 전환합니다. 9.7nm 해상도의 스펙트럼 검출기 ChS를 선택합니다. 420에서 722 nm 사이의 스펙트럼 범위를 선택합니다.
- 이미지를 수집합니다.
- 공여체 방출 피크를 결정한다(이 설정으로 470 nm).
- 수락자 교정
- 로다민 계 형광 프로브를 0.17 μm 유리 바닥의 배양 상자에 놓습니다.
- 동일한 설정으로 이미지를 획득합니다.
- 수락기 방출 피크(이 설정시 570nm)를 결정합니다.
- 최대 "WS 단독" 신호와 sFLIM 측정을 위한 공여량으로 허용자 신호가 없는 스펙트럼 범위를 결정합니다(이 설정으로 460-490 nm).
- 샘플 측정
- 슬라이드와 커버슬립 사이에 얼룩진 식물 섹션을 놓습니다.
- 동일한 설정으로 이미지를 획득합니다.
- lsm 파일을 저장합니다.
- 질적으로 "WS 단독 샘플"에 비해 공여자 방출 피크의 감소와 강한 FRET 이벤트를 연관시키고 로다민 샘플에 비해 수용자 방출 피크의 증가.
5. sFLIM 측정
참고: sFLIM 설정의 경우 사용되는 시스템은 앞서10에설명된 시간 도메인 sFLIM 설정입니다. 직립 현미경 및 다양한 시간 상관 단일 광자 카운팅 카드 및 공초점 현미경 제조 업체가 사용될 수 있으며 프로토콜은 그에 따라 조정되어야합니다.
- 시스템을 sFLIM 모드로 전환합니다.
- 4.1.1 및 4.1.2에 기재된 바와 같이 공초점 현미경을 설정합니다.
- 소프트웨어의 비데스칸 모드로 전환하여 형광광자를 sFLIM 검출기로 보냅니다.
- sFLIM 획득을 활성화 모드로 설정하여 SPC150에서 광자 계수를 허용합니다.
- SPC150에서 30s 타임 컬렉션을 선택합니다.
- CFD가 1 x 105와 1 x 106사이에 있는지 확인합니다.
주의: TCSPC 카드에서 측정된 광자 수가 항상 레이저 여기 주파수의 1% 미만인지 확인하십시오(이 설정에서 레이저 여기 주파수는 80Mhz이고 검출 속도는 더미 업 효과를 피하기 위해 모든 픽셀에서 800kHz를 초과할 수없음).
- 슬라이드와 커버슬립 사이에 "WS 단독" 플랜트 섹션을 놓습니다.
- 소프트웨어를 연속 모드로 설정하여 레이저 스캔을 허용합니다.
- 샘플에서 측정 영역을 선택합니다.
- SPC150에서 시작을 클릭합니다.
- sdt 파일을 저장합니다.
- 조건당 최소 10개의 샘플에 대해 이 과정을 반복합니다.
- 슬라이드와 커버슬립 사이에 얼룩진 식물 섹션을 놓습니다.
- 5.2.1 - 5.2.5 단계를 반복합니다.
6. sFLIM 분석
- "WS 만"에서 수집 한 파일을 sFLIM 데이터를 선택하고 파일을 사용하여 SPCImage 소프트웨어로 가져 오기 | 가져오기.
- 맞춤 매개변수를 선택합니다.
- 옵션에서 | 모델, 불완전다중 지수선택 : 12.5 ns.
- 옵션에서 | 환경 설정, 자동으로 악기 응답 계산을선택합니다.
- 주 패널의 오른쪽 메뉴에서 2개의 지수 맞춤 모델을 선택합니다.
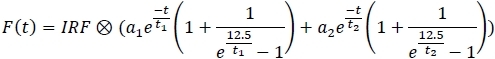
- 각 채널에 대해 피팅 모델을 적용하고 맞춤 매개변수를 스프레드시트에저장합니다(1,2,t1,t2).
- 채널과 실험을 비교하기 위해 스프레드시트(Tm)에서평균 형광 수명을 계산합니다.
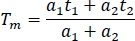
- 모든 채널에서 모든 샘플의 평균 수명(최소 10개)을 계산합니다.
- 기증자 채널(채널 1에서 3: 460-490 nm)에서 Tm을 분석하고 가장 높은 광자 수를 나타내고 리그닌 최대 방출에 해당하는 전용 채널(467.5 - 480 nm에 해당하는 채널 2)을 결정합니다. 채널 2의 값은 6.7단계에서 사용해야 합니다.
- 스테인드 WS에서 수집한 sFLIM 데이터를 선택하고 SPCImage 소프트웨어로 가져옵니다.
- 6.1-6.4단계를 반복합니다.
- 이전 선택한 채널 WS 혼자 (TmD)와스테인드 식물 샘플 (TmDA)에서기증자에 대한 FRET 효율 EFRET를 계산 :
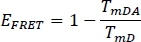
- WS와 샘플 간의 sFLIM 및 EFRET 값을 비교합니다.
- FRET 이벤트로 분석될 WS와 샘플 간의 균일한 수명 감소와 관련된 양수 EFRET를 고려하십시오(자세한 내용은 Spriet et al.12 및 Terrynet al. 10에 의한 대표적인 결과 및 작동 참조).
- FRET 및 리그닌 다짐 레벨의 혼합으로 인해 다르게 분포된 수명 감소를 고려하고 분자 상호작용으로 해석하지 않는다.
- 측정 가능한 FRET 신호가 없는 것으로 평생 수정하지 말고 리그닌과의 상호 작용이 부족하다고 생각하지 마십시오.
결과
리그닌과 형광 태그 분자 사이의 분자 상호 작용을 해부하는 sFLIM 기능을 입증하기 위해, 우리는 먼저 세 가지 다른 샘플을 사용했습니다(그림 3):네이티브 밀 짚 (WS), 로다민 (PR10)으로 태그 된 PEG로 배양 된 네이티브 밀 짚 및 로다민 (DR10)으로 태그가 지정된 토착 밀 짚.10). PR10은 리그닌과 상호 작용하는 것으로 알려져 있으며 DR10은 불활성13,14,15로되어 있다. sFLIM곡선(도 3,상단)은 기준 샘플(WS)과 두 개의 상호작용 사례(DR10 및 PR10) 사이에서 달성될 수 있는 몇 가지 수정사항을 보여 준다. 실제로, 먼저 로다민 방출 범위에 해당하는 스펙트럼 영역에서 형광 증가를 쉽게 알 수 있습니다. 3개의 첫번째 채널 광자 붕괴 곡선의 주의깊은 관찰은 또한 PR10를 위한 보다는 DR10를 위한 강한 변곡점을 제시합니다. 광자 붕괴 곡선을 피팅하고 각 채널의 형광 수명을 계산한 후, FRET 시그니처는 더 분명해진다(그림3,하단). 실제로, 형광 수명은 WS 샘플에 대한 형광 스펙트럼을 따라 대체적으로 증가하고 감소하는 반면, 명확한 FRET 시그니처는 PR10 및 DR10 둘 다에 대해 관찰된다: 1) 공여자 전용 방출 채널(3제1 채널, 파란색)에서 일정한 수명 값; 및 2) 높은 일생 기증자형광공의 증가기여에 대응하는 스펙트럼 채널에서 의 형광 수명이 증가한다.
명확한 FRET가 결정되면 리그닌 형광 수명(채널 2)을 비교하면 WS(0.47 ns), DR10(0.42 ns) 및 PR10(0.36 ns) 사이의 수명 감소를 정량화할 수 있으므로 리그닌과 리그닌 및 분자 상호작용이 밝혀집니다. PR10과 DR10 모두 PR10에 대한 선호도가 더 강합니다.
서로 다른 상호 작용 수준을 정량화하기 위한 이 방법의 관련성을 설명하기 위해 처리된 식물 샘플에 대한 효소 접근성을 모방한 세 가지 다른 샘플( 산 처리 된 WS(AWS)을 5 kDa 및 20 kDa(PR5 및 PR20)의 두 개의 대조 분자량의 PR과 함께 선택합니다. sFLIM 시그니처를 주의 깊게 검사한 후 리그닌 형광 수명이 추출됩니다(그림4). 앞서 언급한 바와 같이, 리그닌 형광 수명은 환경16,17에의해 변경될 수 있다. 산 성 처리 후 AWS의 형광 수명 측정값(0.28ns)은 WS(0.47 ns)에 대해 이전에 측정된 것보다 낮아지며, 이는 수명 감소에 대한 명확한 해석을 위한 sFLIM 절차의 요구 사항과 각 테스트된 조건에 대한 네거티브 컨트롤의 필요성을 확인합니다. 예상대로 리그닌과 상호 작용하는 동안 AWS에 PR을 추가할 때 수명 감소가 관찰됩니다. 더욱이, 상호작용은 PR5(0.16 ns)와 비교하여 더 강하며, 이는 유체역학적 반경 측정(PR5 및 PR20의 경우 각각 2.3 nm 및 4.8 nm)과 일치하여 서로 다른 스테릭 제약을 유발하고 따라서 리그닌에 대한 PR5의 접근성을 높입니다.
두 실험 모두 크기와 식물 시료 전처리에 따라 효소와의 리그닌 상호 작용을 미세하게 평가하기 위해이 방법의 관련성을 보여줍니다.

도 1: 샘플의 상이한 제조 단계. 밀짚 (WS)(A)는먼저 PEG 배지(C)에내장 되는 크기(B)에서감소 됩니다. 블록은 일회용 블레이드(D)가장착 된 마이크로 토메를 사용하여 절단됩니다. 세척 후, 생성된절편(E)은 PEG 또는 덱스란 태그-로다민 용액(F)에서 인큐베이션을 위해 배치된다. 라벨이 부착된 섹션은 sFLIM측정(G)을위해 장착됩니다. 스케일 바는 2cm(A),1cm(B 및 C),200 μm(E 및 G)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
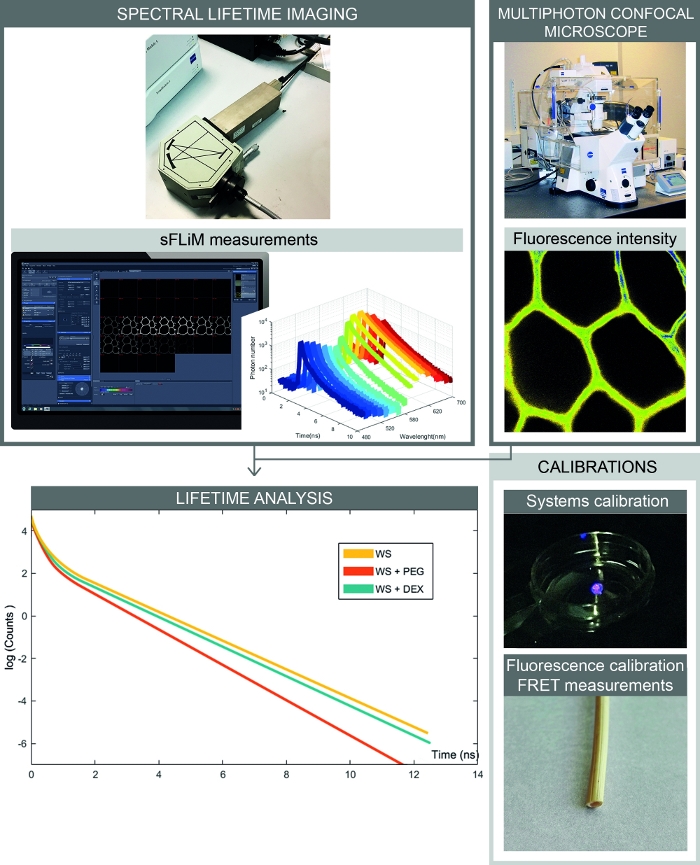
그림 2: 스펙트럼 FRET 기반 상호 작용 측정의 전체 워크플로우. 이 그림은 스펙트럼 형광 강도와 수명 측정을 결합한 설정을 제시합니다. 스펙트럼 형광 이미지는 공초점 현미경으로 획득되며 각 스펙트럼 범위에 대한 순차적 형광 수명은 sFLIM 검출기로 측정됩니다. 광자 붕괴 곡선을 분석하면 시료와 관심 분자 간의 상호 작용을 정확하게 측정할 수 있습니다. 교정은 유물을 피하기 위해 처리되어야 합니다. 첫째, sFLIM 검출기는 스펙터클하게 보정되어야 하며 기악 반응 기능을 확인해야 합니다. 둘째, 복잡한 자가형광 신호는 수용자 분자를 첨가하기 전에 각 채널에서 형광 수명을 결정하기 위해 각 샘플에 대해 정밀하게 보정되어야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 대표적인 sFLIM 측정. sFLIM 곡선(상부 패널)은 로다민(WS+PEG)으로 태그가 지정된 PEG로 인큐베이션된 토종 밀짚(WS+DEX)과 로다민(WS+DEX)으로 태그된 덱스트란이 있는 네이티브 밀 짚으로 인큐베이션된 토종 밀 짚(WS+DEX)에서 획득하였다. 각 샘플에 대해, sFLIM 곡선은 이중 지수 감쇠 모델을 장착하고 평균 형광 수명은 각 채널(하단 패널)에 대해 계산되었다. WS+PEG 및 WS+DEX 샘플은 자가형광 및 로다민의 혼합 방출에 대응하는 채널의 수명 증가와 관련된 자동 형광만(3개의 첫 번째 막대)에 해당하는 채널에서형광 수명 감소를 제시한다. 이 동작은 리그닌과 로다민 태그분자 사이의 FRET 이벤트의 특징이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
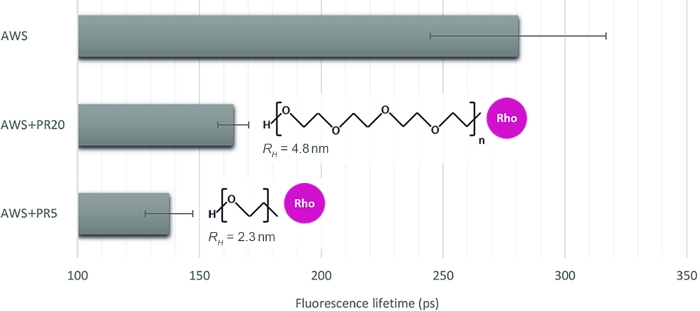
도 4: 리그닌 자동형광에 대응하는 채널의 형광 수명 분석. sFLIM 시그니처를 기반으로 FRET 이벤트를 검증한 후, 평균 형광 수명은 PR5 또는 PR20(각각 5 kDa 및 20 kDa)과 함께 산 처리된 WS(AWS)에서 측정되었습니다. 두 PR 샘플 모두 수명 감소를 제시하는 동안, 작은 리그닌과 강한 분자 상호 작용을 공개, 강한 수명 감소를 특징으로한다. 이 메서드는 따라서 둘 다 를 구별할 수 있을 정도로 민감합니다(평균 값과 표준 오차가 표시되고 조건당 n>10). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
형광 수명과 방출 스펙트럼 측정을 상호 연관시키는 것은 두 방법의 장점을 결합할 수 있게 해줍니다. 실제로 스펙트럼 측정만으로는 감도가 부족하고 질적으로 유지됩니다. 한편, 형광 수명은 전통적인 정량적 FRET 측정을 위한 선택의 방법이지만, 리그닌 자동형광은 리그닌 조성 및환경(16)에따라 달라질 수 있음을 입증하였다. 따라서, 수용자 또는 리그닌 구조적 변화와 리그닌 상호 작용은 둘 다 수명 감소를 초래하기 때문에 구별 될 수 없다. 입증된 바와 같이, 개발된 방법은 식물 섹션에서 리그닌과 수용자 분자 사이의 상호 작용에 대한 명확하고 민감하며 정량적인 측정을 제공합니다. 메서드의 여러 단계가 엄격하게 최적화된 경우에도 다음 사항에 대해 특히 주의해야 합니다.
시료와 관련하여, 공장 섹션의 품질은 인포커스 이미징을 보장하는 데 매우 중요합니다. PEG 포함에 대 한 다른 단계는 엄격 하 게 따라야 한다. 최종 세척 단계는 샘플에 남아 있는 PEG의 간섭을 보장하는 데 필수적입니다. 또한 버퍼 농도와 pH는 모든 측정에서 형광 특성에 강한 영향을 미칠 수 있기 때문에 엄격하게 동일하게 유지되어야 합니다.
수명 측정도 섬세할 수 있습니다. 기증자의 형광 수명은 예를 들어 높은 여기 때문에 불안정할 수 있습니다. 이러한 경우 레이저 전원과 줌을 조정하면 문제가 해결될 수 있습니다. TCSPC 측정에서 아티팩트의 또 다른 잘 알려진 소스는 광자 펄스 더미입니다. 실제로, TCSPC는 동일한 두 레이저 펄스 사이에서 방출되는 두 광자의 속도를 측정할 수 없다. 식물 샘플은 고도로 구조화되어 있지만 형광은 균일하지 않으며 숨겨진 펄스 말뚝 박효과로 이어질 수 있습니다. 초당 광자 수는 1% 여기 제한 미만으로 유지되지만 일부 샘플 영역에서는 더 높을 수 있습니다. 말뚝 을 다질 실험을 보장하기 위해, 다른 광자 플럭스에서 공여자 형광 수명을 측정하는 것을 고려할 수 있습니다. 플럭스가 감소하는 동안 수명이 증가하면 더미 효과가 측정을 변경합니다. 최적의 광자 플럭스는 기증자의 일생 안정성에 도달합니다.
sFLIM 붕괴 곡선 해석과 관련하여 모델이 측정을 정확하게 설명할 수 있도록 각 개별 곡선 맞춤에 의존하는 것이 좋습니다. 그렇지 않은 경우 먼저 앞에서 언급한 아티팩트중 데이터가 손상되지 않았는지 확인합니다. 그런 다음, 단계 2.1.4는 시스템의 기악 응답 함수(IRF)를 제공한다. IRF에서 몇 가지 이상 징후가 나타나는 경우 광학 경로를 최적화하여 최소화합니다. 6.2단계 동안 피팅을 위한 측정된 IRF도 사용할 수 있습니다. 마지막으로 피팅 모델의 자유도는 6.2단계에서 3지수 감쇠로 증가할 수 있습니다. 그러나 개별 수명 및 비율 결정에 필요한 광자의 수는 높으며 따라서 6.4 단계에서 보다 안정적인 평균 수명을 달성하기 위해 만 사용하는 것이 좋습니다. FLIM에 대한 보다 철저한 정보는, 그 특성화18,sFLIM 및 그의 응용프로그램(12)에 특히리그닌(10)에대한 문헌에서 찾을 수 있다.
도전적이지만, 네이티브 자가형광을 사용하는 식물 조직에서의 FRET 측정은 몇 가지 장점을 보여줍니다. 생체 분자 간의 상호 작용 연구가 종종 여기에 제시 된 것과 같은 내장 형광 마커, 리그니화 식물 조직을 표현하는 유전 공학을 필요로하는 살아있는 조직에서 수행 된 FRET 측정에 비해, 자연을 제공 자기 형광, 외적 파트너 형광 프로브를 쉽게 추가 할 수 있습니다, 많은 시간을 절약 할 수 있습니다. 그러나 분석된 식물 종과 가능한 전처리에 따라 자가형광이 수정될 가능성이 있으므로 신중하게 특성화되고 프로브로 사용되는 불소가 적응될 필요가 있습니다.
sFLIM 방법은 촉매 활성이 결여된 형광 프로브(PEG 및 dextran)에 적용되어야 합니다. 식물 리그노셀룰로오스 가수분해의 프레임에서, 다양한 바이오매스 샘플에서 효소의 상호 작용이 수행될 수 있으며, 그 결과 상호작용 강도에 대한 국소화(세포 및 조직)의 영향을 결정할 수 있습니다. 다음 최적화 단계는 분석 단계의 자동화입니다. 실제로 충분한 분석 데이터를 통해 자동화된 표현형 분석을 위해 기계 학습 기반 분석 절차를 배포할 수 있으며, 이를 통해 효소-바이오매스 효율 검사를 빠르게 할 수 있습니다. 더욱이, sFLIM은 시료의 고정을 필요로 하지 않으며 동적 효소-리그닌 상호작용 연구에 용이하게 적용될 수 있다. 이러한 독특한 방법은 리그노셀룰로오스 용맹화를 최적화하기 위해 효소 엔지니어링 전략 및 바이오매스 전처리를 안내할 가능성이 높다.
공개
저자는 공개 할 것이 없다.
감사의 말
패니 로랑(FARE)은 피규어 준비에 대해 따뜻하게 감사를 표합니다. 연구 연맹 FRABio (릴 대학, CNRS)는이 작업을 달성하는 데 도움이 되는 기술 환경을 제공하는 것으로 인정됩니다. 자금은 프랑스 국립 연구 기관 (LIGNOPROG 프로젝트 ANR-14-CE05-0026)에서 얻은.
자료
| Name | Company | Catalog Number | Comments |
| Confocal microscope | ZEISS | LSM 710 NLO | for confocal imaging |
| fine brush | to collect sections | ||
| glass vials | for incubations | ||
| high precision microscope cover glasses 170+/-5µm n°1,5# | Marienfeld | 0107032 | saled by Dutscher s.a in France |
| Infra-red pulsed laser | COHERENT | CHAMELEON VISION | For sample excitation |
| Micropipette Research Plus monocanal 20-200µL | Eppendorf | with corresponding tips | |
| Micropipette Research Plus monocanal 2-20µL | Eppendorf | with corresponding tips | |
| Microscope slides ca. 76 x 26 mm ground edges frosted end | Thermo Fisher Scientific | LR45D | |
| microtome blades disposable (pack of 50) | Agar Scientific | T5024 | saled by Oxford Instruments in France |
| mPEG-Rhodamine, 10 kDa | Creative Peg Works | PSB-2263 | |
| mPEG-Rhodamine, 20 kDa | Creative Peg Works | PSB-22642 | |
| mPEG-Rhodamine, 5 kDa | Creative Peg Works | PSB-2264 | |
| nail polish | for mounting | ||
| pH meter five easy plus | Mettler toledo | FEP20 | with electrode |
| poly (ethylene Glycol) average mol wt 1450 | Merck (sigma-Aldrich) | P5402-1kg | for sample embedding |
| razor blades, single edges blades, stainless steel, box of 100 | Agar Scientific | T586 | for fragments preparation saled by Oxford Instruments in France |
| rotary microtome | Microm Microtech | HM 360 | |
| sFLim detector | BECKER-HICKL | SPC 150 | for lifetime acquisition |
| sodium dihydrogen phosphate dihydrate NaH2PO4, 2H2O | Merck (sigma-Aldrich) | 71500 | for buffer solution |
| sodium phosphate dibasic dihydrate Na2HPO4,2H2O | Merck (sigma-Aldrich) | 30435-1kg | for buffer solution, old reference, the new one is 71643-1kg |
| tetramethyl rhodamine isothiocyanate-dextran 10 k Da | Merck (sigma-Aldrich) | R8881-100mg |
참고문헌
- Inouye, H., et al. Multiscale deconstruction of molecular architecture in corn stover. Scientific Reports. 4, 3756(2014).
- Li, X., Zheng, Y. Lignin-enzyme interaction: Mechanism, mitigation approach, modeling, and research prospects. Biotechnology Advances. 35 (4), 466-489 (2017).
- Vogel, J. Unique aspects of the grass cell wall. Current Opinion in Plant Biology. 11 (3), 301-307 (2008).
- Lynd, L. R. The grand challenge of cellulosic biofuels. Nature Biotechnology. 35, 912(2017).
- Clegg, R. M. Fluorescence resonance energy transfer. Current Opinion in Biotechnology. 6, 103-110 (1995).
- Ishikawa-Ankerhold, H. C., Ankerhold, R., Drummen, G. P. C. Advanced fluorescence microscopy techniques-FRAP, FLIP, FLAP, FRET and FLIM. Molecules. 17 (4), 4047-4132 (2012).
- Pietraszewska-Bogiel, A., Gadella, T. W. J. FRET microscopy: from principle to routine technology in cell biology. Journal of Microscopy. 241 (2), 111-118 (2011).
- Herbaut, M., et al. Multimodal analysis of pretreated biomass species highlights generic markers of lignocellulose recalcitrance. Biotechnology for Biofuels. 11, 52(2018).
- Chabbert, B., et al. Fluorescence techniques can reveal cell wall organization and predict saccharification in pretreated wood biomass. Industrial Crops and Products. 123, 84-92 (2018).
- Terryn, C., Paës, G., Spriet, C. FRET-SLiM on native autofluorescence: a fast and reliable method to study interactions between fluorescent probes and lignin in plant cell wall. Plant Methods. 14 (1), 74(2018).
- Jovin, T. M., Arndt-Jovin, D. J. Cell Structure and Function by Microspectrofluorometry. Kohen, E. , Academic Press. 99-117 (1989).
- Spriet, C., et al. Correlated fluorescence lifetime and spectral measurements in living cells. Microscopy Research and Technique. 70 (2), 85-94 (2007).
- Donaldson, L. A., Newman, R. H., Vaidya, A. Nanoscale interactions of polyethylene glycol with thermo-mechanically pre-treated Pinus radiata biofuel substrate. Biotechnology and Bioengineering. 111 (4), 719-725 (2014).
- Herbaut, M., Zoghlami, A., Paës, G. Dynamical assessment of fluorescent probes mobility in poplar cell walls reveals nanopores govern saccharification. Biotechnology for Biofuels. 11 (1), 271(2018).
- Paës, G., Chabbert, B. Characterization of arabinoxylan / cellulose nanocrystals gels to investigate fluorescent probes mobility in bio-inspired models of plant secondary cell wall. Biomacromolecules. 13, 206-214 (2012).
- Donaldson, L. A., Radotic, K. Fluorescence lifetime imaging of lignin autofluorescence in normal and compression wood. Journal of Microscopy. 251 (2), 178-187 (2013).
- Auxenfans, T., Terryn, C., Paës, G. Seeing biomass recalcitrance through fluorescence. Scientific Reports. 7, 8838(2017).
- Waharte, F., Spriet, C., Héliot, L. Setup and characterization of a multiphoton FLIM instrument for protein-protein interaction measurements in living cells. Cytometry A. 4, 299-306 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유