Method Article
単細胞薬の取り込み、代謝、および効果を研究するための統合ラマン分光法と質量分析プラットフォーム
要約
このプロトコルは、単一セル分解能を達成することができる統合ラマン分光質量分析(MS)プラットフォームを提示します。ラマン分光法は、薬物に対する細胞応答を研究するために使用することができ、MSは薬物の取り込みと代謝の標的および定量的分析に使用することができます。
要約
細胞は、薬物に対する反応において本質的に異種であることが知られている。したがって、単一細胞の不均一性が創薬研究において考慮される必要がある。これは、細胞と薬物間の細胞相互作用の多くを単細胞レベル(すなわち、薬物の取り込み、代謝、および効果)で正確に測定することによって達成することができる。本論文では、薬物に対する細胞の代謝変化をモニタリングする単一細胞ラマン分光法および質量分析(MS)プラットフォームについて述べている。このプラットフォームを使用して、薬物に応答する代謝変化はラマン分光法によって測定することができ、薬物およびその代謝産物は同じ細胞内の質量分析法を用いて定量することができる。この結果は、薬物の取り込み、代謝、および応答に関する情報に単一細胞レベルでアクセスすることができることを示唆している。
概要
細胞は、単一細胞レベルでの微小環境の変化に対して異なる反応を示し、細胞不均一性1と呼げられる現象である。それにもかかわらず、現在の創薬研究は、潜在的な部分集団に関する情報と単一細胞変動に関する情報を難読化する細胞集団の平均測定値に基づいています。この欠落した情報は、一部の細胞が薬物の影響を受けやすい理由を説明し、他の細胞は耐性を持っています。興味深いことに、薬物応答に関する単細胞情報の欠如は、薬物3の第II相臨床試験の失敗の考えられる理由である。したがって、この問題に対処するには、薬物との細胞相互作用(すなわち、取り込み、代謝、および応答)を単一細胞レベルで測定する必要があります。
これを達成するために、我々は、生きている単一細胞がラベルフリーのラマン分光法を使用してスクリーニングされ、質量分析4を使用してさらに特徴付けられるユニークなシステムを設計した。ラマン分光法は、細胞状態の分子指紋を提供し、細胞内の多くの分子の寄与から生じる複雑なスペクトルである。この複雑さにもかかわらず、ラマン指紋は細胞全体の構造と代謝5、6を反映していると考えることができる。ラマン分光法は、非侵襲的で比較的高いスループットの方法で細胞状態を測定することに優れており、単一細胞レベルでの薬物応答のスクリーニングと評価に有用です。
対照的に、MSは単一細胞レベルで薬物の取り込みを測定するために必要な感受性および選択性を提供する。MSは破壊的であるため(サンプル[cell]は通常、分析中に消費されます)、非破壊的なラベルフリーのラマン分光法と統合することで、高スループットと感度の高いシステムを提供できます。この組み合わせプラットフォームは、単一細胞レベルでの薬物の取り込み、代謝、および効果に関するより多くの情報を提供することができます。
この原稿は、統合されたRaman-MSプラットフォームを使用して、in vitro培養を使用して単一細胞レベルで薬物との細胞相互作用を研究するために使用されるプロトコルを解明する。そのために、肝細胞癌細胞(HepG2)およびタモキシフェンがモデルとして用いられる。HepG2細胞はタモキシフェンを取り込んで薬物を代謝するので選ばれ、肝毒性の影響を同時に受ける。この原稿では、薬物処理細胞と非処理細胞(対照)の2つの状態が使用されています。
プロトコル
1. 細胞培養
- 適切な培養媒体に目的とする培養細胞。ペニシリン・ストレプトマイシンは、汚染を避けるために添加され得る。HepG2細胞の場合、10%ウシウシ血清(FBS)および0.1%ペニシリンストレプトマイシンを添加したダルベッコの修飾イーグル培地(DMEM)を含む培養培地中の培養細胞。ラマン分光測定をファシリティするために、細胞は0.1%ゼラチンコーティングガラス底皿または石英スライドで成長させることができる。
- 加湿インキュベーターで細胞を37°Cで2日間、5%CO2でインキュベートします。
- 細胞培養物を同期して70%の合流性に達します。
- 細胞を35mmガラス底グリッド皿にサブカルチャーし、同じ培地を使用して0.7 x 106の播種密度でスライドし、その後37°Cで24時間インキュベートします。
注:培養皿やスライドは、コラーゲンまたはゼラチンコーティング溶液を5 ug/cm2の培養表面比で事前にコーティングし、測定中の生存を保証します。
2. 薬物治療
- インキュベーターから細胞培養物を取り出し、前温PBS緩衝液(37°)で2x洗浄します。
注:50%-60%のコンフルエントで薬物治療のための細胞を除去することは最適です。 - 35 mmの培養皿で細胞を薬物処理および未処理のサブグループに分割します。
- 選択した薬物を培養媒体と混合する。例えば、ジメチルスルホキシド(DMSO)にタモキシフェンを溶解し、培養媒体と混合して、2mLの最終体積と10μMのタモキシフェン濃度を得た。これは薬物処理されたグループになります。
- 対応する溶媒(DMSO)をコントロールとして培地に混ぜ、DMSOの効果を調べるようにします。これが制御グループになります。
- ステップ2.3~2.4で24時間作成したスパイクメディアの両方のグループを2mLでインキュベートします。インキュベーション後の予想される合流率は70%-80%でなければなりません。
3. ラマンスペクトルイメージングとスペクトル処理
注:ラマン分光システムは市販されていますが、ここで使用されるラマン分光システムは、前述の7、8で説明した家庭用ライン走査共焦点顕微鏡です。簡単に言えば、このシステムは532 nmダイオードポンプソリッドステートレーザーが装備されています。レーザー光は円筒レンズを使用して平面に形成され、1回の露光で400スペクトルの測定が可能です。ラマンスペクトルは、指紋領域のスペクトル分解能を最大化するために1,200の溝/mmグレーティングを使用するポリクロメータに取り付けられた冷却されたCCDカメラを使用して記録されました(500-1,800 cm-1から)。このスペクトル領域には、ラマン散乱を発生させる分子に特異的な周波数の高密度が含まれています。水浸物レンズ(NA = 0.95)も使用します。このシステムの空間分解能は~300nmで、スペクトル分解能は1cm-1です。実験中に細胞の生存を確実にするために、電動顕微鏡ステージに固定されたマイクロチャンバーが使用される。
- スペクトル測定の前に、光学系の位置合わせを確認します。50 μm のピンホールを使用して、ピンホールとレーザー位置が正確に一致することを確認できます。できるだけ狭くした場合は、分光光度計のスリットを入力します。
- 各実験の前に分光光度計を校正するためにエタノールを使用してください。これを行うには、EtOHをガラス底皿に入れ、所定のレーザー強度(サンプルで測定)でスペクトルを1s測定し、ピークを既知の波長7に関連付ける。
- サンプルのレーザー強度を~2.4 mW/μm2に最小化し、細胞がレーザー露光を生き残るようにします。
- マイクロチャンバーを5%CO2および37°Cに設定します。
- 顕微鏡システムの準備ができたら、インキュベーターから細胞を取り出し、すぐに加温されたPBS(37°)緩衝液で細胞2xをすすいでから、2mLの加温PBS(37°C)またはDMEMを加えて細胞を再中断します。
注:PBSとフルオロブライトDMEMベースのメディアは、最小限のバックグラウンド信号を生成するため、ラマン分光測定に十分なオプションです。 - 水浸度の対物レンズに10μLの水を加え、ガラス底の細胞皿を顕微鏡の段階に繊細に置きます。
- レーザーラインに焦点を合わせて各セルを測定します。セル当たり15sの露光時間は、明確なラマン信号を有する細胞の断面を得るのに十分である。ガルバノミラーは、数十分以内に1つの細胞または細胞のグループをスキャンすることができます。
注:細胞の完全なスペクトルイメージングの高分解能は、より多くの時間を必要とし、光の損傷につながる可能性があります。ここで、細胞は単一線露光を用いて測定し、各細胞の断面を得た。このアプローチは、スループットを向上させ、細胞を判別するのに十分な情報を得るだけでなく、光ダメージを制限することによって細胞の生存率を確保するための良いトレードオフです。
4. スペクトルデータの前処理と多変量解析
注: 前処理は、スペクトル データ内の不要な技術的なバリエーションを削除するために、追加の分析の前に必要な手順です。メソッドとソフトウェアの多様性のために、網羅的なリストを提供することはできませんし、文献7、8に見られる多くの有用なレビューがあります。このセクションでは、生きている単一細胞から得られたスペクトルラマンデータの解析と解釈に使用されるアプローチについて簡単に説明します。
- ラマン画像を抽出して前処理し、可能な宇宙線干渉を除去します。
注:異なる日/週/月の間に得られたスペクトルのスペクトル軸は、エタノールを使用したキャリブレーション中の小さな技術的なバリエーションに起因するいくつかのバリエーションを含む場合があります。これは、後続の多変量解析と統計比較に強く影響します。実験が異なる週/月の間に行われる場合には、小さな光学的変動が予想されます。この場合、実験間のデータの最終的なスペクトルシフトを修正するために、データを補間する必要があります。ここでは、3 次スプラインを使用した補間を使用します。このステップの後、すべてのスペクトル軸を位置合わせする必要があります。500-1,800 cm-1の範囲は、後続の分析のために考慮されます。 - 自家製アルゴリズムを使用して、各画像から細胞と背景(細胞の不在)のスペクトルデータを抽出します。セルの信号からバックグラウンド信号を差し引きます。次に、残りのピクセルのスペクトルを平均化し、これは単一のセルに対応する必要があります。次の手順は、セルの 2D スペクトルを使用して実行されます。
- ModPoly9または十分に適合すると推定されるその他のアルゴリズムを使用してベースライン補正を実行します。スペクトル範囲を 600 ~1,700 cm-1にトリムして指紋領域を選択し、多項式フィッティングが不良によるスペクトルに不要なエッジ効果がないことを確認します。
- ベクトル正規化(各波数の強度をグローバルl2ノルムまたはスペクトルの最大単数値で除算)などの正規化ステップを実行してスペクトル強度10を正規化するが、他の正規化は考えられる。
- クラス/条件ごとに適切なラベルを持つデータセットを準備します。
注:比較スペクトル分析は、細胞クラス/条件間の可能な相違の性質を探索するために穿極することができる(例えば、対照群の平均スペクトルを他のグループに差し引いて、目的の領域(潜在的バイオマーカーなど)を特定する)。ANOVAとフィッシャースコアの計算も10を実行することができます。 - スペクトルフィーチャに基づいて処理されたセルと未処理のセルを識別するために、多変量解析を適用できます。正規化されたスペクトル データはトレーニング データセットとして使用し、可能であれば、反復実験の不明なデータセット (ラベルなし) をテスト データとして使用する必要があります。
注:主成分分析(PCA-DA10)の一部のベクトルに対して実行される判別分析、潜在スコアの投影、判別分析(PLS-DA)、およびサポートベクターマシン(SVM)11は、フィールドで頻繁に使用されるモデルであり、それぞれが異なる統計的考慮事項を提示します。その結果、データの前処理を実行する必要があります。 - 実験目的に合った機械学習を使用します。ここで、潜在構造(PLS)モデル上の投影は、ラマンスペクトル(600-1,710 cm-1)11、12のスペクトル指紋領域を用いて構築される。必要に応じてデータを平均的に中央に配置します。モデルのクロス検証には、さまざまな手法を適用できます。
注: ここでは、10 個の分割を持つベネチアブラインドクロス検証が適用されます。最適なモデルが二乗平均平方根誤差 (RMSE) 値を最小限に抑えるように、モデルの複雑さ (コンポーネントの数または潜在変数) をテストする必要があります。3 つの潜在ベクター (RV) がデータセットで最良の判別を提供していることがわかりました。 - どのラマンスペクトルピークが細胞の判別に寄与しているかを特定します(例えば、各ラマン波数または回帰係数の大きさについて、投影[VIP]における可変的な重要度のスコアをプロットすることによって)。
注: 変数の VIP スコアは、PLS-DA 成分と元の変数の間の平方相関の加重合計として計算されます。PLSおよびVIPスコアアルゴリズムに関する詳細は、文献11、12で見つけることができます。
5. 単一セルサンプリングのセットアップと手順
- 図 1に示すように、セルサンプリング システムをラマン顕微鏡に固定します。3Dマイクロマニピュレータを、負圧を加えることでサンプル吸引用の空のシリンジに取り付けられているガラスキャピラリーホルダーに接続します(図1)。
- 顕微鏡を高倍率(40x)に設定して、ガラスキャピラリーの先端を観察し、壊れないことを確認します。マイクロマニピュレータ(x、Y、Z軸)を使用してガラスキャピラリーの位置を制御します。毛細血管先端が視野の中央にあることを確認し、後で培養皿のクリアランスを与えるために、毛細血管をZ軸上に上に移動させます。
注:細胞のマイクロサンプリングは、直径が10〜15μmの細胞に対してガラスキャピラリーによって行われます。ボアサイズが~5μmの毛細血管をお勧めします。ボアサイズが小さすぎると、キャピラリー先端がセルに差し込まれ、大きすぎると、後のMS測定の感度が損なわれる可能性があります。 - 顕微鏡のステージにサンプルプレート/皿を置き、倍率と焦点を調整し、グリッド皿上のターゲットセルを選択し、視野の中央に移動します。次に、マイクロマニピュレータ(Z軸)を使用してガラスキャピラリーを慎重に下げて、先端が焦点を合わせます。
注: 毛細血管に焦点が合うまで、X 軸と Y 軸の毛柱を移動しないようにしてください。 - 顕微鏡観察の下で、キャピラリー先端でターゲット単一セルに触れ、シリンジを使用して負圧を加え始め、キャピラリー先端の内側に細胞をトラップします。必要に応じて、セルのタイミングと吸引位置を正確に確認するために写真やビデオを撮ることによって、この手順を記録します。
- 毛細血管を Z 軸上で上に移動します。次いで、MS分析の準備として鉗子を使用して毛細血管ホルダーから毛細血管を取り外す。
6. 質量分析測定
- メーカーの推奨事項に従って、MS計測器の質量精度を調整します。キャリブレーション後、質量誤差が3ppm以下であることを確認します。
- MS インストゥルメントを、対象の検語に最適なパラメータに最適化します。
注:タモキシフェンおよび4-OHT分析の場合、計器パラメータは次のように設定されています:入口キャピラリー温度:400°C、噴霧電圧:1500V、自動ゲイン制御ターゲット(AGC):5.00E+06、SレンズRFレベル:90%、SIM範囲:347-397 m/z、z、次に設定されます。 SIM 最大射出時間: 200 ミリ秒、SIM 解像度: 140,000 FWHM、MS/MS 範囲: 50-400 m/z、MS/MS AGC ターゲット: 2.00E+05、MS/MS 最大射出時間: 100 ミリ秒、MS/MS 解像度: 17,500 FWHM、MS/MS 分離ウィンドウ: 1 m/z、MS/MS - 相対的な定量を達成するためにSIMモードの期間を5分の自動取得方法と、薬物とその代謝物の正の同定のための別のMS/MS法を設定します。取得方法のパラメータは、ステップ6.2で説明した最適化値に設定する必要があります。
- ヒュームフードの下でイオン化溶媒を準備します。溶媒組成物は、目的の検剤に依存する。ここで使用される有機溶媒は、80%MeOH、10%DMSO、および0.1%ギ酸からなる。
- 測定の前に、適切な内部標準を有機溶媒と混合してください。この実験では、d5-タモキシフェンの5.31 nMを内部標準として使用しています。
- 偽陽性を避けるために、細胞部分のサンプリングを避けるために、一定の顕微鏡観察で1μmのボアサイズの毛細血管を使用して薬物で処理された細胞を取り囲む媒体を吸引する。
- ローダー先端に取り付けたピペットを使用して、媒体を含む毛細血管の広い端にイオン化溶媒の2μLを加えます。次いで、MSによってサンプリングされた媒体を分析し、目的の検検の存在を確認する(通常、検出すべきではない)。
- イオン化溶媒を細胞を含む毛細血管に2μLを加え、適切な質量分析計に接続されたナノエレクトロスプレーアダプター(ナノESI)にキャピラリーを固定し、自動取得方法を開始します。
7. 質量分析データの処理と分析
メモ:任意の適切なソフトウェアを使用してデータ分析を実行できます。ただし、研究者が MS ベンダーから提供されていないソフトウェアを使用してデータ分析を実行する場合は、生データを独自のベンダー形式からオープン形式に変換するか、最初にテキスト ファイルとして変換する必要があります (ここでは行いました)。
- 対象の検線のピーク面積を同じ MS スキャンの内部標準のピーク領域で割って、データを正規化します。次に、ピーク比をログ変換して歪度を低減します。
- 薬物またはその代謝産物の正規化された強度を箱ひげ図または密度曲線としてプロットし、単一細胞間の分布を可視化します。ここでは、R統計ソフトウェアがggplot2パッケージとともに使用される。
- 薬物代謝産物の豊富さを各細胞の代謝されていない親分子(すなわち、4-OHTおよびタモキシフェン)とで割ることによって、代謝されていない薬物比に代謝された薬物比を計算する。
注:関心のある特定のラマンピークの変動と薬物またはその代謝産物のMSピークの変動との間の相関関係を調べることができる。これは、単一細胞における薬物自体とその代謝産物との間の可能な相関関係に追加される。これは、両側検定を使用してピアソン相関係数を計算することによって行うことができます。より高度な統合アプローチも考慮する必要があります。
結果
薬物相互作用(取り込み、代謝、および効果)の単細胞分析は、隠れた部分集団や薬剤耐性の部分集団を明らかにするだけでなく、細胞の不均一性の影響を理解するために不可欠です。このプロトコルでは、ラマン分光法とMS.ラマン分光法の2つの相補的な技術を単一細胞で測定するために使用された:ラマン分光法とMS.ラマン分光法は、薬物応答のスペクトルバイオマーカーに基づいて薬物の影響を受ける細胞を迅速に識別する。MSは、選択的かつ半定量的に薬物の取り込みと代謝を監視するために使用されます。細胞を最初にラマン分光法でスクリーニングし、次いでMSによる分析のために個別にサンプリングした。
各状態の平均スペクトル(薬物治療の有無)の比較分析を図2に示す。2つの条件の平均スペクトルは、以前に同定され、分子化合物2に割り当てられた様々なピークで明らかに異なる。特に、1000cmのピーク−(フェニルアラニンおよびチロシンなどの芳香族化合物に割り当てられる)は強い違いを示す。統計的差の有意性は、さらなる多変量解析によって評価されるべきである。
その後、データ・セットを使用して、2つの細胞治療(薬物:n=290、薬物なし:n=115)を区別することを目的としたPLSモデル(ステップ4.5〜4.8)を訓練しました。タモキシフェンの存在下で培養された細胞を分類する予測能力は、試験データにおいて100%の感度と72%の特異性に達した(交差検証されたトレーニングモデルからは不明)。感度はモデルによって正しく識別される真の正の尺度であり、特異性はモデルによって識別される実際の負の尺度です。SVM、LDA、ニューラルネットワークなどの代替モデルは、同様またはより良い結果を提供する可能性がありますが、この研究では包括的な比較は行われていない。
PLSモデルに基づいて、実験条件を判別する際の波長(ラマンシフト)の重要性を表すVIPスコアが計算されました(図3)。重要なことに、VIPプロファイルの最高ピークは、2つの治療の間に強い違いが見られたラマンピークに対応しました。これにより、処理された細胞と未処理細胞の特異的な分子差が確認された。その結果、研究者は、薬物治療に対する単一細胞の応答を反映する可能性のあるスペクトルバイオマーカーを同定することができる。これらのバイオマーカーは、様々な条件および細胞株にわたる生物学的関連性および一般化を検証するためにさらに試験することができる。
生きた単一細胞質量分析(LSC-MS)システムは、ラマン分光法によって以前に測定された単一の薬物処理HepG2細胞で薬物とその代謝産物の両方を検出することができた。加えて、タンデムMSは、両分子の構造を確認するために使用され得る。陽性同定後、薬物とその代謝産物の相対的な豊富度を各細胞で測定し、未処理細胞のバックグラウンドピークと比較した。タモキシフェンの存在量に強い変動が認められ、代謝産物4-OHTの場合には、この現象がさらに顕著であった(図4)。タモキシフェンの存在量とその代謝産物との関係も研究され、両者の間に有意な正の相関が見られた(r = 0.54, p = 0.0001, n = 31)。

図1:顕微鏡ステージに取り付けられた細胞ピッキングシステム。この図の大きなバージョンを表示するには、ここをクリックしてください。
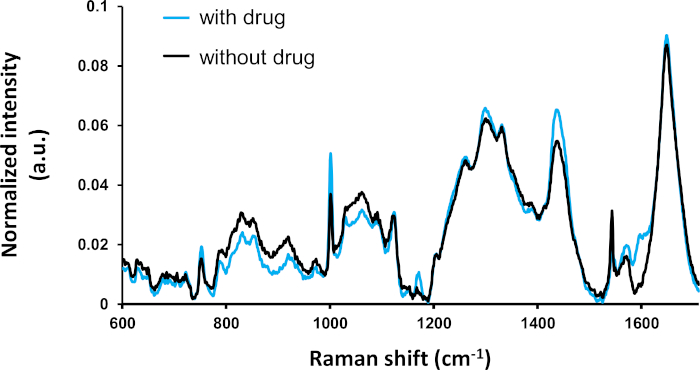
図2:薬物処理細胞の平均スペクトル(タモキシフェン:n=295)および未処理細胞(タモキシフェンなし:n=115)。ラマンのピークは文献から同定することができる。強いスペクトル差のほとんどは、前に説明したように統計的に有意である(ANOVA, p ≤ 0.5)。この図は、以前の文書4から変更されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
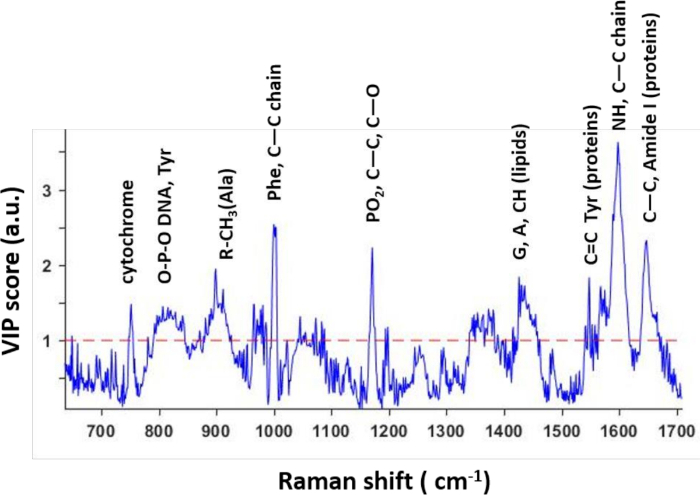
図 3: 予測 PLS モデルから抽出された VIP スコアVIP スコアは、モデル内の 2 つのクラスの区別に寄与する波長を反映します。ピークのほとんどは、薬物処理細胞に対する薬物効果のスペクトルバイオマーカーとして観察される特定の分子に対応しています。この図は、以前の文書4から変更されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
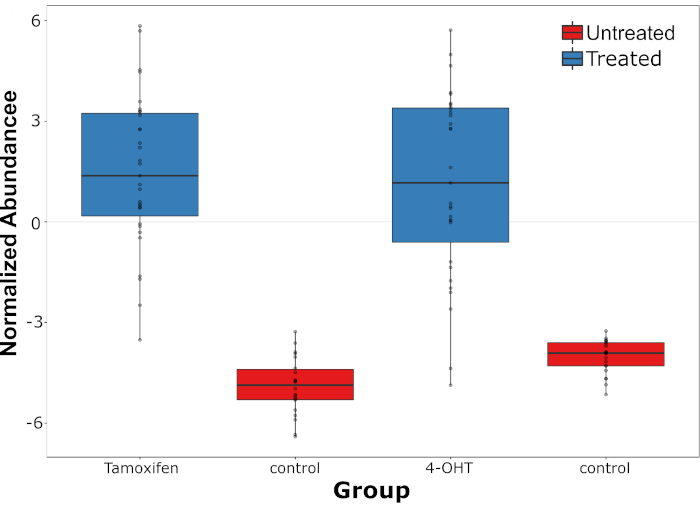
図4:タモキシフェンの存在量とその代謝産物の分布タモキシフェンの存在量とその代謝産物の分布は、未処理細胞における内因性ピークと比較して4-OHT(単一細胞レベルで測定される)(対照)である。この図は、以前の文書4から変更されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
この原稿では、HepG2細胞をタモキシフェンに曝露する(または露出しない)単純なケースを選んだ。ラマン分光法および質量分析システムの能力は、細胞に対するタモキシフェンの影響を監視するために実証されています。ラマン分光法は、薬物暴露に対する単一細胞の一般的な応答を反映する潜在的なバイオマーカーの同定を可能にした。単一細胞間のいくつかの不均一性が観察され、いくつかの細胞が薬物暴露に反応しなかったことを示唆した。一方、LSC-MSは、薬物とその代謝産物の高いレベルで、薬物およびその代謝産物の存在量において高い不均一性が認められた単一細胞レベルで薬物とその代謝産物の標的分析を行うことができる。この不均一性は、一部の細胞が薬物の影響を受ける理由を説明するのに役立ちますが、他の細胞は、おそらく均一な集団12に由来する細胞にもかかわらず、一見そうではありません。
注意が必要なこの技術の特定の側面の中で、データの再現性を確保するために顕微鏡のセットアップと信号処理の品質を評価することが重要です。スペクトルの前処理を慎重に行う場合は、信号の変動を各ピークの局所最大値で最大化する必要があります。対照的に、スペクトルのベースラインとエッジは、テストされたセル条件の間で重なる必要があります。もう一つの重要な側面は、治療間の違いを調べるために使用される多変量モデルです。正確で正確な解析を確実にするために、モデルとモデル パラメータを慎重に評価する必要があります。PLSモデルの利点の1つは、ニューラルネットワークとは異なり、モデルによってテストされた条件を最もよく区別する各波長(ラマンシフト)に関連する重みへのアクセスが可能にすることです。
ラマン分光法は薬物応答の判別に成功したにもかかわらず、この技術は生物学的解釈を提供するためにその使用に限定されることを強調すべきである。これは主に、何千もの分子の混合物を包含するスペクトル信号の複雑さによるものです。したがって、ラマンスペクトル強度と薬物濃度の変動との間の系統的変動を評価するために、さらなる調査が必要である。また、タモキシフェンに関連するスペクトルバイオマーカーの一般化を評価するためには、他の細胞株の同様の研究が必要である。
さらに、薬力学を評価し、各細胞内で薬物がどのように浸透し、流れるかを研究するために、生体組織の測定を行うことが興味深いかもしれません。さらに、LSC-MSにおけるサンプリング工程はオペレータの技量に大きく依存していることに留意すべきである。空間分解能、サンプリング後の毛細血管内の細胞位置、スループット強度などのパラメータは完全にオペレータに依存するため、LSC-MSの大規模な採用が制限されます。ただし、自動サンプリング システムによってこの問題が軽減される場合があります。さらに、LSC-MSは、天然の状態で付着細胞または浮遊細胞のサンプリングに優れていますが、組織切片に埋め込まれた細胞のサンプリングにおいては、よりパフォーマンスが低くなります。これは、サンプル密度が高い場合に、サンプリングキャピラリー先端が破損する傾向があるためです。従って、単一プローブのような別のアプローチは、そのような場合には14、15より適し得る。
ここで使用される細胞は最小限のサンプル調製で周囲条件でサンプリングされるため、LSC-MSは、このプロトコルにおけるラマンとの統合によって示されるように、他の技術と容易に統合することができます。3Dホログラフィーとの別の同様の統合は、細胞下レベル16で細胞代謝産物の絶対定量を達成することを可能にした。さらに、フローサイトメトリーとの統合は、神経芽細胞腫癌患者17、18の単一循環腫瘍細胞における代謝バイオマーカーの解明を可能にした。
将来的には、イメージングモダリティ19からのデータセットの組み合わせへの関心が近年高まっているため、積分計算アプローチを用いてラマン信号と質量分析結果(他のオミックス法)との間の系統的変動を調べるのも興味深い。興味深いことに、我々はすでにVIPスコアによって同定されたラマンピークの強度とMS4によって同定された単一細胞レベルでのタモキシフェンまたはその代謝産物の豊富さとの間にいくつかの弱いが有意な線形相関を発見した。このデータは、MSプロファイルとラマンスペクトルとの間の代謝関係とこれらの値を予測する可能性を示唆している可能性がある。
開示事項
著者は利益相反を宣言しない。
謝辞
著者らは、ヤルノ・ゲルモンド博士に帰属するヤナギダ俊夫氏の支援と理化学研究所の内部協力資金に感謝する。
資料
| Name | Company | Catalog Number | Comments |
| 0.1% penicillin-streptomycin | Nacalai Tesque | 09367-34 | |
| 35mm glass bottom grid dish | Matsunami | ||
| 4-Hydroxy Tamoxifen standard | Sigma-Aldrich | 94873 | |
| 532 nm diode pumped solid-state laser | Ventus, Laser Quantum | ||
| BIOS-L101T-S motorized microscope stage | OptoSigma | ||
| CT-2 cellomics coated sampling capillaries | HUMANIX | ||
| d5-Tamoxifen standard | Cambridge Isotope Laboratories | ||
| Dimethyl sulfoxide LC-MS grade | Nacalai Tesque | D8418 | |
| Dulbecco's Modified Eagle's medium | Sigma-Aldrich | D5796 | |
| Eppendorf GELoader tips | Eppendorf | ||
| fetal bovine serum | Hyclone laboratories | SH3006603 | |
| FluoroBrite DMEM | Thermo Fisher Scientific | ||
| Formic acid LC-MS grade | Sigma-Aldrich | 33015 | |
| HepG2 cell line (RCB1886) | RIKEN cell bank center | RCB1886 | |
| MC0-19A1C Incubator | Sanyo Electric Co. | MC0-19A1C | |
| Methanol LC-MS grade | Sigma-Aldrich | 1060352500 | |
| MMO-203 3-D Micromanipulator | Narshige | MMO-203 | |
| NA:0.95, UPL40 water-immersion Olympus objective lens | Olympus | ||
| Nanoflex nano-ESI adaptor | Thermo Fisher Scientific | ES071 | |
| On-stage incubator | ibidi | ||
| Pierce LTQ Velos ESI calibration solution | Thermo Fisher Scientific | 88323 | |
| PIXIS BR400 cooled CCD camera | Princeton Instruments | ||
| Q-Exactive Orbitrap | Thermo Fisher Scientific | ||
| Rat-tail collagen coating solution | Cell Applications Inc. | ||
| Tamoxifen standard | Sigma-Aldrich | 85256 |
参考文献
- Altschuler, S. J., et al. Cellular heterogeneity: do differences make a difference?. Cell. 141 (4), 559-563 (2010).
- Ali, A., et al. Single-cell metabolomics by mass spectrometry: Advances, challenges, and future applications. TrAC Trends in Analytical Chemistry. , (2019).
- Bunnage, M., et al. Target validation using chemical probes. Nature Chemical Biology. 9 (4), 195-199 (2013).
- Ali, A., et al. Single-Cell Screening of Tamoxifen Abundance and Effect Using Mass Spectrometry and Raman-Spectroscopy. Analytical Chemistry. 91 (4), 2710-2718 (2019).
- Wu, H., et al. In vivo lipidomics using single-cell Raman spectroscopy. Proceedings of the National Academy of Sciences of the United States of America. 108 (9), 3809-3814 (2011).
- Okada, M., et al. Label-free Raman observation of cytochrome c dynamics during apoptosis. Proceedings of the National Academy of Sciences of the United States of America. 109 (1), 28-32 (2012).
- Palonpon, A. F., et al. Raman and SERS microscopy for molecular imaging of live cells. Nature Protocols. 8 (4), 677-692 (2013).
- Butler, H. J., et al. Using Raman spectroscopy to characterize biological materials. Nature Protocols. 11 (4), 664-687 (2016).
- Mark, H., Workman, J. . Chemomtrics in Spectroscopy. , (2018).
- Lieber, C. A., Mahadevan-Jansen, A. Automated method for subtraction of fluorescence from biological Raman spectra. Applied Spectroscopy. 57, 1363-1367 (2003).
- Germond, A., et al. Raman spectral signature reflects transcriptomic features of antibiotic resistance in Escherichia coli. Communications Biology. 1, 85 (2018).
- Wold, S., et al. Partial Least Squares Projections to Latent Structures (PLS) in Chemistry. Encyclopedia of Computational Chemistry. , (2002).
- Chong, I. G., Jun, C. H. Performance of some variable selection methods when multicollinearity is present. Chemometrics and Intelligent Laboratory Systems. 78, (2005).
- Inde, Z., Dixon, S. J. The impact of non-genetic heterogeneity on cancer cell death. Critical Reviews in Biochemistry and Molecular Biology. 53 (1), 99-114 (2018).
- Pan, N., et al. The single-probe: a miniaturized multifunctional device for single cell mass spectrometry analysis. Analytical chemistry. 86 (19), 9376-9380 (2014).
- Rao, W., et al. Applications of the Single-probe: Mass Spectrometry Imaging and Single Cell Analysis under Ambient Conditions. Journal of Visualized Experiments. (112), e53911 (2016).
- Ali, A., et al. Quantitative Live Single-cell Mass Spectrometry with Spatial Evaluation by Three-Dimensional Holographic and Tomographic Laser Microscopy. Analytical Sciences: the International Journal of the Japan Society for Analytical Chemistry. 32 (2), 125-127 (2016).
- Abouleila, Y., et al. Live single cell mass spectrometry reveals cancer-specific metabolic profiles of circulating tumor cells. Cancer Science. 110, 697-706 (2018).
- Hiyama, E., et al. Direct Lipido-Metabolomics of Single Floating Cells for Analysis of Circulating Tumor Cells by Live Single-cell Mass Spectrometry. Analytical Sciences: the International Journal of the Japan Society for Analytical Chemistry. 31 (12), 1215-1217 (2015).
- Ryabchykov, O., et al. Fusion of MALDI Spectrometric Imaging and Raman Spectroscopic Data for the Analysis of Biological Samples. Frontiers in Chemistry. 6, 257 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved