Method Article
LQ αおよびβパラメータ、放射線投与スキーマ、および生体内線量堆積の評価のための照射試運転と線量測定
* これらの著者は同等に貢献しました
要約
放射線線量測定は、前臨床実験の精度を高め、提供される放射線量が臨床パラメータと密接に関連していることを保証する技術を提供します。このプロトコルは、適切な実験計画を確実にするために、前臨床放射線実験中に各段階で取られるステップを記述する。
要約
放射線線量測定は、高い翻訳関連性を持つ前臨床モデルにおける放射線スキームの正確な送達と再現性において重要です。インビトロまたはインビボ実験を行う前に、照射器および個々の実験計画に対する特定の用量出力を評価する必要があります。イオン化チャンバー、電気計、固体水の設定を使用して、アイソセンターで広いフィールドの線量出力を決定することができます。イオン化チャンバの代わりに放射性クロムフィルムと同様のセットアップを使用して、異なる深さで小さいフィールドの線量率も決定することができる。放射線治療に応答したがん細胞の生体外クロノジェニック生存アッセイは、これらのデータを従来の線形二次モデルに適合させることによって細胞株の固有の無線感受性の尺度を提供する安価な実験である。これらのアッセイから推定されるモデルパラメータは、生物学的有効用量の原理と組み合わせることで、腫瘍を持つ動物実験で同等の有効用量を提供する放射線治療のための様々な分画スケジュールを開発することを可能にする。これは、生体内放射線療法のスケジュールを比較して、配信された有効用量の分散による結果の潜在的な交和を排除する際に考慮し、修正する重要な要因です。この記事では、前臨床動物およびキャビネット照射器の線量出力検証、放射線感受性のインビトロ評価、および小さな生物における放射線送達の検証のための一般的な方法を提供する。
概要
癌は、米国および世界中の多くの国で2番目に多い死因を総称する。放射線療法は、多くの腫瘍サブタイプの治療の基礎であり、すべての癌患者の約半分に投与される2,3.放射線量を照射するために使用される装置が着実に進行し、いくつかの効果的なマルチモーダル療法アプローチが4、5、6を開発したため、ほぼすべての癌の患者の転帰は、時間の経過とともに改善されたが、特定のタイプの腫瘍の患者の再発および死亡率は依然として高い7、8、9である。したがって、がんの放射線治療は基礎研究と臨床研究の活発な分野であり続けている。多くの前臨床放射線治療研究は、がんのインビトロまたは動物モデルに放射線量を提供するために小規模な照射器を使用しています。機械化された放射線生物学の詳細や新しい治療法を探求する多数の潜在的な実験により、誤った結論、再現性の悪さ、無駄な資源につながる一般的な落とし穴が発生する可能性があります。これらの落とし穴は、照射器の線量測定、モデル細胞株のインビトロ特性、インビボ照射の照射のスケジュールとセットアップの3つの重要な領域に含まれる。より高度な実験による正確で再現性の高い結果は、放射線治療研究のこれらの基本的な側面に注意を払わなければ達成することは困難である。
ここで説明するプロトコルは、これらの問題を回避または軽減するための一般化された戦略を説明し、独立した使用を目的としたいくつかの以前に開発された方法論を引き出す。これらの異なる方法は、前臨床放射線療法実験の開始または改善に興味を持つ研究者がこれを堅牢な実験レイアウトとして使用できるようにマージされました。提案されたフレームワークには、小規模動物照射器の試運転、モデル癌細胞株の基本的な放射線特性の決定、および生体内腫瘍モデルの投与および分画スケジュールを適切に設計および管理するための方法論が含まれる。
プロトコル
取り扱いと手順を含む実験動物の使用を含むこのプロトコルの任意のステップは、ウェストバージニア州モーガンタウンのウェストバージニア大学の施設動物のケアと使用委員会によって承認されました(プロトコル番号:1604001894)。
1. 線量出力の決定
- このプロトコルは、米国医学タスクグループ(AAPM TG)6110 の「幻外法」プロトコルに基づいて使用し、Xstrahlが設定した試運転プロトコルと同様に、以下の条件下での特定の幾何学的形状に関する小動物照射器のビーム出力を決定する。
- 照射器を220kVpと13 mAで照射し、アイソセンターに位置するオープンフィールド(17 cm x 17 cm)、またはソースから35cmに照射します。さらに、広い焦点を持つ0.15 mm Cuフィルターでビームをフィルターします。一部の細胞照射器は放射性源のみを含み、このプロトコルはX線照射器にのみ使用することができる。
- 固体水ファントムを次の順序で整列させます:1 cmスラブ、イオン化チャンバースロット付き2 cmスラブ、2センチスラブ、1 cmスラブ。この順序で固体水ファントムを積み重ね、イオン化チャンバーを2cmの深さに配置し、4cmの後方散乱を可能にする。ドシメトリーの設定をグラフィカルに描写するには、 図 1 を参照してください。
注:固体水の大きな、かなり重いスタックに対応するために、著者らはファントムスタックがレベルであり、中央だけでなく、材料の表面を横切ってソースから正しい距離にあることを確認するために、可変サポートを備えたカスタム3Dプリントソファの取得をお勧めします。
- 測定装置(すなわち、ADCL較正イオン化チャンバ、電気計)と使用した補正係数の説明を使用して、それぞれ 材料表 および 表1 に記載されています。
注: ADCL が異なるハーフバリュー レイヤ(HVL、ビーム品質の測定)の 2 つのポイントで Nk の値を提供していること。プロトコルで使用される Nk の値は、単位の測定された HVL の ADCL 値の補間に基づく必要があります。メーカーは、当社のユニットのHVLを測定し、我々は我々の線量率出力決定にそれを使用しました。 - ファントムスタックを設定し、ステップ1.1.2で指定したファントムにイオン化チャンバーを挿入します。
- ファントムスタックを調整して、ソースから表面までの距離(SSD)、または放射線源から第1の表面までの距離が、適宜平準化した場合は33cmになるように調整する。
注:著者らは、固体水スラブの寸法をサポートするのに十分な大きさのカスタム3Dプリントソファを作成することを提案しています。さらに、このプロトコルで利用される1つは、ファントムスタックを平準化するための調整可能なコンポーネントを有する。
- ファントムスタックを調整して、ソースから表面までの距離(SSD)、または放射線源から第1の表面までの距離が、適宜平準化した場合は33cmになるように調整する。
- 3つの別々のX線露出の平均を取り、300Vに設定された電位計バイアス電圧で1分の測定値を取ります。結果は M +と呼ぶ。
メモ:照射は220 kVpおよび13 mAで放射線を送達するように設定された器械によって行われる。これは、次の 2 つの手順 (手順 1.5 ~ 1.6) でも同じです。ユーザーの安全のために、処置の間ドアが閉まっていることを確認してください。 - 3つの別々のX線露光の別のセット、-150 Vに設定された電気計バイアス電圧で1分の測定値を実行します。結果は MLと呼ぶ。
- 3つの別々のX線露光、1分の測定値の別のセットを実行し、電気計バイアス電圧を-300 Vに設定します。結果は MHと呼ぶか、M-と呼ぶ。
- 以下に示すように、それぞれ式 1と数式 2を使用して Pの polと Pイオンを計算します。
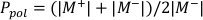 (数式 1)
(数式 1)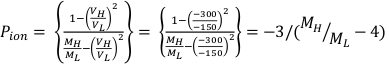 (数式 2)
(数式 2) - 校正されたデジタル温度計と気圧計を使用して、照射器内の温度を摂氏温度と圧力(kPa)で測定します。次に、式3に示すように PTPを計算します。
注: この計算では、空気角膜キャリブレーション係数の値を示す際に、ADCL が標準温度と圧力値を 22 °C および 101.33 kPa で使用したと想定しています。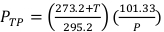 (数式 3)
(数式 3) - 補正されたチャンバーの読み取り値を計算します, M, 生のチャンバーの読み取り, MH, Pelecによって, Ppol, Pイオン, PTP.この方程式は、以下の 数式 4にあります。
注: この計算では、ADCL がバイアス電圧を -300V に設定してキャリブレーションを実行したと想定しています。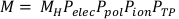 (数式 4)。
(数式 4)。 - さらに、修正されたチャンバーの読み取り値を Nk、(μen/p)w空気)水、 P Q、 チャム、および Pシースを掛けます。Pシース は、水で得られる測定にのみ必要です。したがって、このプロトコルの場合、Pシース は1だけである。
注: このプロトコルの条件を使用して、後者の 3 つの項目は 1.0731 の値を与えます。この値はビームの品質に依存するため、HVL を判別するためには HVL が認識されている必要があります。1.0731 の値は、当社のユニットに固有であり、例として示されています。装置に固有のPQ,chamと[(μen/p)wair]の水の値を決定するには、測定されたHVLを使用して表VIIと表VIIIから補間し、AAPM TG61プロトコル10の図3と図4に従って参照フィールドサイズを修正します。この例では、Nkに 1.0731 を掛けると、AdCL Nk値が Gy/Coulumbs で指定されていると仮定して、1 分間の公称時間の Gy の水に対する線量 Dwが提供されます。 - 使用している照射器のエンドエフェクトを決定します。X線が最初に生成されると、出力はある程度の有限時間にわたってその完全な値に上昇します。同様に、X線源をオフにすると、出力は有限時間に対してゼロに減少します。
- この遷移の時間、またはエンドエフェクトを考慮します。これは、さまざまな時間設定のために、-300 Vに設定された電位計バイアス電圧で3つの測定値の平均を取ることによって行うことができます。6、12、18、24、30、および 60 秒間、これを行います。
- 時間に対して電解計の測定値をプロットし、最良の直線を見つけます。1分間の処理の合計時間(t)は 、式 5で計算できます。
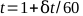 (方程式5)。
(方程式5)。
- 指定された照射器の線量率を 式 6で計算します。
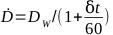 (方程式 6)
(方程式 6)
2. 放射性膜の較正曲線の作成
- 必要な材料の一覧については、 材料表を参照してください。
- 前のプロトコルと同じ設定を使用して、固体水ファントムスタックの深さ2cmにフィルムを配置します。固形水ファントムの順序は、蓄積と後方散乱効果のために、上に2cmの固体水と4cmの固体水が下にある限り、重要ではありません。
- プロトコル1で委託された決定用量を使用して、 表2 に記載されている用量の処理時間を 式7を用いて決定した:
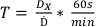 (数式 7)
(数式 7) - 各フィルムが同じサイズであり、スキャン獲得までの処理から同じ向きに残っていることを確認するフィルムのいくつかの部分を準備します。これは、左下隅に小さな斜め切り線を配置することによって行うことができます。この時点から各フィルムはフィルムの同じバッチからでなければなりません。
注:評価される各用量ポイントのために3つの別々の複製を準備します。 - 48ビットカラーフォトスキャナを使用して、すべての補正をオフにして、カット部分をスキャンします。各フィルムがスキャンベッドの正確な中央に配置されていることを確認します。得られた値は、非露光光学密度11,12を決定するために使用される事前露光スキャンである。ですべての画像を保存します。キーデータの圧縮を避けるため、TIFF ファイル形式。
注:著者は、フィルムを3回スキャンし、取得した平均を特定のフィルムの単一の値として使用することをお勧めします。 - フィルムを4cmの固体水の上に置いてフィルムの照射を開始し、このセクションで前述したように、残りの2cmの固体水を上に配置します。
- イオン化チャンバーと同じ距離のフィルムが線量出力を決定する際に、その原産地から同じ距離になるようにファントムセットを調整する。これは、照射器のアイソセントリックポイントです。
- 1つの所定用量について上記のステップ2.3で計算された治療時間をプログラムする。
- 表2に記載されている各用量について、処理を繰り返します。
- フィルムが光から保護された24時間休むことを許可します。
- 上記と同様に、露光後フィルムスキャンを取得します。
- ImageJ解析ソフトウェアに画像をインポートし、赤チャンネルですべての測定を行います。
- で画像をドラッグします。Tiff ファイル形式をイメージ J に変換します。
- [イメージ] ドロップダウン メニュー を クリックします。[イメージから 色 ] ドロップダウン メニュー を 選択します。 [色] オプションから [分割チャネル] を選択します。
- 赤の画像チャンネルのみを使用して、四角形ツールを使用して対象領域を描画します。 Ctrl キーを押しながら Mキーを押します。結果ウィンドウから平均値を書き起こす。
- スキャンしたすべてのフィルムについて、手順 2.12.1 ~ 2.12.4 を繰り返します。
- 非露出フィルムと露出フィルムの両方について、中央に位置する1 cm x 1 cm四方のピクセル値を取得します。これらの値はそれぞれPVU(D) とPV(D) と表記され、 式8で説明されているように正味光学密度の計算に使用できます。
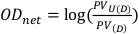 (数式 8)13
(数式 8)13
- フィルムイメージのペアごとに、露出前と露出後の両方についてステップ2.13を繰り返します。
- 線量対正味光学密度のグラフをプロットし、y = ax3 + bx2 + cx + dの形式で曲線を立方多項式に適合させます。図 2Bに例を示します。
3. クロノジェニックアッセイによる特定の癌細胞株のα/β値の決定
注: 次のプロトコルは、フランケンら14 で説明されているメソッドの修正版であり、図 3に示されています。
- 細胞を約80%の合流まで成長させます。細胞が細胞増殖の対数段階にある必要がある場合、この実験には過剰コンフルエントな細胞源の使用を避けてください。 図3Cに示す代表的なクロノゲンアッセイ結果については、脳熱帯MDA-MB-231乳癌細胞を、10%の胎児ウシ血清およびペニシリン/ストレプトマイシンを添加したDulbeccoの修飾イーグル培地(DMEM)で培養し、37°Cおよび5%の炭酸ガスで加湿したインキュベーターでインキュベートした。
- コロニーアッセイのために所望の密度で細胞を播種します。播種中の正確な希釈は、アッセイのめっき効率を決定するために重要です。必ず複数の複製をプレートにしてください。
- 放射線処理が細胞めっきの前に行われる場合は、このステップを進めます(図3A)。あるいは、細胞めっきが放射線処理に先行する場合は、ステップ3.4に進みます。
- 培養フラスコに対して所望の放射線処理を行う。任意の追加の治療(すなわち薬物治療)は、この前後の任意の時点で行われ得る。 図3Cにおける代表的な結果については、めっき細胞の後に放射線処理が起こり、ステップ3.4で詳述した。
- 好ましいトリプシン化法を用いて細胞を抽出し、単一の細胞懸濁液を作成する。培養培地を除去し、組換え酵素(例えば、トリプルエクスプレス)を添加してフラスコから細胞を取り外す。軽顕微鏡を用いて細胞を検出して分離するまで、酵素を用いて細胞を約3分間インキュベートする。等量の細胞培養培地を用いて酵素を中和する。遠心分離細胞は10分間300xgで、培地中で所望の濃度まで再懸濁した。
- 複数の反復で所望の密度でセルをプレートします。
- 最初の24時間後に新鮮なメディアで置き換えます。
- 2~3日ごとにメディアの交換を続けます。
- 制御コロニーがコロニー当たり50個の細胞を超えるまで、9~14日まで細胞培養を続ける。対照コロニーは、放射線量を受け取らない治療群である。薬物治療を用いた実験では、薬物の服用を伴う別の対照群も必要とされない。
- 放射線治療の前に細胞を播種する場合、このステップを進めます(図3B)。
- 好ましいトリプシン化法を用いて細胞を抽出し、単一細胞懸濁液を作成する。
- 複数の反復で目的の密度にセルを配置します。
- 細胞が一晩プレートに付着することを許可します。
- 所望の放射線量を行う。薬物の服用などの追加の治療は、細胞が治療プレートに付着している限り、このステップの前後の任意の時点で行われ得る。 図3Cの代表的な結果については、1250個の脳トロピックMDA-MB-231細胞を処置前にめっきした(ステップ3.4)。次いで、細胞を3GyのX線で照射する3時間前に15nMドキソルビシンで処理した。
- 最初の24時間後にメディアを交換してください。
- 2~3日ごとにメディアを交換してください。
- 対照群コロニーが50個を超えるまで処理した細胞を培養し、〜9〜14日を超える。対照コロニーは、放射線量を受け取らない治療群である。薬物治療を用いた実験では、薬物の服用を伴う別の対照群も必要とされない。
- 井戸や皿から培養培地を取り出し、PBSで洗います。
- 氷河酢酸とメタノールの1:7(v:v)溶液で細胞を15分間固定します。
- 固定ソリューションを削除します。
- 固定後、蒸留水とメタノールの4:1(v:v)溶液中の水晶バイオレットの2.5〜5.0 mg/mL溶液を室温で、30分間、または2時間の期間で染色する。
- 汚れ溶液を取り除き、大きな室温の水浴で細胞を洗います。
注:流水で洗わないで下さい。 - 各処理群のコロニーの結果数をカウントし、各プレートの生存率を計算します。
- 配信された対応する線量に対して生存率をプロットし、指数フィットで曲線を適合させます。
- α/β値を推定するには、上記プロットの指数適合を使用して、以下に示す線形二次方程式の調整可能な各パラメータの値を推定します。
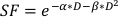 (数式 9)
(数式 9)
注:細胞の照射は、通常、フィールドサイズが十分なプレートやシャーレを収容するのに十分な大きさである限り、コリメーションなしでアイソセンターで行うことができます。このプロトコルの潜在的な落とし穴には、コロニー形成なし、明確な細胞増殖を伴う有意な細胞移動、真のコロニーがない、または非無菌照射器室での治療による汚染などの収量が含まれる可能性がある。
4. 可変実験計画の特定線量出力の決定
- ソースから目的のフィールドサイズと距離を決定します。
注:コリメーションは、X線源からのコリメータのサイズや距離に関係なく、線量速度を変更します。 - 固形水ファントムを使用して蓄積と後方散乱を提供し、実験計画を最もよく描写する正しい向きにフィルムを配置します。
注: 実験用の設定では、固体水は、特定の設計の最も正確な表現を提供しない場合があります。代わりに、実際の実験の容器(すなわち、ペトリ皿、井戸プレート、小動物ファントムなど)を使用することをお勧めします。 - フィルムを1分間(N=3)および2(N=3)分間照射します。
- フィルムが光から保護された24時間休むことを許可します。
- セクション2の手順に従って各フィルムの正味光学密度を決定します。フィルムの較正曲線を使用して、正味光学密度から線量を決定します。
- 1 分での線量を決定します, D1, 出力線量率として, Ḋ, 式で 定義されたこの実験セットアップのための次のように:
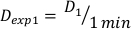 (数式 10)
(数式 10) - 同様に、 以下のように式11 により2分間で線量をカクル化する:
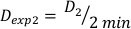 (数式 11)
(数式 11) - 終了効果のため、上記の計算のための線量率は若干異なるかもしれません。このため、目的の実験計画の Dexpを計算するために、式 12に示すように個々の Dexpの平均を使用します。
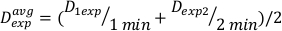 (数式 12)
(数式 12) - この平均を使用して、 式13でこの特定の設定のための任意の所望の用量に治療するための時間を定義します。
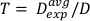 (数式 13)
(数式 13)
5. 対象の解剖学的位置で腫瘍を担うマウスの治療
- 施設のIACUCによって承認された安全で人道的な麻酔技術でマウスを麻酔します。
- 所望の実験計画で示されるように拘束で麻酔動物を置く。
- このステップは オプションですが、使用できない場合はステップ 5.6 に進みます。 アルミニウムフィルターを使用して、コリメーションなしでマウスのオンボードポータルカメラを使用して、ラジオグラムを取得します。
- コリメーションを配置した第 2 のラジオグラムを取得します。
- ビームの位置を示すために ImageJ でラジオグラムをオーバーレイします。
- 所定のα/β値を使用して、研究用の質問に答える最も合理的なアプローチを提供する用量スキームを決定する(すなわち、3Gyの10画分で送達された30Gyの用量の効果をモデル化したいが、4つの分数のみを与えたい)。 式14 を用いて、想定α/β値を10(この値は プロトコル3の個々の癌細胞株について決定することができる)と30Gy/10 Fのそれと同様のBEDを用いて、6Gyの4画分で24Gyで治療する。
- 所望の用量のために与えられた所定の時間のために動物を扱う。
6. 生体内での用量沈着の組織学的確認
- プロトコル5に従って、治療15、16の1時間以内に関心のある組織を収集する。組織収穫後、好ましい免疫組織化学プロトコルを進める。例を以下に示します。
- 氷冷4%パラホルムアルデヒド(PFA)で動物を浸透させます。
- 4°CでPFAでの後修正。
- 固定後、組織を10%、20%、および30%のスクロースを室温でそれぞれ24時間順次固定する。
- ゼラチンに組織を埋め込み、4%PFAで順次固定し、室温でそれぞれ24時間、再び10〜30%のスクロースで再び固定する。
- ブロックをトリムし、30分間-80°Cに置きます。
- 20~30μmの切片に組織をスライスします。
- 免疫染色体は、6つのウェルプレート17,18に遊離浮遊部としてスライドする。
- 1%トリトンで1.83%リジン、4%の熱不活性化ヤギ血清でシェーカーで3回洗浄し、30分間透過させます。
- 抗γH2AX抗体を24時間インキュベートし、続いて所望の二次抗体を用いて2時間インキュベートした。
- 好ましい取り付けメディアを使用してガラスカバーリップ付きカバースリップスライド。
- 蛍光顕微鏡上の画像。
結果
以下のプロトコル1は、使用されている照射器に固有のGy /minで用量速度を提供する。しかし、照射器の種類に関係なく、公知の線量レートを用いて、同じフィルムを生成するプロトコル2を用いて較正曲線を生成することができ、 図2A-Bのそれと同様の較正曲線を得ることができる。プロトコル3からのアッセイが成功すると、均質に紫色に染色される細胞の明確で、よく分別されたコロニーが生じる。α/βの推定値は、文献値または他の治療群と比較して、所定の細胞株の電波感受性を解釈することができる。プロトコル2に従って開発され、 図2Bに表示される較正曲線を利用して、プロトコル4は、必要な実験照射時間を推定するために使用できる 図2A に似た2つのフィルムサンプルを生成する。使用されている照射器にオンボードポータルイメージングカメラが利用可能な場合、小動物のラジオグラムは、コリメーションの有無にかかわらず得ることができます。これらの画像を重ね合わせると、 図4Aで描かれている小動物に対するコリメートされた放射線ビームの正確な位置を示す。プロトコル5における正常な用量堆積は、プロトコル6に従って確認することができる。インビボ系またはインビトロ系に放射線が堆積していることを示す1つの兆候は、二本鎖DNA切断の検出である。 図4Bに示すように、 図4Aの右半球を通してのみ処理された同じマウスは、処理された半球のみにおいて正のγH2AX染色を示している。この図では、核はDAPIで染色され、2つのことを示しています。1)全体は、抗γH2AX抗体が組織学的分析中に適用された脳のものであり、2)未治療の半球の脳は染色されないままである。
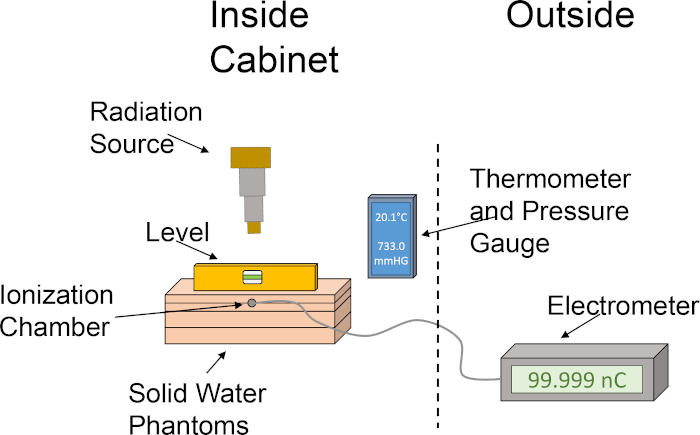
図1:線量出力の決定のために設定されたイオン化チャンバーと水ファントムのラフセットアップ。ピクトグラムは、照射器のキャビネット内のイオン化チャンバーおよび固体水ファントムを使用して、線量測定に必要な種々の成分を利用した基本設定を示す。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:放射性クロムフィルムを用いた較正曲線の生成(A) 放射線色素膜の代表的な色変化と用量の増加左上 (0 cGy);右下(2000 cGy)。(B)正味光学密度と線量を比較した潜在的な放射性クロムフィルムの較正曲線。 この図の大きなバージョンを表示するには、ここをクリックしてください。
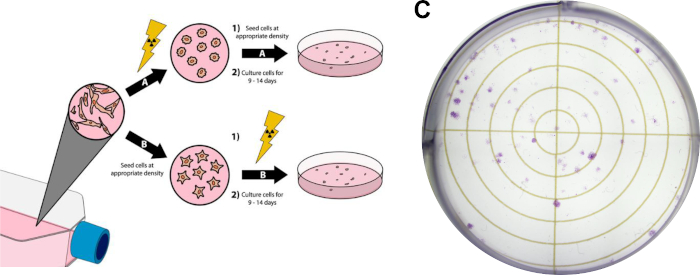
図3:がん細胞のクロノジェニックアッセイ細胞の放射線処理は、6つのウェルプレート/シャーレ(A)または後(B)でメッキする前に行うことができます。パネル(C)において、プロトコルセクション3に従った後のMDA-MB-231乳癌細胞を用いた正常なクロノゲンアッセイの代表的な画像が表示される。 この図の大きなバージョンを表示するには、ここをクリックしてください。
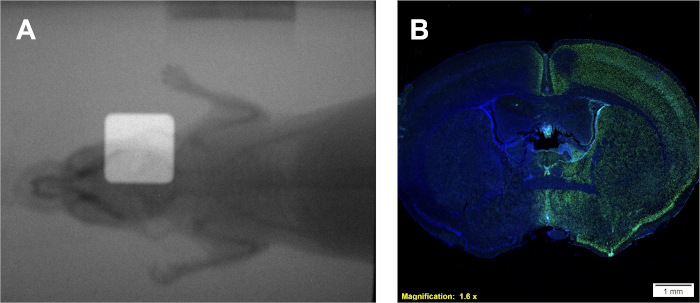
図4:投与量沈着の確認のための位置決め(可能な場合)および正のγH2AX免疫学的染色のための二重重膜放射計の使用。(A) 放射線ビームの配置を描いた代表的なラジオグラムを重ねた。(B)γH2AX強度の増加によって示されるように右半球への用量沈着を示す代表的な結果。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 補正係数 | 説明 | |
| Nκ | 空気角膜キャリブレーション係数 | |
| [(μen/ρ)Wエア]水 | 空気への水の質量エネルギー吸収係数の配給;約1.05 | |
| Pq,チャム | チャンバーによる光子フルエンスパータベーションに影響を与えるチャンバーステムの補正会計;約1.022 | |
| Pシース | 外イオン化チャンバのシースの補正会計;部屋が防水であるように、1の値 | |
| Pポール | 極性を考慮した補正係数プロトコル 1 で決定 | |
| Pイオン | イオンの組換えのための補正係数を考慮;プロトコル 1 で決定 | |
| PTp | 実験の日にテメルパチャーと圧力のための補正因子のアコカント;プロトコル 1 で決定 | |
表1:プロトコル1での線量率の決定に必要な補正因子
| 線量 | N |
| 0.5 | 3 |
| 1 | 3 |
| 2 | 3 |
| 3 | 3 |
| 4 | 3 |
| 6 | 3 |
| 8 | 3 |
| 10 | 3 |
| 12* | 3 |
| 15* | 3 |
| 20* | 3 |
| *個々の実験のために10を超える用量にのみ必要です。 | |
表2:放射性クロムフィルムの較正曲線の生成に使用される用量。
ディスカッション
上記のプロトコルは、放射線量体測定のためのユーザーフレンドリーなアプローチ、癌細胞株におけるα/β値の決定、および乳癌脳転移の前臨床モデルにおける照射のアプローチの簡単な例を記述する。これらの方法は、癌の任意のモデルを研究するために使用することができ、乳癌の脳転移に限定されません。このセクションでは、前臨床放射線療法実験の根底にある関連する複雑さを議論する。
線量測定は、1)農家室で出力を較正し、X線ユニットの線量速度が確立されるように、2)放射性クロムフィルムを用いた実用的な量体測定システムを調製する。出力キャリブレーションに関して、TG-61は水中で再生可能な方法を提供します。ここでのプロトコルは、XStrahl、放射線照射器のメーカーが推奨するGammex RMI 457固体水を使用しています。固水による相対線量測定(プロファイルまたは深さの線量曲線を最大線量まで正規化)分析は、水のそれと1%より良いと同意するが、水に比べて固体水の質量エネルギー吸収係数が高いため、絶対用量で約3〜4%の差がある。しかし、XStrahlシステムのすべてのインストールでは、出力キャリブレーションに固体水プロトコルが使用されているため、これらの違いを修正できませんでした。出力を知ることで、所望の線量を提供するために必要な露光時間の計算が可能になります。農家室と同じセットアップにフィルムを配置すると、フィルムに既知の用量を提供することができます。フィルムをスキャンすると、光学密度が提供されます。フィルムへの線量は、次いで対応する正味光学密度(露光後と露光前の光密度の差)に対してグラフ化することができる。これにより、フィルムのキャリブレーションカーブが生成されます。実験の設定を変更すると、その状況での線量率は、被写界の大きさ、深さ、照射される材料に依存するため、変化する可能性があります。実験用の設定でフィルムを露出させることは、正味の光学密度を提供し、フィルムキャリブレーション曲線を使用して、対応する用量を決定することができます。この用量をフィルムが照射された時間で割ると、用量率が得られる。この用量レートは、与えられた実験セットアップのために所望の用量を提供するために露出時間を計算するために使用することができる。上述のプロトコルは、フィルム・ドシメトリーに関連するいくつかのニュアンスを処理します。例えば、露光後、フィルムの活性層の化学反応が事実上完了するまでに約24時間を要する。この時間を待たないと、光密度が低くなります。
再現可能な量化を持つ研究のためには、特定の照射器のいくつかの重要な要素を知り、理解することが重要です。特に、使用する照射器の作り方やモデルを他の研究者に知っておき、詳細を知ることは重要です。 ソースタイプ(X線、放射性など)、エネルギー、半値層、フィールドサイズ、表面とソースからアイソ中心距離、照射された材料のサイズ、照射された材料の前後散乱の前後の減衰、実験特異的線量率、分画スキーマ、正確な線量測定装置の利用、および使用される線量測定プロトコル。これらの情報点のすべては、任意の動物または細胞19に用量を送達する前に、与えられた照射器のビーム品質をまとやかに記述するものである。このプロトコルと他の他の情報の別の関連点は、プロトコル1で達成された線量率は、単に使用されている照射器の出力であるということです。任意の実験では、生成された放射性膜の較正曲線(プロトコル2)と比較して、その特定のセットアップ(プロトコル4)の線量速度を定義することが重要です。
インビトロ実験は、がん細胞株の放射性生物学的挙動に関する重要な詳細を提供する。生体外のクロノジェニック細胞生存アッセイは、細胞株20の固有の無線感度を正確に推定および定量し、その後の細胞または小動物実験21における分画スケジュールの設計を支援する。具体的には、これらのアッセイは、線形二次モデルで使用されるαおよびβのパラメータの値を近似し、次の式に従って放射線療法に応答して細胞死を予測します。
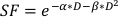 (数式 9)
(数式 9)
ここでSFは、クロノジェニック生存細胞の生存割合であり、DはGyで放射線量であり、αとβは、パラメータ22を適合させる。α/β比は、細胞の無線感度の固有の尺度を提供し、より高い値は細胞株22の感度の増加と相関する。この機能的関係は用量に対して非線形であるため、放射線療法分画スキームの生物学的効果は、総送達用量だけでなく、画分23の数および大きさにも関連している。生物学的有効用量(BED)は、組織に送達される真の生物学的用量の尺度であり、異なる分別スキーム24,25の直接比較を可能にする。BED 式は、α/βの推定値のみを必要とし、以下に表示されます。
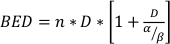 (数式 14)
(数式 14)
ここでnは、d.クロノジェニック細胞生存アッセイはα/βを推定し、BED式を介した放射線療法分画スキームの直接比較を容易にする用量D.クロノジェニック細胞生存アッセイの画分数である。治療群のBEDが実験の中または間で公平でない場合、放射線療法(または他のモダリティとの放射線療法の組み合わせ)に対する組織または臓器の応答に関する誤った結論が導かれる可能性がある。例えば、5 Gyの4画分と比較して10Gyの2画は同じBEDを生み出さないので、これらのドージングスキームは生物学的応答の観点から直接比較することができない。BED式は、線形二次モデルにおける固有の制限のために不完全であるが、幅広い実験的処置条件24,25に対する公平な効果を確実に推定する。
クロノジェニック細胞生存アッセイは明らかに癌モデルにおける放射線療法効果を研究する上で重要な役割を果たしているが、インビトロ実験は癌細胞放射線生物学の機械主義的詳細をさらに探求するための多くの追加の選択肢を提供する。クロノジェニック細胞生存アッセイの単純な修飾は、パクリタキセルまたはエトポシド26、27のようないくつかのラジオ感作化学療法のための作用様式を決定するために使用された。さらにインビトロ実験オプションには、γ-H2AX病巣や53BP1染色などの特定の細胞修復経路を調べる免疫細胞化学研究が含まれる。これらの実験は、特に特定の細胞株の機械的な詳細を探査する場合、単一のモダリティと併用療法とを比較する場合に特に興味深い場合がある。他の実験的選択肢としては、細胞死の様式(すなわち、アポトーシス、壊死、有糸分裂症など)の異なる治療条件の下での細胞の炎症反応の生来の役割を調べるサイトカイン測定が含まれる。このタイプの実験は、動物実験を補完または置き換えることができ、癌細胞株の放射線生物学のより完全な理解を提供する。実施する追加実験の選択にかかわらず、プロトコル3に記載されている標準的なクロノジェニック細胞生存アッセイは、細胞株の重要な初期放射線学的評価である。
クロノジェニックアッセイと放射線線量測定は、臨床シナリオに直接似た実験を正確に計画する手段を研究者に提供します。前臨床癌小さいげっ歯類モデルの付加によって、単独でまたは生体内の処置計画の文脈で放射線に対する応答を研究することができる。動物を使用する前に、用量出力32,33の判定に用いる設定と異なる場合は、特定の設定の相対用量出力を決定することが重要である。それは<10 mmのフィールドサイズの線量率を決定することになると、イオン化チャンバーの使用は、小さなフィールドと部分的な体積平均効果33内の位置合わせのために精度が低くなります。放射性クロムフィルムを使用して生体内免疫組織化学実験と組み合わせて出力を決定することは、過去16、34、35、36、37、38において出力および用量沈着を決定するために使用されてきた。
開示事項
著者らは開示を行う必要はありません。
謝辞
著者らは、WVUの顕微鏡および動物モデルイメージングファシリティに対して、グラント番号P20GM103434によってサポートされている機器の使用に感謝したいと考えています。さらに、この研究は、国立がん研究所の助成番号F99CA25376801、およびMylanチェア基金によって、国立一般医学研究所からの助成金番号P20GM121322によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| Acetic acid, glacial | Sigma-Aldrich | A6283 | This or comparable glacial acetic acid products are acceptable. |
| Crystal Violet | Sigma-Aldrich | C6158 | This or comparable crystal violet products are acceptable. |
| Digital Baraometer | Fisher Scientific | 14-650-118 | For pressure and temperature measurements. |
| Electrometer | Standard Imaging | CDX 2000B | Calibrated by an ADCL; Need correction factor, Pelec |
| Film | Gafchromic | EBT3 Film | Comes in sheets of 25; calibration films and experimental films must come from same set |
| Ionization Chamber | Farmer | PTW TN30013 | Calibrated by an ADCL @ two calibration points |
| Methanol | Sigma-Aldrich | 34860 | This or comparable methanol products are acceptable. |
| Photo Scanner | Epson | Perfection V700 | Equivalent scanners are V800, V10000, V11000, V12000 |
| XenX | Xstrahl | NA | Irradiator used. |
参考文献
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2019. CA: A Cancer Journal for Clinicians. 69 (1), 7-34 (2019).
- Allen, C., Her, S., Jaffray, D. A. Radiotherapy for Cancer: Present and Future. Advanced Drug Delivery Reviews. 109, 1-2 (2017).
- Delaney, G., Jacob, S., Featherstone, C., Barton, M. The role of radiotherapy in cancer treatment: estimating optimal utilization from a review of evidence-based clinical guidelines. Cancer. 104 (6), 1129-1137 (2005).
- Chen, H. H. W., Kuo, M. T. Improving radiotherapy in cancer treatment: Promises and challenges. Oncotarget. 8 (37), 62742-62758 (2017).
- Le, Q. T., Shirato, H., Giaccia, A. J., Koong, A. C. Emerging Treatment Paradigms in Radiation Oncology. Clinical Cancer Research. 21 (15), 3393-3401 (2015).
- Baumann, M., et al. Radiation oncology in the era of precision medicine. Nature Reviews Cancer. 16 (4), 234-249 (2016).
- Leeman, J. E., et al. Patterns of Treatment Failure and Postrecurrence Outcomes Among Patients With Locally Advanced Head and Neck Squamous Cell Carcinoma After Chemoradiotherapy Using Modern Radiation Techniques. JAMA Oncology. 3 (11), 1487-1494 (2017).
- Coy, P., et al. Patterns of failure following loco-regional radiotherapy in the treatment of limited stage small cell lung cancer. International Journal of Radiation Oncology - Biology - Physics. 28 (2), 355-362 (1994).
- Achrol, A. S., et al. Brain metastases. Nature Reviews Disease Primers. 5 (1), 5(2019).
- Ma, C. M., et al. AAPM protocol for 40-300 kV x-ray beam dosimetry in radiotherapy and radiobiology. Medical Physics. 28 (6), 868-893 (2001).
- Wang, Y. F., Lin, S. C., Na, Y. H., Black, P. J., Wuu, C. S. Dosimetric verification and commissioning for a small animal image-guided irradiator. Physics in Medicine and Biology. 63 (14), 145001(2018).
- Wack, L., et al. High throughput film dosimetry in homogeneous and heterogeneous media for a small animal irradiator. Physical Medicine. 30 (1), 36-46 (2014).
- Devic, S. Radiochromic film dosimetry: past, present, and future. Physical Medicine. 27 (3), 122-134 (2011).
- Franken, N. A., Rodermond, H. M., Stap, J., Haveman, J., van Bree, C. Clonogenic assay of cells in vitro. Nature Protocols. 1 (5), 2315-2319 (2006).
- Ford, E. C., et al. Localized CT-guided irradiation inhibits neurogenesis in specific regions of the adult mouse brain. Radiation Research. 175 (6), 774-783 (2011).
- Zarghami, N., et al. Half brain irradiation in a murine model of breast cancer brain metastasis: magnetic resonance imaging and histological assessments of dose-response. Radiation Oncology. 13 (1), 104(2018).
- Nwafor, D. C., et al. Loss of tissue-nonspecific alkaline phosphatase (TNAP) enzyme activity in cerebral microvessels is coupled to persistent neuroinflammation and behavioral deficits in late sepsis. Brain, Behavior, and Immunity. , (2019).
- Amtul, Z., Hepburn, J. D. Protein markers of cerebrovascular disruption of neurovascular unit: immunohistochemical and imaging approaches. Reviews in Neuroscience. 25 (4), 481-507 (2014).
- Draeger, E., et al. A Dose of Reality: How 20 Years of Incomplete Physics and Dosimetry Reporting in Radiobiology Studies May Have Contributed to the Reproducibility Crisis. International Journal of Radiation Oncology - Biology - Physics. 106 (2), 243-252 (2020).
- Dunne, A. L., et al. Relationship between clonogenic radiosensitivity, radiation-induced apoptosis and DNA damage/repair in human colon cancer cells. British Journal of Cancer. 89 (12), 2277-2283 (2003).
- Yang, Y., Xing, L. Optimization of radiotherapy dose-time fractionation with consideration of tumor specific biology. Medical Physics. 32 (12), 3666-3677 (2005).
- Hall, E. J., Giaccia, A. J. Radiobiology for the radiologist. Eighth edition. , Wolters Kluwer. (2019).
- van Leeuwen, C. M., et al. The alfa and beta of tumours: a review of parameters of the linear-quadratic model, derived from clinical radiotherapy studies. Radiation Oncology. 13 (1), 96(2018).
- Fowler, J. F. 21 years of biologically effective dose. British Institute of Radiology. 83 (991), 554-568 (2010).
- Jones, B., Dale, R. G., Deehan, C., Hopkins, K. I., Morgan, D. A. The role of biologically effective dose (BED) in clinical oncology. Clinical Oncology journal | The Royal College of Radiologists. 13 (2), 71-81 (2001).
- Choy, H., Rodriguez, F. F., Koester, S., Hilsenbeck, S., Von Hoff, D. D. Investigation of taxol as a potential radiation sensitizer. Cancer. 71 (11), 3774-3778 (1993).
- Ng, C. E., Bussey, A. M., Raaphorst, G. P. Inhibition of potentially lethal and sublethal damage repair by camptothecin and etoposide in human melanoma cell lines. International Journal of Radiation Biology. 66 (1), 49-57 (1994).
- Kurashige, T., Shimamura, M., Nagayama, Y. Differences in quantification of DNA double-strand breaks assessed by 53BP1/gammaH2AX focus formation assays and the comet assay in mammalian cells treated with irradiation and N-acetyl-L-cysteine. Journal of Radiation Research. 57 (3), 312-317 (2016).
- Schaue, D., Kachikwu, E. L., McBride, W. H. Cytokines in radiobiological responses: a review. Radiation Research. 178 (6), 505-523 (2012).
- Mery, B., et al. In Vitro Cell Death Determination for Drug Discovery: A Landscape Review of Real Issues. Journal of Cell Death. 10, 1179670717691251(2017).
- Galluzzi, L., et al. Molecular mechanisms of cell death recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death & Differentiation. 25 (3), 486-541 (2018).
- Felix, M. C., et al. Collimator optimization for small animal radiation therapy at a micro-CT. Z Medical Physics. 27 (1), 56-64 (2017).
- Newton, J., et al. Commissioning a small-field biological irradiator using point, 2D, and 3D dosimetry techniques. Medical Physics. 38 (12), 6754-6762 (2011).
- Wong, J., et al. High-resolution, small animal radiation research platform with x-ray tomographic guidance capabilities. International Journal of Radiation Oncology - Biology - Physics. 71 (5), 1591-1599 (2008).
- Ghita, M., et al. Small field dosimetry for the small animal radiotherapy research platform (SARRP). Radiation Oncology. 12 (1), 204(2017).
- Biglin, E. R., et al. Preclinical dosimetry: exploring the use of small animal phantoms. Radiation Oncology. 14 (1), 134(2019).
- Munoz Arango, E. T., Peixoto, J. G., de Almeida, C. E. Small field dosimetry with a high-resolution 3D scanning water phantom system for the small animal radiation research platform SARRP: a geometrical and quantitative study. Physics in Medicine and Biology. , (2019).
- Murrell, D. H., et al. Evaluating Changes to Blood-Brain Barrier Integrity in Brain Metastasis over Time and after Radiation Treatment. Translational Oncology. 9 (3), 219-227 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved