Method Article
有機Catプロセスを用いたリグノセルロース系バイオマスの分画
要約
OrganoCatはリグニン、発酵性糖、セルロースパルプへの穏やかな条件下でのリグノセルロースの前処理および分画の方法です。2,5フランカルボン酸を触媒とした生物原性の二相性溶媒系と2-メチルテトラヒドロフラン(2-メチルテトラヒドロフラン)では、OrganoCat製品を その際に 分離して簡単な製品回収を行います。
要約
石油ベースから持続可能でバイオベースの経済への移行には、原材料とエネルギーの供給を維持するための新しい製油所の概念の開発が必要です。これらの新しく持続可能なバイオリファイナリーの概念のためには、グリーンケミストリーの原理に沿った触媒と溶媒を使用することが重要です。したがって、バイオジェニック代替の実施は有望な解決策であり得る。本明細書で提示されるリグノセルロース前処理および分画処理プロセスは、リグノセルロースを触媒として2,5−フランジカルボン酸などの生物原性酸を用いてその主成分に統合された分画である。ヘミセルロースおよび他の非セルロース系多糖類は、希釈された酸によって選択的に脱重して溶解し、結晶セルロースは固体パルプに残る。生物起源2−メチルテトラヒドロフランからなる第2の有機相の存在下で、ジゼンタングルドリグニンは 、その中で抽出される。このプロセスにより、リグニン、セルロース、および非セルロース系の3つの成分の効率的な分画が可能になります。これは、リグニンの品質、セルロース濃縮パルプの酵素加水分解の改善、および低分解を伴う軽度の非セルロース糖抽出に焦点を当てるのに役立ちます。
概要
化石資源の利用は、日常生活に不可欠な数多くの製品の基礎となるため、技術の進歩に大きくつながっています。しかし、地球上の石油やガスなどの資源の制限や、その搾取に伴う環境被害は、代替案の緊急の必要性を生み出します。リグノセルロース系バイオマスは、再生可能で汎用性が高く、カーボンニュートラルな炭素系化学物質の有望な供給源である。リグノセルロースは、基本的にヘミセルロース、セルロース、リグニンの3つの主要な分画で構成されています。その産業加工は長い歴史を持っています。しかし、紙業界の亜硫酸塩およびクラフトプロセスのような確立され、広範なプロセスは、主にパルプおよび製紙業界2で利用するためのセルロースに焦点を当てている。リグノセルロース処理を経済的および環境的な観点からより収益性の高い化学物質にするためのリグノセルロースの全3つの分率の完全な評価が必要です。
多くのリグノセルロースの評価戦略では、リグニンはエネルギー回収のためにしばしば燃焼される単なる副産物です。現在、工業的に生産されたリグニンの1〜2%だけが、コンクリート添加剤、界面活性剤、バニリン3などの付加価値製品を製造するために使用されています。それにもかかわらず、それは芳香族の最大の再生可能な供給源であり、したがってポリマー4、炭素繊維5、および燃料2の基礎として適用するための有望な特性を有する。リグニンの評価における課題は、ソース材料と抽出条件に応じて、その複雑な構造と多様性にあります。さらに、そのプロセス条件のために、最も一般的なリグノセルロース分画プロセスは、モノマー単位間のC-Cリンケージの数が多いスルホン化リグニンを送達する。そのため、市販のリグニンは脱重合に挑戦的である。
3つの画分の全体的な利用に焦点を当てたさまざまなアプローチの範囲は、リグノセルロース分画のために開発されています。ほとんどのプロセスは、希釈された酸および塩基を用いて、または高温での水の自己プロトライシスを利用することによって、ヘミセルロースの加水分解に依存しています。最も探求された選択肢の1つとして、有機ソルブプロセスは、通常、水と組み合わせて、低沸点有機溶媒を使用しています。このプロセスのよく知られた変異体は、50%エタノールを利用するアルセルプロセス、および第1ステップでメタノールを使用し、第2ステップでNaOHを加える有機細胞プロセスを含む。ギ酸または酢酸を使用する酸オルガノソルブプロセスも2.主要なバイオリファイナリダイル製品としてのリグニンの評価に最近焦点を当てたため、リグニン抽出を後続または統合変換ステップと組み合わせて、より小さなリグニン化合物とより安定した貴重な製品6、7、8を生成する新しいアプローチが開発されました。
OrganoCat リグノセルロース分画プロセス (オルガノキャット) は、水と 2-メチルテトラヒドロフラン (2-MTHF)9の 2 相系に基づいています。さらに、リサイクル可能な有機酸を触媒として使用し、穏やかな温度でヘミセルロースを選択的に加水分解します。すべてのプロセス化学物質は、グリーンケミストリー10の原理に従ってプロセスの環境への影響を低減する比較的安価でバイオジェニックな方法で製造することができます。このプロセスは、有機相のリグニン、水相での脱重化されたヘミセルロース糖、およびセルロース濃縮パルプを固体残基として3つの別々の製品ストリームを提供します。製品ストリームを簡単に分離できるため、ダウンストリームのステップ、エネルギー需要、および材料コストは、例えば単一のアプローチと比較して大幅に削減できます。リグニンは比較的低分子量であり、β-O-4リンケージ11の数が多い。脱重化されたヘミセルロース糖は、発酵または微細な化学物質12への変換に使用することができる。セルロースパルプは、酵素分解9に対して非常にアクセス可能である。
元のOrganoCatプロセスは、リグノセルロースを分画する触媒としてシュウ酸を使用しています。その後、結晶化9によって、ウキ酸を回収することができる。しかし、これは、反応を冷却し、水の部分的な蒸発のためのプロセスコストを増加させます。シュウ酸の部分的な分解は、収益をさらに減少させる13.このため、2,5-フランジカルボン酸(FDCA)を触媒11として導入することで、OrganoCatのプロセスが改善された。FDCAは、反応を触媒するのに十分な酸性であるだけでなく、5−ヒドロキシメチルフルフラール及びその後の金属系触媒14、15、16、17による酸化への脱水を介してグルコースに由来することもできる。FDCAの酸性度はやや低いが、シュウ酸よりも熱安定性が高い。FDCAは室温で水への溶解度が低いため、反応後の水相からの容易な回復が可能です。
OrganoCat プロセスのスケールアップは、3 L 反応器18に開発に成功しました。OrganoCat リグニンに関する追加の研究は 、n-ヘキサンまたは n-ペンタンを用いた反溶媒沈殿により、エネルギー効率の良いリグニン回収を可能にすることを発見した。異なる分子量20でリグニン画分を得ることは可能であった。本論文では、FDCAを触媒として用いたリグノセルロース系バイオマスのスケーラブルなワンステップ分画プロセスの完全な調製方法を紹介する。このプロセスは、抽出されたリグニン、脱重化ヘミセルロース、およびセルロースパルプを3つの容易に分離可能な製品ストリームで得る。
プロトコル
注:プロセスは、室温(数日間)または冷蔵庫(より長い期間)にサンプルを残すことによって、任意の時点で一時停止することができます。このプロトコルで使用される材料の詳細については、 資料表 を参照してください。
1. ブナ材の粒子
- ブナ材の粒子径(Fagus sp.)を10mmふるいの切削ミルを用いて生成し、50°Cで粒子を一定の質量(〜24時間)に乾燥させ、残った水分含有量を10%程度残します。
2. リグノセルロース分画とワークアップ
- リグノセルロース前処理と分画
- ブナ材500mg(Fagussp)粒子と78.0mgのFDCAの78.0mg(0.5 mmol,0.1 M)を、25mLのステンレス鋼高圧反応器で室温で超純水5mLで懸濁します。懸濁液に5mLの2-MTHFと攪拌バーを加え、反応器を閉じます。1時間1500rpmの攪拌速度で加熱プレート上で160°Cに反応器を加熱します。
- 10分の間、氷水中の反応を室温まで冷まします。反応器を開き、NaOH溶液52.5μL(蒸留水に50重量%NaOH)を加え、攪拌板で室温で15分間、500rpmで攪拌します。
- 有機相の分離とリグニン定量
- 混合物を遠心分離する(室温、5分、1880×g)。 ピペットを使用して、有機相(2-MTHF)を50 mLのラウンドボトムフラスコに移します。
- 有機相をロータリーエバポレーター(40°C、200rpm、180mbar)で蒸発させ、固体および乾燥リグニン分画が得られるまで。分析バランスで計量することでリグニンの収率を決定します。固体リグニンを室温で保存し、さらに分析します。
- 固体セルロース濃縮パルプと水相の分離
- セルロースフィルターペーパー(17~30μmの孔径)を使用してセルロースを濃縮したパルプを分離し、水相を5mLバイアルに移します。パルプを3 x 25 mLの水で中性pHまで洗浄し、100 mLビーカーに別々に保管してください。パルプを80°Cで一定の質量(〜24時間)に乾燥させます。
- 分析バランスで計量することにより、乾燥パルプ収率を決定します。
- 水相のFDCAリカバリと分離
- 氷浴中の溶液を冷却しながら濃縮されたHClを用いて、一定撹拌下でステップ2.3から水相及び洗浄液のpHをpH1に調整する。ユニバーサルインジケーター用紙を使用してpHを制御します。
- 両方の溶液から沈殿した固体(FDCA)を濾過し、残基を組み合わせ、80°Cで一定の質量(〜24時間)に乾燥させた。するは捨てよ。分析バランスで計量することでFDCAの収率を測定します。
- 水相を25mLフラスコに移し、4°Cで保存して分析します。
- フルフラール定量のサンプル調製
- 別の実験を実行して、フルフラールの数量を決定します。ステップ 2.1.1 から 2.2.1 を繰り返します。
- 収集した有機溶媒画分に内部標準として 40mgのn-デカンを加え、分析用に保存します。
3. 分析
- パルスアンペロメトリック検出(HPAEC-PAD)による高性能アニオン交換クロマトグラフィーによる水相の糖の分析
- 190 μLの蒸留水でステップ2.4.3で集めた水相の10μLを希釈します。希釈したサンプルに2 mM 2-デオキシDグルコースの10 μLを加えます。
- 流量0.5 mL∙min-1の単糖セパレータカラムで単糖類の分離を行い、2mM NaOHで平衡後10分間サンプルを注入します。中性糖を2 mM NaOHで18分以上分離します。その後、550 mM NaOH を 10 分間使用して、ウロン酸を分離します。800 mM NaOH でカラムを 10 分間リンスします。
注:ソフトウェアは、単糖の量を内部標準の量に正規化し、異なる単糖の標準キャリブレーション曲線を使用して定量化します。
- 1H-13Cヘテロ核単一量子相関核磁気共鳴によるリグニン解析(1H-13C-HSQC NMR)
- 0.5mLの重水素ジメチルスルホキシド([d 6]DMSO)にリグニンの50mgを溶解し、混合物をNMRチューブに移します。400 MHz の分光計を使用して、1H-13C HSQC (測定時間 220 分) NMR 測定を行います。
- スペクトルを使用してリグニンに存在するリンケージの種類を決定する。
- DMSO信号へのスペクトルの化学シフトを参照してください(δ(1H) = 2.500 ppm; δ(13 C) = 39.52 ppm.
- すべての信号が正になるまで両軸で手動の位相補正を行い、ベースライン補正を実行します。
- 芳香族ユニットの信号とリグニンのリンケージを統合します。化学シフトについては 、表1 を参照してください。
- 次の式を使用して、芳香族単位 (arom.) の合計を計算します。
Σ(arom.) = (S2,6 / 2) + ((G2 + G5) / 2) + (H2,6 / 2) (1)
Si は、2および6シリンギル陽子に対応する信号の上に積分され、Gi は2および5グアヤシル陽子に対応する信号の上に積分であり、Hi は2および6 p-ヒドロキシフェニル陽子に対応する信号の上に積分である。 - 次の式を使用して、各単位の割合を計算します。
S = (S2,6/ 2) / Σ(arom.) × 100% (2)
G =(G2 + G5) / 2) / Σ(arom.) × 100% (3)
H = (H2,6 / 2) / Σ(arom.) × 100% (4)
S、G、およびHが各モノマー-シリンギル−(S)の割合であるとともに、グアイアシル−(G)、 およびp−ヒドロキシフェニル(H)−モノマー単位当たり100単位当たり。 - 次の式を使用して、100 単位あたりのリンケージ数を計算します。
β-O-4 リンケージ = α β-O-4 / Σ (arom.) × 100% (5)
リンケージ = (α β-β + β β-β + γ β β) / Σ(arom.) × 100% (6)
リンケージ = (α β-5 + β β-5 + γ β-5) / Σ(arom.) × 100% (7)
α、β、γが、対応するβ-O-4-、β-β、β-5リンケージのα、β、γ-陽子信号に対応する信号に対して積分される。
注:リンケージは、100モノマー単位あたりのリンケージとして与えられます。ピークの重なり合いにより、β-O-4はαプロトン信号のみを用いて計算される。β-βおよびβ-5リンケージは、対応するリンケージのすべてのシグナルを使用して計算されます。
- ゲル浸透クロマトグラフィー(GPC)解析
- 乾燥リグニン10mgとグルコース1mg(内部標準)を0.1M NaOHの1mL、1.5mLガスクロマトグラフィー(GC)バイアルで0.01重量%NaN3水溶液に溶解します。中隔のキャップを使用してGCバイアルを閉じます。
- 100 μL のサンプルを、紫外線検出器を搭載した高速液体クロマトグラフィー(HPLC)システムに注入し、λ = 280 nm の波長をモニタリングします。極性シリカ(8 mm x 50 mm)と3つのゲルカラム(8 mm x 300 mm、粒子径:5 μm、公称孔幅:1000 Å)を備えた事前段組みプログラム温度スプリット/スプリットレスインジェクターシステムで構成されるシステムを、1 mL min-1の流量で使用します。得られたデータを内部標準の信号(グルコース)に参照する。266~65000 Daの範囲でポリ(スチレンスルホン酸)を用いた外部較正を参照し、ソフトウェアを使用して質量分布を計算します。
- GC によるフルフラール定量化
- OrganoCat前処理の有機相に内部標準として20mg n-デカンを加えます。有機相1mLを1.5mLのGCバイアルに移します。
- この溶液の1 μLを、1.5 mLminの流量を有するキャリアガスとして極性ポリウレタングリコール定常相とヘリウムを用いた30mカラムを用いてガスクロマトグラフに注入し、炎イオン化検出器を使用します。初期温度を50°Cに設定し、8°C-1~250°Cで昇温し、250°Cで5分間維持します。
- ソフトウェアによって与えられた積分(Int)と外部計算された補正係数(cf)を使用して、フルフラールを定量化します。
- 2-MTHFの1mLに1mgのフルフラールと5mgの n-デカンのサンプルを調製し、前述の手順を用いてGCに注入する。補正係数を次のように計算します。
cf = (Int(n -デケイン)/m(n -デケイン)) / (Int(フルフラール)/Int(フルフラール)) (8) - 次の数式を使用して、未知のサンプルのフルフラルの量を計算するには、補正係数を使用します。
m(フルフラール) =m(n-デカン) / イント(n-デカン) × cf × Int(フルフラール) (9)
- 2-MTHFの1mLに1mgのフルフラールと5mgの n-デカンのサンプルを調製し、前述の手順を用いてGCに注入する。補正係数を次のように計算します。
- セルロース濃縮パルプ加水分解
- 1.5 mLバイアルを用いて、加熱ブロックでオルガノキャット前処理から得られたセルロース濃縮残渣のパルプ加水分解を行う( 材料表参照)。
- セルロースを豊富に含むパルプ20mgとセルラーゼ10μL(60濾紙単位(FPU)mLおよび82セロビアス単位(CBU)mL-1)を1.5mLバイアルで1mL(pH = 4.5)に加え、50°Cで0h、1h、または72hで振る。その後、サンプルを99°Cに加熱して10分間加熱し、酵素を変性させます。
- グルコース(ヘキソキナーゼ)アッセイキットを用いてグルコース濃度を決定する。
結果
リグノセルロース前処理および分画処理の典型的な条件セットであるOrganoCat(OrganoCat)は、触媒として0.1M FDCAを使用し、100gL-1(ブナ木材、水相と比較して)のバイオマスローディング、反応温度として1時間、160°Cの反応温度として使用します。ブナ材の組成は他の21(〜48%セルロース、27%ヘミセルロース、26%リグニン)で公開されている。図1は、この一組の条件で抽出されたヘミセルロース加水分解物を、より長い反応時間(3時間)および低温(140°C)で示した。
より厳しい条件、 例えば、より高い温度および長い反応時間を使用すると、より高い抽出収率につながる可能性がありますが、また、5-(ヒドロキシメチル)フルフラール(5-HMF)は、グルコースの対応する分解産物であるのに対し、キシロースの分解産物である製品の分解をもたらす可能性があります。160°Cで3時間の反応時間を有する(水相と有機相の間に分布する)製品においてより多くのフルフラールが注目された。 糖分解製品は反応性が高く、フラン類や糖類のフミンオリゴマーを形成する傾向があるため、より高い温度での反応時間が短いほど、高い抽出効率と低糖分解の間の良い妥協点と考えられる。
抽出されたリグニンの量は、反応温度および時間にも直接関係しています。図2は、抽出されたリグニンの量、β-O-4-リンケージ含量、および抽出されたリグニンの質量平均モル質量を示す。抽出されたリグニンの収率は反応時間が長くなると上昇するが、1時間ではなく3時間反応すると、インタクトβ-O-4-リンケージの数は約半分に減少する。反応温度を160°Cから140°Cに下げるとリグニンへの影響が非常に低くなり、結果的に収率がやや低下し、質量平均モル質量が小さくなり、β-O-4-含有量が高くなります。
(lingo-)セルロースの酵素加水分解はパルプ効率の一般的な指標であり、上記のOrganoCat反応条件セットから生じる異なるOrganoCatパルプに市販セルロースカクテルを適用した(図3)。セルラーゼは基質に最適化されていないので、セルロース変換全体は最先端の性能と比較できません。しかし、それは互いに異なるパルプの比較を可能にする。反応時間が長いほど、初期反応時間と72時間後のグルコース収率に大きな影響を与え、〜2.5倍の倍率で改善する。温度を下げることは、この治療における酵素消化の違いを引き起こす主な要因が、デリニケーションの程度であることを示唆し、はるかに小さな影響を示すように見える。
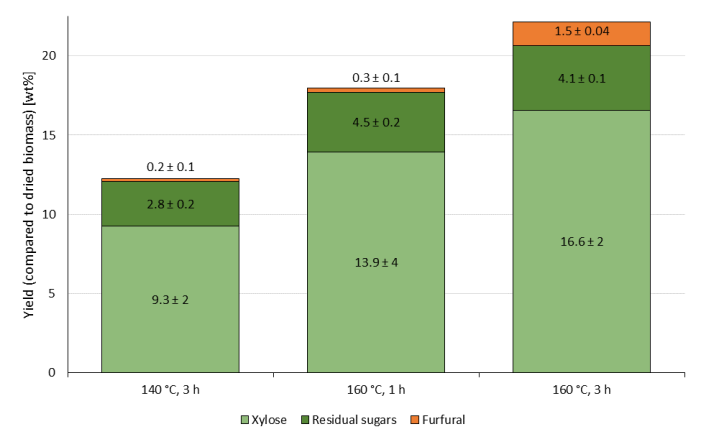
図1:X軸11に示すように異なる反応温度および時間で、0.1M 2,5-フランディカルボン酸を触媒として、100gL-1ブナ材(水相と比較して)を用いたOrganoCatプロセスにおける糖抽出およびフルフラールの製造。すべての実験は三重で行われました。平均は標準偏差で示されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
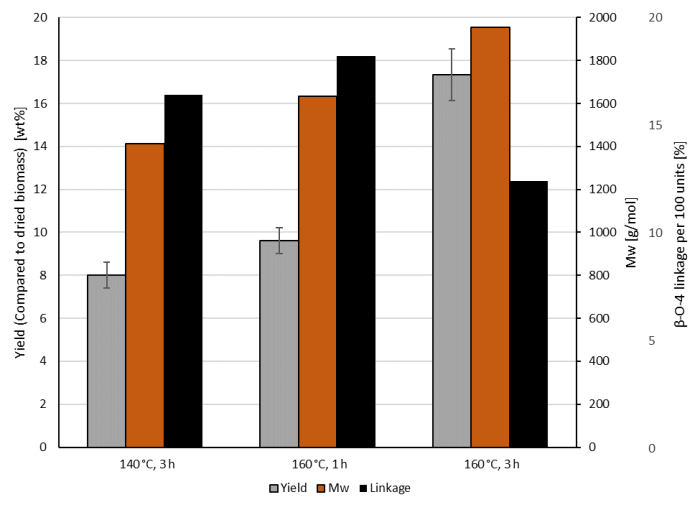
図2:X軸11に示される異なる反応温度および時間で、0.1M 2,5-フランジカルボン酸を触媒として、100gL-1ブナ材(水相と比較して)でのOrganoCatプロセスによって抽出されたリグニンの量および分析。リグニンの収量は三重で計算されています。平均は標準偏差で示されます。分子質量および結合は、代表的な単一実験から導出された。この図の大きなバージョンを表示するには、ここをクリックしてください。
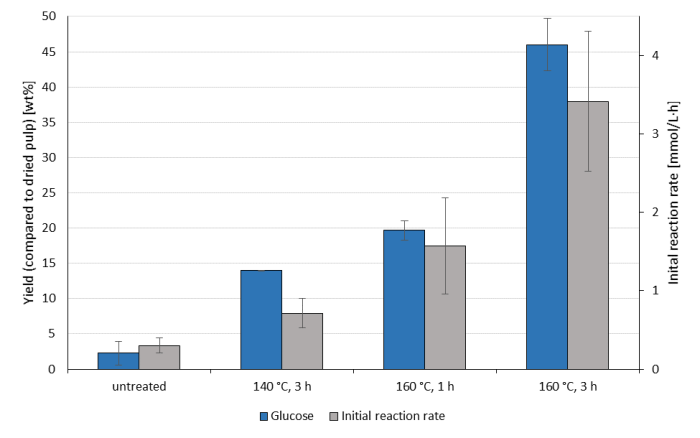
図3:パルプの酵素加水分解グルコース収量は、未処理のブナ木材とセルロース濃縮パルプの加水分解から最初の1時間以内の72時間(青いバー)および反応速度(灰色のバー)を触媒として0.1M 2,5-フランディカルボン酸、100gL-1ブナ木材(水性相と比較して)を触媒と時に示したx軸と異なる反応温度で得た未処理ブナ木材およびセルロース濃縮パルプの加水分解から得られる。セルラーゼは、50°Cで、コントライト緩衝液中で最大72時間(pH4.5)11に対して異なる基質に塗布した。すべての実験は三重で行われました。平均は標準偏差で示されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 単位 | シフトδ (1H)(13C) | 連動 | シフトδ (1H)(13C) |
| [ppm] | [ppm] | ||
| S2,6 | (6.95–6.46)(106.8–101.9) | α β-O-4 | (5.08–4.69)(75.8–69.9) |
| G2 | (7.12–6.72)(113.4–108.7) | α β-β | (4.72–4.58)(87.46–84.0) |
| G5 | (7.04–6.51)(117.8–113.4) | β β-β | (3.35–3.11)(62.0–57.9) |
| H2,6 | (7.01–6.8)(129.1–123.2) | γ β-β 1 | (4.26–4.09)(73.0–70.0) |
| γ β-β 2 | (3.87–3.71)(73.0–70.0) | ||
| α β-5 | (5.51–5.41)(88.8–86.6) | ||
| β β-5 | (3.52–3.42)(54.0–52.1) | ||
| γ β-5 | (3.80–3.67)(64.1–62.1) |
表1:リグニンにおける異なる結合に対する1H-13Cの異核単一量子相関核磁気共鳴(1H-13C-HSQC NMR)によって決定される化学シフト。略語: S = シリンギルユニット, G = グアイアシルユニット, H = p-ヒドロキシフェニル単位.
ディスカッション
リグノセルロースの記載された分画は、反応時間や温度に応じてフラン類に糖分解を避けるため、ヘミセルロース加水分解効率と選択性とのトレードオフを示す(図1)。リグニン抽出は、同様に、より厳しい条件によって影響を受けた。特に、β-O-4-リンケージの減少と、より高い温度と反応時間での再凝縮による質量平均分子量の増強は、この妥協を強調する必要があります。反応時間と温度の選択は、したがって、このリグノセルロース分画プロセスにおいて重要なステップです。酵素加水分解の効率は、FDCA触媒OrganoCatプロセスにおけるデリニュフィによって主に決定されるように見えるので、最も過酷な処理条件は最もアクセスしやすいパルプを提供します。プロセス9、11、18、22の他のバリエーションは、例えば、異なる触媒を使用して、反応性溶液中の触媒および最終pHの強度がプロセス効率に最も強い影響を及ぼすことを示す。手順の修飾は、例えば.、リン酸による前膨潤、22と同様に有益な効果を有することが示されている。しかし、組成の多様性のために、プロセスは、異なる原料21に応じて、最適化を必要とする。プロセス全体の性能を考慮すると、分離された分数の下流浄化を考慮する必要があり、選択性が大きな役割を果たす理由です。他のオルガノソルブのようなプロセスと比較して、OrganoCatは二相性水/2-MTHFシステムを使用し、3つの比較的簡単で別々のストリームで主要な成分を提供します。このようにして、さらに下流および結果として生じるエネルギーおよび設備コストを13,18に削減することができる。
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、ドイツの大学で科学と研究を推進するドイツ研究財団のエクセレンス・イニシアティブと、AP³フォーカス・ラボで支援されるバイオエコノミー科学センター(BioSC)の一環として、クラスター・オブ・エクセレンス「バイオマスからのオーダーメイド燃料」と「燃料科学センター」の一環として行われました。バイオエコノミー科学センターの科学的活動は、NRWストラテギープロジェクトBioSC(no. 313/323-400-002 13)の枠組みの中で、イノベーション、科学、研究省によって財政的に支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 1200 HPLC system | Agilent | n.a. | was used for size exclusion chomatogaphy |
| 2,5-furandicarboxylic acid | TCI Deutschland GmbH | F0710 | Purity: >98.0%(T)(HPLC) |
| 2-methyltetrahydrofuran | Carl Roth GmbH | 6845.4 | SOLVAGREEN ≥99 %, extra pure |
| Accellerase 1500 | Provided by Genencor (60 FPU mL-1 and 82 CBU mL-1; 2300 AE Leiden, Netherlands) | n.a. | cellulase for pulp hydrolysis |
| beech wood (Fagus sp.) | local supplier | n.a. | |
| BioTek Power Wave HT UV-Vis Spectrometer | BioTek Germany, 74177 Bad Friedrichshall, Germany | BT-RPRWI | |
| Bruker AS400 (400 MHz) Spectrometer | Bruker, Billerica, MA 01821, USA | n.a. | HSQC-NMR analysis |
| CarboPac PA20 column | Dionex | 302747 | monosaccharide separator column for high-performance anion-exchange chromatography |
| centrifuge 5430 R | Eppendorf | 5428000610 | |
| Focus GC | Thermo Fischer | n.a. | gas chromatograph |
| Glucose (hexokinase) assay kit | Sigma-Aldrich | GAHK20-1KT | |
| GPC- precolumn PSS PolarSil in DMAc | PSS Polymer Strandards Service GmbH | PSA080505 | precolumn with polar silica (8 x 50 mm) |
| HP-INNOwax column 30 m | Agilent J & W | 19091N-213IE | GC column with a polar polyethylene glycol stationary phase |
| PSS MCX | PSS Polymer Strandards Service GmbH | MCA0830051E3 | gel columns (8 x 300 mm, particle diameter: 5 µm, nominal pore width: 1000 Å |
| ThermoMixer | Eppendorf | n.a. | mixing and heating block |
| tinyclave steel Typ 3 / 25 mL | Büchi | 49,33,45,10,000 | 100 bar, 200 °C |
参考文献
- Isikgor, F. H., Becer, C. R. Lignocellulosic biomass: a sustainable platform for the production of bio-based chemicals and polymers. Polymer Chemistry. 6 (25), 4497-4559 (2015).
- Azadi, P., Inderwildi, O. R., Farnood, R., King, D. A. Liquid fuels, hydrogen and chemicals from lignin: A critical review. Renewable & Sustainable Energy Reviews. 21, 506-523 (2013).
- Aro, T., Fatehi, P. Production and application of lignosulfonates and sulfonated lignin. ChemSusChem. 10 (9), 1861-1877 (2017).
- Kai, D., et al. Towards lignin-based functional materials in a sustainable world. Green Chemistry. 18 (5), 1175-1200 (2016).
- Fang, W., Yang, S., Wang, X. -. L., Yuan, T. -. Q., Sun, R. -. C. Manufacture and application of lignin-based carbon fibers (LCFs) and lignin-based carbon nanofibers (LCNFs). Green Chemistry. 19 (8), 1794-1827 (2017).
- Linger, J. G., et al. Lignin valorization through integrated biological funneling and chemical catalysis. Proceedings of the National Academy of Sciences of the United States of America. 111 (33), 12013-12018 (2014).
- Liao, Y., et al. A sustainable wood biorefinery for low-carbon footprint chemicals production. Science. 367 (6484), 1385-1390 (2020).
- Galkin, M. V., Samec, J. S. M. Lignin valorization through catalytic lignocellulose fractionation: a fundamental platform for the future biorefinery. ChemSusChem. 9 (13), 1544-1558 (2016).
- vom Stein, T., et al. From biomass to feedstock: one-step fractionation of lignocellulose components by the selective organic acid-catalyzed depolymerization of hemicellulose in a biphasic system. Green Chemistry. 13 (7), 1772-1777 (2011).
- Anastas, P. T. Meeting the challenges to sustainability through green chemistry. Green Chemistry. 5 (2), 29-34 (2003).
- Weidener, D., et al. One-step lignocellulose fractionation by using 2,5-furandicarboxylic acid as a biogenic and recyclable catalyst. ChemSusChem. 11 (13), 2051-2056 (2018).
- vom Stein, T., Grande, P. M., Leitner, W., Domínguez de María, P. Iron-catalyzed furfural production in biobased biphasic systems: from pure sugars to direct use of crude xylose effluents as feedstock. ChemSusChem. 4 (11), 1592-1594 (2011).
- Viell, J., Harwardt, A., Seiler, J., Marquardt, W. Is biomass fractionation by Organosolv-like processes economically viable? A conceptual design study. Bioresource Technology. 150, 89-97 (2013).
- Ait Rass, H., Essayem, N., Besson, M. Selective aerobic oxidation of 5-HMF into 2,5-furandicarboxylic acid with Pt catalysts supported on TiO2 - and ZrO2 -based supports. ChemSusChem. 8 (7), 1206-1217 (2015).
- Yi, G., Teong, S. P., Zhang, Y. Base-free conversion of 5-hydroxymethylfurfural to 2,5-furandicarboxylic acid over a Ru/C catalyst. Green Chemistry. 18 (4), 979-983 (2016).
- Ardemani, L., et al. Solid base catalysed 5-HMF oxidation to 2,5-FDCA over Au/hydrotalcites: fact or fiction. Chemical Science. 6 (8), 4940-4945 (2015).
- Domínguez de María, P., Guajardo, N. Biocatalytic valorization of furans: opportunities for inherently unstable substrates. ChemSusChem. 10 (21), 4123-4134 (2017).
- Grande, P. M., et al. Fractionation of lignocellulosic biomass using the OrganoCat process. Green Chemistry. 17 (6), 3533-3539 (2015).
- Holtz, A., et al. Process development for separation of lignin from OrganoCat lignocellulose fractionation using antisolvent precipitation. Separation and Purification Technology. 236, 116295 (2020).
- Weidener, D., et al. Lignin precipitation and fractionation from OrganoCat pulping to obtain lignin with different sizes and chemical composition. Molecules. 25 (15), 3330 (2020).
- Weidener, D., et al. Multiscale analysis of lignocellulose recalcitrance towards OrganoCat pretreatment and fractionation. Biotechnology for Biofuels. 13 (1), 155 (2020).
- Weidener, D., et al. Lignocellulose fractionation using recyclable phosphoric acid: lignin, cellulose, and furfural production. ChemSusChem. 14 (3), 909-916 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved