Method Article
Фракционирование лигноцеллюлозной биомассы с использованием процесса OrganoCat
В этой статье
Резюме
OrganoCat - это метод предварительной обработки и фракционирования лигноцеллюлозы в мягких условиях в лигнин, ферментируемые сахара и целлюлозную целлюлозу. В биогенной двухфазной системе растворителей воды и 2-метилтетрагидрофурана с 2,5-фуранкарбоновой кислотой в качестве катализатора продукты OrganoCat разделяются in situ для простого извлечения продукта.
Аннотация
Переход от экономики, основанной на нефти, к более устойчивой и основанной на биотехнологии экономике требует разработки новых концепций нефтеперерабатывающих заводов для поддержания поставок сырья и энергии. Для этих новых и устойчивых концепций биоперерабатывающего использования важно использовать катализаторы и растворители, которые соответствуют принципам зеленой химии. Поэтому внедрение биогенных альтернатив может быть перспективным решением. Представленный в настоящем описании процесс предварительной обработки и фракционирования лигноцеллюлозы - OrganoCat - представляет собой интегрированное фракционирование лигноцеллюлозы в ее основные компоненты с использованием биогенных кислот, таких как 2,5-фурандикарбоновая кислота в качестве катализатора. Гемицеллюлозы и другие нецеллюлозные полисахариды селективно деполимеризуются разбавленной кислотой и растворяются, в то время как кристаллическая целлюлоза остается в твердой пульпе. В присутствии второй органической фазы, состоящей из биогенного 2-метилтетрагидрофурана, распутанный лигнин экстрагируется in situ. Процесс позволяет эффективно фракционирование трех основных компонентов - лигнина, целлюлозы и нецеллюлозных сахаров. Это помогает сосредоточиться на качестве лигнина, улучшении ферментативного гидролиза обогащенной целлюлозой целлюлозы целлюлозе и мягкой экстракции нецеллюлозного сахара с низкой деградацией.
Введение
Использование ископаемых ресурсов принесло большие технологические достижения, поскольку они составляют основу для многочисленных продуктов, которые необходимы для повседневной жизни. Однако ограниченность таких ресурсов, как нефть и газ на земле, и экологический ущерб, связанный с их эксплуатацией, создают настоятельную потребность в альтернативах. Лигноцеллюлозная биомасса является перспективным источником химических веществ на основе углерода, поскольку она является возобновляемой, универсальной иуглеродно-нейтральной1. Лигноцеллюлоза в основном состоит из трех основных фракций для использования: гемицеллюлозы, целлюлозы и лигнина. Его промышленная переработка имеет давнюю историю. Однако устоявшиеся и широко распространенные процессы, такие как сульфитные и крафтовые процессы в бумажной промышленности, в основном сосредоточены на целлюлозе для использования в целлюлозно-бумажной промышленности2. Полная валоризация всех трех лигноцеллюлозных фракций необходима, чтобы сделать переработку лигноцеллюлозы в химические вещества более прибыльной с экономической и экологической точек зрения.
Во многих стратегиях валоризации лигноцеллюлозы лигнин является простым побочным продуктом, который часто сжигается для восстановления энергии. В настоящее время только 1-2% промышленно производимого лигнина используется для производства продуктов с добавленной стоимостью, таких как добавки для бетона, поверхностно-активные вещества иванилин 3. Тем не менее, он является крупнейшим возобновляемым источником ароматических веществ и поэтому обладает перспективными свойствами для применения в качестве основы для полимеров4,углеродных волокон5и топлива2. Проблемы в валоризации лигнина заключаются в его сложной структуре и разнообразии в зависимости от исходного материала и условий добычи. Кроме того, из-за условий их процесса наиболее распространенные процессы фракционирования лигноцеллюлозы доставляют сульфированный лигнин с большим количеством связей C-C между мономерными установками. Поэтому коммерчески доступный лигнин трудно деполимеризировать.
Для фракционирования лигноцеллюлозы был разработан ряд различных подходов, которые сосредоточены на целостном использовании всех трех фракций. Большинство процессов основаны на гидролизе гемицеллюлозы либо с разбавленными кислотами и основаниями, либо с использованием аутопротолиза воды при повышенных температурах. В качестве одного из наиболее изученных вариантов органосольв-процессов используют низкокипящие органические растворители, обычно в сочетании с водой. Хорошо известные варианты этого процесса включают процесс Alcell, в котором используется 50% этанола, и процесс Organocell, который использует метанол на первом этапе и добавляет NaOH на втором этапе. Кислотные органосольные процессы, использующие муравьиную или уксусную кислоту, также описаны2. В связи с недавним акцентом на валоризацию лигнина в качестве основного продукта биоперерабатывающего средства были разработаны новые подходы, которые сочетают экстракцию лигнина с последующими или интегрированными этапами конверсии для получения меньших соединений лигнина и более стабильных и ценных продуктов6,7,8.
Процесс фракционирования лигноцеллюлозы OrganoCat (OrganoCat) основан на двухфазной системе воды и 2-метилтетрагидрофурана (2-MTHF)9. Кроме того, в качестве катализатора используется перерабатываемая органическая кислота, которая селективно гидролизует гемицеллюлозы при умеренных температурах. Все технологические химикаты могут быть произведены относительно недорогим и биогенным способом, что снижает воздействие процесса на окружающую среду в соответствии с принципами Green Chemistry10. Процесс доставляет три отдельных потока продукта с лигнином в органической фазе, деполимеризованными гемицеллюлозными сахарами в водной фазе и обогащенной целлюлозой целлюлозой целлюлозой в виде твердого остатка. Поскольку потоки продукта могут быть легко разделены, последующие этапы, спрос на энергию и материальные затраты могут быть значительно снижены по сравнению, например, с монофазными подходами. Лигнин имеет относительно низкую молекулярную массу и большое количество связейβ-О-411. Деполимеризованные сахара гемицеллюлозы могут быть использованы для ферментации или превращения в тонкие химические вещества12. Целлюлозная целлюлозная масса высокодоступна для ферментативной деполимеризации9.
Оригинальный процесс OrganoCat использует щавелевую кислоту в качестве катализатора для фракционирования лигноцеллюлозы. Затем щавелевая кислота может быть восстановлена кристаллизацией9. Однако это увеличивает затраты на охлаждение реакции и частичное испарение воды. Частичное разложение щавелевой кислоты уменьшило бы доходы еще13. По этой причине процесс OrganoCat был улучшен путем введения 2,5-фурандикарбоновой кислоты (FDCA) в качестве катализатора11. FDCA не только достаточно кислый для катализа реакции, но также может быть получен из глюкозы путем обезвоживания до 5-гидроксиметилфурфурла и последующего окисления с помощью катализаторов на основе металлов или биокатализаторов14,15,16,17. Хотя кислотность FDCA немного ниже, она имеет более высокую термическую стабильность, чем щавелевая кислота. FDCA имеет низкую растворимость в воде при комнатной температуре, что позволяет легко восстанавливать ее из водной фазы после реакции.
Масштаб процесса OrganoCat был успешно разработан до 3-х лреактора 18. Дополнительные исследования лигнина OrganoCat показали, что антирастворимые осаждения с n-гексаном или n-пентаном позволяют энергоэффективное восстановление лигнина19. Удалось получить фракции лигнина с разной молекулярной массой20. В данной работе представлен полный препаративный метод для масштабируемого, одностадийного процесса фракционирования лигноцеллюлозной биомассы с использованием FDCA в качестве катализатора. Этот процесс дает экстрагированный лигнин, деполимеризованные гемицеллюлозы и целлюлозную целлюлозную целлюлозу в трех легко отделяемых потоках продукта.
протокол
ПРИМЕЧАНИЕ: Процесс может быть приостановлен в любой момент, оставив образцы при комнатной температуре (на несколько дней) или в холодильнике (на более длительные периоды времени). Подробную информацию о материалах, используемых в этом протоколе, см. в Таблице материалов.
1. Частицы буковой древесины
- Генерируйте желаемый размер частиц буковойдревесины (Fagus sp.) с помощью режущей мельницы с ситом 10 мм и высушивайте частицы при 50 °C до постоянной массы (~ 24 ч), оставляя остаточное содержание влаги ~ 10% воды.
2. Лигноцеллюлозное фракционирование и отработка
- Предварительная обработка и фракционирование лигноцеллюлозы
- Суспендировать 500 мг частиц буковой древесины(Fagus sp.)и 78,0 мг (0,5 ммоль, 0,1 М) FDCA в 5 мл сверхчистой воды при комнатной температуре в реакторе высокого давления из нержавеющей стали 25 мл. Добавьте 5 мл 2-MTHF и перемешивающий стержень к суспензии и закройте реактор. Нагревайте реактор до 160 °C на нагревательной пластине со скоростью перемешивания 1500 об/мин в течение 1 ч.
- Дайте реакции остыть до комнатной температуры в ледяной воде в течение ~ 10 минут. Откройте реактор, добавьте 52,5 мкл раствора NaOH (50 мас.% NaOH в дистиллированной воде) и перемешивайте в течение 15 мин при комнатной температуре и 500 об/мин на перемешивающей пластине.
- Выделение органической фазы и количественное исследование лигнина
- Центрифугировать смесь (комнатная температура, 5 мин, 1880 × г). Используйте пипетку для переноса органической фазы (2-MTHF) в колбу с круглым дном 50 мл.
- Испаряют органическую фазу во вращательном испарителе (40 °C, 200 об/мин, 180 мбар) до получения твердой и сухой лигниновой фракции. Определите выход лигнина путем взвешивания с помощью аналитических весов. Храните твердый лигнин при комнатной температуре для дальнейшего анализа.
- Разделение твердой целлюлозной целлюлозы и водной фазы
- Отфильтруйте кувыхожую фазу с помощью целлюлозной фильтровальной бумаги (размер пор 17-30 мкм) в воронке, чтобы выделить обогащенную целлюлозой целлюлозу целлюлозу пульпы и перенесите водный эффект во флакон объемом 5 мл. Промыть мякоть до нейтрального рН водой 3 х 25 мл и хранить раствор для промывки отдельно в 100 мл. Мякоть высушит при 80 °C до постоянной массы (~24 ч).
- Определите выход высушенной целлюлозы путем взвешивания с помощью аналитических весов.
- Восстановление FDCA и выделение водной фазы
- Регулируют рН водной фазы и моющего раствора со стадии 2.3 отдельно при постоянном перемешивании до рН 1 с использованием концентрированного HCl при охлаждении раствора в ледяной ванне. Контролируйте pH с помощью универсальной индикаторной бумаги.
- Отфильтруйте осажденное твердое вещество (FDCA) из обоих растворов, соедините остатки и высушите при 80 °C до постоянной массы (~24 ч). Откажитесь от стирок. Определите выход FDCA путем взвешивания с помощью аналитических весов.
- Переложите водный этап в колбу 25 мл и храните ее при 4 °C для анализа.
- Пробоподготовка для количественной оценки фурфурла
- Провести отдельный эксперимент по определению количества фурфурла. Повторите шаги 2.1.1-2.2.1.
- Добавьте 40 мг n-декана в качестве внутреннего стандарта к собранной фракции органического растворителя и сохраните для анализа.
3. Анализ
- Анализ сахара в водной фазе методом высокоэффективной амионообмонной хроматографии с импульсным амперометрическим детектированием (HPAEC-PAD)
- Разбавить 10 мкл водной фазы, собранной на стадии 2.4.3, 190 мкл дистиллированной воды. Добавьте 10 мкл 2 мМ 2-дезокси-D-глюкозы к разбавленный образец.
- Выполняют разделение моносахаридов на колонне моносахаридного сепаратора со скоростью потока 0,5мл∙мин-1,и вводят в образец после уравновешивания 2 мМ NaOH в течение 10 мин. Отделите нейтральные сахара 2 мМ NaOH в течение 18 мин. После этого используйте 550 мМ NaOH в течение 10 минут для разделения уроновых кислот. Промыть колонну 800 мМ NaOH в течение 10 мин.
ПРИМЕЧАНИЕ: Программное обеспечение нормализует количество моносахаридов до количества внутреннего стандарта и количественно оценивает их с помощью стандартных калибровочных кривых различных моносахаридов.
- Анализ лигнина с помощью гетероядерного однозначного квантового магнитного резонанса 1H-13C(1H-13C-HSQC ЯМР)
- Растворить ~50 мг лигнина в 0,5 мл дейтерированного диметилсульфоксида ([d6]ДМСО) и перенести смесь в ЯМР-трубку. Проведение ЯМР-измерений 1H-13C HSQC (время измерения 220 мин) с использованием спектрометра 400 МГц.
- Определите типы связей, присутствующих в лигнине, используя спектр.
- Отсылать химический сдвиг спектра к сигналу DMSO(δ(1H) = 2.500 ppm;δ(13C) = 39.52 ppm).
- Выполните ручную коррекцию фазы по обеим осям, пока все сигналы не будут положительными, затем выполните коррекцию базовой линии.
- Интегрировать сигналы ароматических единиц и связи лигнина; химические сдвиги см. в таблице 1.
- Рассчитайте сумму ароматических единиц (аром.) по следующей формуле:
Σ(аром.) = (S2,6 / 2) + ((G2 + G5) / 2) + (H2,6 / 2) (1)
При этом Si является интегралом над сигналом, соответствующим 2 и 6 сирингильным протонам, Gi является интегралами над сигналами, соответствующими 2 и 5 гваяцил-протонам, а Hi является интегралом над сигналом, соответствующим 2 и 6 p-гидроксифенилпротонам. - Рассчитайте процент каждой единицы, используя следующие формулы:
S = (S2,6/ 2) / Σ(аром.) × 100% (2)
G = ((G2 + G5) / 2) / Σ(arom.) × 100% (3)
H = (H2,6 / 2) / Σ(аром.) × 100% (4)
При этом S, G и H являются процентами соответствующих мономеров-сирингил- (S), гваяцил- (G) и p-гидроксифенил(H)-мономерных единиц на 100 мономерных единиц. - Рассчитайте количество связей на 100 единиц по следующим формулам:
β-O-4 связей = α β-O-4 / Σ(arom.) × 100% (5)
связи = (α β-β + β β-β + γ β-β) / Σ(аром.) × 100% (6)
связи = (α β-5 + β β-5 + γ β-5) / Σ(аром.) × 100% (7)
При этом α, β и γ являются интегралом над сигналом, соответствующим α-, β- и γ-протонные сигналы соответствующих связей β-O-4-, β-β- и β-5.
ПРИМЕЧАНИЕ: Соединения приведены в виде рычажного механизма на 100 мономерных единиц. Из-за перекрытия пиковβ-O-4рассчитывается с использованием только α протонного сигнала. β-β и β-5 соединения рассчитываются с использованием всех сигналов соответствующего звена.
- Анализ гель-проникающения (GPC)
- Растворить 10 мг сушеного лигнина и 1 мг глюкозы (в качестве внутреннего стандарта) в 1 мл 0,1 М NaOH и 0,01 мас.% NaN3 водном растворе в 1,5 мл газовой хроматографии (ГК)-флаконе. Закройте GC-флакон с помощью колпачка с перегородкой.
- Впрыскивайте 100 мкл образца в высокоэффективную систему жидкостной хроматографии (ВЭЖХ), оснащенную ультрафиолетовым детектором и контролируя длину волны λ = 280 нм. Используйте систему, состоящую из предколонкционно-программируемой системы с разделением температуры / бездвещевной инжекторной системой с полярным кремнеземом (8 мм х 50 мм) и тремя гелевыми колоннами (8 мм х 300 мм, диаметр частиц: 5 мкм, номинальная ширина пор: 1000 Å) при расходе 1 мл мин-1. Привязка полученных данных к сигналу внутреннего стандарта (глюкозы). Рассчитайте распределение масс с помощью программного обеспечения, ссылающегося на внешнюю калибровку с поли(стиролсульфонатом) в диапазоне от 266 до 65000 Да.
- Количественная оценка фурфурла через GC
- Добавьте 20 мг н-деканав качестве внутреннего стандарта к органической фазе предварительной обработки OrganoCat. Перенесите 1 мл органической фазы во флакон GC-флакон 1,5 мл.
- Вводят 1 мкл этого раствора в газовый хроматограф с помощью 30-м колонки с полярной стационарной фазой полиуретанового гликоля и гелием в качестве газа-носителя со скоростью потока 1,5 млмин-1 и пламенно-ионизационным детектором. Установите начальную температуру на 50 °C, затем поднимите на 8 °C мин-1 до 250 °C и выдерживайте при 250 °C в течение 5 мин.
- Количественная оценка фурфурала с использованием интегралов (Int), заданных программным обеспечением, и внешне рассчитанного поправоческого коэффициента (cf).
- Подготовьте образец из 1 мг фурфурола и 5 мг н-декана в 1 мл 2-MTHF и вводят его в ГК с использованием вышеупомянутой процедуры. Рассчитайте поправочный коэффициент следующим образом:
cf = (Int(n-декан) / m(n-decane)) / (Int(furfural) / Int(furfural)) (8) - Используйте поправочный коэффициент для расчета количества фурфурла в неизвестном образце по следующей формуле:
m(furfural) = m(n-decane) / Int(n-decane) × cf × Int(furfural) (9)
- Подготовьте образец из 1 мг фурфурола и 5 мг н-декана в 1 мл 2-MTHF и вводят его в ГК с использованием вышеупомянутой процедуры. Рассчитайте поправочный коэффициент следующим образом:
- Гидролиз обогащенной целлюлозой целлюлозы
- Проводят гидролиз целлюлозы обогащенного целлюлозой остатка, полученного из предварительной обработки OrganoCat, в нагревательном блоке с перемешиванием (см. Таблицу материалов)с использованием флаконов по 1,5 мл.
- Добавьте 20 мг обогащенной целлюлозой целлюлозы целлюлозы и 10 мкл целлюлозы (60 единиц фильтровальной бумаги (FPU) мл-1 и 82 единицы целлобиазы (CBU) mL-1)в 1 мл цитратного буфера (pH = 4,5) во флаконе 1,5 мл и встряхните при 50 °C в течение 0 ч, 1 ч или 72 ч. После этого нагреваем образцы до 99 °C в течение 10 мин, чтобы детировать ферменты.
- Определите концентрацию глюкозы с помощью набора для анализа глюкозы (гексокиназы).
Результаты
Типичный набор условий для процесса предварительной обработки и фракционирования лигноцеллюлозы OrganoCat (OrganoCat) использует 0,1 M FDCA в качестве катализатора, нагрузку биомассы 100 гL-1 (буковая древесина, по сравнению с водной фазой), 1 ч времени реакции и 160 °C в качестве температуры реакции. Состав древесины бука был опубликован в другом месте21 (~48% целлюлозы, 27% гемицеллюлозы, 26% лигнина). На рисунке 1 показан экстрагированный гидролизат гемицеллюлозы с этим набором условий, а также более длительное время реакции (3 ч) и более низкая температура (140 °C).
Использование более суровых условий, например,более высокой температуры и более длительного времени реакции, может привести к более высоким выходам экстракции, но также приводит к большей деградации продуктов - фурфураль является продуктом разложения ксилозы, тогда как 5-(гидроксиметил)фурфурол (5-HMF) является соответствующим продуктом деградации глюкозы. В продуктах отмечалось более высокое количество фурфурула (распределяемого между водной и органической фазами) со временем реакции 3 ч при 160 °C. Поскольку продукты распада сахара являются высокореакционноспособными и имеют тенденцию образовывать гумины-олигомеры фуранов и сахаров, более короткое время реакции при более высокой температуре можно считать хорошим компромиссом между высокой эффективностью экстракции и низкой деградацией сахара.
Количество экстрагированного лигнина напрямую связано с температурой и временем реакции. На рисунке 2 показано количество извлеченного лигнина, содержание β-O-4-связей и среднемассивные молярные массы экстрагированных лигнинов. В то время как выход экстрагированного лигнина увеличивается сболее длительным временем реакции, число интактных связей β-O-4 уменьшается примерно вдвое при реакции в течение 3 ч вместо 1 ч. Снижение температуры реакции со 160 °C до 140 °C оказывает гораздо меньшее влияние на лигнин, что приводит кнесколько меньшему выходу, меньшей средней по массе молярной массе и более высокому содержанию β-O-4.
Поскольку ферментативный гидролиз (линго-)целлюлозы является общим показателем эффективности варки целлюлозы, коммерческий целлюлозный коктейль был нанесен на различные пульпы OrganoCat, полученные в результате вышеупомянутых наборов условий реакции OrganoCat(рисунок 3). Поскольку целлюлаза не оптимизирована для субстратов, общая конверсия целлюлозы не сопоставима с современными характеристиками; однако он позволяет сравнивать различные пульпы друг с другом. Более длительное время реакции оказывает значительное влияние на начальное время реакции и выход глюкозы через 72 ч, улучшаясь в 2,5 раза. Снижение температуры, по-видимому, показывает гораздо меньшее воздействие, подразумевая, что основным фактором, вызывающим различия в ферментативной усвояемости в рамках этого лечения, является степень делигнификации.
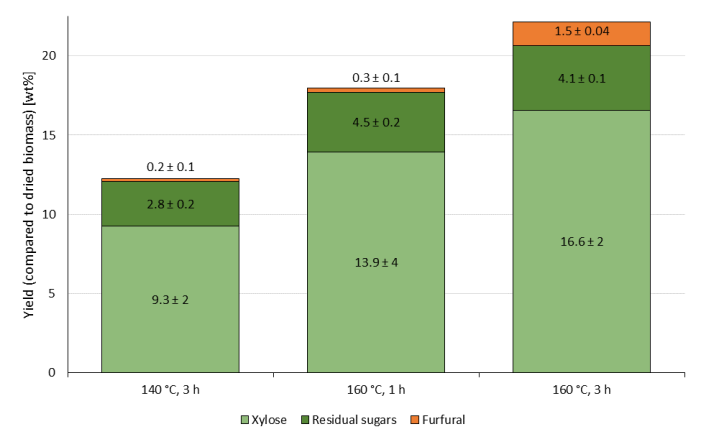
Рисунок 1:Экстракция сахара и производство фурфурол в процессе OrganoCat с 0,1 М 2,5-фурандикарбоновой кислоты в качестве катализатора и 100 гЛ-1 буковой древесины (по сравнению с водной фазой) при различных температурах реакции и времени, как указано на осиХ 11. Все эксперименты были проведены в трехяго. Среднее значение показано со стандартным отклонением. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
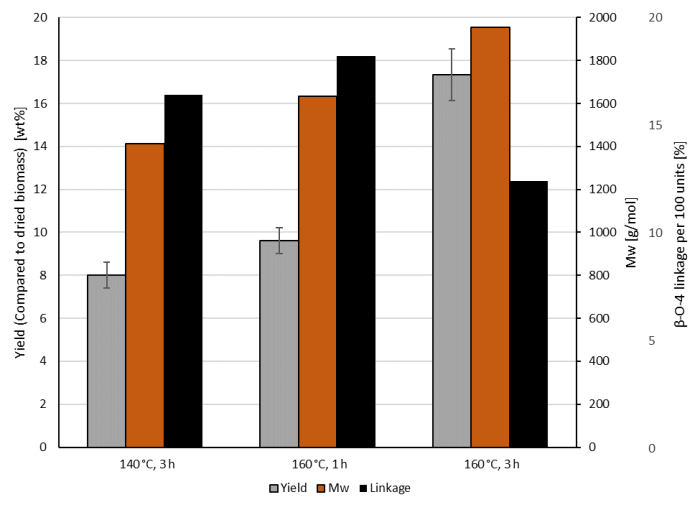
Рисунок 2: Количество и анализ лигнина, экстрагированного методом OrganoCat с 0,1 М 2,5-фурандикарбоновой кислоты в качестве катализатора и 100 гЛ-1 буковой древесины (по сравнению с водной фазой) при различных температурах реакции и времени, как указано на осиХ 11. Выходы лигнина были рассчитаны в трех расчетах. Среднее значение показано со стандартным отклонением. Молекулярная масса и связи были получены из репрезентативных одиночных экспериментов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
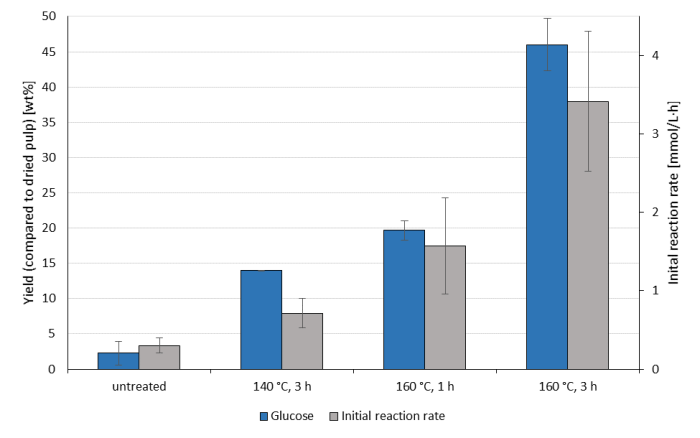
Рисунок 3:Ферментативный гидролиз пульпы. Глюкоза получается через 72 ч (синие полоски) и скорости реакции в течение первого часа (серые батончики) из гидролиза необработанного букового дерева и обогащенной целлюлозой пульпы, полученной из OrganoCat с 0,1 М 2,5-фурандикарбоновой кислотой в качестве катализатора и 100 гЛ-1 буковой древесины (по сравнению с водной фазой) при различных температурах реакции и времени, указанных на оси X. Целлюлазу наносили на различные субстраты при 50 °C в течение 72 ч в каящемся буфере (рН 4,5)11. Все эксперименты были проведены в трехяго. Среднее значение показано со стандартным отклонением. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Единица | Смена δ (1H)(13C) | Связь | Смена δ (1H)(13C) |
| [промилле] | [промилле] | ||
| С2,6 | (6.95–6.46) (106.8–101.9) | α β-О-4 | (5.08–4.69) (75.8–69.9) |
| Г2 | (7.12–6.72) (113.4–108.7) | α β-β | (4.72–4.58) (87.46–84.0) |
| Г5 | (7.04–6.51) (117.8–113.4) | β β-β | (3.35–3.11) (62.0–57.9) |
| Н2,6 | (7.01–6.8) (129.1–123.2) | γ β-β 1 | (4.26–4.09) (73.0–70.0) |
| γ β-β 2 | (3.87–3.71) (73.0–70.0) | ||
| α β-5 | (5.51–5.41) (88.8–86.6) | ||
| β β-5 | (3.52–3.42) (54.0–52.1) | ||
| γ β-5 | (3.80–3.67) (64.1–62.1) |
Таблица 1: Химические сдвиги, определяемые гетероядерным одноквантовым ядерным резонансом(1 H-13C-HSQC ЯМР) для различных связей в лигнине. Сокращения: S = единица сирингила, G = гваяциловая единица, H = p-гидроксифенильная единица.
Обсуждение
Описанное фракционирование лигноцеллюлозы показывает компромисс между эффективностью гидролиза гемицеллюлозы и селективностью, чтобы избежать деградации сахара до фуранов в зависимости от времени реакции и температуры(рисунок 1). На экстракцию лигнина также повлияли более суровые условия. В частности, уменьшениеβ-O-4-связей и увеличение средней молекулярной массы за счет реконденсации при более высокой температуре и времени реакции подчеркивает этот компромисс, который должен быть сделан. Поэтому выбор времени реакции и температуры является критическим этапом в этом процессе фракционирования лигноцеллюлозы. Поскольку эффективность ферментативного гидролиза, по-видимому, в основном определяется делигнификацией в катализируемом FDCA процессе OrganoCat, самые суровые условия обработки обеспечивают наиболее доступную целлюлозу. Другие вариации процесса9,11,18,22, например, с использованием различных катализаторов, показывают, что прочность катализатора и конечный рН в реакционноспособном растворе оказывают сильнейшее влияние на эффективность процесса. Было показано, что модификации процедуры, например,предварительная набухание фосфорной кислотой, оказывают благотворное влияние, а также22. Однако из-за разнообразия в составе процесс нуждается в оптимизации, в зависимости от различных исходного сырья21. Учитывая общую производительность процесса, необходимо учитывать последующее очищение разделенных фракций, поэтому селективность играет важную роль. По сравнению с другими органосольв-подобными процессами, OrganoCat использует двухфазную систему воды / 2-MTHF, которая предоставляет основные компоненты в трех относительно простых, отдельных потоках. Таким образом, дальнейшие затраты на энергию и оборудование могут быть сниженына 13,18.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была выполнена в рамках Кластера передового опыта «Индивидуальное топливо из биомассы» и «Центра науки о топливе», которые финансируются Инициативой передового опыта Немецкого исследовательского фонда для продвижения науки и исследований в немецких университетах, а также частью Научного центра биоэкономии (BioSC), поддерживаемого в проекте AP³ Focus Lab. Научная деятельность Научного центра биоэкономии была финансово поддержана Министерством инноваций, науки и исследований в рамках NRW Strategieprojekt BioSC (No 313/323-400-002 13).
Материалы
| Name | Company | Catalog Number | Comments |
| 1200 HPLC system | Agilent | n.a. | was used for size exclusion chomatogaphy |
| 2,5-furandicarboxylic acid | TCI Deutschland GmbH | F0710 | Purity: >98.0%(T)(HPLC) |
| 2-methyltetrahydrofuran | Carl Roth GmbH | 6845.4 | SOLVAGREEN ≥99 %, extra pure |
| Accellerase 1500 | Provided by Genencor (60 FPU mL-1 and 82 CBU mL-1; 2300 AE Leiden, Netherlands) | n.a. | cellulase for pulp hydrolysis |
| beech wood (Fagus sp.) | local supplier | n.a. | |
| BioTek Power Wave HT UV-Vis Spectrometer | BioTek Germany, 74177 Bad Friedrichshall, Germany | BT-RPRWI | |
| Bruker AS400 (400 MHz) Spectrometer | Bruker, Billerica, MA 01821, USA | n.a. | HSQC-NMR analysis |
| CarboPac PA20 column | Dionex | 302747 | monosaccharide separator column for high-performance anion-exchange chromatography |
| centrifuge 5430 R | Eppendorf | 5428000610 | |
| Focus GC | Thermo Fischer | n.a. | gas chromatograph |
| Glucose (hexokinase) assay kit | Sigma-Aldrich | GAHK20-1KT | |
| GPC- precolumn PSS PolarSil in DMAc | PSS Polymer Strandards Service GmbH | PSA080505 | precolumn with polar silica (8 x 50 mm) |
| HP-INNOwax column 30 m | Agilent J & W | 19091N-213IE | GC column with a polar polyethylene glycol stationary phase |
| PSS MCX | PSS Polymer Strandards Service GmbH | MCA0830051E3 | gel columns (8 x 300 mm, particle diameter: 5 µm, nominal pore width: 1000 Å |
| ThermoMixer | Eppendorf | n.a. | mixing and heating block |
| tinyclave steel Typ 3 / 25 mL | Büchi | 49,33,45,10,000 | 100 bar, 200 °C |
Ссылки
- Isikgor, F. H., Becer, C. R. Lignocellulosic biomass: a sustainable platform for the production of bio-based chemicals and polymers. Polymer Chemistry. 6 (25), 4497-4559 (2015).
- Azadi, P., Inderwildi, O. R., Farnood, R., King, D. A. Liquid fuels, hydrogen and chemicals from lignin: A critical review. Renewable & Sustainable Energy Reviews. 21, 506-523 (2013).
- Aro, T., Fatehi, P. Production and application of lignosulfonates and sulfonated lignin. ChemSusChem. 10 (9), 1861-1877 (2017).
- Kai, D., et al. Towards lignin-based functional materials in a sustainable world. Green Chemistry. 18 (5), 1175-1200 (2016).
- Fang, W., Yang, S., Wang, X. -. L., Yuan, T. -. Q., Sun, R. -. C. Manufacture and application of lignin-based carbon fibers (LCFs) and lignin-based carbon nanofibers (LCNFs). Green Chemistry. 19 (8), 1794-1827 (2017).
- Linger, J. G., et al. Lignin valorization through integrated biological funneling and chemical catalysis. Proceedings of the National Academy of Sciences of the United States of America. 111 (33), 12013-12018 (2014).
- Liao, Y., et al. A sustainable wood biorefinery for low-carbon footprint chemicals production. Science. 367 (6484), 1385-1390 (2020).
- Galkin, M. V., Samec, J. S. M. Lignin valorization through catalytic lignocellulose fractionation: a fundamental platform for the future biorefinery. ChemSusChem. 9 (13), 1544-1558 (2016).
- vom Stein, T., et al. From biomass to feedstock: one-step fractionation of lignocellulose components by the selective organic acid-catalyzed depolymerization of hemicellulose in a biphasic system. Green Chemistry. 13 (7), 1772-1777 (2011).
- Anastas, P. T. Meeting the challenges to sustainability through green chemistry. Green Chemistry. 5 (2), 29-34 (2003).
- Weidener, D., et al. One-step lignocellulose fractionation by using 2,5-furandicarboxylic acid as a biogenic and recyclable catalyst. ChemSusChem. 11 (13), 2051-2056 (2018).
- vom Stein, T., Grande, P. M., Leitner, W., Domínguez de María, P. Iron-catalyzed furfural production in biobased biphasic systems: from pure sugars to direct use of crude xylose effluents as feedstock. ChemSusChem. 4 (11), 1592-1594 (2011).
- Viell, J., Harwardt, A., Seiler, J., Marquardt, W. Is biomass fractionation by Organosolv-like processes economically viable? A conceptual design study. Bioresource Technology. 150, 89-97 (2013).
- Ait Rass, H., Essayem, N., Besson, M. Selective aerobic oxidation of 5-HMF into 2,5-furandicarboxylic acid with Pt catalysts supported on TiO2 - and ZrO2 -based supports. ChemSusChem. 8 (7), 1206-1217 (2015).
- Yi, G., Teong, S. P., Zhang, Y. Base-free conversion of 5-hydroxymethylfurfural to 2,5-furandicarboxylic acid over a Ru/C catalyst. Green Chemistry. 18 (4), 979-983 (2016).
- Ardemani, L., et al. Solid base catalysed 5-HMF oxidation to 2,5-FDCA over Au/hydrotalcites: fact or fiction. Chemical Science. 6 (8), 4940-4945 (2015).
- Domínguez de María, P., Guajardo, N. Biocatalytic valorization of furans: opportunities for inherently unstable substrates. ChemSusChem. 10 (21), 4123-4134 (2017).
- Grande, P. M., et al. Fractionation of lignocellulosic biomass using the OrganoCat process. Green Chemistry. 17 (6), 3533-3539 (2015).
- Holtz, A., et al. Process development for separation of lignin from OrganoCat lignocellulose fractionation using antisolvent precipitation. Separation and Purification Technology. 236, 116295 (2020).
- Weidener, D., et al. Lignin precipitation and fractionation from OrganoCat pulping to obtain lignin with different sizes and chemical composition. Molecules. 25 (15), 3330 (2020).
- Weidener, D., et al. Multiscale analysis of lignocellulose recalcitrance towards OrganoCat pretreatment and fractionation. Biotechnology for Biofuels. 13 (1), 155 (2020).
- Weidener, D., et al. Lignocellulose fractionation using recyclable phosphoric acid: lignin, cellulose, and furfural production. ChemSusChem. 14 (3), 909-916 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены