このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
固体材料を封入する細菌セルロース球
要約
このプロトコルは、細菌セルロース(BC)球体を形成する簡単で安価な方法を提示する。この生体材料は、バイオチャー、ポリマー球、鉱山廃棄物などの固体材料のカプセル化媒体として機能します。
要約
細菌セルロース(BC)球体は、新しい材料としてBCの普及以来、ますます研究されています。このプロトコルは、BC球体生産のための手頃な方法と簡単な方法を提示します。これらの球体の生成に加えて、固体粒子のカプセル化方法も同定されている。BC球体を生成するには、水、紅茶、砂糖、酢、細菌培養をバッフルフラスコに組み合わせて、内容物を攪拌する。BC球形成のための適切な培養条件を決定した後、固体粒子を封入する能力をバイオチャー、ポリマービーズ、および鉱山廃棄物を用いて試験した。球体は、ImageJ ソフトウェアと熱重量分析 (TGA) を使用して特徴付けられた。 結果は、直径7.5mmの球体を7日間で作ることができることを示している。様々な粒子を添加すると、BCカプセルの平均サイズ範囲が増加する。球体は乾燥質量の10〜20%を封入した。この方法は、容易に入手できる材料で可能な低コストの球体生産およびカプセル化を示す。BC球体は、汚染物質除去助剤、放出性肥料コーティング、または土壌修正として将来的に使用され得る。
概要
細菌セルロース(BC)は、その機械的強度、高純度および結晶性、保水能力、および複雑な繊維構造1、2、3、4のために、その潜在的な産業の使用のために注目されている。これらの特性は、生物医学、食品加工、環境修復法を含む様々な用途に適した生体材料であるBCを1.BCフィルムの形成は、単一の生物培養物または昆布茶5、発酵茶飲料に使用されるもののような混合培養物で行うことができる。醸造昆布茶は、一般的にSCOBYとして知られている「細菌と酵母の共生培養」に依存しています。生物のこの共生文化を用いて、BC球体を作り出すために同様の技術が用いられた。この生体材料は、より効率的な作物生産を達成するために、環境汚染物質を分離し、バイオチャーのような農業改正を固定するのに役立つ可能性があります。
以前の文献では、攪拌状態で生成されたBCの特性が静止培養で生産されたBCと比較してどのように議論されてきた。静止培養は液体空気界面で形成されるフィルムをもたらし、振られた培養物は液体6内に浮遊する様々なBC粒子、ストランド、および球体をもたらす。多くの研究は、BCの商業生産は、この論文の方法を適用するための根拠を提供する動的な条件6、7でより実現可能であるという主張を参照しています。さらに、BC球体の構造や性質に関する様々な調査が行われています。豊崎ら6は、動揺したBC生産におけるバッフルと滑らかな壁のエルレンマイヤーフラスコを比較した。HuとCatchmark4の研究では、現在のBC球体生産プロセスのガイドラインとして使用されたBC球体の条件が決定され、その結果は、球体のサイズが60時間後に増加し続けないことを示しています。MohammadらのBC生産のレビューは、BC培養を揺るがすことで、BCの成長を成功させるために必要な酸素供給と分布さえ保証することを示している。オランダ等は、X線回折とフーリエ変換赤外分光法を用いてBCの結晶性と化学構造を研究した。BCカプセルも同様の特徴を示し、今後の研究では構造特性を調査する。研究はまた、改善されたバイオコンポジットを生成するためにBCを使用することの有益な効果を探っています。.研究者は、エポキシ樹脂をベースとして、BCの添加により疲労寿命、破壊靭性、引張および曲げ強度9,10などの材料特性が向上することを示している。過去と現在の研究で示されるように、多くはBCの使用を商品化することに興味を持っています。
多くの研究者は、制御放出系で細菌セルロースを調査しており、ここで説明する方法は、制御放出システムとして利用できるカプセルを生成する。この研究の多くは、生物医学分野における制御放出と、制御放出肥料(CRF)投与におけるいくつかの探査に焦点を当てています。BCのアモキシシリン11、リドカイン12、およびイブプロフェン13の制御放出の成功に基づいて、BCはペレット化肥料などの他の物質と同様の送達特性を示し得る。ShavivとMikkelsen14によるCRFの概要は、CRFがより効率的で、労働力を節約し、一般的に従来の肥料塗布よりも環境劣化が少ないことを認めています。細菌セルロースは、CRFの良好な封入材料として働く可能性があります。肥料はBC膜から浸出するか、BC生分解15、16として排出することができる。BCの高水膨張能力は、肥料の栄養素と水分の両方がBC球体の適用によって地面に放出される可能性があるため、有益な土壌修正17、18、19としても機能します。これらの形質を使用すると、BC球カプセル化によって形成されたCRFは、生産および処分段階で悪影響を及ぼす可能性のある他の肥料コーティング材料よりも有利である可能性があります。BCを肥料コーティングに適応させることは、CRF技術をさらに向上させる可能性があります。肥料の放出率を下げることで、作物は肥料を取り込み、水域への過剰流出を防ぐのに十分な時間を持ち、それによって富栄養化および非酸素化地帯を減少させる。同様の緩徐放出肥料が、ポリマーコーティング20を用いて調製および試験的に製造されている。
以前の研究で概説されたプロトコルとは異なり、これは高いセルロース収率ではなく、均一でまとまりのある球体生産に焦点を当てています。さらに、他の固形物のBCカプセル化はセルロース膜で研究されているが、球体21ではない。細菌セルロース球の研究を拡大することにより、BCの環境的に安全な特徴のために有益であるBCを商業的に生産するためのさらなるステップを作ることができます。BC球の製造のこの方法は、安価で容易に入手可能な料理の食材を利用しています。最初のアセンブリの後、BC球は干渉なしで2日以内に形成し始める。この戦略を通じてBC球体を生産するには、スペースがほとんどなく、食用の副産物である発酵茶「昆布茶」があります。他の研究で言及されたカプセル化技術は、相反転技術22、23、マトリックス形成24、噴霧乾燥25、および合成中の直接封入26を介して形成されるコーティングを含む。本稿で概説されている直接封入法は、容易に入手できる材料を利用する、簡単で安価なプロセスを望む人に有用である。
この研究を通じて、BC球体生産とカプセル化のための成功したプロトコルが作成されました。BC球体は、バイオチャー、鉱山テーリング、ポリスチレンマイクロビーズの固体粒子を個々の構造内に封入することができます。まだ業界で広く使用されていませんが、BCは実用的で持続可能な材料であり、将来の用途に使用できる天然材料です。
プロトコル
細菌性セルローススターター培養の作成と維持
- 細菌セルロースのスターター培養物を、約50g、SCOBYの形態で得る。商業的に購入することができます(例えば、健康のための文化から)。SCOBYをペーパータオルで覆われた1 Lビーカーに入れる。
- 700mLの脱イオン水を沸騰させ、SCOBYを含む容器から別の容器に移し、85gのスクロースを加えます。
- ショ糖が溶けたら、紅茶(4.87g)を2袋加えます。お茶を1時間急いでから、かき混ぜたロッドを使用してティーバッグを慎重に取り出します。
- お茶に蒸留白酢200mLを加えます。混合物を25°Cに冷却させる。 冷却したら、SCOBYを含むビーカーに室温ティー700mLを加えます。
注意:熱すぎる間に酸性茶を加えると、SCOBYの生物に害を与える可能性があります。 - ビーカーをペーパータオルで覆い、弾性バンドで固定し、温度が25°Cのストレージエリアにビーカーを置きます。 この船は一般的にストックカルチャーまたはホテルと呼ばれています。
- SCOBYを健康に保つには、月に2回程度のメンテナンスが必要です。
- 手袋をはめた手を使ってSCOBYマットを押さえ、ホテルから別のビーカーに液体を排出します。液体と容器に、溶液の合計700 mLのための十分な酸性茶を加えます。
- 65gのスクロースを酸性茶で容器に溶かします。スクロースが溶けるのを待つ間、慎重にDI水でSCOBYマットをすすいでください。
- ショ糖が完全に溶解したら、液体をすすいでSCOBYマットを含むビーカーに添加することができます。ビーカーを覆い、インキュベーションエリアに戻します。
2. 細菌セルロース球の製造
注: 熱湯を使用する場合は注意してください。ガラス製品が沸騰水温に耐えることができ、欠陥がなく、適切なサイズであることを確認してください。BC球体の生産を説明する回路図を 図1に示します。
- 350mLの脱イオン水を湯釜で沸騰させます。500 mL ビーカーに熱湯を移します。42.5gのグラニュー糖のショ糖を攪拌棒を用いてお湯に溶かす。
- スクロースが完全に溶解すると、スクロースと水を含むフラスコに1袋の紅茶(2.54g)が1時間浸る。その後、かき混ぜ棒でティーバッグを取り出し、ティーバッグを壊さないように気をつけて、ゴミ箱に捨てます。
- 蒸留した白酢100mLをビーカーに加え、十分に混ぜます。酸性茶混合物80 mLを250 mLバッフルフラスコに移す。お茶の混合物を室温、20〜25°Cに冷却させます。
注:この時点で、混合物は一晩、または次のステップのために準備されるまで冷却するために残すことができます。 - 液体温度が室温(20〜25°C)に入ったら、バッフルフラスコに20mLの微生物スターター培養液を加えます。この液体は、SCOBYホテルから入手することができます。パラフィルムでフラスコを覆います。
- バッフルフラスコを軌道シェイクテーブルに置き、速度を毎分125回転(rpm)に設定します。20~25°Cの温度で室内またはインキュベーターで3日間揺れ、BC球体を生成します。
注意:フラスコの内容物に不規則な形状が形成される場合、またはセルロースの塊がフラスコの壁に付着する場合は、さらに不規則なBC塊が形成されるのを防ぐために除去する必要があります。ピンセットを使用して、薄い弦、リング、筒状の形状、その他の明らかに非球状の形状など、不要なBC質量を除去します。 - 球体が形成されたら、フラスコからそっと注ぎ、本論文に記載されていない方法で分析、処分、または使用します。
3. 細菌セルロース球を用いて、粒子や汚染物質を封入する
- 上記 の手順 2.1 ~2.5 に 従ってください。
- 3日間振盪した後、約0.01gの細かく粉砕された粒子状物質をバッフルフラスコに加えます。適切な固形物には、バイオチャール(260±140 μm)、鉱山廃棄物(350±140 μm)、ポリスチレンマイクロビーズ(3μm)が含まれます。これらの資料のデータは、 代表結果 セクションに概説されています。バイオチャー、鉱山廃棄物、マイクロビーズの詳細については、付属の 資料表 をご覧ください。
- パラフィルムでフラスコを再び覆い、さらに3日間同じ速度と周囲温度(20〜25°C)を使用して軌道シェーカーに戻します。BC カプセル化されたパーティクルを削除して、解析、廃棄、またはその他の用途に使用します。
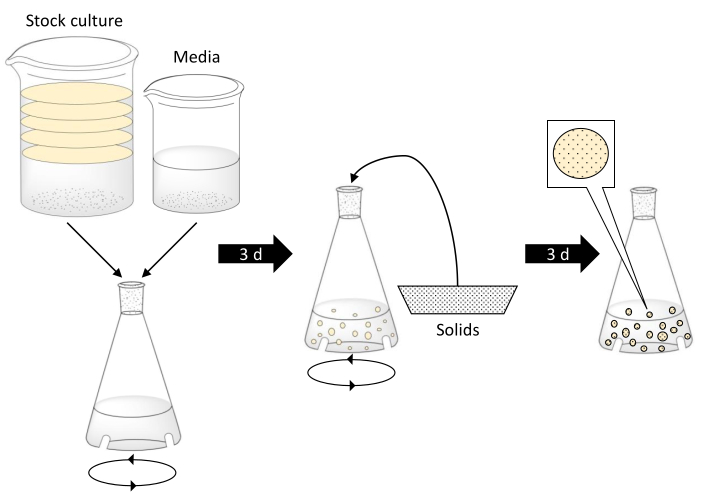
図 1.細菌セルロース球の作製および固体粒子の封入。 ステップ1は、細菌ストック培養と紅茶、砂糖、酢培地をバッフルフラスコに組み合わせることを含む。ストック カルチャのディスクは BC マットを表します。次いで、バッフルフラスコを3日間軌道揺れテーブルに置く。中央のステップは、BC球体が形成されるとフラスコに添加される固体を示しています。フラスコはさらに3日間振られます。最後のステップでは、BC球体はサイズが増加し続け、固体粒子を封入しました。 この図の大きなバージョンを表示するには、ここをクリックしてください。
結果
BC球体は、培養の最初の48時間の間に最も速い成長率を有する(図2)。また、球が最大平均サイズに達し、その後、一定の状態を保つ傾向がある様子も図 2 に示します。この実験では、球体は平均直径7.5±0.2mmに達した。BC球体は10日間の成長期間内に完全に悪化することはありませんでしたが、8日目頃に球体から伸びる腱を形成し始めました。これは...
ディスカッション
このプロトコルは、BC球体の生産方法と、実施が容易で費用対効果の高いカプセル化方法を概説しています。元のプロトコルに対する様々な調整によって、適切なプロセスが特定されました。有効な球体を確保するには、重要な手順に従う必要があります。BC形成に関与するすべての成分は、球体の健康と耐久性において重要な役割を果たしています。スクロースは生物に餌を与え、茶は窒素...
開示事項
著者らは開示するものは何もない。
謝辞
この作品は、アドルフォ・マルティネス、キャサリン・マルホランド、タイラー・サマヴィル、ローレル・ビッターマンによるモンタナ工科大学研究アシスタントメンターシッププログラムプロジェクトの継続です。研究は、グラントNo.の下で国立科学財団によって後援されました。OIA-1757351および戦闘能力開発司令部陸軍研究所(協同協定番号W911NF-15-2-0020)。この資料で表明された意見、調査結果、結論、または勧告は著者のものであり、必ずしも国立科学財団または陸軍研究所の見解を反映しているわけではありません。また、エイミー・クエンジ、リー・リチャーズ、ケイトリン・アレー、クリス・ギャモンズ、マックス・ヴォルゲナント、クリス・ボッシュの貢献に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 100 mL graduated cylinder | |||
| 1000 mL beaker | |||
| 25 mL graduated cylinder | |||
| 250 mL Erlenmeyer baffled flask | Chemglass | CLS-2040-02 | |
| 500 mL beaker | |||
| Balance | |||
| Biochar | Ponderosa pine heat treated under argon gas, heated at 15 °C per minute to 800 °C | ||
| Black tea | |||
| Deionized water | |||
| Distilled white vinegar | |||
| Elastic band | |||
| Microbial starter culture | Cultures for Health | ||
| Mine waste | Collected from Butte, MT: 46.001978,-112.582465. Mine waste contains soil and metals originating from past copper mining. Mn, Si, Ca, Al, and Fe were the five most prevalent elements measured in the mine waste through x-ray diffraction. | ||
| Mortar and pestle | |||
| Orbital shaker | Used various brands | ||
| Paper towel | |||
| Polystyrene microbeads | Polybead | 17138 | 3 micron diameter |
| Stir rod | |||
| Sucrose | |||
| Tea kettle | |||
| TGA | TA Instruments | TA Q500 | 400 °C/min to 800 °C, 100 mL/min N2 |
| Thermometer | |||
| XRF Analyzer | ThermoFisher Scientific | 10131166 |
参考文献
- Mohainin Mohammad, S., Abd Rahman, N., Sahaid Khalil, M., Rozaimah Sheikh Abdullah, S. An Overview of Biocellulose Production Using Acetobacter xylinum Culture. Advances in Biological Research. 8 (6), 307-313 (2014).
- Dufresne, A. Bacterial cellulose. Nanocellulose. , 125-146 (2017).
- Czaja, W., Romanovicz, D., Brown, R. M. Structural investigations of microbial cellulose produced in stationary and agitated culture. Cellulose. 11 (3-4), 403-411 (2004).
- Hu, Y., Catchmark, J. M. Formation and characterization of spherelike bacterial cellulose particles produced by acetobacter xylinum JCM 9730 strain. Biomacromolecules. 11 (7), 1727-1734 (2010).
- Goh, W. N., Rosma, A., Kaur, B., Fazilah, A., Karim, A. A., Bhat, R. Microstructure and physical properties of microbial cellulose produced during fermentation of black tea broth (kombucha). International Food Research Journal. 19 (1), 153-158 (2012).
- Toyosaki, H., Naritomi, T., Seto, A., Matsuoka, M., Tsuchida, T., Yoshinaga, F. Screening of Bacterial Cellulose-producing Acetobacter Strains Suitable for Agitated Culture. Bioscience, Biotechnology, and Biochemistry. 59 (8), 1498-1502 (1995).
- Shi, Z., Zhang, Y., Phillips, G. O., Yang, G. Utilization of bacterial cellulose in food. Food Hydrocolloids. 35, 539-545 (2014).
- Holland, M. C., Eggensperger, C. G., Giagnorio, M., Schiffman, J. D., Tiraferri, A., Zodrow, K. R. Facile Postprocessing Alters the Permeability and Selectivity of Microbial Cellulose Ultrafiltration Membranes. Environmental Science and Technology. 54 (20), 13249-13256 (2020).
- Le Hoang, S., Vu, C. M., Pham, L. T., Choi, H. J. Preparation and physical characteristics of epoxy resin/ bacterial cellulose biocomposites. Polymer Bulletin. 75 (6), 2607-2625 (2018).
- Vu, C. M., Nguyen, D. D., Sinh, L. H., Pham, T. D., Pham, L. T., Choi, H. J. Environmentally benign green composites based on epoxy resin/bacterial cellulose reinforced glass fiber: Fabrication and mechanical characteristics. Polymer Testing. 61, 150-161 (2017).
- Pavaloiu, R. D., Stoica, A., Stroescu, M., Dobre, T. Controlled release of amoxicillin from bacterial cellulose membranes. Central European Journal of Chemistry. 12 (9), 962-967 (2014).
- Trovatti, E., et al. Biocellulose membranes as supports for dermal release of lidocaine. Biomacromolecules. 12 (11), 4162-4168 (2011).
- Trovatti, E., et al. Bacterial cellulose membranes applied in topical and transdermal delivery of lidocaine hydrochloride and ibuprofen: In vitro diffusion studies. International Journal of Pharmaceutics. 435 (1), 83-87 (2012).
- Shaviv, A., Mikkelsen, R. L. Controlled-release fertilizers to increase efficiency of nutrient use and minimize environmental degradation - A review. Fertilizer Research. 35 (1-2), 1-12 (1993).
- Eggensperger, C. G., et al. Sustainable living filtration membranes. Environmental Science and Technology Letters. 7 (3), 213-218 (2020).
- Schröpfer, S. B., et al. Biodegradation evaluation of bacterial cellulose, vegetable cellulose and poly (3-hydroxybutyrate) in soil. Polimeros. 25 (2), 154-160 (2015).
- Orts, W. J., Glenn, G. M. Reducing soil erosion losses with small applications of biopolymers. ACS Symposium Series. 723, 235-247 (1999).
- Mohite, B. V., Patil, S. V. A novel biomaterial: Bacterial cellulose and its new era applications. Biotechnology and Applied Biochemistry. 61 (2), 101-110 (2014).
- Mikkelsen, R. L. Using hydrophilic polymers to control nutrient release. Fertilizer Research. 38 (1), 53-59 (1994).
- Du, C. W., Zhou, J. M., Shaviv, A. Release characteristics of nutrients from polymer-coated compound controlled release fertilizers. Journal of Polymers and the Environment. 14 (3), 223-230 (2006).
- Serafica, G., Mormino, R., Bungay, H. Inclusion of solid particles in bacterial cellulose. Applied Microbiology and Biotechnology. 58 (6), 756-760 (2002).
- Tomaszewska, M., Jarosiewicz, A. Use of polysulfone in controlled-release NPK fertilizer formulations. Journal of Agricultural and Food Chemistry. 50 (16), 4634-4639 (2002).
- González, M. E., et al. Evaluation of biodegradable polymers as encapsulating agents for the development of a urea controlled-release fertilizer using biochar as support material. Science of the Total Environment. 505, 446-453 (2015).
- Shavit, U., Shaviv, A., Shalit, G., Zaslavsky, D. Release characteristics of a new controlled release fertilizer. Journal of Controlled Release. 43 (2-3), 131-138 (1997).
- Kolakovic, R., Laaksonen, T., Peltonen, L., Laukkanen, A., Hirvonen, J. Spray-dried nanofibrillar cellulose microparticles for sustained drug release. International Journal of Pharmaceutics. 430 (1-2), 47-55 (2012).
- Zaharia, A., et al. Bacterial cellulose-poly(acrylic acid-: Co-N, N ′-methylene-bis-acrylamide) interpenetrated networks for the controlled release of fertilizers. RSC Advances. 8 (32), 17635-17644 (2018).
- Peterson, J. D., Vyazovkin, S., Wight, C. A. Kinetics of the thermal and thermo-oxidative degradation of polystyrene, polyethylene and poly(propylene). Macromolecular Chemistry and Physics. 202 (6), 775-784 (2001).
- Goh, W. N., Rosma, A., Kaur, B., Fazilah, A., Karim, A. A., Bhat, R. Fermentation of black tea broth (kombucha): I. effects of sucrose concentration and fermentation time on the yield of microbial cellulose. International Food Research Journal. 19 (1), 109-117 (2012).
- Zhu, H., Jia, S., Yang, H., Jia, Y., Yan, L., Li, J. Preparation and application of bacterial cellulose sphere: A novel biomaterial. Biotechnology and Biotechnological Equipment. 25 (1), 2233-2236 (2011).
- Nguyen, V. T., Flanagan, B., Gidley, M. J., Dykes, G. A. Characterization of cellulose production by a Gluconacetobacter xylinus strain from Kombucha. Current Microbiology. 57 (5), 449-453 (2008).
- Costa, A. F. S., Almeida, F. C. G., Vinhas, G. M., Sarubbo, L. A. Production of bacterial cellulose by Gluconacetobacter hansenii using corn steep liquor as nutrient sources. Frontiers in Microbiology. 8, 1-12 (2017).
- Watanabe, K., Tabuchi, M., Morinaga, Y., Yoshinaga, F. Structural features and properties of bacterial cellulose produced in agitated culture. Cellulose. 5 (3), 187-200 (1998).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved