Method Article
VMXmビームラインにおける微結晶のサンプル調製パイプライン
要約
データの信号対雑音比は、マイクロクリスタルからのX線回折測定を行う上で最も重要な考慮事項の1つです。VMXmビームラインは、このような実験のための低ノイズ環境とマイクロビームを提供します。ここでは、VMXmおよび他のマイクロフォーカス高分子結晶結晶ビームライン用のマイクロ結晶を取り付け、冷却するためのサンプル調製方法について述べる。
要約
単結晶クライオ結晶学用のマイクロクリスタル(<10 μm)の実装は、些細な課題です。マイクロ結晶のマイクロ結晶に対するデータ品質の向上は、ダイヤモンド光源1のVMXmビームラインなど、サブミクロンからミクロンに焦点を合わせてビームラインの安定性と可変ビームサイズを開発して見られました。サンプル環境やサンプル調製の改善により、データ品質のさらなる向上が図られます。微小結晶は本質的に弱い回折を生み出すため、信号対雑音の改善は品質のX線回折データを収集する鍵であり、主にバックグラウンドノイズの減少から来る。回折実験におけるX線バックグラウンドノイズの主な原因は、サンプルの前後の空気経路との相互作用、サンプルを取り巻く過剰な結晶化溶液、結晶性氷の存在、および他のビームライン計装またはX線窓からの散乱である。VMXmビームラインは、これらのノイズ源をすべて低減するための計測器とサンプル調製プロトコルを備えています。
まず、VMXmの真空中のサンプル環境は、X線源とサンプル間の空気経路を除去します。次に、VMXmにおける高分子結晶学用のサンプル調製プロトコルは、cryoTEMから適応した多くのプロセスおよびツールを利用する。これには、穴のあいたカーボンサポートフィルムを備えた銅グリッド、液体エタンを利用した自動ブロッティング、プランジ冷却ロボットが含まれます。これらのツールは、低雑音サポートで最小の周囲の液体で、単一のcryoTEMグリッド上に数百個のマイクロクリスタルを調製することができます。また、結晶を取り巻く残りの液体から結晶性の氷の形成を最小限に抑えます。
可視光と走査型電子顕微鏡を用いて可溶性タンパク質微結晶の品質を調製・評価するプロセスを、X線回折実験のためにVMXmビームラインに取り付ける前に行います。また、良質サンプルの例と、さらなる最適化と戦略が必要なサンプルも提供します。
概要
高分子結晶学(MX)による生体分子の高解像構造の決定に大きな障壁は、良好な拡散結晶の生成を良好なサイズで維持する。組換えタンパク質遺伝子構築設計から、初期結晶2を生成する可能性のある化学カクテルの大規模なまばらなマトリックス検索まで、この目標を達成するための多くの戦略があります。後者の場合、結晶性は、結晶決定研究3のための十分な回折品質とサイズを有する結晶を得るために、任意の初期ヒットを最適化する必要がある場合が多い。これらのオプションにもかかわらず、一部の標的分子は大きな結晶(>10μm)を生成することはなく、その結果、結晶発生物は微結晶とそのようなサンプルが存在する課題に耐えなければなりません。これらは、結晶を適切に取り付け、凍結保護し、本質的に弱い回折および増加した放射線感受性を管理することを含む。微結晶は、より大きな結晶よりも少ない単位の細胞および分子から形成され、したがって、回折は大きい結晶と比較して同じ程度に増幅されず、本質的に弱い回折強度をもたらす。背景信号がこれらの反射をマスクしないことが重要です, 特に弱い反射強度が失われる可能性がある高い解像度で4.また、マイクロクリスタルは放射線損傷に対してより敏感であり、液体窒素温度5で回折を記録しているにもかかわらず、単一の結晶から完全なデータを収集することができない可能性があり、非常に多数の結晶からデータを収集して単一の完全なデータセット6を生成する必要がある。
X線自由電子レーザー(XFET)の入手可能性の向上と連続結晶学法(SFX)7の進化は、より小さな微結晶からデータを収集するためのルートを提供してきました。しかし、これらは、かなりの量のハードウェアおよびソフトウェアの専門知識を必要とするオーダーメイドのサンプル配信方法であり、実験は室温に限定され、通常はサンプル消費量が高く(数百マイクロリットル)、さらに最適化が必要な場合があります8。そのため、限られた量のマイクロクリスタルしか作ることができないプロジェクトは、SFXには適していません。
一方、ここ数十年の間にシンクロトロンビームライン技術は、これまでより小さな結晶10、11からのデータ収集を可能にした輝きを持つ、より小さく、より安定したビーム9を生成するために進歩しました。ダイヤモンド光源のNSLS-IIのFMXやダイヤモンド光源のI24などのマイクロフォーカスビームラインは、最大寸法が〜3μm12の結晶から新しい構造を決定し、さらに小さい結晶から~1μm13を測定する使用可能なデータを収集する能力を実証することができました。ビームラインは、優れた高解像度のオン軸視光学、サンプル回転のための混乱の最小の球、およびX線ビームと一致する正確に整列された回転軸で、正確に構成する必要があります。X線ビームプロファイルを結晶体積と密接に一致させ、X線ビーム内で結晶が正確に整列していることを確認することが重要です - 結晶<5 μm14の課題。ビームラインでこれらの実験条件を満たすことは、マイクロクリスタルからの最高の品質データを記録するために不可欠です。
微小結晶からのデータ収集の残りおよびおそらく最も重要な側面は、X線ビームへの結晶の提示である。マイクロクリスタルは、多くの場合、ポリイミドから製造されたマイクロメッシュサンプルマウントに取り付けられ、10 μm15、16の小さな開口を有する低X線散乱材料である。ポリイミドメッシュは、磁気SPINEベースに設定された標準ピンに取り付け、ほとんどのMXビームライン17と互換性があります。メッシュマウントは、通常のループ式マウントを使用して100 μmの結晶を取り付けるのと同じ手順に従って、結晶の結晶を結晶の落下から釣り上げるために使用されます。結晶はメッシュ全体に分布する可能性がありますが、重要な欠点は、比較的大量の液体を収穫中にメッシュとピンで運ぶことができます(図1C、D)。結晶自体よりも何倍も大きくなる液体のこの量は、X線で照らされたときのバックグラウンドノイズに寄与する。フラッシュ冷却中に液晶が結晶性の氷を形成する場合、この背景散乱はさらに強くなり、氷回折の解像度内で既に弱い強度の信号対雑音比が減少します。したがって、過剰な液体がサンプルから除去され、すべての信号が記録されることを確実にすることが重要である。この課題は、LCPが強い背景散乱を発生し、結晶18の周囲から除去することも困難である脂質立方相(LCP)内に形成された膜タンパク質結晶の場合にはさらに大きい。
ダイヤモンド光源の新しい多目的高分子結晶学マイクロフォーカス(VMXm)ビームラインは、サイズがミクロン未満の可能性のある結晶からデータを収集するための条件を提供します。ビームラインは、0.3 μm x 0.5 μm (VxH)1のビームプロファイル、60 nm 以下の混乱球を持つゴニオメーター、 および真空 中のサンプル環境を提供するように設計されています。VMXmのエンドステーションのこれらの設計特徴は、サンプル14によって生成される最大の残りの背景源を有するデータ収集中のビームライン装置によるバックグラウンドX線ノイズの発生を最小限にする。
VMXmビームライン用に設計された特定のサンプル調製方法は、この背景を低減し、回折データの信号対雑音をさらに改善する機会を提供し、<10μmのマイクロクリスタルから記録できるデータの品質を最大化します。ここで概説する微小結晶からの低バックグラウンド回折に関する要件の多くは、極低温透過型電子顕微鏡(cryoTEM)19およびマイクロクリスタル電子回折(microED)20にも共通している。その結果、クライオテムサンプルの調製のために既に開発されたツールの多くは、微結晶の調製のためにいくつかの適応と、適切である。単一粒子cryoTEMのサンプルの調製では、調査中の粒子は、電子がサンプルを透過できるように、バイリウス氷の非常に薄い層(典型的には<100 nm)に埋め込まれます。薄い均一層は、過剰な液体を消し去ることによって達成され、試料のガラス化は、試料(〜104Ks-1)21を~93K22で保持された液体エタンに突っ込んで21を急速に冷却することによって達成される。これに対し、液体窒素は、MX試料調製のために日常的に用いられているように、エタンよりも効率の悪いクライオゲンであり、サンプル21内の結晶性氷形成に対する傾向が大きい。結晶性氷の形成は、回折を劣化させ、バックグラウンドノイズを発生させる可能性があり、通常、凍結保護化合物23の使用によって緩和される。ポリエチレングリコール(PEG)400およびメチル-2,4-ペンタンジオール(MPD)、糖、油または飽和塩などの低分子量ポリマーは、低濃度24の結晶化溶液のアリコートに添加することができます - 最も適切な凍結保護剤を選択するための「1つのサイズがすべてに適合する」溶液はありません。.また、結晶は、収穫および凍結保護プロセス中に複数の操作を行い、結晶に損傷を与える可能性があり、液体エタンを利用する機会は、このステップの省略を可能にし、結晶の完全性を保護するのに役立ちます。
液体エタンは、試料の薄さのために微小結晶(<10μm)に有効な凍結原であるが、特に、厳しく制御された湿度の高い環境26を使用して結晶の水分含有量を減らすなど、結晶の結晶形成を防ぐ代替方法がある277のループと表面の両方から余分な液体のウィッキングを通じてただし、これらは再びサンプルの操作を大きくする必要があります。cryoTEMのように、液体エタンによる自動ブロッティングおよびプランジ凍結の使用は、過剰な結晶化溶液を一緒に除去し、操作を最小限に抑えようとしながら、制御された方法で冷却された微結晶をフラッシュする手段を提供する。
ここでは、VMXmビームラインのユーザーと他のマイクロフォーカスビームラインの両方が高いシグナル対ノイズ回折データを収集するだけでなく、microED実験用に可溶性タンパク質結晶および洗剤ベースの膜タンパク質結晶サンプルを調製する方にも有用である可能性のあるプロトコルを提示する。サンプルを準備し、評価するためのすべての施設はVMXmで利用可能ですが、多くの構造生物学の研究室は、cryoTEMサンプル調製のためにますます装備されています。その結果、VMXmでのビームタイム用にサンプルを用意するために、自分の施設を使用したい人もいると考えています。
プロトコル
1. 機器のセットアップ
注:ここで説明する方法は、単一のブロッティングアームを備えたプランジ冷凍器具を使用しています。いくつかの機器は2つのブロットアームが装備されており、我々は1つのブロッティングアームが使用されるように、機器を調整するためにメーカーの指示を確認することをお勧めします。
- 顕微鏡とプランジフリーザーの両方がユーザーの手の届きやすいように、軽い顕微鏡がプランジ凍結器具の近くに配置されていることを確認してください。
- メーカーの指示に従って、自動プランジ冷凍庫をセットアップして冷却します。
注:サンプルチャンバー温度は、結晶が成長した温度に設定する必要があります。ブロッティングペーパーをサンプルチャンバーに入れないでください。
注意:液体エタンは非常に可燃性の爆発物であり、潜在的な火花源から離れた換気の良い領域でのみ使用する必要があります。 - グリッドボックスに適切なラベルを付け、液体窒素を使用して小さなデュワーでそれらを冷却します。
- グリッドを慎重に配置し、カーボンフィルム側を上に、グロー放電のための適切なキャリア(パラフィルムで包まれたガラス顕微鏡スライドなど)上に置きます。
- グロー放電クライオテムグリッドは、15 mAの電流を使用して、0.39 mBarで25 sのクライオテムグリッドを放電します。グリッドが使用される直前のグロー放電。準備ができるまで覆われたペトリ皿にグロー排出グリッドを保ちます。グロー放電後に30分経過した場合は、グロー放電を繰り返します。
注:プランジ冷凍庫の準備ができて、グリッドを準備すると、注意がサンプルに向けることができます。
2. 初期ブロッティングパラメータの決定
- サンプルチャンバの相対湿度を90%、ブロッティング時間を5 sに設定し、ブロッティングが完了した後にプランジフリーザーが自動的にサンプルを突っ込むように設定されていることを確認します。
注:これらの開始パラメータは、Leica GPプランジ冷凍庫に最も適しており、ブロット力などの他のパラメータは、FEI Vitrobotで利用可能です。しかし、我々の経験では、結晶の完全性は、単一のブロッティングアームの使用によって維持される可能性が高い。 - 目的の井戸が開いたら結晶化トレイを密封できるように、テープの小さなストリップをカットし、一方の端に折り畳んでシールの開口部を容易にするタブを作成し、慎重に片側に配置します。
- リザーバーを含む結晶化ウェルの上にシールを切り開きます。速やかに作業し、2~5 μLのリザーバー溶液を水晶含有液に塗布し、液量を低下に維持します。
- テープのタブを使用してウェルを再密封し、結晶化液が乾燥しないようにします。
- 一時的に結晶化井戸の上にテープを開いたままにして、リザーバ溶液の10 μLを0.5 mLチューブに移して、後のステップで使用します。
- 井戸を再シールします。
- プランジ冷凍器具のブロッティングアームに、プレカットのブロッティングペーパーを置きます。
- 単一のグロー排出グリッドをプランジ凍結鉗子に入れ、カーボン側がブロッティングアームから離れて向き合うよう機器に積み込みます。
- ブロッティングチャンバー内の相対湿度が90%であることを確認してください。
- カーボンフィルム側がブロッティングアームに向かるように鉗子を回転させます。
- 2.5 μL ピペットを使用して、0.5 mL チューブから、cryoTEM グリッドの非支持(光沢のある銅)側に 2 μL のリザーバー溶液を塗布します。
- グリッドを回転させて、炭素支持側がブロッティングアームから離れた方向に向き合い、プロセスを繰り返し、グリッドのカーボンフィルム支持側に慎重に液体を塗布します。カーボンフィルムを傷つけずにピペットチップでカーボンフィルムに触れないようにしてください。液体は、グロー放電中に堆積した電荷のためにグリッド全体に広がる必要があります。
- グリッドを観察しながらブロッティングプロセスを開始します。この目的のために、Leica GP2で視聴範囲を利用できます。
- この間、液体がグリッドの炭素表面から引き出されるかどうかを観察し、これは液体がグリッドを通って邪悪になると平坦化グリッド上の液体ボーラスの大部分から始まります。各グリッドの正方形の液体がさらに減少するにつれて、グリッドの表面を横切る「飛び出す」波が観察される。この効果が観察された場合、ブロットは、ポップ効果終了の2〜3s以内に停止することができます。廃棄できるテストグリッドを突き落とす必要はありません。
- いわゆる「飛び出す」効果が観察されない場合は、ステップ2.11-2.14を繰り返し、ブロッティングアームがグリッドから引き込まれる直前に飛び出す効果が観察されるまで、ブロッティング時間を1〜2 s延長します。この時間は手順 3 に注意してください。
注:このポッピング効果が発生するとすぐにブロッティングが停止し、プロセス中に結晶が過ブロッティングから脱水されないようにすることが重要です。サンプルのバックブロッティングと希釈のためにリザーバからの結晶化溶液を使用して、結晶が一貫した溶液の対象となることを保証し、結晶を不安定化させるリスクを低減します。
3. 結晶の収穫
- 結晶化プレートを光顕微鏡の下に置き、視野内にターゲットを十分に配置します。
- 新鮮なグロー放電グリッドをプランジフリーザー鉗子に入れ、カーボンフィルム側をブロッティングアームから離して、プランジフリーザーに鉗子を取り付けます。
- カーボンフィルム側がブロッティングアームに向かるように鉗子を回転させます。
- 2.5 μL ピペットを使用して、0.5 mL チューブから 2 μL のリザーバー溶液を cryoTEM グリッドの非支持側に塗布し、グリッドを回転させて、カーボンフィルム支持側がプランジフリーザーのサンプルポートに面するようにします。
- 一時的なシールを剥がし、ピペットを2μLに設定して、結晶化液を繰り返し軽く吸引して微結晶を吊り下げます(気泡をドロップに導入しないことが重要です)。
注:このプロセスを光顕微鏡で観察して、表面の皮膚やウェルの基部から結晶が放出されるようにすることが重要です。結晶が付け込まれ、吸引性を持って描かれていない場合は、ピペット先端または鍼治療針などの他の結晶化ツールを、結晶を穏やかに外すために使用することができる。光顕微鏡の結晶の大きさや被写界深度によっては、顕微鏡を用いて、ピペット先端に入る結晶を見ることもできる場合がある。 - 吸引したマイクロクリスタルスラリーの2μLをプランジフリーザーに移し、すべてのサンプルをクライオテムグリッドのカーボン側に塗布します。
- ステップ2で決定された時間のブロットとすぐにプランジ凍結を開始します。ブロッティング中に、グリッド全体で波の波の効果が発生するのを観察し、これがグリッド全体で完全に発生したかどうかを確認します。結晶の存在は、初期のブロッティング時間に影響を与える可能性があり、これは1-2 sで後続のグリッドのために調整する必要があります。
- 迅速に作業し、液体エタンから液体窒素に浸したグリッドボックスにグリッドを転送します。残留エタンは、液体窒素に入ると、グリッド上の不透明な白色固体に変えることができます。これを減らすには、液体エタンからグリッドを着実に取り出し、液体窒素貯蔵所に素早く移します。
- グリッドボックスに4グリッドを配置したら、ネジで箱の蓋を固定し、液体窒素の泡デュワーに移して、スキャン電子顕微鏡(SEM)でさらなるサンプル評価を行うか、適切な貯蔵容器を使用して液体窒素貯蔵デュワーに移します。
4. 光顕微鏡によるサンプル密度評価
注意: この方法は破壊的です。1つまたは2つの結晶化液滴など、サンプルの入手が限られている場合は、このステップをスキップすることをお勧めします。プランジ凍結サンプル(ステップ3.7)の後、グリッド全体の結晶の分布を評価することができます。
- ドライ、室温のクライオテムグリッドをプランジフリーザー鉗子に取り付け、グリッドを視野に入れて、光顕微鏡の側に鉗子を置きます。グリッド全体と個々のグリッドの正方形を解決できるように、適切な倍率と焦点を設定します。
- 手順 3.1 ~ 3.7 に従ってください。
- グリッドをグリッドボックス(ステップ3.8)に転送する代わりに、プランジ冷凍庫をリセットして、液体エタンからプランジされたグリッドを引き込みます。
注意: グリッドとサンプルは室温まで暖かく、それ以上の回折実験には使用できません。 - プランジ冷凍器具から鉗子を取り外します。
- 鉗子の中にグリッドを保持しながら、光顕微鏡の下にグリッドを置く - 焦点はすでにおおよそ設定されます。
- 細かい焦点を実行し、グリッド全体の結晶の密度を評価します。良いグリッドは、各グリッドの正方形内のグリッドバーから離れていくつかの孤立した結晶が含まれ、結晶の束は最小限です。
- グリッド内の結晶の密度が、わずか数個の単離された結晶で結晶の束を生じさせる場合、さらにリザーバー溶液で結晶スラリーを希釈し、ステップ3を繰り返します。希釈によって結晶が溶解しないように、サンプルを希釈する際には注意してください。
- 0.5~1 μLの少量を使用して、水晶を薄くします。
5. 走査型電子顕微鏡によるサンプル評価
注:クライオテムグリッド上のマイクロクリスタル製剤は、極低温条件下で走査型電子顕微鏡(SEM)で最もよく評価され、これはクライオステージを装着したSEMで達成することができます。VMXmでは、クォーラムPP3006エアロックとクライオステージを備えたJEOL JSM-IT100 SEM(タングステンソース)が利用されています。VMXm28、29でサンプルを表示する際の放射線損傷を最小限に抑えるために、次の設定が使用されます: 5 kV加速電圧;スポットサイズは40(JEOL JSM-IT100の任意の単位)10 mmの作業距離。画像は二次電子検出器を使用して記録され、サンプルの位置合わせと焦点を合わせるのに0.8μsの位取り時間が使用され、16μsの位取り時間を使用して単結晶の高解像度画像がキャプチャされます。サンプルをSEMにロードする前に、顕微鏡がメーカーの指示に従って整列することが重要です。同じパラメータで準備された残りのグリッドはX線回折実験用に予約されている間、SEMにロードされるグリッドは1つだけであることをお勧めします。
- メーカーの指示に従って、サンプルのクライオステージを-180°Cに冷却してSEMを準備します。cryoTEM グリッドを利用可能な特定のシステムにロードするための指示に従ってください。
- SEMにサンプルをロードして、電子ビームをオンにし、サンプルを整列させ、高倍率(0.8 μsのドウェル時間)を使用して焦点を合わせます。
- まず、グリッド全体を低倍率(x45)で初期評価を実行します。この倍率で画像を記録します。
- 個々のグリッドの正方形の詳細な検査を可能にするために拡大を増やす、個々の結晶は非常に明確に観察可能でなければなりません。
- グリッド内を移動し、静止画像(16 μsのデュエルタイム)をキャプチャして、次の要件を満たしていることを確認してから次の要件を満たします。
- グリッドが平らで、カーボン支持フィルムが大部分がそのままであることを確認してください。
- 結晶を取り巻くガラス化された液体の狭いハローを持つ多数の単結晶があることを確認してください。
- 炭素支持フィルムの穴が見えるようにしてください。
- 暗くて滑らかな外観で定義されるガラス化された液体の大きな領域がないことを確認します。
- 六角形の氷、または表面の氷がグリッド全体に散らばっていることを確認します。
- 結晶が支持フィルム全体に均等に分布し、重ならないようにしてください。
- この時点で、多数の結晶の寸法を正確に測定し、後の回折実験中に正確なX線ビームサイズの相関を可能にする。
- SEMから確実に回収し、低温で維持できる試料は、後でX線回折実験に使用することができます。これが不可能な場合は、これらのサンプルを廃棄します。
注: グリッド全体と個々のマイクロクリスタルの両方をイメージングする際(それぞれ約 x45 倍と x700 倍)、同じパラメータを使用して用意したグリッドを使用してビームラインに進むか、またはステップ 3 で調整が必要なパラメータがあるかどうかを評価する必要があります。グリッドは、ステップ 5.5 で説明したテストを満たす必要があります。グリッドがこれらの基準を満たしていない場合は、ステップ 5 を繰り返す前に、ステップ 3 の間にさらに最適化が必要になります。
6. VMXmで回折実験用グリッドを準備する
- 液体窒素を使用して、サンプルローダーを大きな泡デュワー(図4B)でサンプルカートリッジに積み込んだVMXmサンプルホルダー(図4A)(最大5)を冷却してください。液体窒素レベルは、サンプルローダー上のサンプル位置のすぐ上にあるべきです。
- サークリップとツールを準備します。
- クリッピングツール、鉗子、VMXmサンプル鉗子などのツールをサンプルローダーの穴に入れ、冷却します。それは、デュワーの上にスポットライトを配置するのに役立ちます。
- マイクロクリスタルにロードされたグリッドを含むグリッドボックスをサンプルローダーのグリッドボックスの凹部に素早く移し、蓋を緩めて回転可能にします(取り外さない)。
- 液体窒素の下で大きな鉗子でサンプルカートリッジから蓋を取り出し、サンプルローダーの下に置きます。
- VMXm サンプル鉗子を使用してサンプルホルダーをサンプルローダーに持ち上げ、ホルダーがグリッドを受け入れられるように上向きであることを確認します。正しい位置に入ると、サンプルローダーの小さなピンがサンプルホルダーの中央にある小さな穴にかかわってきます。
- 冷却された細かい鉗子で、グリッドボックスから慎重にグリッドを持ち上げ、サンプルホルダーのグリッド開口部に近づけます。グリッドを平らに配置するように回転させます(サポートフィルム側がどちらの方向に向いているかは関係ありません)。
- フォースを緩やかに下げて、グリッドがグリッド開口部の上にできるだけ近くになるように (グリッドを曲げないように注意して)、グリッドを開口部に放します。グリッドが正しく取り付けられていない場合は、細かい鉗子を慎重に使用してグリッドを位置に微調整するか、より大きな鉗子でサンプルホルダーを軽くタップします。
- グリッド開口部のグリッド上に冷却されたサークリップツールを素早く配置し、ボタンを押してサークリップを取り付けます。ボタンの2つのくぼみの適用は、サークリップが正しく取り付けられていることを確認するのに役立ちます。
- 液体窒素を上に上げて、レベルがサンプルホルダーの上に約1.5cmになるようにします。VMXm サンプル鉗子を使用して、サンプルローダーの小さなピンの上に慎重に持ち上げ、サンプルカートリッジに戻します。サンプルカートリッジのサンプルホルダーの位置番号をメモします。
- すべてのサンプルがロードされるまで、サンプルホルダにグリッドをロードし続けます。
- サンプルが内部に残っている場合は、グリッドボックスをストレージデュワーに戻し、より多くのスペースを作成するためにデュワーからサンプルローダーを取り外します。
- カートリッジのカートリッジ蓋を交換し、カートリッジの上部にあるピンが蓋の穴に固定されていることを確認します。
- 冷却し、液体窒素でVMXmエアロックデュワーを充填し、ロードされたサンプルカートリッジを含む泡のデュワーの隣に置きます。
- VMXmカートリッジツールを使用して、カートリッジの側面にあるリッジに慎重にツールを取り付け、カートリッジをエアロックのデュワーに素早く持ち上げます。
- 液体窒素レベルがカートリッジを覆っていることを確認します。
- エアロックデュワーに蓋を置き、ロードされたサンプルカートリッジでVMXmのエンドステーションに進みます。
メモ:サンプルカートリッジをVMXmのエンドステーションにロードする場合は、ビームラインスタッフが行います。
結果
このプロトコルの目的は、回折信号を改善するために、最小限の背景散乱でX線回折実験を可能にする結晶を取り巻く液体の最小量でガラス化されたマイクロクリスタルを達成することです。CryoTEM グリッド上で最小限のバックグラウンド散乱のために調製された微結晶の SEM 画像の例を 、図 1A,B および 図 2に示します。均一に分布する単結晶を持つグリッドは、良好な信号対雑音で、グリッドの最も効率的な使用を提供します。ただし、通常、グリッド全体では不可能であり、一部の領域では束が表示されることがあります (図 2A,B)。この束にもかかわらず、これらの例は、低バックグラウンド回折を提供する単一の単一の結晶の有用な数をまだ表示します(図5)。低背景散乱を維持するブロッティングのレベルは、異なる場合があります。炭素支持膜の穴がはっきりと見えるが、結晶が水和したままであるような強いブロッティングが目的である(図2C,D)。しかし、良好な品質のグリッドは、サポートフィルムの穴の中に液体を表示することができますが、穴の位置はまだ識別可能でなければなりません(図2A,B)。重要なことに、これらの例のすべては、ブロッティングとプランジ凍結の間の水和を維持するために、結晶を囲む液体のガラス化されたハローを有する単一の、単離された結晶を表示する。
多くのサンプルは、さらなる最適化(図3)を必要とし得るが、これは、ブロッティング時間の変動またはマイクロ結晶の濃度を含むことができる。結晶で過負荷状態のグリッドは、ブロッティング効率の低下を示し、複数の格子が単一回折画像に記録される可能性があります(図3A,B)。8%PEG 4000および15%エチレングリコール(図3 C)を含むトリプシン(図3C)のようなより粘性結晶化条件は、より長いブロット時間(>10 s)の必要性をもたらすことができる。逆に、非常に低い粘度で結晶化条件が非常に速く、ブロットが発生する前に沈降する原因となる重力による分布問題に苦しむことがあり、その結果、グリッドの片側に沿って全ての微結晶が沈降する(図3D)。
サンプルの最適な調製により、VMXmの全機能を利用して、高い信号対雑音で可能な限り最高の解像度で高品質のX線回折データを収集することができます(図5)。これらのサンプルは 、真空中 のサンプル環境と互換性があり、回折画像の平均バックグラウンドカウントが非常に低いかゼロになるという利点があります。液体エタンを使用すると、凍結保護剤が存在せず、氷環が存在しない(図5)、結晶が銅グリッドバーの近くに横たわっているが、X線ビームは、銅粉末の回折リングを生じさせるバーを一目見ることができる。〜2.1Åおよび〜1.8Å。

図1:マイクロメッシュマウントとサイオテムグリッドのマイクロクリスタル実装の比較ウイルス多面体の急落凍結微結晶の走査電子顕微鏡写真(A,B)5kV加速電圧、スポットサイズ39(任意単位)、16μsのドウェル時間。グリッドは過剰な液体(A)から自由であり、結晶(B)を囲む液体の狭いハローが観察される。液体窒素中でフラッシュ冷却する前にマイクロメッシュ(20 μmアパーチャー)に取り付けられた同じサンプルをビームラインI24フェイスオン(C)およびサイドオン(D)でオン軸観察システムを使用して観察した。光学歪み(C)を見る際に、マイクロメッシュ全体の液体厚さの程度を示し、マイクロメッシュサイドオン(D)を見るとより明確である。 C と D の赤いターゲットは、X線ビームの位置とサイズを表します。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2: 良質サンプルの例単一の100 μmのグリッドの正方形の間で観察される多面体の結晶(A)。結晶の一部はわずかに凝集し、周囲の液体の接続性を示していますが、結晶を取り巻く小さな液体を持つ孤立した単結晶が数多く存在します。わずかに大きいインスリン結晶(B)測定〜5 x 5 μmもいくつかの凝集を示すが、再びよく孤立した個々の結晶がある。針結晶は非常に狭い次元を有することができ、これらの針状のリソチーム結晶(C)のようなマイクロビームを必要とする。これらの結晶(薄い灰色のハロー)を囲む液体の狭いバンドが見られます。最大数十ミクロンまでの大きなマイクロクリスタルは、これらの〜7μmのプロテインナーゼK結晶(D)のようなクライオテムグリッドに十分に取り付けることができます。(C)と(D)の両方で、より少ない程度では(A)、炭素支持膜の穴がはっきりと見え、ほとんどまたは無水の存在を示す。例Bでは、空の穴は見られないが、穴の位置は依然として特定することができ、液体が支持膜の穴のみを満たしていることを示している。これらの例では、グリッドの正方形(丸い内側の正方形)の端の周りに液体のハローが見られ、穴は明るい灰色の外観を持っています。これは、十分に準備されたグリッドの共通の機能です。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3: さらなる最適化を必要とするサンプルの例マイクロクリスタル(A、B)で過負荷状態のグリッドは、サンプルがブロッティング効率を低下させる支持フィルムの穴をブロックし、結晶間のより高い表面張力でより多くの液体が残るように、背景散乱を増加させることができます。信号対雑音の劣化が原因で情報が消失するとともに、複数の格子が記録される可能性が高い。ブロッティング時間が十分でない場合、または高粘性結晶化溶液を使用すると、過度に湿ったサンプル(C)が発生し、信号対雑音も低くなります。牛のインスリン(D)のような沈殿物のない結晶化条件は、非常に低い粘度を有する。これは非常に短いブロット時間をもたらす一方で、それはまた、重力の影響のためにブロッティングの前と中にグリッドを横切って結晶の動きをもたらすことができます。これは通常、1つのエッジに沿って結晶の高濃度を持つ大部分の空のグリッドになります (D).結晶流量を減らし、結晶の分布を改善するために格子に塗布する直前に、エチレングリコールなどの粘性剤を結晶スラリーに添加することが有利です。また、ブロッティング時間を長くして、ブロッティングを観察しやすくすることもできます。この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:VMXmでのサンプル読み込み用ツールVMXm サンプルホルダ(A)をロードするように、特注のツールセットが設計されています。サンプルローダー(B)は、作業中に単一のVMXmサンプルホルダー、グリッドボックス、およびツールストレージ用のスペースを備えています。また、液体窒素の表面のすぐ下で作業できるように設計されており、サンプルカートリッジが下に収まるように設計されています(B)。VMXmのエンドステーションのエアロック窒素ガスボックスに適合するエアロックデュワー(C)は、ロードされたサンプルカートリッジをラボからビームライン実験小屋に持ち込むために使用されます。オフラインSEMでサンプルを表示するために、ビームラインで使用されるサンプルホルダーで評価を可能にするために、ベースなしのVMXmサンプルホルダーからなる別注シャトル(D)が作られました。この図の大きなバージョンを表示するには、ここをクリックしてください。
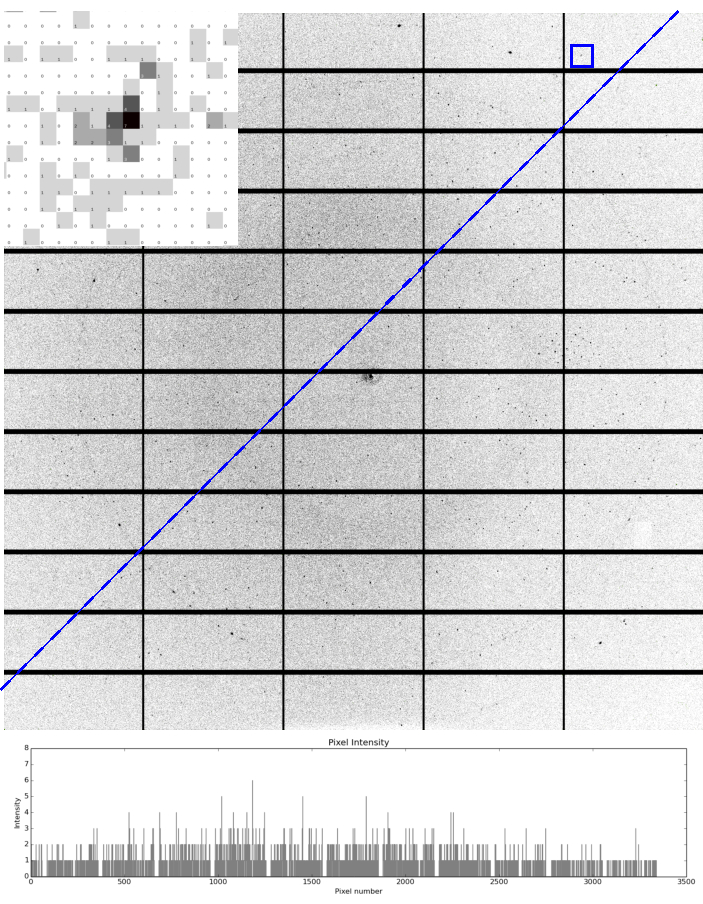
図5: VMXmにおける微小結晶からの回折例 プランジ凍結法を用いて、クライオテムグリッドに搭載された~3μmウイルス多面体結晶のVMXmでピラタス36M検出器を用いて記録された単一回折像。回折は1.7Åを超えて観測され、1.74Åの反射(青い正方形)が差し込み、低い背景散乱を示し、ゼロカウントのピクセル数が多いことを示します。エチレングリコールは、最終的な濃度50%v/vに加え、グリッドに塗布する前に結晶スラリーに添加した。VMXm サンプル位置の背景の低さは、ビーム中心の近くでも、青色の破線の下にプロットされた強度によって示されるように、画像全体の一定の背景によって示されます。プロットされた強度は、背景が3カウント未満のままであることを示しています。2.15 Å と 1.86 Å で 2 つの微弱なリングが観察され、これはクライオテム グリッドの銅の粉末回折によって生成されます。検出可能な氷リングはなく、ブロッティングの有効性を示し、続いて液体エタンで冷却します。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
このプロトコルは、マイクロフォーカスビームラインでのX線回折実験のための微結晶の調製に、cryoTEMサンプル調製のツールがどのように使用できるかを示す。標準ビームライン計測器はピンマウントサンプルを中心にしており、マイクロクリスタル用にこれらのマウントにサンプルサポートを提供する努力がなされている一方で、最高の信号対雑音が達成されるようにしながら、サンプルをロードすることはしばしば困難です(図1C,D)。これらのサンプルの多くは、サンプルが万が一に満ちっていることを確認するために、凍結保護条件の最適化を必要とするかもしれません。プランジ凍結法は、過剰な液体を除去し、効率的なクライオゲンでサンプルを冷却する繰り返し可能な方法を提供する(図1A,B)。その後、グリッドはピン板ベースのピンマウントを備えた標準ビームラインに取り付けることができますが、VMXmサンプルホルダーは、導電冷却を介して真空環境でグリッドを受け入れ、ガラス転移温度以下に保持するように特別に設計されています。VMXmのサンプル環境では、低バックグラウンドデータ収集が可能で、サンプルはバックグラウンドの残りのソースであり、10μm未満の寸法を持つ結晶を一致させるために使用できるマイクロビームを提供します。また、このサンプル調製方法は、電子の浸透が弱いために過剰な液体やガラス状の試料の要件が非常に少ない電子回折のためのナノ結晶を調製するためにも使用できます。cryoTEMグリッドは壊れやすいですが、ループ内の結晶の収穫に経験したものは、グリッドの取り扱いに素早く適応します。少量の経験を持つ場合、プロトコルのブロッティング、凍結、ロード段階で失われるグリッドはほとんどありません。最適化の手順は、しかし、この成功に不可欠であり、慎重な準備は、結晶を失うか、結晶の完全性を低下させる可能性を低減します。
CryoTEMグリッドは、何百もの結晶を含むことができる比較的大きな単一マウントを提供するため、小さな回折データを記録することしかできないスループットが向上します。単一のグリッドはまた、タンパク質構造を決定するのに十分な結晶を提供することができる, 特に高い対称性の結晶で.1つまたは2つの単結晶化滴のみがマイクロ結晶を生成している場合、結晶化条件の試用ブロッティングだけでは、マイクロクリスタルがブロットされている場合、使用される時間が初期の良好な品質サンプルを生成するために必要なものにできるだけ近いことを保証することができます。カーボンフィルムのサポートはX線には見えず、特定の形態に合わせて使用することができる異なった穴間隔と利用できる。最も一般的には、2 μmの間隔で2μmの穴を持つ支持フィルムを利用していますが、間隔が大きい小さな穴は2μm未満の結晶に適している可能性があります。4μmの間隔を持つ1μmの穴を持つものや、異なる形状の穴を持つ支持フィルムなど、他の支持フィルムも利用可能で、そのすべてがブロッティング時間に影響を与えます。グリッド正方形のメッシュサイズ200(1インチ当たり200平方)も銅グリッドバー間に十分なスペース(約100μm)を提供し、X線ビームが銅と強く相互作用せず、結晶を積んだ炭素フィルムに対して十分な構造サポートを提供します。液体エタンの使用は、凍結保護剤の必要性を否定し、凍結保護条件の最適化に使用されたであろうサンプル体積の要件を減らす。
プロセス中に最適化される主なパラメータは、ブロッティング時間とサンプル希釈です。ブロッティング時間は、急落凍結の前にグリッド全体にわたって「飛び出す」効果を観察するのに十分な長さでなければなりません。オーバーブロッティングは結晶の脱水をもたらす可能性があるが、サンプルチャンバー内の湿度の制御は、この効果を最小限に抑えるために使用される。相対湿度90%を使用することが示唆されていますが、一部のサンプルは湿度の最適化に役立つ可能性があります。湿度は、ゆっくりと水で飽和することができるブロッティング紙のブロッティング効率に影響を与える可能性があります。さらに、試料チャンバ内の湿度制御は、結晶30の回折品質を向上させるために使用することができる。回折の質が低下しないように回折完全性をチェックする前に、湿度の小さな変化(<5%)を行うことをお勧めします。
非貴重なサンプルの最適化は、SEMの代わりに光顕微鏡を使用して行うことができます。破壊的ですが、グリッド全体の結晶の密度を評価し、グリッド全体の結晶をより良く分散させるためにサンプルを希釈するか濃縮するかの意思決定を可能にするのに役立ちます。このステップは、利用可能な結晶の数が多く、特に高濃度サンプルがある場合に最も便利です。結晶の束を避ける必要があります (図3),それは、データ収集中に同時に 2 つの結晶が照らされている場合、重要な問題ではないが、その束を囲む液体の量が大きくなり、信号対雑音を低減する可能性があります (図 5)。光顕微鏡を用いてグリッド全体で大量の液体を観測することは可能ですが、微結晶を取り巻く液体の量や結晶性の氷の存在の評価は、極低温真空移動システムとステージを取り付けた電子顕微鏡を使用してのみ行うことができます。場合によっては、結晶をグリッドに適用した後、ブロッティングが発生する前に、低粘度溶液中の結晶がグリッドの1つの端に沿って沈落することがあります。エチレングリコールの50%の最終濃度まで加えて、液滴を通る結晶の移動を遅くし、グリッド全体の微結晶のより良い分布を確保し、ブロット時間を長くすることによってブロットをより細かく制御できることを発見しました(図3D)。
高分子量のPEGsなどの粘性沈殿剤を含むいくつかの結晶化溶液は、ブロットに挑戦し、ますます長いブロット時間(>10 s)を必要とすることを証明することができます。このような場合には、グリッドの裏面に堆積する液体の量、ならびにグリッドの支持膜側への結晶含有溶液の体積を減少させると役立つ場合がある。2層のブロッティングペーパーやガラス繊維を用いるような戦略は、これらの困難な場合31においてブロッティングを助けるかもしれない。
このパイプラインは可溶性タンパク質結晶に適していますが、LCPの膜タンパク質のような非常に粘性の高い媒体に形成されるものは、このプロトコルが適さない別の課題を提示します。しかし、LCPに相変化を誘導してサンプルの粘度を低下させるなど、マイクロED用のクライオテムグリッド上でLCP結晶を調製するための戦略が浮上しています。これにより、この記事で説明した方法と同様の方法でグリッドにサンプルを適用できます。最後に、試料を、過剰な非結晶材料32、33、34を除去するために、焦点を合わせイオンビームで粉砕することができる。
全体として、このパイプラインは一般的に、VMXmに到着したサンプルから、サンプルの可用性、結晶の濃度、結晶の粘度に応じて、適切に分散されたガラス化サンプルを最適化されたグリッドを提供するために、1〜2時間(機器の段取り時間を含む)を要します。これらの方法は、試料を取り巻く微小な液体が必須である28,35の微小結晶の放射線損傷を探るX線回折実験のためのマイクロ結晶の調製に既に成功している。プロトコルは、既に最適化されているサンプルを十分に拡散するだけでなく、すべての可溶性マイクロクリスタルサンプルに適用できることに留意すべきです。マイクロ結晶性材料を生成する結晶化実験は、従来より大きな結晶を得ることを目的とした最適化のターゲットとなるだろうが、このサンプル調製方法とVMXmの能力は、さらなる最適化なしにそのようなサンプルから適切なデータを収集することを可能にするかもしれない。あるいは、このような微結晶性試料が十分に回折しが悪い場合、このサンプル調製方法を用いてVMXmから収集されたデータは、結晶化条件のさらなる最適化に役立つガイドとして機能し続けることができる。グロー放電やプランジ凍結などのグリッドを準備するためのツールは、クライオテム実験用の研究機関で広く利用可能になり、VMXmでビームタイムの前にサンプルを準備できる多くのユーザーが利用できるようになります。
開示事項
宣言する利益相反はありません。
謝辞
著者らは、ジェレミー・キーオン、ジョン・グライムス、ジェフ・サットン、デイブ・スチュアート、STRUBIオックスフォード大学、レイチェル・ボルトン(サウサンプトン大学)に対し、ビームラインの試運転を可能にすることに加えて、VMXmビームラインのサンプル調製方法の開発とデモンストレーションのためのマイクロクリスタルサンプルを親切に提供してくれたことに感謝したいと考えています。また、この原稿の公開機会と支援に対するiNEXT-Discovery(プロジェクト番号871037)に感謝したいと考えています。
資料
| Name | Company | Catalog Number | Comments |
| Automated Cryo-EM plunge freezing instrument | Leica or ThermoFisher | Various | |
| Benchtop light microscope with light source | Various | Various | |
| Blade/Scalpel | Fisher Scientific | Various | |
| CryoTEM Copper 200 mesh grids with carbon support film with 2 µm holes | Quantifoil | N1-C16nCu20-50 | |
| CryoTEM grid storage boxes | Agar Scientific | AGG3727 | |
| ddH2O | n/a | n/a | |
| Ethane gas supply | n/a | n/a | |
| Ethylene Glycol | Acros Organics | 146750010 | |
| Glass microscope slides | FisherBrand | 12383118 | |
| Glass petri dish | FisherBrand | 455732 | |
| Glow discharging device | Pelco | 91000S | |
| Laboratory wrapping film (Parafilm) | Bemis | HS234526B | |
| Large and small, fine forceps | Agar Scientific | Various | |
| Liquid nitrogen supply | n/a | n/a | |
| Pipette tips | Various | Various | |
| Pipetting devices | Various | Various | |
| Sealing tape for crystallisation plates. | Molecular Dimensions | MD6-01 | |
| Small/medium liquid nitrogen dewars | Spearlab | Various | |
| Sprung circlip clipping tool | Subangstrom | SCT08 | |
| Whatmann No.1 pre-cut filter paper | Leica | 16706440 |
参考文献
- Laundy, D., et al. Development of a multi-lane X-ray mirror providing variable beam sizes. Review of Scientific Instruments. 87 (5), 051802-051806 (2016).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta crystallographica. Section F, Structural biology communications. 70, 2-20 (2014).
- McPherson, A., Cudney, B. Optimization of crystallization conditions for biological macromolecules. Acta crystallographica. Section F, Structural biology communications. 70 (11), 1445-1467 (2014).
- Holton, J. M., Frankel, K. A. The minimum crystal size needed for a complete diffraction data set. Acta Crystallographica Section D. 66, 393-408 (2010).
- Garman, E. F., Owen, R. L. Cryocooling and radiation damage in macromolecular crystallography. Acta Crystallographica Section D. 62 (1), 32-47 (2005).
- Gildea, R. J., et al. New methods for indexing multi-lattice diffraction data. Acta Crystallographica Section D. 70, 2652-2666 (2014).
- Chapman, H. N. X-Ray Free-Electron Lasers for the Structure and Dynamics of Macromolecules. Annual Review of Biochemistry. 88 (1), 35-58 (2019).
- Beale, J. H., et al. Successful sample preparation for serial crystallography experiments. Journal of Applied Crystallography. 52, 1385-1396 (2019).
- Smith, J. L., Fischetti, R. F., Yamamoto, M. Micro-crystallography comes of age. Current Opinion in Structural Biology. 22 (5), 602-612 (2012).
- Owen, R. L., Juanhuix, J., Fuchs, M. Current advances in synchrotron radiation instrumentation for MX experiments. Archives of Biochemistry and Biophysics. 602, 21-31 (2016).
- Miller, M., et al. Getting the Most Out of Your Crystals: Data Collection at the New High-Flux, Microfocus MX Beamlines at NSLS-II. Molecules. 24 (3), 496 (2019).
- Axford, D., Ji, X., Stuart, D. I., Sutton, G. In cellulo structure determination of a novel cypovirus polyhedrin. Acta Crystallographica Section D. 70, 1435-1441 (2014).
- Ji, X., et al. Polyhedra structures and the evolution of the insect viruses. Journal of structural biology. 192 (1), 88-99 (2015).
- Evans, G., Axford, D., Owen, R. L. The design of macromolecular crystallography diffraction experiments. Acta Crystallographica Section D. 67, 261-270 (2011).
- . MiTeGen Available from: https://www.mitegen.com/product/micromeshes/ (2020)
- Guo, G., et al. Sample manipulation and data assembly for robust microcrystal synchrotron crystallography. IUCrJ. 5, 238-246 (2018).
- Cipriani, F., et al. Automation of sample mounting for macromolecular crystallography. Acta Crystallographica Section D. 62 (10), 1251-1259 (2006).
- Caffrey, M. A comprehensive review of the lipid cubic phase or in mesomethod for crystallizing membrane and soluble proteins and complexes. Acta crystallographica. Section F, Structural biology communications. 71 (1), 3-18 (2015).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Nannenga, B. L. MicroED methodology and development. Structural Dynamics. , 1-8 (2020).
- Dubochet, J., et al. Cryo-electron microscopy of vitrified specimens. Quarterly Reviews of Biophysics. 21 (2), 129-228 (1988).
- Tivol, W. F., Briegel, A., Jensen, G. J. An improved cryogen for plunge freezing. Microscopy and Microanalysis. 14 (5), 375-379 (2008).
- Garman, E. F., Schneider, T. R. Macromolecular Cryocrystallography. Journal of Applied Crystallography. 30 (3), 211-237 (1997).
- Pflugrath, J. W. Practical macromolecular cryocrystallography. Acta Crystallographica Section F. 71 (6), 622-642 (2015).
- Alcorn, T., Juers, D. H. Progress in rational methods of cryoprotection in macromolecular crystallography. Acta crystallographica Section D. 66, 366-373 (2010).
- Bowler, M. W., Montgomery, M. G., Leslie, A. G. W., Walker, J. E. Reproducible improvements in order and diffraction limit of crystals of bovine mitochondrial F(1)-ATPase by controlled dehydration. Acta Crystallographica Section D. 62, 991-995 (2006).
- Pellegrini, E., Piano, D., Bowler, M. W. Direct cryocooling of naked crystals: are cryoprotection agents always necessary. Acta Crystallographica Section D. 67, 902-906 (2011).
- Beale, E. V., et al. Scanning electron microscopy as a method for sample visualization in protein X-ray crystallography. IUCrJ. , 1-9 (2020).
- Hattne, J., et al. Analysis of Global and Site-Specific Radiation Damage in Cryo-EM. Structure. 26 (5), 759-766 (2018).
- Sanchez-Weatherby, J., et al. Improving diffraction by humidity control: a novel device compatible with X-ray beamlines. Acta crystallographica Section D. 65 (12), 1237-1246 (2009).
- Tan, Y. Z., Rubinstein, J. L. Through-grid wicking enables high-speed cryoEM specimen preparation. Acta Crystallographica Section D. 76 (11), 1092-1103 (2020).
- Martynowycz, M. W., Khan, F., Hattne, J., Abramson, J., Gonen, T. MicroED structure of lipid-embedded mammalian mitochondrial voltage-dependent anion channel. Proceedings of the National Academy of Sciences. 117 (51), 32380-32385 (2020).
- Zhu, L., et al. Structure Determination from Lipidic Cubic Phase Embedded Microcrystals by MicroED. Structure. 28 (10), 1149-1159 (2020).
- Polovinkin, V., et al. Demonstration of electron diffraction from membrane protein crystals grown in a lipidic mesophase after lamella preparation by focused ion beam milling at cryogenic temperatures. Journal of Applied Crystallography. 53 (6), 1416-1424 (2020).
- Storm, S. L. S., et al. Measuring energy-dependent photoelectron escape in microcrystals. IUCrJ. 7 (1), 129-135 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved