このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
近接ライゲーションアッセイを用いた異流体せん断応力条件下でのTGFβ/BMP/SMADシグナル伝達の可視化と定量化
要約
ここでは、病理的および生理的な流体せん断ストレス条件に曝露した内皮細胞における近接ライゲーションアッセイ(PLA)を用いて、複数のSMAD複合体を同時に可視化・解析するプロトコルを確立する。
要約
変形成長因子β(TGFβ)/骨形態形成タンパク質(BMP)シグナル伝達は、血管系の発達および恒常性の間に厳しく調節され、バランスがとれ、従って、このシグナル伝達経路の調節緩和は、肺動脈高血圧症、遺伝性血性動脈硬化症、アテローム硬化症などの重度の血管病理をもたらす。血管の最も内側の層として、血管内皮細胞(IC)は、常に流体せん断応力(SS)にさらされています。流体SSの異常パターンは、TGFβ/BMPシグナル伝達を増強することが示されており、これは、他の刺激と共に、アテローム発生を誘発する。これに関連して、アテローム化、低層SSは、アテロープロテクティブ、高層SS、このシグナル伝達を減少させながらTGFβ/ BMPシグナル伝達を強化することが判明した。これらの経路の活性化を効率的に解析するため、市販の空気圧ポンプシステムと近接ライゲーションアッセイ(PLA)を用いて、低層SSおよび高層SS条件下での転写因子複合体の形成を調査するワークフローを設計しました。
アクティブTGFβ/BMPシグナル伝達は、2つの調節SMAD(R-SMAD)からなる三量体SMAD複合体の形成を必要とする;共通のメディター SMAD (コ-SMAD;スマッド4)。三量体SMAD複合体の異なるサブユニット、すなわちR-SMAD/co-SMADまたはR-SMADまたはR-SMADのいずれかの異なるサブユニットを標的とするPLAを用いて、活性SMAD転写因子複合体の形成は、蛍光顕微鏡を用いて定量的および空間的に測定することができる。
連続で接続することができる6つの小さな並列チャネルを有するフロースライドの使用は、転写因子の複雑な形成および必要な制御の包含の調査を可能にする。
ここで説明するワークフローは、SMADの近接性を他の転写因子に対して対象とする研究や、異なる流体SS条件でSMAD以外の転写因子複合体に容易に適応させることができる。ここで示したワークフローは、定量的にも空間的にも、ECsにおける流体SS誘導TGFβ/BMPシグナリングを迅速かつ効果的に研究する方法を示しています。
概要
トランスフォーム成長因子β(TGFβ)スーパーファミリーのタンパク質は、TGFβs、骨形態形成タンパク質(BMP)、およびアクティビンズ1,2を含む様々なメンバーを有する多方性サイトカインである。リガンド結合は、リン酸化に至る受容体オリゴマーの形成を誘導し、それにより、細胞ゾーリック調節SMAD(R−SMAD)の活性化を行う。リガンドのサブファミリーに応じて、異なるR-SMAが活性化される1,2。TGFβsおよびアクチビンは主にSMAD2/3のリン酸化を誘導するが、BMPはSMAD1/5/8リン酸化を誘導する。しかし、BMPとTGFβs/アクティビンは、他のサブファミリーのR-SMAを活性化し、「横信号」3,4,5,6,7,8と呼ばれるプロセスで、SMAD1/5とSMAD2/3の両方からなる混合SMAD複合体があるという証拠が蓄積されています。.2つの活性化されたR-SMADは、その後、一般的なメディエーターSMAD4と三量体複合体を形成する。これらの転写因子複合体は、核に転写し、標的遺伝子の転写を調節することができる。SMADは、様々な転写共活性化因子および共抑制因子と相互作用し、標的遺伝子10を調節する可能性の多様化につながる。SMADシグナル伝達の調節緩和は、様々な疾患において深刻な影響を及ぼす。これに伴い、不均衡なTGFβ/BMPシグナル伝達は、肺動脈高血圧症、遺伝性出血性血管拡張症、またはアテローム性動脈硬化症3、11、12、13、14などの重度の血管病理を引き起こす可能性がある。
内皮細胞(ECs)は血管の最も内側の層を形成し、したがって、せん断応力(SS)に曝露され、血液の粘性流によって作用される摩擦力である。興味深いことに、高レベルの均一な層状SSにさらされる血管構造の一部に存在するECは、ホメオスタティックで静止状態に保たれています。対照的に、低い非均一なSSを経験するICは、例えば、大動脈弓の分岐またはより少ない湾曲において、増殖し、炎症経路を活性化する15。さらに、機能不全のICの部位はアテローム性動脈硬化症を発症しやすい。興味深いことに、これらのアテローム発生領域のICは、活性化されたSMAD2/3およびSMAD1/516,17,18の異常に高いレベルを表示します。この文脈において、増強されたTGFβ/BMPシグナル伝達は、アテローム硬化性病変19の発症における早期の事象であることが判明し、BMPシグナル伝達との干渉は、血管炎症、アテローム形成、および関連する石灰化20を著しく減少させることが判明した。
近接ライゲーションアッセイ(PLA)は、in situ21,22におけるタンパク質とタンパク質の相互作用を研究するための生化学的手法です。これは、目的の標的タンパク質を結合することができる異なる種の抗体の特異性に依存し、単一細胞レベルでの内因性タンパク質相互作用の高度に特異的な検出を可能にする。ここで、一次抗体は、検出23を可能にするために40nm未満の距離で標的エピトープに結合する必要がある。したがって、PLAは、内因性タンパク質相互作用を検出するために数百万個の細胞が必要な従来の共免疫沈降アプローチよりも非常に有益です。PLAでは、種特異的な二次抗体は、DNA断片(プラスおよびマイナスプローブと呼ぶ)に共有結合し、一次抗体に結合し、関心のあるタンパク質が相互作用する場合、プラスおよびマイナスプローブが近接して来る。DNAは次のステップで結紮され、円形DNAの転環増幅が可能になる。増幅の間、蛍光標識された相補オリゴヌクレオチドは合成されたDNAに結合し、これらのタンパク質相互作用を従来の蛍光顕微鏡で可視化することを可能にする。
ここで説明するプロトコルは、プラを使用して、科学者がアテロプロテク保護およびアテローム化SS条件で活性SMAD転写複合体の数を定量的に比較することを可能 に する。SSは定義されたレベルの層の単方向流れを生成し、流量の段階的な増加を可能にすることができるプログラム可能な空気ポンプシステムを介して生成される。この方法により、SMAD1/5またはSMAD2/3とSMAD4との相互作用、および混合R-SMAD複合体の相互作用を検出することができます。転写共調整因子とのSMADの相互作用を分析したり、SMAD以外の転写因子複合体に分析したりすることが容易に可能です。 図 1 は、以下に示すプロトコルの主要な手順を示しています。
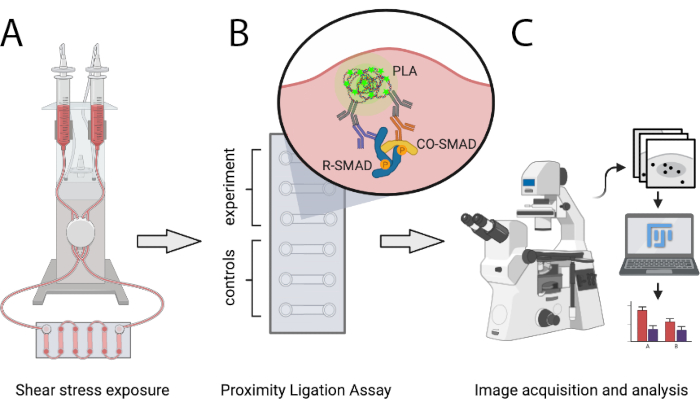
図1:記載されたプロトコルの概略表現。 (A)6チャンネルスライドに播種された細胞は、空気圧ポンプシステムでせん断応力にさらされます。(B) 固定細胞はPLA実験や制御条件に使用されます。(C) PLA実験の画像は蛍光顕微鏡で取得し、ImageJ解析ソフトを用いて解析します。 この図の大きなバージョンを表示するには、ここをクリックしてください。
プロトコル
1. 細胞培養と流体せん断ストレス暴露
注: ヒト臍静脈脳(HUVEC)はSS誘導SMAの相互作用を研究する例として用いられた。以下に説明するプロトコルは、すべてのSS応答セルタイプに適用できます。
- PBSで0.1%ブタスキンゼラチンを37°Cで30分間コーティングする6チャンネルスライド。
- M199フル培地の30 μLでmLあたり2.5 x 106 細胞の密度で、事前にコーティングされた6チャンネルスライドにHUVECをシードします。
注: フロー スライドのセルにシードを付ける方法の詳細については、reference24 を参照してください。 - 加湿インキュベーターで細胞を37°Cで1時間接着させる。
- 各貯留槽に、60 μLのあらかじめ温めたM199フル培地を加えます。
- 2日間培養し、1日1回、加湿インキュベーターで37°Cで穏やかな培地交換を行った。
- 貯留層を完全に吸引し、1つの貯留槽に120μLの予め温めたM199フル培地を加え、反対側から吸引する。
- 両方の貯留層に60 μLのあらかじめ温めたM199フル培地を加えます。
- reference25 で詳細に説明されているように、フローのセットアップを組み立てて開始します。
- 流体ユニットにチューブを取り付けます。ここでは、直径0.8mmと1.6mmのシリコーンチューブを使用して、それぞれ1 dyn/cm2 と30 dyn/cm2のせん断応力を適用します。
注: 材料とチューブの長さは、変更によって発生するせん断応力に影響を与える可能性があります。一般に、ポンプシステムとチューブの他の組み合わせは、得られるせん断応力が既知である限り、使用することができ、ポンプは安定した層流を作成します。 - 事前に温めたM199フル培地(最低10 mL)の適切な量で貯水池を充填します。
- 流体ユニットをチューブとポンプシステムに接続し、セルなしで事前実行を行い、培地を平衡化し、残りのair25を取り除きます。
- シリアル接続チューブを使用して、6チャンネルスライドの単一チャンネルを相互にシリアル接続します。スライドの最初のチャネルと最後のチャンネルは、1.6.1 で組み立てられたチューブに接続されます(図 1A を参照)。これは細胞に深刻な害を与える可能性がありますので、システムに空気を導入しないように注意してください。シリアル接続の詳細については、参照26を参照してください。
- 高レベルのせん断応力(>20 dyn/cm2)への細胞の暴露については、ランプフェーズ、すなわち、適応段階で段階的にせん断応力を増加させます。ステップは30分あたり5 dyn/cm2 単位で設定できます。
- 流体ユニットにチューブを取り付けます。ここでは、直径0.8mmと1.6mmのシリコーンチューブを使用して、それぞれ1 dyn/cm2 と30 dyn/cm2のせん断応力を適用します。
2. 固定
- 流体SS露光後にポンプからスライドを取り外します。取り外し時にチューブにクランプを使用して、インキュベーターでの媒体の流出を避けます。
- 残りのチューブは順次取り外しされながら、すぐに氷の上に流れスライドを移します。貯留槽からチューブを取り外すとき、反対側の貯留所は、チャネル内の気泡をトラップしないように指で閉じておく必要があります。これは、固定手順を妨げる可能性があります。
- 氷の上に細胞を保ち、細胞が存在するチャネルから慎重に培地を吸引する。その後、3倍のチャネル容量(90 μL)で、冷たい滅菌PBS(4°C)でサンプルを洗浄します。1つの貯水池にPBSを加え、もう一方の貯水池から慎重に吸引します。スライドごとに 6 チャンネルずつこの手順を繰り返します。
注:すべての洗浄およびインキュベーションステップでは、それぞれの溶液がチャネル内の溶液の交換につながる貯水池の1つに追加されます。チャネル内の溶液の完全な置換を可能にするために、過剰な溶液は、他の貯蔵所から吸引されます。チャネル内のセルの上部にあるソリューションは削除されません。細胞はいつでも乾燥してはいけません。そのため、スライドに気泡を挿入することなく注意深く洗浄することが重要です。 - PBSを事前に添加した同じリザーバに90 μLの緩衝4%PFA溶液を加えて細胞を固定し、同様に他のリザーバから液体を吸引します。各スライドの各チャンネルでこの手順を繰り返します。PFA溶液を添加した後、氷から室温(RT)にサンプルを移し、20分間インキュベートします。
注意: PFA は毒性があり、慎重に取り扱う必要があります。手袋を使用し、ヒュームフードの下で動作します。 - 細胞3xを1つの貯留槽に加え、もう一方の貯留層から注意深く吸引することによって、PBS(RT)で細胞を洗浄する。貯留層だけを空にして、チャネルを乾燥させないようにします。スライドごとに 6 チャンネルごとにこの手順を繰り返します。
- 貯留槽の1つで、90 μLのアンビエント 50 mM クロリドアンモニウムをPBSに加えて PFA 固定をクエンチします。他の貯水池から余分な溶液を吸引する。スライドの各チャンネルに対して繰り返します。RTで10分間サンプルをインキュベートします。
- ステップ2.5に記載の通り洗浄する。
注:この時点で、サンプルは一晩4°Cで保存されるか、またはプロトコルをブロッキングおよび一次抗体インキュベーションで直ちに継続することができる(ステップ3参照)。
3. ブロッキングおよび一次抗体インキュベーション
- 細胞を透過させるには、空いた貯蔵所にPBSに0.3%トリトン-X-100の90 μLを加え、各チャネルの他の貯留槽から吸引する。RTで10分間インキュベートします。
- ステップ2.5に記載の通り洗浄する。
- チャネルの1つの貯留層に90μLの無菌PLA遮断溶液を加え、もう一方の側から吸引する。各チャンネルに対してこの手順を繰り返します。加湿チャンバーで37°Cで1時間ブロックします。
- 加湿チャンバーを作るためには、ワックスフィルムで密封された湿ったティッシュと10cm皿を使用し、インキュベーターに皿を置きます。別の方法として、湿気の多い雰囲気を供給する他の湿気室フォーマットを使用することができる。
注:または、自作のブロッキング溶液(例えば、PBSで3%(w/v)BSA、無菌フィルタ)を使用することができます。
- 加湿チャンバーを作るためには、ワックスフィルムで密封された湿ったティッシュと10cm皿を使用し、インキュベーターに皿を置きます。別の方法として、湿気の多い雰囲気を供給する他の湿気室フォーマットを使用することができる。
- PLA抗体希釈剤で一次抗体(1:100)を調製する。チャネルごとに30 μLのソリューションを用意します。一次抗体と渦の両方を同時に追加します。
注:あるいは、自作の抗体希釈剤(例えば、PBS中の1%(w/v)BSA)を使用することができる。ここで使用される抗体は、SMAD1-SMAD2/3、SMAD2/3-SMAD4およびホスホ-SMAD1/5-SMAD4の組み合わせです。詳細は 、材料表を参照してください。 - 一次抗体の適用前に、ブロッキング溶液を貯留槽から吸引し、また、チャネルからも注意深く取り出す。一次抗体溶液のピペット30 μLは、溶液を添加しながらチャネルを傾けることで、すぐに空のチャネルに入る。
注:ブロッキング溶液の除去と抗体溶液チャネルごとの追加を行い、細胞が間に乾燥しないようにします。 - サンプルを一次抗体と一晩、4°Cの加湿チャンバーでインキュベートする。
注:インキュベーションは、同じ日に次の手順を続行することに興味がある場合は、室温で1時間実行することもできます。
4. PLAプローブインキュベーション
注:セクション4.1-7.3のすべてのステップでは、洗浄バッファAとBは4°Cで保存され、使用前にRTに温める必要があります。
- PLA-プローブ(+)マウスおよび(-)-ウサギをPLA抗体希釈液(または1%BSA)溶液で1:5に希釈した。チャネルあたり30 μLを準備します。
- サンプルをRTで90 μLの洗浄バッファーAを使用して、2xを洗浄し、もう一方の貯留層から注意深く吸い込みます。スライドごとに 6 チャンネルごとにこの手順を繰り返します。
- 洗浄緩衝液Aを注意深く吸気し、工程3.5で一次抗体を添加するのと同様に、PLAプローブ溶液(ステップ4.1で調製)の30μLを加える。
- 加湿チャンバ内で37°Cで1時間のサンプルをインキュベートする。
5. ライゲーション
- 4.2に記載されているように、RTで90μLの洗浄バッファーAを使用して、サンプルを2倍にして5分間洗浄します。
- 1:5の希釈液を脱イオン水に調製します。このバッファーを使用して、リガーゼ酵素を 1:40 (氷上) に希釈します。チャンネルあたり30μLを使用してください。
- 洗浄緩衝液Aを完全に吸引し、3.5に記載したライゲーション溶液を添加する。
- 加湿チャンバ内で37°Cで30分間のインキュベートサンプル。
6. 増幅
- 4.2に記載されているように、RTで90 μLの洗浄バッファーAを使用して2分間サンプルを2倍洗浄します。
- 1:5を脱イオン水に希釈して増幅バッファーを調製し、ポリメラーゼ酵素を1:80(氷上)に希釈します。光から守る。チャネルあたり30 μLを準備します。
- 洗浄緩衝液Aを完全に吸引し、3.5に記載されているように、調製した増幅溶液を空のチャネルに直ちに加える。加湿チャンバ内で37°Cで100分間サンプルをインキュベートします。
7. 取り付け
- 4.2で説明したようにRTで90 μLの洗浄バッファーBを使用して、サンプルを10分間2倍洗浄します。核を染色する最初の洗浄で1 mg/mLストック溶液(脱イオン水)からDAPI(1:500)を加えます。チャネルを乾燥させないでください。
- 洗浄バッファー B を脱イオン水 (1:10) で希釈し、4.2 に記載されているとおり、0.1x バッファー B 溶液の 90 μL で 1x を洗います。
- 洗浄緩衝液Bを完全に吸引し、すぐに2~3滴の液体実装媒体を1つの貯留槽に加える。スライドを傾けてチャネルに分散させます。サンプルは、イメージングまで加湿環境で4°Cで保存します。
8. 画像取得
- 蛍光顕微鏡を用いて画像を取得します。蛍光PLAプローブに適合する各フィルタが利用可能であることを確認します。
注:得られたPLAスポットがより定義されるように、可能であれば、共焦点顕微鏡を使用することは有益です。また、画像処理やデータ解析もサポートします。
9. 画像解析と画像定量
- ImageJ27 などのイメージ処理プログラムを使用して、エクスポートされたイメージ (.tiff) を処理します。
注: この調査で使用され、セル、核、およびすべての PLA イベント (セルごと) の自動カウントに必要なすべてのスクリプトは、GitHub リポジトリで見つけることができます: https://github.com/Habacef/Proximity-Ligation-Assay-analysis。適切なプログラムまたはツールを使用して統計分析を実行します。
結果
我々は、以前、PLAを用いて異なるSMADタンパク質3 の相互作用を検出し、SMADリン酸化28におけるせん断応力誘発変化を解析した。
ここで、両方の方法を上記のプロトコルと組み合わせた。ハヴェックは1 dyn/cm2 および30 dyn/cm2 のせん断応力を受け、SMAD転写因子の相互作用について分析した。我々は、高剪断応力(30 dyn/cm...
ディスカッション
ここで説明するPLAベースのプロトコルは、定量的および空間的解像度でせん断応力にさらされたECにおける2つのタンパク質の近接性(例えば、その直接相互作用)を効率的に決定する方法を提供します。複数の並列チャネルを有するフロースライドを使用することにより、複数の異なるタンパク質相互作用を同一の機械的条件下で細胞内で同時に検査することができます。対照的に、カスタム?...
開示事項
著者らは利益相反を宣言しない。
謝辞
マリア・ライヒェンバッハ博士とクリスチャン・ヒエペン博士がフローセットアップシステムをサポートし、エレノア・フォックスとユンユン・シャオが原稿を批判的に読んでくれて感謝します。P-L.Mは、国際的なマックスプランク研究学校IMPRS生物学と計算(IMPRS-BAC)によって資金提供されました。PKはDFG-SFB1444から資金提供を受けた。図 1 は、バイオレンダリングを使用して作成されました。
資料
| Name | Company | Catalog Number | Comments |
| µ-Slide VI 0.4 | ibidi | 80606 | 6-channel slide |
| Ammonium Chloride | Carl Roth | K298.1 | Quenching |
| Bovine Serum Albumin | Carl Roth | 8076.4 | Blocking |
| DAPI | Sigma Aldrich/ Merck | D9542 | Stain DNA/Nuclei |
| DPBS | PAN Biotech | P04-53500 | PBS |
| Duolink In Situ Detection Reagents Green | Sigma Aldrich/ Merck | DUO92014 | PLA kit containing Ligase, ligation buffer, polymerase and amplification buffer (with green labeled oligonucleotides) |
| Duolink In Situ PLA Probe Anti-Mouse MINUS | Sigma Aldrich/ Merck | DUO92004 | MINUS probe |
| Duolink In Situ PLA Probe Anti-Rabbit PLUS | Sigma Aldrich/ Merck | DUO92002 | PLUS probe |
| Duolink In Situ Wash Buffers, Fluorescence | Sigma Aldrich/ Merck | DUO82049 | PLA wash buffers A and B |
| Endothelial Cell Growth Supplement | Corning | supplement for medium (ECGS) | |
| Fetal calf Serum | supplement for medium | ||
| FIJI | Image Analysis software | ||
| Formaldehyde solution 4% buffered | KLINIPATH/VWR | VWRK4186.BO1 | PFA |
| Full medium | M199 basal medium +20 % FCS +1 % P/S + 2 nM L-Glu + 25 µg/mL Hep + 50 µg/mL ECGS | ||
| Gelatin from porcine skin, Type A | Sigma Aldrich | G2500 | Use 0.1% in PBS for coating of flow channels |
| GraphPad Prism v.7 | GarphPad | Statistical Program used for the Plots and statistical calculations | |
| Heparin sodium salt from porcine intestinal mucosa | Sigma Aldrich | H4784-250MG | supplement for medium (Hep) |
| HUVECs | |||
| ibidi Mounting Medium | ibidi | 50001 | Liquid mounting medium |
| ibidi Pump System | ibidi | 10902 | pneumatic pump |
| Leica TCS SP8 | Leica | confocal microscope | |
| L-Glutamin 200mM | PAN Biotech | P04-80100 | supplement for medium (L-Glu) |
| Medium 199 | Sigma Aldrich | M2154 | Base medium |
| mouse anti- SMAD1 Antibody | Abcam | ab53745 | Suited for PLA |
| mouse anti- SMAD2/3 Antibody | BD Bioscience | 610843 | Not suited for PLA in combination with CST 9515 |
| mousee anti- SMAD4 Antibody | Sanata Cruz Biotechnology | sc-7966 | Suited for PLA |
| Penicillin 10.000U/ml /Streptomycin 10mg/ml | PAN Biotech | P06-07100 | supplement for medium (P/S) |
| Perfusion Set WHITE | ibidi | 10963 | Tubings used for 1 dyn/cm2 |
| Perfusion Set YELLOW and GREEN | ibidi | 10964 | Tubings used for 30 dyn/cm2 |
| rabbit anti- phospho SMAD1/5 Antibody | Cell Signaling Technologies | 9516 | Suited for PLA |
| rabbit anti- SMAD2/3 XP Antibody | Cell Signaling Technologies | 8685 | Suited for PLA |
| rabbit anti- SMAD4 Antibody | Cell Signaling Technologies | 9515 | Not suited for PLA in combination with BD 610843 |
| Serial Connector for µ-Slides | ibidi | 10830 | serial connection tubes |
| Triton X-100 | Carl Roth | 6683.1 | Permeabilization |
参考文献
- Yadin, D., Knaus, P., Mueller, T. D. Structural insights into BMP receptors: Specificity, activation and inhibition. Cytokine and Growth Factor Reviews. 27, 13-34 (2016).
- Sieber, C., Kopf, J., Hiepen, C., Knaus, P. Recent advances in BMP receptor signaling. Cytokine and Growth Factor Reviews. 20 (5-6), 343-355 (2009).
- Hiepen, C., et al. BMPR2 acts as a gatekeeper to protect endothelial cells from increased TGFβ responses and altered cell mechanics. PLoS Biology. 17 (12), 3000557 (2019).
- Hildebrandt, S., et al. ActivinA induced SMAD1/5 Signaling in an iPSC derived EC model of Fibrodysplasia Ossificans Progressiva (FOP) can be rescued by the drug candidate saracatinib. Stem Cell Reviews and Reports. , (2021).
- Goumans, M. J., et al. Balancing the activation state of the endothelium via two distinct TGF-beta type I receptors. The EMBO Journal. 21 (7), 1743-1753 (2002).
- Goumans, M. J., et al. Activin receptor-like kinase (ALK)1 is an antagonistic mediator of lateral TGFbeta/ALK5 signaling. Molecular Cell. 12 (4), 817-828 (2003).
- Daly, A. C., Randall, R. A., Hill, C. S. Transforming growth factor beta-induced Smad1/5 phosphorylation in epithelial cells is mediated by novel receptor complexes and is essential for anchorage-independent growth. Molecular and Cellular Biology. 28 (22), 6889-6902 (2008).
- Ramachandran, A., et al. TGF-β uses a novel mode of receptor activation to phosphorylate SMAD1/5 and induce epithelial-to-mesenchymal transition. eLife. 7, 31756 (2018).
- Flanders, K. C., et al. Brightfield proximity ligation assay reveals both canonical and mixed transforming growth factor-β/bone morphogenetic protein Smad signaling complexes in tissue sections. The Journal of Histochemistry and Cytochemistry : The Official Journal of The Histochemistry Society. 62 (12), 846-863 (2014).
- Miyazono, K., Maeda, S., Imamura, T., Dijke, P. T., Heldin, C. -. H. . Smad Signal Transduction: Smads in Proliferation, Differentiation and Disease. , 277-293 (2006).
- Goumans, M. J., Zwijsen, A., Ten Dijke, P., Bailly, S. Bone morphogenetic proteins in vascular homeostasis and disease. Cold Spring Harbor Perspectives in Biology. 10 (2), 031989 (2018).
- Cai, J., Pardali, E., Sánchez-Duffhues, G., ten Dijke, P. BMP signaling in vascular diseases. FEBS Letters. 586 (14), 1993-2002 (2012).
- Cunha, S. I., Magnusson, P. U., Dejana, E., Lampugnani, M. G. Deregulated TGF-β/BMP signaling in vascular malformations. Circulation research. 121 (8), 981-999 (2017).
- MacCarrick, G., et al. Loeys-Dietz syndrome: a primer for diagnosis and management. Genetics in Medicine : An Official Journal of the American College of Medical Genetics. 16 (8), 576-587 (2014).
- Baeyens, N., Bandyopadhyay, C., Coon, B. G., Yun, S., Schwartz, M. A. Endothelial fluid shear stress sensing in vascular health and disease. The Journal of Clinical Investigation. 126 (3), 821-828 (2016).
- Min, E., et al. Activation of Smad 2/3 signaling by low shear stress mediates artery inward remodeling. bioRxiv. , 691980 (2019).
- Zhou, J., et al. BMP receptor-integrin interaction mediates responses of vascular endothelial Smad1/5 and proliferation to disturbed flow. Journal of Thrombosis and Haemostasis. 11 (4), 741-755 (2013).
- Zhou, J., et al. Force-specific activation of Smad1/5 regulates vascular endothelial cell cycle progression in response to disturbed flow. Proceedings of the National Academy of Sciences of the United States of America. 109 (20), 7770-7775 (2012).
- van Dijk, R. A., et al. Visualizing TGF-β and BMP signaling in human atherosclerosis: A histological evaluation based on Smad activation. Histology and Histopathology. 27 (3), 387-396 (2012).
- Derwall, M., et al. Inhibition of bone morphogenetic protein signaling reduces vascular calcification and atherosclerosis. Arteriosclerosis, Thrombosis, and Vascular Biology. 32 (3), 613-622 (2012).
- Fredriksson, S., et al. Protein detection using proximity-dependent DNA ligation assays. Nature Biotechnology. 20 (5), 473-477 (2002).
- Söderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nature Methods. 3 (12), 995-1000 (2006).
- Alam, M. S. Proximity Ligation Assay (PLA). Current Protocols in Immunology. 123 (1), 58 (2018).
- Application Note 03: Growing Cells in µ-Channels. ibidi Available from: https://ibidi.com/img/cms/support/AN/AN03_Growing_cells.pdf (2012)
- Application Note 13: HUVECs under perfusion. ibidi Available from: https://ibidi.com/img/cms/support/AN/AN13_HUVECs_under_perfusion.pdf (2019)
- ibidi. Application Note 31: Instructions µ-Slide VI 0.4. ibidi. , (2013).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Reichenbach, M., et al. Differential impact of fluid shear stress and YAP/TAZ on BMP/TGF-β induced osteogenic target genes. Advanced Biology. 5 (2), 2000051 (2021).
- Hiepen, C., Mendez, P. L., Knaus, P. It takes two to tango: Endothelial TGFβ/BMP signaling crosstalk with mechanobiology. Cells. 9 (9), 1965 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved