このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ショ ウジョウバエ・ ウーサイトにおける核移動
要約
ショウジョウバエでは、卵母細胞核は卵発生時に微小管依存性の移動を受ける。ここでは、卵室ex-vivoでライブイメージングを行うことで、移行に追随するために開発されたプロトコルについて説明します。私たちの手順は、スピニングディスク共焦点顕微鏡を使用してマルチポジション3Dタイムラプス映画を取得するために12時間生きている卵室を維持します。
要約
生細胞イメージングは、細胞内の細胞内の運動、細胞骨格の再編成、または極性のパターン形成を調節する細胞および分子メカニズムを理解するために特に必要です。卵母細胞核の位置決めを研究する際には、このプロセスの動的事象を捉えるためには、ライブイメージング技術が不可欠です。 ショウジョウバエ の卵室は多細胞構造であり、多数の遺伝的ツールの大きなサイズと可用性のために、この現象を研究するための優れたモデルシステムです。ショ ウジョウバエ 中発性の間に、核は卵母細胞内の中央位置から移行し、微小管生成力によって媒介される非対称的な位置を採用する。この核の移動および位置決めは、胚およびそれ以降の成体フライの極性軸を決定するために必要である。この移行の特徴の1つは、3次元(3D)で発生し、ライブイメージングの必要性を生み出すことである。このように、核移動を制御するメカニズムを研究するために、解剖された卵室を培養し、スピニングディスク共焦点顕微鏡を用いたタイムラプス取得により12時間のライブイメージングを行うプロトコルを開発しました。全体的に、我々の条件は、我々は長期間生きている ショウジョウバエ の卵室を維持することを可能にし、それによって核移動の完了を3Dの多数のサンプルで視覚化することを可能にする。
概要
数年前から、ショウジョウバエの卵母細胞は核移動を研究するモデルとして登場してきた。ショウジョウバエの卵母細胞は、卵室と呼ばれる多細胞構造で発達する。卵室は、卵胞体細胞の上皮層に囲まれた16個の生殖細胞(15個のナース細胞および卵母細胞)を包含する。卵室の発達は14段階(図1A)に細分化されており、その間に卵母細胞が成長し、胚の早期発達に必要な埋蔵量を蓄積する。開発中、母体決定因子の微小管再編成および非対称輸送時に、卵母細胞は前側側および側腹側の軸に沿って偏光する。これらの軸は、この卵母細胞1の受精に起因する胚および成体のその後の極性軸を決定する。卵発の間、核は卵母細胞で非対称的な位置を採用する。ステージ6では、核は細胞の中心となる。卵母細胞が受け取る後濾胞細胞によって発されるシグナルがまだ同定されていない時に、核はステージ7の前部と横形質膜の交点に向かって移動する(図1B)2、3。この非対称位置は、ドーソ側腹筋軸の決定を誘導するために必要である。
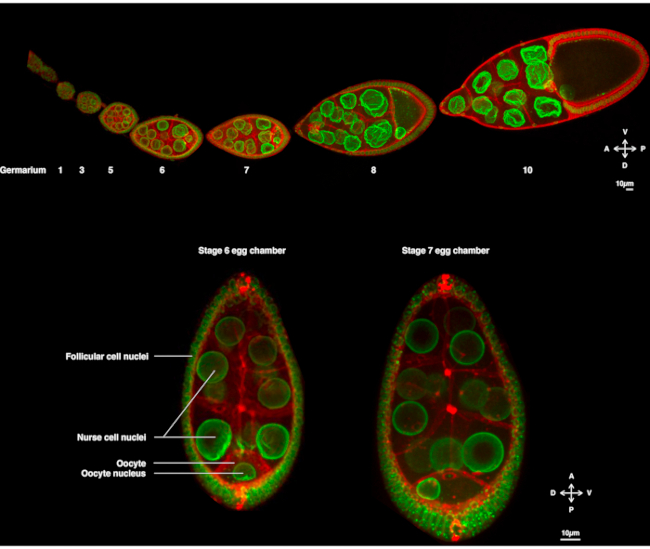
図1:ショウジョウバエメラノガスター卵室( A) 原形膜にラベルを付ける原子核エンベロープとubi-PH-RFPを標識するFs(2)Ket-GFPを発現するトランスジェニックハエから変性を固定した。ovarioleは異なった段階で発達する卵の部屋から成っている。成熟は、生殖幹細胞が存在する前先端(左)のゲルマリウムと後方先端(右)の古い段階で前部後軸に沿って増加する。(B) 卵子の中心となる卵発生の段階6(左)で円盤共焦点顕微鏡を紡ぐことによる生きている卵室のZ投影。核は、前細胞膜(卵母細胞とナース細胞の間)と横形の形質素子膜(卵子と卵胞細胞の間)に接触するステージ7(右)で非対称位置を採用するために移行する。この位置は、卵室の側側および、したがって、ドーソ腹側軸の決定を誘導する。この図の大きなバージョンを表示するには、ここをクリックしてください。
何十年もの間、この核移動は免疫染色によって固定組織に関して研究されてきた。このアプローチは、このプロセスが微小管4,5の密集したネットワークに依存していることを実証することを特に可能にしました。最近では、数時間の間に卵母細胞のライブイメージングと互換性のあるプロトコル提供条件を開発し、このプロセスを動的に研究することを可能にする6.
したがって、初めて、核が、前形質素膜(APM)に沿って1つ、卵母細胞の横形質素子膜(LPM)に沿って、その移動中に優遇および特徴的な軌道を有することを説明することができた(図2)。これらの最新の結果は、核移行などの動的プロセスを研究する際のライブイメージングプロトコルの重要性を強調している。
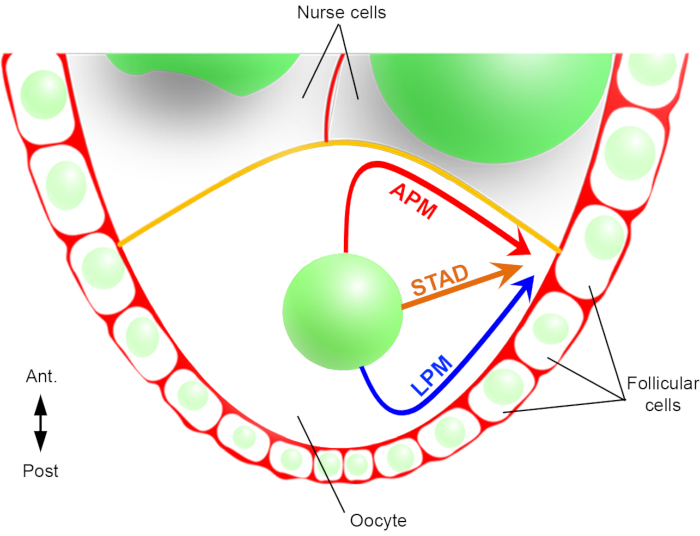
図2:核の異なる移動経路の概略図 卵発のステージ6では、卵母細胞は中心核を有する大細胞である。この段階では、前方の後方極軸は、濾胞細胞と接触する卵母細胞の後部/側面形質素子膜(黄色)が看護師細胞2と接触して設定される。我々は以前に、核が前形質素膜(APM)に沿って、側形形質素子膜(LPM)に沿って、または細胞質(STAD、前側の側側皮質にまっすぐ)を通って移動することができることを報告した。 この図の大きなバージョンを表示するには、ここをクリックしてください。
卵母細胞核の移行は約3時間6の現象であり、これまでのところ、実際の移行の開始を引き起こす事象は不明である。このメカニズムを研究するために使用されるタンパク質変異体によって、移行の開始も遅れることがある。これらの未知の変数は、長期間にわたって画像を取得する動機を与えました(10-12時間)。したがって、卵母細胞が生き続けることを保証することが重要です。卵の部屋が発達するにつれて、それは球形から楕円形に前部後軸に沿って伸びる。この伸びは、前部後方軸7に垂直な、ステージ1からステージ8に起こる濾胞細胞の回転によって駆動される。さらに、脈動性を有する筋肉の管状鞘が卵室を囲む。その生理学的機能は、発達中の卵胞を連続的に卵管に向かって押し出す8.解剖後に卵室の振動を誘発する動きを制限するために、高さ150μmの観測マイクロチャンバーを設計しました(図3A)。この高さは、ステージ 10 と 11 の卵胞のサイズよりもわずかに高くなります。卵室の回転を維持しながらサンプルの垂直方向の動きをかなり制限し、それによって卵胞の発生に欠陥が限定されます。次に、回転ディスク共焦点顕微鏡を用いて、多位タイムラプス取得により、解剖卵チャンバー上で12時間のライブイメージングを行います。ここでは、第6段階と第7段階の間の卵母細胞核移動を研究するためのプロトコルについて説明する。
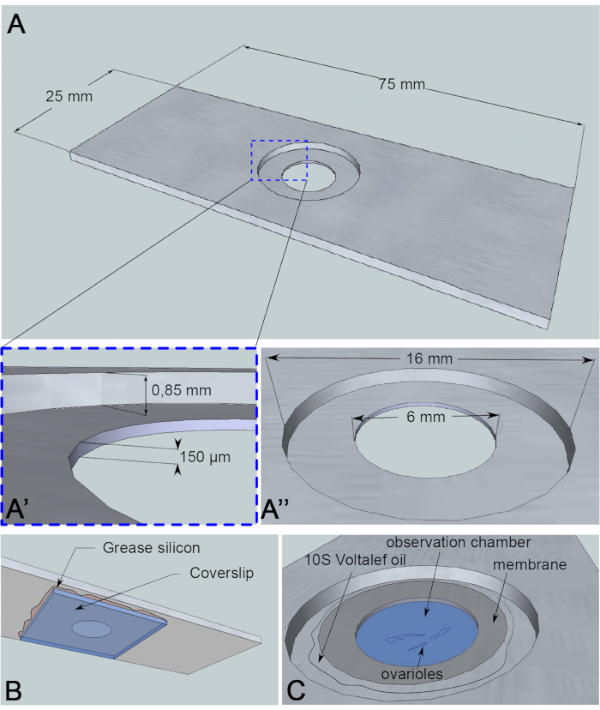
図3:観測室の模式図表(A)(上面図)スライドの中央に掘削されたウェルの高さ(A')と円周(A')を有するアルミニウムスライドの正確な寸法。(B)(下面図)ウェルをふさいでいるカバースリップは、シリコングリースでスライドに密封されます。(C)(上視)解剖された卵巣は、ガス透過膜で覆われたイメージング媒体で発生する。ハロカーボンオイルは、膜を安定化させるために使用されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
核移動に従い、卵母細胞の軌道を正確に評価するためには、核エンベロープと原形質膜の両方のマーカーが必要です。この目的により、高いシグナル/ノイズ比を持ち、ライブイメージングの過程でフェードしない2つの遺伝子が選択されました。細胞膜に標識するには、RFPに融合したヒトホスホリパーゼC∂1(PLC∂1)のプレクストリン相同性(PH)ドメインをコードするP[ubi-PH-RFP]の使用が推奨される。このPHドメインは、卵母細胞9の血漿膜に沿って分布するホスホイノシチドPI(4,5)P2に結合する。核エンベロープの場合、P[PPT-un1]Fs(2)GFPをコードする遺伝子内に挿入されたP[PPT-un1]Fs(2)Ket-GFPタンパクトラップ株は、均質で強烈なシグナル10を表示する。 若いハエ(1-2日齢)は、卵巣解剖の24〜48時間前に乾燥酵母を含む新鮮なバイアルに入れられます。
このライブイメージングアッセイでは、サンプルに対して反応性のない厚さ1mmのアルミニウムが顕微鏡スライドの寸法に切断されました。それは0.85 mmに反退屈されているスライドの中心に16のmmの直径の穴を有する。このカウンターボアには、深さ150 μmの直径6mmの穴が追加されています(図3A)。カバースリップは、アルミニウムチャンバーの底部にシリコーングリース(サンプル用不活性)で接着されています(図3B)。試料を培地充填ウェルに入れた後、O2/CO2交換に透過性の膜を培地上に置き、ハロカーボンオイルで囲む(図3C)。
解剖のために、それは0.05 x 0.02 mmの先端の次元、および0.20 mmの直径の針の卵巣子の分離のためのステンレス鋼の鉗子を使用することを推薦する(図4B、C)。移動核は、カメラを搭載した回転円盤共焦点反転顕微鏡CSU-X1上で画像化される。多位画像は24°Cで15分毎にタイムラプスで取得した。 15分間隔で、蛍光タンパク質の限定的な光漂白とサンプルの光毒性でマルチポジション取得を行うことができます。さらに、間隔を短くしても、核軌道に従う情報データはあまり提供されません。映画はフィジーソフトウェア11を介して処理され、分析されます。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. イメージング媒体製剤
- 使用当日に新鮮なメディアを準備します。シュナイダー培地のピペット200 μL(NaHCO3 のL-グルタミンおよび0.40 g/Lを含み、10%の熱不活性化胎児仔血清、100 U/mLのペニシリン、および100mg/mLのストレプトマイシンを補完した)。
- 30 μLのインスリン 10 mg/mL を補います。
- 熱不活性化胎児の子牛の血清の4 μLを加える。
2. 観測室の準備
- ピペットチップを使用して、穿刺されたスライドの下側の穴の周りに少量のシリコーングリースを塗布します(図4D)。
- 厚さ0.13~0.16mmの24 x 50 mmのカバースリップを配置します。
- ピペットチップの広い端で、カバースリップを密封し、スライドにシリコーンリング内部を作成するために、カバースリップに圧力をかけると(図4F、G)。
3. 卵巣解剖
- CO2パッド上の所望の表現型の雌のハエを麻酔する。
- 画像化媒体の150μLのメスを解剖井戸に移す(図4H)。
- 鉗子で胸郭をつかみ、2番目の鉗子で後部腹部のキューティクルをつまむことによって、1人の女性を開きます。
- キューティクルの開口部に容易に見えるはずの卵巣のペアを分離して取り外す。
- 子宮、卵管、筋鞘を慎重に取り除く(図4I)。
- 10~15μLの撮像媒体を1滴ずつ入れ、1つの卵巣を撮像チャンバーに移す(図4J,K)。
4. 卵チャンバーアイソレーション
- 卵巣を分離するには、卵巣の後端(古い段階に向かって)を針で保持する。別の針でゲルマリウムを慎重に引っ張って卵巣体を引き離します。
- 卵室に残りの筋肉鞘を取り除く;一方の針は鞘を保持し、もう一方は大きなチャンバー(ステージ9以上)を通して卵巣を引っ張る。
- 覆いの外に出たオヴァロルを沈め、カバースリップに接触させる。
- 鉗子の助けを借りてマイクロチャンバーから後期および卵巣の残りの部分を除去する。他の針で他の人から慎重に卵巣を離して、取得を容易にします(図4L)。
5. 観測室閉鎖
- 透過性膜の小さな正方形(10 x 10 mm)を切ります(図4M,N)。
- 画像媒体の上に膜を慎重に塗布して、気泡を排出する(図4O)。
- 膜の輪郭上のウェルの周りにハロカーボン油の薄い層でチャンバーを密閉する(図4P、Q)。
6. イメージング
- 40倍の目的(HCX PL Apo、1.25NA、油浸漬)を使用して、反転顕微鏡のスライドホルダーにイメージングセットアップを置きます。
- 核が移行する準備ができている異なるステージ6の卵母細胞の位置を見つけて保存します。
- 488および561 nmレーザーをセットアップします。150 mWの測定出力レーザーパワーで、レーザーパワーの30%、300 msと500 msの露光をそれぞれ使用します。
- 実験をセットアップします。1μmの間隔を核に中心にした15分-41セクションの間隔で12時間のタイムラプスを取ります。
注: 上記の露光時間に従って、この設定により、45 s の 1 つの位置を取得できます。位置の変更による遅延があるため、これらの条件では最大12ポジションを設定することをお勧めします。
7. 画像解析
- ソフトウェアフィジーでムービーを処理し、プラグイン直交ビューを使用して、手動で核を追跡します。

図4:ステップバイステップマイクロチャンバー取り付け写真。 (A,B,C)必要なツールの準備:井戸板、鉗子、針、画像媒体、ケイ素グリース、透過性膜、およびアルミニウムスライドを解剖する。(D) ピペットチップ付きアルミニウムスライド後部のシリコングリースの塗布。(E)ガラスカバースリップは、チャンバーの底部を作成するためにシリコングリースに接着されています。(F,G)ピペット先端の広い四肢を持つカバースリップに圧力適用し、チャンバー内にジョイントを作成します。(H,I)画像媒体におけるハエ卵巣の解剖。(J)マイクロチャンバ内の撮像媒体の滴下のピペッティング。(K,L)針を用いたマイクロチャンバ内の卵巣の分離。(M,N,O)透過性膜は10×10mmの正方形に切り、マイクロチャンバ内の媒体の滴の上に置く。(P,Q)マイクロチャンバーのハロカーボンオイルによるシーリング。サンプルをイメージする準備ができました。 この図の大きなバージョンを表示するには、ここをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
結果
移行前に、核は動的であり、移行前と定義された期間の中心位置の周りに振動します。これらの小さな動きは、卵母細胞の真ん中に平衡を維持する押しと引き力のバランスを反映しています。核の軌跡を定量化することで、APMとLPMの軌道の割合が同じであることを示しました。我々は、核と原形質膜6との間の最初の接触によって軌道の性質を定義する。したがって、核は、...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
他のプロトコルは、ショウジョウバエ卵室ex vivoを生画像アッセイ12,13に対して調製および培養する方法を説明する。このプロトコルの目新しさは、くり抜かれたアルミニウムスライド、カバースリップ、およびO2 /CO2透過膜を使用して構築されたイメージングチャンバーの使用である。このセットアップの主な利点は、サンプ...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは競合する利益を宣言しない。
謝辞
もともとプロトコルを開発し、図3のグラフィカルな要素を共有してくれたジャン=アントワンヌ・ルペサンとニコラ・ティソに非常に感謝しています。図4の写真を撮ったファニー・ローランド=ゴセリンに感謝します。また、この技術の改善に貢献した有益な議論と、この原稿の改善に役立ったナサニエル・ヘネマンのコメントに対する他の研究室メンバーに感謝します。我々は、フランスバイオイメージング(ANR-10-INBS-04)のメンバーであるジャック・モノド研究所のイマゴセイン・コア・ファシリティを認める。マエリス・ローは、フランス研究省(MESRI)の博士課程のフェローシップに支えられている。アントワン・ギシェとフレッド・バーナードは、ARC(グラントPJA20181208148)、アントレ・ル・ガン(グラント・ゲフルック2020#221366)、イデックス・ユニバーシクル・ド・パリ(ANR-18-IDEX-0001)の出現助成金によって支えられました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Anesthetize CO2 pad | Dutscher | 789060 | Anesthetize flies |
| Coverslip (24x50 mm) | Knittel Glass | VD12450Y100A | Observation-chamber preparation |
| Forceps Dumont #5 | Carl Roth | K342.1 | Dissection |
| Stainless steel needles | Entosphinx | 20 | Dissection |
| Heat-inactivated fetal calf serum | SIGMA-ALDRICH | F7524 | Imaging medium |
| Insulin solution bovine pancreas | SIGMA-ALDRICH | 10516 - 5ml | Imaging medium |
| Penicilin/Streptomycin solution | SIGMA-ALDRICH | P0781 | Imaging medium |
| Permeable membrane | Leica | 11521746 | Observation-chamber preparation |
| Schneider Medium | Pan Biotech | P04-91500 | Imaging medium |
| Silicon grease | BECKMAN COULTER | 335148 | Observation-chamber preparation |
| Spinning disk confocal | Zeiss | CSU-X1 | Nuclear migration observation |
| Voltalef oil 10S | VWR | 24627 - 188 | Observation-chamber preparation |
参考文献
- Merkle, J. A., Wittes, J., Schüpbach, T. Signaling between somatic follicle cells and the germline patterns the egg and embryo of Drosophila. Current Topics in Developmental Biology. 140, 55-86 (2020).
- Roth, S., Lynch, J. A. Symmetry breaking during drosophila oogenesis. Cold Spring Harbor Perspectives in Biology. 1 (2), 001891(2009).
- Bernard, F., Lepesant, J. -A., Guichet, A. Nucleus positioning within Drosophila egg chamber. Seminars in Cell and Developmental Biology. 82, 25-33 (2017).
- Koch, E. A., Spitzer, R. H. Multiple effects of colchicine on oogenesis in Drosophila: Induced sterility and switch of potential oocyte to nurse-cell developmental pathway. Cell and Tissue Research. 228 (1), 21-32 (1983).
- Januschke, J., et al. The centrosome-nucleus complex and microtubule organization in the Drosophila oocyte. Development. 133, Cambridge, England. 129-139 (2006).
- Tissot, N., et al. Distinct molecular cues ensure a robust microtubule-dependent nuclear positioning in the Drosophila oocyte. Nature Communications. 8, 15168(2017).
- Cetera, M., Horne-Badovinac, S. Round and round gets you somewhere: collective cell migration and planar polarity in elongating Drosophila egg chambers. Current Opinion in Genetics & Development. 32, 10-15 (2015).
- Hudson, A. M., Petrella, L. N., Tanaka, A. J., Cooley, L. Mononuclear muscle cells in Drosophila ovaries revealed by GFP protein traps. Developmental Biology. 314, 329-340 (2008).
- Gervais, L., Claret, S., Januschke, J., Roth, S., Guichet, A. PIP5K-dependent production of PIP2 sustains microtubule organization to establish polarized transport in the Drosophila oocyte. Development. 135 (23), 3829-3838 (2008).
- Villányi, Z., Debec, A., Timinszky, G., Tirián, L., Szabad, J. Long persistence of importin- b explains extended survival of cells and zygotes that lack the encoding gene ' n Villa. Mechanisms of Development. 3-4 (125), 196-206 (2008).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Prasad, M., Jang, A. C. C., Starz-Gaiano, M., Melani, M., Montell, D. J. A protocol for culturing drosophila melanogaster stage 9 egg chambers for live imaging. Nature Protocols. 2 (10), 2467-2473 (2007).
- Weil, T. T., Parton, R. M., Davis, I. Preparing individual Drosophila egg chambers for live imaging. Journal of Visualized Experiments: JoVE. (60), (2012).
- Chanet, S., Huynh, J. R. Collective cell sorting requires contractile cortical waves in germline cells. Current Biology. 30 (21), 4213-4226 (2020).
- Zhao, T., Graham, O. S., Raposo, A., St Johnston, D. Growing microtubules push the oocyte nucleus to polarize the drosophila dorsal-ventral axis. Science. 336 (6084), New York, N.Y. 999-1003 (2012).
- Legent, K., Tissot, N., Guichet, A. Chapter 7 Oogenesis using fixed and live imaging. Drosophila Oogenesis: Methods and Protocols. 1328, 99-112 (2015).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved