Method Article
交差神経移植手術のための脊髄前ルートを介した直接吻合のマウスモデル
* これらの著者は同等に貢献しました
要約
マウスの脊髄前経路を介した両側腕神経叢神経の直接吻合プロトコルを確立するための臨床手術のシミュレーションを行い、中枢神経系および末梢神経系損傷後の交差神経伝達時のリハビリテーションの根底にある神経メカニズムの研究に貢献しました。
要約
交差神経移植手術は、腕神経叢剥離損傷患者の損傷上肢を修復するための強力なアプローチです。最近では、この手術が脳損傷の臨床治療に独創的に応用され、麻痺した腕の実質的なリハビリテーションを達成しました。手術後のこの機能回復は、末梢感覚運動介入が脳損傷後の機能喪失を補うために深部神経可塑性を誘発することを示唆しています。しかし、その根底にある神経機構はよくわかっていません。したがって、創発的な臨床動物モデルが必要です。ここでは、マウスの脊髄前経路を介した両側腕神経叢神経の直接吻合のプロトコルを確立するために、臨床手術をシミュレートしました。神経解剖学的、電気生理学的、および行動学的実験により、これらのマウスの移植された神経が障害された前肢を正常に再神経支配し、脳損傷後の運動回復の促進に寄与することが確認されました。そこで、マウスモデルにより、中枢神経系および末梢神経系損傷後の交差神経伝達時のリハビリテーションの神経機構を明らかにしました。
概要
腕神経叢(BP)は、腕、手、指の感覚と動きをつかさどる異なる脊椎セグメント(C5-T1)を持つ5つの神経で構成されています。これら5つのBP神経が脊髄から出た後、それらは合流して3つの神経幹を形成します:上(C5とC6の合流によって形成される)、内側(C7から)、および下(C8とT1の枝)。特に交通事故による重傷は、BP神経根の剥離につながることが多く、そのような機能障害は患者に壊滅的な影響を及ぼします1。強力な臨床的アプローチとして、交差神経移植手術は、損傷した神経末端をBPの健康な側に再接続することにより、BPへの剥離損傷を修復するために行われてきました2,3。この手術により、負傷した手の機能が改善され、患者の両半球の感覚運動皮質が直接再編成されます4。動物実験では、交差神経伝達後に皮質回路の劇的な再編成が誘導されることが明らかになっています5。末梢感覚運動の修飾は、成熟した脳の休眠中の可塑性を再活性化することができるため、交差神経移植手術は、脳損傷の修復にも大きな可能性を秘めています6。
最近では、中枢神経系の問題に対する新しい末梢神経変化戦略として、交差神経伝達の独創的な利用の可能性を確認しました。交差神経移植手術の一種である対側頸部第7神経移植術(CC7)は、脳損傷後の患者の非麻痺側から麻痺側にC7神経を移すことにより、麻痺した腕の有意な機能回復を達成するために適用されました7。この外科手術のユニークな特徴は、麻痺した上肢の感覚信号と運動信号が、「左右交差」の変位神経を介して対病変半球に伝達されたことです。注目すべきことに、CC7手術によって引き起こされる機能回復は、C7神経自体によって神経支配される機能に限定されない8。また、CC7手術は、脳性麻痺の小児の治療だけでなく、中高年の脳卒中患者のリハビリテーションにも活用できます。したがって、交差神経伝達が神経可塑性を刺激し、末梢感覚運動系を調節することにより、脳損傷からの運動回復を加速できると信じる十分な理由があります。
交差神経移植手術は、腕神経叢損傷(BPI)と脳損傷の両方の臨床治療において実質的なリハビリテーションを達成していますが、この手術の根底にある神経メカニズムは十分に理解されていません。臨床的特徴を特徴とする適切な動物モデルの欠如は、内部メカニズムの研究を制限してきました。従来、診療所では、病変の反対側にあるC7神経根を神経移植片(尺骨神経、腓腹神経、伏在神経など)を介して損傷側に移植し、患部の腕神経叢(正中神経、C7根、下体幹など)と接続していました2,3,9。この手術の比較的新しい修正では、罹患していないC7根が脊髄前ルートを介して罹患したC7神経に隙間なく直接移動することが含まれ、最適な解決策が提案されています7。現在、マウスは細胞型の特異性と遺伝的系統の多様性において優位性を示しており、神経生理学的メカニズムの研究に適しています。そこで、マウスの脊髄前ルートを介した両側C7神経根の直接吻合のプロトコルを確立するために臨床手術をシミュレートし、交差神経伝達時のリハビリテーションの根底にある神経メカニズムの研究に貢献しました。
プロトコル
すべての動物実験は、復旦大学の実験動物施設管理委員会と中国科学院によって、国立衛生研究所のガイドラインに準拠して承認されました。8週齢の成体雄C57BL/6Nマウスを用いた。
1. 術前設定
- オートクレーブ滅菌された手術器具、機器、鎮痛薬、麻酔薬の適切な在庫を確保してください。
- 手術台に十分な作業スペースを確保してください。
- おむつで覆われたカスタマイズされた外科用フォームボードをマウスのベッドとして使用して、手術台を準備します。滅菌ガーゼで覆われた医療用テープで発泡スチロールボードに温熱パッドを固定します。
- 血管鉗子で鍼を曲げて半分に折り、折りたたんだ鍼の先端をフック状に曲げてリトラクターを作成します。鍼の先にゴム片を固定し、画鋲を使ってゴム片の端を発泡スチロールボードに固定します。
- 実体顕微鏡を校正します。適度な焦点距離の実体顕微鏡を選びましょう。ズーム/フォーカスボタンを滅菌アルミホイルで覆い、外科医が手術中に調整できるようにします。滅菌されたアルミホイルはズーム/フォーカスボタンに配置され、外科医は滅菌手袋を着用して使用することができました。
2. マウス麻酔と調製
- マウスの体重を量り、体重(イソフルラン3%)に対応する麻酔をかけます。麻酔の深さを確認するために、足の指間スペースをつまんだときにマウスが反応しないことを確認します。処置全体を通して、適切な麻酔の深さを維持する必要があります(1%イソフルラン)。.
- 手術中の角膜の刺激や乾燥を防ぐために、眼科用軟膏を両側に目に入れます。
- 自動バリカンで首と胸の毛を剃って手術部位を準備します。抜けた髪を取り除き、きれいにします。
- 滅菌ガーゼで覆われた保温パッドの上にマウスを仰臥位で置きます。操作中、マウスの温度を37°Cに維持します。マウスを医療用テープで固定し、前肢を水平に外転させ、後肢と尻尾が動かないようにします。適切な開口部を有する滅菌済み使い捨て外科用ドレープをマウス上に配置した。
3.手術手順
- 先制鎮痛剤としてトラマドールを注射します(20 mg / kg、i.p.)。.鎖骨の上端に横切開に印を付けます。ヨードフォア消毒液とエタノールを交互に3サイクルスクラブして、手術部位を消毒します。手術前につま先をつまんで麻酔の深さを確認してください。
- 顕微鏡下で作業し、滅菌メスを使用してマークに沿って4mmの横切開を行います。必要に応じて、処置中に切開を拡大します。
- 皮下筋膜を鈍く解剖し、顎下腺の下縁を特定します。顎下腺を上に引っ張って、鎖骨上窩と胸骨を露出させます。
注:この領域には小口径の血管がある可能性があります。電気焼灼は出血を止めるために使用することができます。 - 胸骨を中央線に沿って頭から尾まで切開することにより、胸骨の部分正中切開(~4 mm)を行います。胸骨切開術中に胸膜、心臓、血管を保護します。
- 胸骨舌骨筋を特定します。鍼で作られた2つの小さなカスタマイズされたリトラクターで胸骨を静かに引っ張り、気管と食道の上にある胸骨舌骨筋を特定します。この筋肉を引っ込めて、頸動脈、内頸静脈、横隔神経、迷走神経、気管、食道を露出させます。
注意: 胸骨を静かに引っ込めて、気胸の開放を防ぎます。ヒトとは異なり、マウスの食道は気管の後ろではなく、左側の気管に隣接しています。 - 左腕神経叢を特定します。左内頸静脈の外側縁で、筋膜と脂肪組織を外側に引っ張り、腕神経叢を露出させます。3つの枝を持つC5神経とC6神経で構成される上幹を探します。C7神経で構成される中体幹と、C8神経とT1神経で構成される下体幹を、マウスの尾部まで上体幹に沿って特定します。
注:腕神経叢の表面には縦方向の血管があります。出血を防ぐために電気焼灼を使用してください。左腕神経叢を分離するときは、乳瘻を避けるために乳糜管を保護します。 - 左C7神経を採取します。鎖骨下の臍帯間レベルまで中幹(C7神経)の前部分裂部と後部部を解剖し、神経幹への局所注入により0.1mLの2%リドカインでC7神経を遮断します。C7神経を外側索および後索との合流点でバンナスプリングハサミで切除します。各分割の長さが同じになるようにC7神経をトリミングします。
注:C7神経の前部と後部、および上体幹と下胴体の前後部は合流するまでに長い距離を走っているため、切除前にC7神経を十分に解放する必要があります。実際、C7神経は必ずしも2つの部門に分かれているわけではありません。まれに3つに分かれたり、4つに分かれたりすることもあります。 - 左のC6腹側椎弓を取り除きます。横隔神経を注意深く保護し、C6セグメントのレベルで前斜角筋を激しくして、C7神経根を露出させます。傍脊髄筋を神経支配しているC7神経の小さな枝をマイクロ鉗子で切ります。C7神経を静かに引き抜き、C6腹側椎弓を慎重に切除します。
注:左頸動脈の内側と食道の外側の間に骨の隆起があります。この骨の隆起は、第6頸椎 の腹側椎弓です。C6腹側層の外側縁の縦筋は前斜角筋であり、横隔神経は前斜角筋の表面を走っています。 - 右のC7神経を採取します。左側と同様に右側の前斜角筋を激しくし、椎間孔に近い右のC7神経根を切除します。右C7神経をその分裂レベルから解剖します。
注意: 神経の下の血管の損傷を防ぐために、右のC7神経を慎重に切断します。 - 左C7神経を移す。
- 両側の椎体の横にある筋長骨を部分的に除去します。気管食道と椎体の間の空間を鈍く分離して拡張します。
- 脊椎体の右側から脊椎前ルートを通って左側に半分の5-0ナイロン縫合糸を送ります。
- 左のC7神経を輸液チューブでつなぎ、脊髄前ルートを介して神経を右側に誘導します。
- 気管と食道を静かに引っ込め、12-0ナイロン縫合糸を使用して、緊張せずに左C7神経の前部と後部を右C7神経根に密着させます。神経の周りの神経上膜を4〜5針縫合して、神経を強く結集させます。
注意: 適切な厚さのプラスチック製輸液チューブを選択することが重要です。チューブが細すぎると神経が損傷する可能性があり、チューブが太すぎると気管と食道が損傷する可能性があります。また、気管食道と椎体の間の空間は「V」字型の空間であり、筋長鎖の一部を切断することで伝達経路を短くすることができます。
4.創傷閉鎖
- 滅菌の生理食塩水で傷口を灌漑し、滅菌ガーゼで乾燥させます。
- 胸骨を縫合し、5-0のモノフィラメント縫合糸を使用して皮膚を閉じます。
5.術後のケア
- マウスが麻酔から目覚めるのを待ちます。マウスを清潔なケージに移し、寝具は使用せず、温かい毛布で温めます。歩行可能になるまでマウスを観察します。術後鎮痛剤としてトラマドール(20mg / kg、i.p.)を使用します。.
- マウスを回復ケージに入れ、回復するまで監視します。手術後、マウスの水と食事を回復させます。術後、栄養失調、猫背、フリルの毛皮など、障害や感染の兆候がないか毎日マウスを監視します。手術後2週間で、抜糸が行われるはずです。
注:エリスロマイシン軟膏を創傷表面に毎日3日間連続して塗布します。. - 創傷浮腫などの合併症が観察された場合は、すぐに解決する必要があります。
6.行動分析
注:すべての行動テストと分析は、実験グループを知らされていない観察者によって行われました。
- シリンダーテスト
注:シリンダーテストは、手術後4週間および8週間後のシリンダー内の自発的な垂直探索中の前肢の使用を評価します21。- マウスを透明な円柱(直径9 cm、高さ15 cm)の高いフレームに置きます。
- 観察と記録を容易にするために、ミラーをシリンダーから45°の角度で固定します。
- 鏡の助けを借りて観察された各マウスの自発的な飼育を10分間記録します。
- (i)右足、(ii)左足、または(iii)両足がガラスの壁に接触した時間の長さを手動で決定します。各セッションで合計20の動きを数えます。テスト中にアクティブでないマウスを分析から除外します。
- テストのパフォーマンスを次のようにスコアリングします。
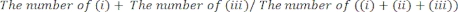
- グリッドウォーク試験
注:グリッドウォークテストは、手術後4週間と8週間の自発的な探索中に、グリッドの横線に前足を正確に配置することを評価します。22。- 25mm四方の穴の開いたワイヤーグリッド(20cm×24cm)にマウスを置き、ビデオカメラでパフォーマンスを記録しながら、10分間自由に探索させます。
- 次のいずれかの場合に足を滑らせます。
- 前足が横木を完全に逃した場合(この場合、手足が横木の間に落ち、動物はバランスを失います)。
- 前足が横木に正しく置かれているのに、体重を支えているときに滑り落ちる例を探します。
- テスト結果は、右前肢の足の滑り/足全体の滑りとして表します。シリンダーテストもグリッドウォークテストもトレーニングを必要としませんが、手術前に各動物を1回テストしてベースラインスコアを取得します。
結果
片側性脳損傷は、成人の代償性神経可塑性の限界により、対側肢の永久的な機能障害を引き起こすことがよくあります10,11。以前、CC7手術が脳損傷後の成人患者の片麻痺上肢の治療に使用できることを報告しました7。脊髄前ルートを介した直接吻合両側C7神経のプロトコルの有効性を評価するために、片側性外傷性脳損傷(TBI)後のマウスで交差神経移植手術を実施しました。 図1は、TBIの手順を説明し、損傷の範囲と影響を検証しています。まず、電気皮質挫傷インパクター(eCCI)を用いて、成体マウスの左半球の大脳皮質(前後=+1.0mm〜-2.0mm、正中径=0.5mm〜3.5mm)を損傷し、片側性脳損傷を負わせた。2週間後、解剖学的構造により、このTBIプロトコルは、運動を開始するための重要な場所である感覚運動皮質をほぼ破壊することが確認されました。片側性TBIのマウスは、右前肢に重大な運動障害を認めた。
図 2 は、CC7 の手順を示しています。CC7手術の経路図から、脊髄前経路を表す経路Aが他の経路と比較して最も短いアプローチであることが明らかになりました。経路Aの長さは、左側(非麻痺側)の採取されたC7神経の長さよりもさらに短い。この発見は、神経移植手術を完了するための脊髄前ルートを選択するための解剖学的基礎を提供しました。CC7手術は、TBI後2週間で脊髄前ルートを介した直接吻合で行われました。非麻痺側の頸部7(C7)神経は、本来の脳接続を行う代わりに、麻痺側に直接移動した。 図3 は、電子顕微鏡検査の結果、移植されたC7神経が正常に再生したことを明らかにしたものです。転移したC7神経のミエリン鞘の厚さは、CC7手術後4週間から徐々に増加し、CC7手術後8週間の対照群とほぼ同等であった。 図4 は、筋電図記録を用いて、転移したC7神経の筋再神経支配を同定したものである。C7神経吻合の近位端を電気的に刺激すると、術後4週間で患部前肢の複数の筋肉に安定的に活動電位が誘導され、電子顕微鏡検査の結果と一致しました。 図5 は、コレラ毒素サブユニットB(CTB)の逆行性標識により、移植されたC7神経には、腹角からの運動線維と、健康な側の脊髄C7セグメントの後根神経節からの感覚線維が含まれていることを示しています。
図6 は、マウスモデルが片側性TBI後に有意な運動回復を示したことを示しており、臨床試験の結果と一致しています。TBI後の損傷した運動機能の回復に対するCC7手術の効果を検証するために、TBI+偽群および対照+偽群が確立されました。TBI+偽群およびTBI+CC7群のマウスは、TBI傷害に対して同時に同じ処置を受けたが、対照+偽群のマウスは偽手術のみを受けた。TBI+CC7群のマウスは神経移植手術を受けたが、TBI+偽群および対照+偽群のマウスは両側頸部7(C7)神経切除を受けた。シリンダー試験では、TBI + CC7群は、CC7手術後4週間と8週間の両方で、TBI群よりも障害のある前肢の使用率が有意に高いことを示しました(p < 0.01)。グリッド歩行試験では、TBI + CC7群は、CC7手術後4週間でTBI群よりも低いエラー率を示しました。さらに、CC7手術後8週間の時点で、TBI+CC7群のエラー率はTBI群よりも有意に低かった(p < 0.05)。これらの行動結果は、CC7手術がTBIマウスの患肢の運動機能を改善できることを示しました。これらの結果を総合すると、CC7手術によって脊髄前ルートを介して再建されたC7神経が、損傷した前肢の再生と再神経支配に成功し、片側性TBIの成体マウスの運動回復に寄与したことが示唆された。
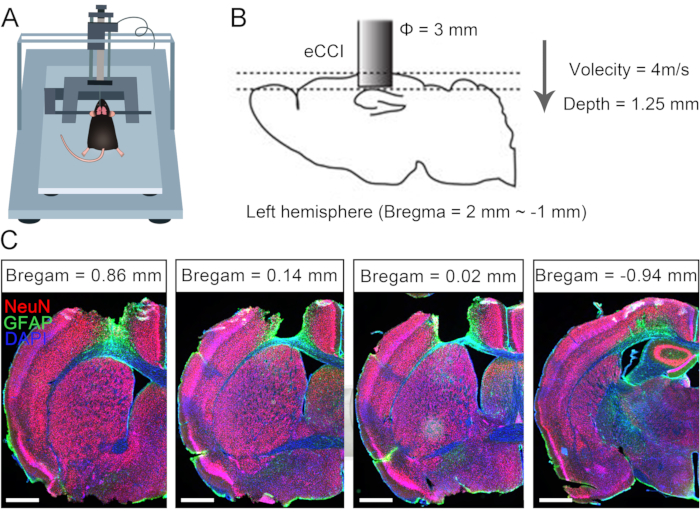
図1:片側性外傷性脳損傷の特性評価。 (A)eCCIにおけるマウスの位置を示す模式図。(B)eCCIのパラメータと損傷範囲。(C)病変皮質を示す代表的な冠状切片(TBIの2週間後、スケールバー= 500μm)。略語:eCCI = 電気皮質挫傷インパクター。 この図の拡大版をご覧になるには、ここをクリックしてください。
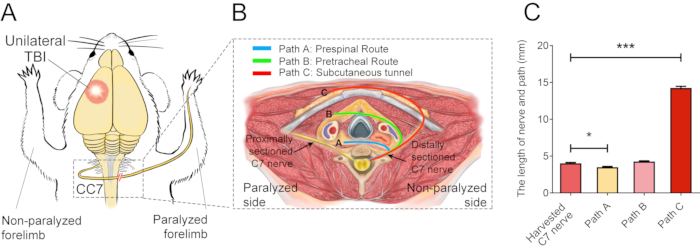
図2:外科用基本図。 (a)TBIマウスにおいて対側C7神経移植を行うための実験計画を示す模式図。赤丸は外傷の位置を示す。破線の長方形内の赤い二重スラッシュは、縫合された神経を示しています。(B)断面図は、マウスにおける対側C7神経伝達の3つの代替経路を示している。経路A、青い線は、移動した神経の脊髄前経路を示しています。経路B、緑色の線は、移動した神経の気管前経路を示しています。経路Cの赤い線は、移動した神経の皮下トンネルを描いています。(C)グラフは、(B)の経路の長さと採取されたC7神経を示しています。経路Aの長さ(3.3 ± 0.10 mm)は、採取されたC7神経の長さ(4.05 ± 0.11 mm;* p < 0.05、一元配置分散分析、各群でn = 20)よりも有意に短かった。経路Cの長さ(14.15 ± 0.20 mm)は、採取されたC7神経の長さよりも有意に長かった(*** p < 0.001、一元配置分散分析、各群でn = 20)。経路Bの長さは4.2±0.08mm(n=20)であった。 この図の拡大版をご覧になるには、ここをクリックしてください。
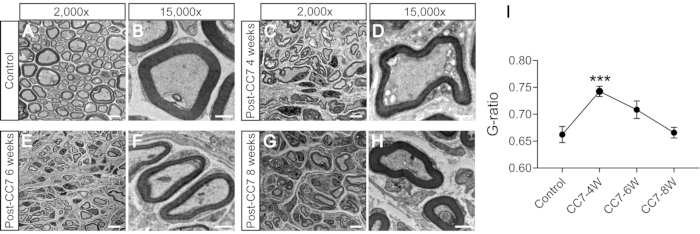
図3:神経の断面の電子顕微鏡分析。 (A,B) 対照マウスの神経の画像。スケールバー = 5 μm (A) および 1 μm (B)。(C、D)手術後1ヶ月で再生した神経の画像。スケールバー = 5 μm(C)および1 μm(D)。(E、F)術後5ヶ月のある時点で再生した神経の画像。スケールバー = 5 μm (E) および 1 μm (F)。(G、H)術後2ヶ月で再生した神経の画像。スケールバー = 5 μm (G) および 1 μm (H)。A、C、E、Gの倍率、2,000倍。B、D、F、Hの倍率、15,000倍。(I)G比(ミエリン鞘の内径と外径の比)は、対照群のサンプルでは4週間のサンプルよりも低く、術後6〜8週間のサンプルに等しくなります(***:p < 0.001;異なるグループの軸索でのt検定との比較、n = 各グループで3匹のマウス)。略語:CC7 =対側頸部第7神経移動;CC7-XW = 術後 X 週間。この図の拡大版をご覧になるには、ここをクリックしてください。
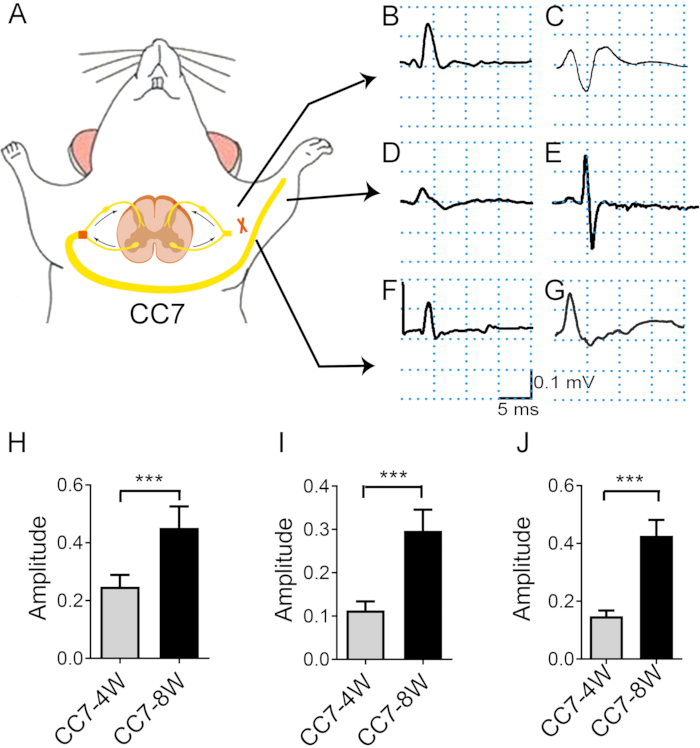
図4:対側のC7神経移植後の筋電図解析は、神経再生速度を示します。 (A)電子伝達刺激および 生体内 筋電図記録を示す模式図。刺激強度は試験全体を通して同じ(2mA)であった。刺激部位は、吻合部位に近位のC7神経である。(B、C)術後2週間(B)および4週間(C)に大胸筋に記録された活動電位を示す写真。(D、E)筋電図は、術後4週間(D)および8週間(E)に指伸筋に記録されました。(F)3週間で、CMAPは上腕三頭筋に出現しました。(G)4週目と8週目で、上腕三頭筋のCMAPが増加した。(H)大胸筋の平均振幅は、4週間で~0.25mV±0.16mVに達したのに対し、8週間で0.45mV±0.03mVに達し、2つの時点の間に有意差が見られた(***p<0.001、 t検定、各群でn=6)。(I)上腕三頭筋の平均振幅は、4週間で~0.15mV±0.01mVに達し、8週間で0.46mV±0.02mVに達し、2つの時点の間に有意差が見られました(***:p<0.001、 t検定、各群でn = 6)。(J)指伸筋の平均振幅は、4週間で~0.11mV±0.01mVに達したのに対し、8週間で0.29mV±0.02mVに達し、2つの時点の間に有意差が見られました(***:p<0.001、 t検定、各群でn=6)。略語:EMG =筋電図;CMAP = 複合筋活動電位。 この図の拡大版をご覧になるには、ここをクリックしてください。
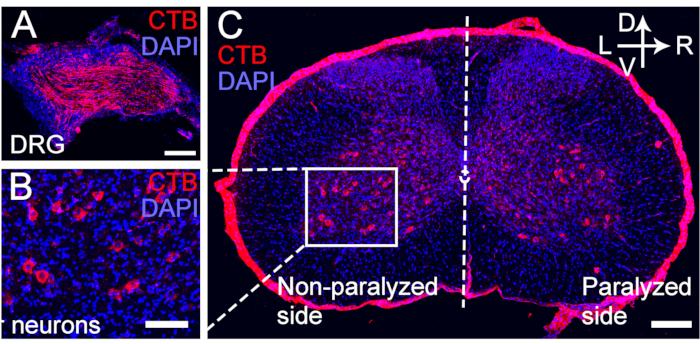
図5:転移したC7神経の運動ニューロンと感覚ニューロンのCTB逆行性標識。 (A-C) CTBは、CC7手術後4週間でC7神経吻合の遠位端に注射されました。(ア)感覚ニューロンはDRG用に標識されました。(B、C)転移したC7神経の運動ニューロンは、脊髄前角について標識された。倍率、20倍。スケールバー = 200 μm (A, B);100μm(C)です。略語:CTB =コレラ毒素サブユニットB;DRG =後根神経節;DAPI = 4',6-ジアミジノ-2-フェニルインドール。この図の拡大版をご覧になるには、ここをクリックしてください。
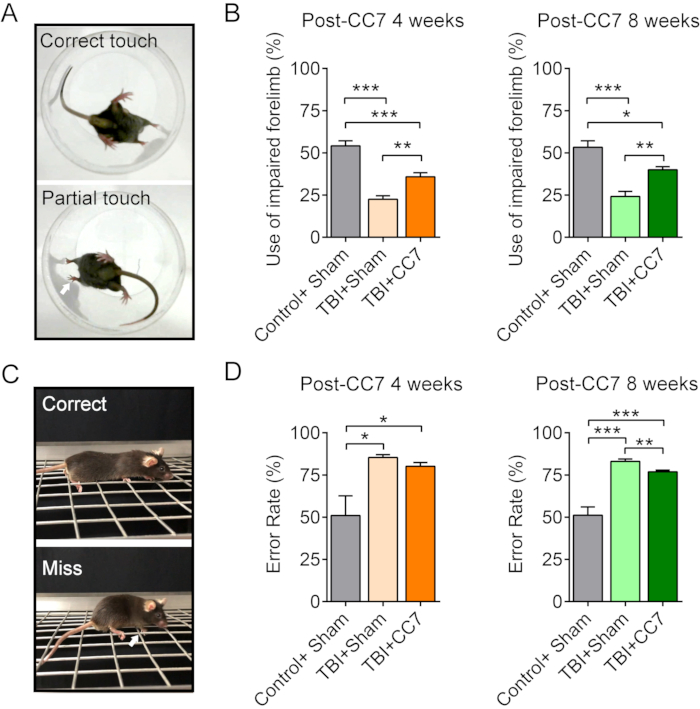
図6:CC7手術後の行動の変化。 (A)画像はマウスのシリンダーテストです。(B)TBIマウス(n=6匹のマウス)に対する手術後4週間および8週間後のCC7移植の効果を示す要約グラフ。p = 0.001;対応のない t検定。障害のある前肢の平均使用率は、対照+偽群で54.17%±3.01%であったのに対し、TBI+偽群では22.5%±2.14%であった。CC7手術後4週間±TBI+CC7群で35.83%2.39%であり、有意差が認められた(一元配置分散分析;p < 0.05、各群でn = 6)。CC7移行後8週間±、使用率は、対照+偽群、TBI+偽群、およびTBI+CC7群で、それぞれ53.33%3.80%、24.17%±3.01%、および40.00%±1.83%であり、有意差が認められました(*p < 0.05、一元配置分散分析、各群でn = 6)。(C)画像はグリッドウォークテストを示しています。(D)グラフは、TBI+偽群における前肢障害の平均過誤率が85.41%±1.59%(n=6)であり、TBI+CC7群の80.17%±2.19%(n=6)に等しく、対照+偽群(50.99%±11.69%)よりも高いことを示しています。術後8週間の時点で、TBI + CC7群の過誤率は76.87±1.07%(n = 6)であり、TBI+Sham群(83.06%±1.41%;p < 0.05、一元配置分散分析、各群でn = 6)よりも有意に低かった。略語:CC7 =対側頸部第7神経移動;TBI = 外傷性脳損傷。 この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
クリニックでは、交差神経移植手術が、腕神経叢剥離損傷の患者や、脳卒中やTBIなどの脳損傷後の患者の治療に使用されています7,9,12。特に、脳の損傷は、てんかん、脳ヘルニア、感染症など、いくつかの合併症を引き起こす可能性のある重篤な神経学的状態です13。片側性脳損傷のすべての患者がCC7手術に適しているわけではありません。一般に、CC7手術は、慢性期(受傷後6ヶ月)の中枢性片麻痺の患者さんに対して、脳浮腫の影響を極力避けるために行われてきました。脳損傷後の認知障害および四肢麻痺の患者は、CC7手術の治療から除外されます。
ほとんどの研究は、皮下アプローチと腓腹または尺骨神経移植片吻合を使用して、対側のC7神経根を移植することを報告しています14,15。しかし、このような方法による神経再生には6か月を要するため、運動回復プロセスが妨げられ、脳の可塑性に影響を与える可能性さえあります14。以前の研究では、対側C7転移がラットで行われ、両側C7神経は介在自家移植された腓腹神経の4本の鎖を介して使用されました。しかし、マウスの脊髄前経路を介したC7神経伝達の報告はありません。マウスに修正された脊髄前ルートのCC7手術を行い、C7神経移植後の機能回復速度を検証しました。この研究では、脊髄前ルートを介した対側C7神経移植は、神経移植動物モデルの回復期間の短縮を反映して、術後1か月で麻痺した四肢機能を改善しました。したがって、このモデルは臨床状況を正確にシミュレートし、さらなる実験の基礎を築くことができます。
神経根を解剖し、リスクを軽減する方法は、C7移植にとって不可欠な問題です。ヒトとは異なり、マウスの腕神経叢は鎖骨の下の胸部に位置しています5,16。したがって、C7神経および脊椎17の根根の観察を可能にするために、アクセス戦略を変更する必要があった。胸骨切開術は安全で効果的な手術アプローチであり、心臓胸部手術のマウス実験で一般的に適用されています18,19。C6腹側椎弓も神経移動の障害です。そこで、胸骨切開手術を行い、C7神経根を解剖し、C6腹側椎弓を切断して移動距離を短縮した。
脊髄前ルートは、神経移植手術の直接吻合の成功率を有意に高めることができるが、すべてのマウスが直接吻合できるわけではない。これは主に、これらのマウスの解剖学的な違いによるものです。中体幹(C7神経)は、椎間孔に非常に近い場所で上体幹または下体幹と合流します。したがって、採取に利用できるC7神経の長さは不十分です。現在、唯一のアプローチは神経移植またはマウスの置換です。このモデルは、通常、8週齢のマウス(20〜25 g)で採用されますが、これはマウスが成熟しており、C7神経が処理に十分なサイズであるためです。この手術プロトコルは若いマウスにも適用できますが、若いマウスでは手術の難易度が大幅に増加します。
TBI+CC7群のマウスの前肢運動機能は、1ヶ月と2ヶ月で有意に増加しており、転移したC7神経が障害前肢の回復に寄与していることが示唆された。再髄鞘形成は、機能的な神経回復に不可欠です。以前の研究では、損傷した神経のミエリン鞘が1か月後に再生することが示されており、これらの結果と一致しています20。ここで、転移した神経は徐々に成熟し、行動テストと一致しました。筋電図検査は、神経伝達後の機能回復率をさらにテストするために使用されました。その結果、移植された神経は手術後4週間で患部の筋肉を神経支配することが実証されました。特に、この研究は、交差神経移植手術後の直接吻合による再神経支配の時点を決定した最初の研究です。
要約すると、マウスの脊髄前経路を介した両側腕神経叢神経の直接吻合のプロトコルを確立するための臨床手術をシミュレートし、変位した神経の機能を確認しました。このマウスモデルは、中枢神経系および末梢神経系損傷後の交差神経伝達時のリハビリテーションの神経機構の解明に貢献しました。
開示事項
著者は、宣言すべき利益相反を持っていません。
謝辞
この研究は、中国国家自然科学基金会(82071406、81902296、81873766)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | KDL | K-20200808 | |
| 12-0 nylon sutures | Chenghe | 20082 | |
| 5-0 silk braided | MERSILK,ETHICON | QK312 | |
| 75% ethanol | GENERAL-REAGENT | P1762077 | |
| Acupuncture needle | Chengzhen | 190420 | Use for making retractors |
| Automatic clipper | Codos | CHC-332 | |
| C57BL/6N mice | SLAC laboratory (Shanghai) | C57BL/6Slac | |
| Electrocautery | Gutta Cutter | SD-GG01 | |
| Erythromycin ointment | Baiyunshan | H1007 | |
| Iodophor disinfection solution | Lionser | 20190220 | |
| Medical tape | Transpore,3M | 1527C-0 | |
| Micro needle holder | Chenghe | X006-202003 | |
| Micro-forceps | Chenghe | B001-201908 | |
| Micro-scissors | 66VT | 1911-2S276 | |
| Operating microscope | OLYMPUS | SZX7 | |
| Ophthalmic scissor | Chenghe | X041D1251 | |
| Pentobarbital sodium | Sigma | 20170608 | |
| Plastic infusion tube | KDL | C-20191225 | |
| Sterile normal saline | KL | L121021109 | |
| Vascular forceps | Jinzhong | J31020 | |
| Warming pad | RWD | 69027 |
参考文献
- Aszmann, O. C., et al. Bionic reconstruction to restore hand function after brachial plexus injury: a case series of three patients. Lancet. 385 (9983), 2183-2189 (2015).
- Gu, Y., Xu, J., Chen, L., Wang, H., Hu, S. Long term outcome of contralateral C7 transfer: a report of 32 cases. Chinese Medical Journal. 115 (6), 866-868 (2002).
- Gu, Y. D., et al. Long-term functional results of contralateral C7 transfer. Journal of Reconstructive Microsurgery. 14 (1), 57-59 (1998).
- Feng, J. T., et al. Brain functional network abnormality extends beyond the sensorimotor network in brachial plexus injury patients. Brain Imaging and Behavior. 10 (4), 1198-1205 (2016).
- Stephenson, J. B. t., Li, R., Yan, J. G., Hyde, J., Matloub, H. Transhemispheric cortical plasticity following contralateral C7 nerve transfer: a rat functional magnetic resonance imaging survival study. The Journal of Hand Surgery. 38 (3), 478-487 (2013).
- Hübener, M., Bonhoeffer, T. Neuronal plasticity: beyond the critical period. Cell. 159 (4), 727-737 (2014).
- Zheng, M. X., et al. Trial of contralateral seventh cervical nerve transfer for spastic arm paralysis. The New England Journal of Medicine. 378 (1), 22-34 (2018).
- Spinner, R. J., Shin, A. Y., Bishop, A. T. Rewiring to regain function in patients with spastic hemiplegia. The New England Journal of Medicine. 378 (1), 83-84 (2018).
- Hua, X. Y., et al. Contralateral peripheral neurotization for hemiplegic upper extremity after central neurologic injury. Neurosurgery. 76 (2), 187-195 (2015).
- Robertson, C. S., et al. Effect of erythropoietin and transfusion threshold on neurological recovery after traumatic brain injury: a randomized clinical trial. Journal of the American Medical Association. 312 (1), 36-47 (2014).
- Skolnick, B. E., et al. A clinical trial of progesterone for severe traumatic brain injury. The New England Journal of Medicine. 371 (26), 2467-2476 (2014).
- Wang, G. B., et al. Contralateral C7 to C7 nerve root transfer in reconstruction for treatment of total brachial plexus palsy: anatomical basis and preliminary clinical results. Journal of Neurosurgery. Spine. 29 (5), 491-499 (2018).
- Wilson, L., et al. The chronic and evolving neurological consequences of traumatic brain injury. The Lancet. Neurology. 16 (10), 813-825 (2017).
- Hua, X. Y., et al. Enhancement of contralesional motor control promotes locomotor recovery after unilateral brain lesion. Scientific Reports. 6, 18784 (2016).
- Hua, X. Y., et al. Interhemispheric functional reorganization after cross nerve transfer: via cortical or subcortical connectivity. Brain Research. 1471, 93-101 (2012).
- Pan, F., Wei, H. F., Chen, L., Gu, Y. D. Different functional reorganization of motor cortex after transfer of the contralateral C7 to different recipient nerves in young rats with total brachial plexus root avulsion. Neuroscience Letters. 531 (2), 188-192 (2012).
- Yamashita, H., et al. Restoration of contralateral representation in the mouse somatosensory cortex after crossing nerve transfer. PLoS One. 7 (4), 35676 (2012).
- Tavakoli, R., Nemska, S., Jamshidi, P., Gassmann, M., Frossard, N. Technique of minimally invasive transverse aortic constriction in mice for induction of left ventricular hypertrophy. Journal of Visualized Experiments: JoVE. (127), e56231 (2017).
- Melhem, M., et al. A Hydrogel construct and fibrin-based glue approach to deliver therapeutics in a murine myocardial infarction model. Journal of Visualized Experiments: JoVE. (100), e52562 (2015).
- Liu, B., et al. Myelin sheath structure and regeneration in peripheral nerve injury repair. Proceedings of the National Academy of Sciences of the United States of America. 116 (44), 22347-22352 (2019).
- Overman, J. J., et al. A role for ephrin-A5 in axonal sprouting, recovery, and activity-dependent plasticity after stroke. Proceedings of the National Academy of Sciences of the United States of America. 109 (33), 2230-2239 (2012).
- Yoshikawa, A., Nakamachi, T., Shibato, J., Rakwal, R., Shioda, S. Comprehensive analysis of neonatal versus adult unilateral decortication in a mouse model using behavioral, neuroanatomical, and DNA microarray approaches. International Journal of Molecular Sciences. 15 (12), 22492-22517 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved