Method Article
PCRプレートディープウェルマイクロプレートデバイスを用いた細菌バイオフィルムバイオマスの生成
要約
このプロトコルは、ハイスループットの96ウェルペッグ蓋静的バイオフィルムスクリーニングのための自己組織化ディープウェルPCRプレート装置を使用してバイオフィルム成長およびバイオマス測定を実行する方法論を提示する。
要約
細菌バイオフィルムは、従来の抗菌介入を用いて表面から根絶することは困難である。ハイスループット96ウェルマイクロプレート法は、最小バイオフィルム除菌濃度(MBEC)値を計算するための迅速な抗菌感受性試験のために、細菌バイオフィルムを培養するために頻繁に使用されます。標準的なバイオフィルムデバイスは、96ウェルマイクロプレートに取り付けられたポリスチレンペッグ蓋で構成され、バイオフィルムバイオマスおよびMBEC値の測定に最適ですが、これらのデバイスは、バイオマス蓄積およびコストのために利用可能なペグ表面積によって制限されます。ここでは、自己組織化ポリプロピレン96ウェルディープウェルPCRプレートペッグ蓋装置を使用して 、大腸菌 BW25113および 緑膿菌 PAO1バイオフィルムを増殖させるためのプロトコルを概説する。クリスタルバイオレットバイオマス染色およびMBEC測定アッセイを用いて、各種によって標準および深井戸装置上に形成された24時間バイオフィルムの比較が記載されている。ディープウェルデバイスのより大きな表面積は、両方の種による全体的なバイオフィルム形成を2〜4倍に増加させると予想された。 緑膿菌は、 標準的な装置と比較して、深い井戸ペグ上に有意に大きいバイオマス/ mm2 を形成した。 大腸菌 は、ディープウェル装置と比較して、標準的なポリスチレン装置でより大きなバイオマス/ mm2 を有していた。 次亜塩素酸ナトリウム(漂白剤)または塩化ベンザルコニウム(BZK)などの消毒剤を用いたバイオフィルム根絶アッセイは、両方の化合物が両方のデバイスから 大腸菌 および 緑膿菌 バイオフィルムを排除できるが、MBEC値が異なることを示した。BZKバイオフィルム根絶は、デバイス間で可変 の大腸菌 MBEC値をもたらしたが、漂白剤は種とデバイスの両方で再現可能なMBEC値を示した。この研究は、より多くの量の静的バイオフィルムを必要とする下流の研究のために、ポリプロピレンデバイス上で大量のバイオフィルムを成長させるための高スループットのディープウェル法を提供する。
概要
緑膿菌と大腸菌はグラム陰性プロテオバクテリアで、バイオフィルムとして知られる固着性の表面付着細胞群集を形成する能力について一般的に研究されています1。どちらの種も、バイオフィルムとして増殖すると、主に異なる多糖類およびタンパク質からなる細胞外高分子物質(EPS)のマトリックスを分泌することができ、それはまた、細胞外DNAおよび/または脂質を含むことができ、過酷な栄養制限された環境におけるさらなる細胞保護および増強された生存を提供する2,3。両種によるバイオフィルム生理学および形成は、カナダにおける病院患者の血液、尿路および肺感染症から最も一般的に単離された抗菌薬耐性病原体のトップ5を表すため、臨床的関連性を有する4,5。また、バイオフィルムは、これらの細菌種によって引き起こされるすべての慢性および再発性感染症のほぼ80%を占めると推定されていることに注意することも重要です6。分泌されたEPS物質と代謝活性の低下7,8のために、確立されたバイオフィルムは、移植された医療機器、瘢痕組織、および嚢胞性線維症患者の肺などの表面に形成されると根絶するのがより困難になり9,10、抗菌耐性が増す。
細菌バイオフィルムの反抗的な増殖特性は、しばしば抗菌阻害および/または根絶に対してより耐性を持たせる2,9。したがって、細菌バイオフィルムの抗菌除菌を研究するためのin vitro法を確立することは、感染が医療用プラスチック(例えば、居住用カテーテル)および医療用インプラント上に形成されるときに感染を根絶するのに有効な化合物を選択するために最も重要である。最も迅速なインビトロバイオフィルム抗菌除菌培養法は、バイオフィルム増殖を「連続」培養ではなく「静的」バイオフィルム培養として調べ、静的細菌増殖は、同じ増殖培地中での短い(24〜96時間)時間枠にわたってバイオフィルム形成の初期段階から後期段階で監視される。連続バイオフィルム法は、より少ない反復で成長培地の連続的な流れと交換を可能にするチャンバー内で成長したより長い時間枠にわたって評価されるバイオフィルム成長を必要とするため、迅速な分析には面倒です11。連続バイオフィルムの維持と確立に必要な時間と労力のために、静的in vitroバイオフィルムは、同時に試験された培養数を制限する精巧なフローチャンバーシステムではなく、プラスチック96ウェルマイクロタイタープレートでのハイスループット抗菌感受性試験アッセイに容易に適合するため、最も人気があります12,13.最も単純な静的「インウェル」バイオフィルムマイクロプレートアッセイは、標準的なポリスチレンまたはビニル(300μL容量)マイクロタイタープレートを使用して、各ウェルの側面および底部のバイオフィルム形成を測定し、多くの場合、空気と液体の表面界面のリングとして測定します。細菌のウェル内バイオフィルム形成は、増殖培地液体が除去され、バイオフィルムが洗浄された後、ウェルに付着した堆積バイオマスを染色することによって測定される12,13。これらのアッセイは経済的に人気がありますが、堆積したバイオフィルムは細胞回収およびバイオマス染色手順のためのすすぎ中に損傷または損失を起こしやすいため、その固有の設計のために再現性の問題がしばしばあります11,14。
バイオフィルム損失を低減するために、標準的な市販のバイオフィルムデバイスは、本明細書で「標準バイオフィルムデバイス」と呼ばれる標準96インウェルプレート設計に挿入可能な96ウェルペッグポリスチレン蓋を追加することによって、インウェルバイオフィルムマイクロプレート設計を改善した。ペッグされた蓋の添加は、各マイクロプレートウェルにおいて利用可能な表面積を拡大し、表面接着性の向上およびバイオフィルムバイオマス形成を可能にする15,16。標準的なバイオフィルムペッグ蓋装置は、ペッグされた蓋が薬物または成長条件の課題を含む新しいマイクロタイタープレートに挿入された場合、その後の抗菌バイオフィルム感受性および除菌試験のために、より大きなバイオフィルムの回収、除去、およびすすぎを可能にする。インウェルバイオフィルムマイクロプレート技術と同様に、除去および洗浄されたペッグ付き蓋デバイスから回収された材料は、典型的にはクリスタルバイオレット(CV)色素製剤17、18、19を含む細胞生存試験およびバイオフィルムバイオマス染色を可能にする。標準的なバイオフィルム装置は、バイオフィルム抗菌感受性のスクリーニングにも最適である。これらのアッセイは、2つの方法でバイオフィルム増殖阻害をモニターする:1)増殖開始時に抗菌剤が細胞に添加されると、最小バイオフィルム阻害濃度(MBIC)値を決定することができる。2)確立されたバイオフィルムが24時間後にペグ上に形成され、次いで抗菌剤に曝されると、最小バイオフィルム除菌濃度(MBEC)値17,20を決定することができる。インウェルバイオフィルムマイクロプレートデバイスと同様に、標準的なバイオフィルムデバイスには、デバイスあたりのコストが高いこと、オートクレーブできないこと、使用されるポリスチレンプレート材料のために化学溶媒に対する耐久性が低いことなど、いくつかの注目すべき制限があります。標準的なバイオフィルムデバイスはまた、表面積対ペグ比が低く、各ウェルの最大作業量を200μLに制限しています。これらの要因により、標準的なバイオフィルムデバイスを、ハイスループットフォーマットで大量のバイオフィルムを必要とする研究に使用するのをより困難にする可能性があります。
ここでは、標準プレートよりも深いウェルを有する96ウェルマイクロタイタープレートに取り付けた市販のポリプロピレンセミスカート0.5mL 96ウェルPCRプレートを用いて、当研究室で開発した静的バイオフィルムペッグ蓋96ウェル法について述べる(材料表)。これらの組み立てられた装置は、バイオフィルム(本明細書では「ディープウェルバイオフィルム装置」として知られる)を成長させるために使用される場合、750μLの最大作動量を有する。これらのディープウェルバイオフィルムデバイスを使用する利点は、標準的なバイオフィルムデバイスと比較して低コストであり、オートクレーブによって滅菌することができ、より大きな外部PCRプレート「チューブ/ペグ」上のバイオフィルム形成のための表面積を増加させる。この方法を用いて、我々は 、大腸菌 BW25113および 緑膿 菌PAO1によって形成されたバイオフィルムバイオマスを成長させ、特徴付けるためのこれらの装置の用途を示す。バイオフィルム根絶アッセイを用いてMBEC値を決定する方法は、第四級アンモニウム化合物消毒剤塩化ベンザルコニウム(BZK)および次亜塩素酸ナトリウム(漂白剤)抗菌剤を用いて記載されている。消毒剤BZKは、この化合物が汚染された表面からのバイオフィルムを阻害するために頻繁に使用されるため、選択されたが、十分に確立されたバイオフィルムを根絶するのにはあまり効果的ではないと報告されている21。漂白剤は、確立されたバイオフィルムの根絶に非常に効果的な化学物質であり、化学消毒 22の主力である。両方の消毒剤は、各バイオフィルムデバイス21についてのMBEC値の有用な比較を提供する。MBEC測定のためのCV染色およびバイオフィルム根絶アッセイを用いたこのバイオフィルムデバイス評価のためのプロトコルは、この記事に要約される。これらのメソッドのワークフローの概要を簡略化するためのプロトコル フローチャートが含まれています (図 1)。
プロトコル
バイオフィルム増殖のための無菌培養調製(Days 0-1)
- 0日目に、凍結保存されたストック(グリセロールまたはジメチルスルホキシド(DMSO)中)から、試験用の所望の細菌株を栄養寒天プレート上に直接ストリークし、株が必要とするように抗菌性を選択する。寒天プレートを、株の増殖に最適な温度(37°C)および時間(18〜22時間)でインキュベートする。
- 翌日(Day 1)に、寒天プレートからコロニーを5mLの成長培地に最適な生育条件で接種する。これらの培養物は、バイオフィルムデバイス用の2日目開始接種として使用される(ステップ2.2; 図1)。
注:この研究のために、 大腸菌 K-12 BW21153および 緑膿菌 PAO1を、ルリア・ベルタニ(LB)培地中で37°Cで18時間、毎分160回転(rpm)で振とうしながら増殖させた。- 少なくとも3つの独立して培養された株を調製して、固定された蓋デバイス上のバイオフィルムバイオマス形成の統計的変動性のために、バイオフィルム測定のための生物学的複製を生成する。
2. プレートの準備と接種(2日目)
- オートクレーブ処理された96ウェル、1.1 mL/ウェルのポリプロピレンプレートの外側のウェルに、750 μL/ウェルの滅菌水を入れます(図2A)。ネガティブコントロールウェル(未接種培地ウェル;カラムB)を750 μL成長培地で満たし、残りのウェルを675 μL成長培地で満たします。
注: 上記のステップ 2.1 および以下のステップには、ディープウェルバイオフィルムデバイスに適したボリュームがリストされています。標準的なバイオフィルム装置を使用する場合、体積は以下のように変更されるべきである:75μLの接種物培養物を20μLに;675 μLの成長培地を180 μLに;750 μLの滅菌水/増殖培地を200 μLに;さらに、以下のステップ3.6では、標準的なバイオフィルムデバイスマイクロプレートの使用時に混合した後、ポリスチレンマイクロプレートで500nm(A550nm)の吸光度を直接読み取ることができます。 - 1日目の一晩培養を使用して、培養物を600nm(OD600nm)=1.0の光学密度または0.5-1単位のマクファーランド規格に標準化する。
- 10-3希釈に達するまで、試験管または96ウェルディープウェルマイクロタイタープレートで各標準化培養物の10倍段階希釈を作成します。
- 図2Bに示すようにウェルを含む培地に75 μLの1 x 10-3希釈培養液を接種し、最終的に10-4のウェル内細菌希釈液を得た。
- オートクレーブ処理されたPCRプレート(ペッグ付き蓋)を接種したディープウェルプレートに慎重に挿入します。プレートを最適な株条件(37°C)で振とう(最大160rpm)しながら、湿度50〜60%のインキュベーター内で24時間インキュベートします。
3. CV染色を用いたデバイスからのバイオフィルムバイオマス測定(3日目)
- 各装置からバイオフィルムペッグ蓋を無菌的に取り外し、800 μLの滅菌リン酸緩衝生理食塩水(PBS)/ウェルで調製したオートクレーブ処理されたディープウェルプレートに30秒間挿入してすすぎ、プランクトン細胞を除去した。
- バイオマスCV染色の場合は、ペッグしたPCRプレートの蓋をdH2Oで800 μL/ウェル0.1%(w/v)CVで調製した新しいプレートに移し、5分間染色します。
- 800 μL/ウェルの滅菌PBSで調製したディープウェルプレートでペッグされた蓋をすすぐことによって余分な汚れを取り除きます。ペグが上を向いたバイオセーフティキャビネットでプレートを10分間乾燥させます。
- 乾燥したPCRプレートの蓋を800 μL/ウェルの30%(v/v)酢酸を含むプレートに移し、蓋を5分間脱染させます。
- 脱染したPCRペグの蓋を取り外し、ピペッティングによって溶液を十分に混合する。ディープウェルプレートから標準96ウェルマイクロプレートに200 μLを移し、紫外線(UV)/可視(Vis)範囲マイクロプレートリーダーで波長550nm(A550nm)の脱染色溶液の吸光度を測定します。
- 測定されたA550nm値を用いて、各バイオフィルム試料値から平均ブランク(陰性対照)A550nm値を差し引く。各ブランク減算したA550nmバイオフィルム試料値を平均し、生体複製した試料を表す。
4. 抗菌剤によるバイオフィルムの24時間抗菌MBEC値の計算に挑戦する(3日目)
- 試験する所望の最高抗菌濃度の2倍(2倍)濃度である水中の抗菌ストック溶液を調製する。
- 抗菌原液の 2 倍希釈系列を 2 倍の濃縮増殖培地で作成し、抗菌濃度が 8 回になるようにします。
- 図 2B に示すように、オートクレーブ処理されたディープウェルプレートの外側のウェルを 750 μL/ウェルの滅菌水で満たします。プレートのカラム B (陰性対照、無菌) および C (陽性対照、抗菌暴露なし) を 750 μL/ウェルの増殖培地で満たします。残りのウェルに、図 2B に示すように、抗菌希釈シリーズの 750 μL/ウェルを充填します。
- 手順 3.1 で説明したように、ペッグで固定された蓋を取り出してすすぎ、抗菌チャレンジ プレートに移します。
- プレートを振とう(最大160rpm)適切なひずみ条件で、所望の暴露時間枠でインキュベートします。
5. ペッグ蓋からのバイオフィルムバイオマスの回収(4日目)
- 抗菌性に露出したペッグ付き蓋を取り出し、ステップ3.1の説明に従ってすすいでください。ペッグした蓋を、内側のウェルに750 μL/ウェルの回収培地、外側のウェルに750 μL/ウェルの滅菌dH2Oを含む深いウェルプレートに移します。
- 70 mL の回収培地を調製するには、35 mL の 2x 濃縮 LB、0.7 mL の 100% tween-20、3.5 mL の 20x ユニバーサル中和溶液、および 30.8 mL の滅菌 dH2O を滅菌ボトルに混ぜ合わせます。
- 20倍の濃縮ユニバーサル中和溶液を調製するには、1.0gのL-ヒスチジン、1.0gのL-システイン、および2.0gの還元型グルタチオンを20mLのdH2Oの最終容量に加える。
- ステップ5.1の装置を超音波処理水浴の内部に取り付けられた二次ビンに入れる。デバイスを30分間超音波処理して、バイオフィルムをペグから回収媒体に除去します。
- 超音波処理後、ペッグされた蓋を取り外し、滅菌平板カバー蓋をディープウェル回収媒体プレートの上に置きます。ペッグされた蓋は捨てることができます。
- ステップ5.3からの回収培地と共にプレートを最適な株増殖条件で一晩(16〜18時間)インキュベートする。
6. デバイスMBEC値の決定(5日目)
- 翌日、ステップ5.4からインキュベートしたディープウェルプレートの各ウェルから200 μLを新しい96ウェルマイクロタイタープレートに移した。UV/Visレンジマイクロプレートリーダーを使用して各ウェルのOD600nm を読み取ります。
- 陰性対照(未接種ブランク)OD600nm 値を各バイオフィルム含有試料ウェルから差し引く。
- OD600nm値を使用して各サンプルのMBEC値を計算し、MBEC値は、特定の抗菌処理種/株サンプルについて最低OD600nm値(未接種対照と区別がつかない)をもたらした最低抗菌濃度です。
結果
この研究の目的は、ディープウェルバイオフィルムデバイスを使用して、より大きな体積、ハイスループット(96ウェル)、静的バイオフィルムデバイス測定を行う方法を提供することでした。ここでは、ディープウェルデバイスとして知られるディープウェルマイクロプレートに挿入された自己組織化セミスカートPCRプレートを、一般的に使用される標準的なバイオフィルムペッグ蓋デバイスと比較して、静的バイオフィルムを形成する能力を調べた。CV染色バイオマスおよびバイオフィルム根絶アッセイ(MBEC)を用いて、両方の装置によるバイオフィルム形成を評価した。
各装置上の異なる種によるバイオフィルム形成を比較するために、我々は、バイオフィルムCV染色プロトコル17を用いて、大腸菌BW25113および緑膿菌PAO1によって形成されたバイオフィルムバイオマスを評価した。CV染色は一般にA550nm値として報告されていますが、各デバイスの成長量と利用可能な表面積の違いにより、CV染色A550nm値を溶液中のモルCV濃度に変換しました。モルCV濃度は、各装置の体積差を説明し、各装置から回収されたバイオマスを表すCV濃度の比較を可能にした。結果は、両方の種が標準的なバイオフィルムデバイス(図3A-B)と比較して、ディープウェルバイオフィルムデバイス(2.1倍大腸菌;4.1倍緑膿菌)上で有意に多くのバイオマスを産生することを示した(図3A-B)。この結果は、標準装置ペグ表面積(108.9mm2)と比較して、ディープウェルPCRペグ(320.4mm2)の表面積が大きいことを考えると予想されました。この知見はまた、標準的なデバイスウェル(200μL)と比較して、ディープウェルバイオフィルムデバイスで使用される増加した体積(750μL)の増加と一致している。したがって、ディープウェルデバイスは、標準的なバイオフィルムデバイスを備えたより小さなペグと比較して、PCRチューブペグ上のバイオフィルムバイオマス蓄積を増加させた。
両バイオフィルムデバイスは、大腸菌および緑膿菌によって形成された生物学的に複製されたバイオフィルムを比較したときに再現可能なバイオフィルムを形成した(図3A−B)。ディープウェル装置で増殖したいずれの菌株についても、CV染色されたM A550nm値の技術的複製においてより大きな変動性が観察されたにもかかわらず、ペアワイズ二元分散分析(ANOVA)またはスチューデントのT検定(両方ともp >0.05)。この知見は、ディープウェルおよび標準デバイスによるバイオフィルム形成が再現可能なバイオフィルムを形成することを示している。しかし、CV染色の結果から、各装置のペグ表面積差を考慮したところ、大腸菌と緑膿菌によるバイオフィルムバイオマス形成はバイオマス蓄積に統計的に有意な差を示したことも示しました(表1)。大腸菌のペグ表面積(mm2)あたりの平均CV染色バイオマス(M)の計算により、ポリプロピレン製ディープウェル装置では、標準的なバイオフィルム装置と比較してバイオフィルム形成が1.5倍低いことが示されました(表1)。しかし、緑膿菌では反対の結果が得られ、標準的なバイオフィルム装置と比較して、ポリプロピレン製ディープウェル装置で1.4倍高いCV M/mm2が実証されました(表1)。各デバイスによるバイオフィルムバイオマス蓄積の種特異的な違いが観察されたにもかかわらず、ディープウェルデバイスは依然として、各種によるバイオフィルムバイオマス形成全体(2〜4倍の増加)を実証した(図3)。
ディープウェルバイオフィルムデバイスの抗菌感受性試験用途を決定するために、我々は、バイオフィルム根絶の可能性について、一般的に使用される2つの消毒剤、BZKおよび漂白剤を比較した。両方の化学物質は、臨床的および産業的用途において細菌バイオフィルムを防止(BZK)および/または根絶(漂白)するために一般的に使用されている21,22,23。各化合物を、標準およびディープウェルバイオフィルムデバイス上の大腸菌および緑膿菌によって形成されたバイオフィルムに2倍の濃度で添加した22,23(図1、2B)。陰性対照ウェルと区別がつかないOD600nm値をもたらしたBZKまたは漂白剤の最低濃度をMBEC値と定義した。標準的なバイオフィルム装置上に形成されたバイオフィルムを漂白剤で処理すると、大腸菌および緑膿菌について0.625%の同じ漂白MBEC値が得られた(表1、図4A−B)。ディープウェル装置上に形成された大腸菌および緑膿菌バイオフィルムについて決定された漂白剤MBEC値は、両種によって2〜4倍低いMBEC値を示した(大腸菌;0.156%;緑膿菌 0.313%)を標準装置と比較した場合(表1)。種間の漂白剤MBEC値の2倍の差がディープウェル装置で認められ、緑膿菌は大腸菌と比較してバイオフィルムを根絶するために2倍高い濃度の漂白剤を必要とした(図4A-B、表1)。ディープウェル装置における緑膿菌と大腸菌との間の2倍の漂白剤MBEC差は、大腸菌と比較して緑膿菌によるCV染色バイオマス形成の1.5倍の増加と逆相関しているようである(図3A-B)。 ディープウェルデバイスペグ上で緑膿菌によって形成されるバイオマスの量が多いことも、ディープウェル上の大腸菌と比較して、緑膿菌バイオフィルムを根絶するためにより高い漂白剤濃度が必要であった理由を説明するかもしれない(図3A-B、表1)。したがって、ディープウェルデバイスバイオフィルム根絶アッセイは、両方の種が漂白剤の影響を受けやすいが、標準的なデバイスと比較して低い(2〜4倍)漂白剤濃度であったことを示している。これは、ディープウェルデバイスPCRプレートペグの3倍大きいペグ表面積および体積と反比例する。このことは、漂白剤曝露の場合、バイオマス表面積が大きいほど、バイオフィルム根絶に必要な漂白剤濃度を低下させる可能性があることを示唆している。
BZKバイオフィルム根絶試験は、漂白剤の結果と比較した場合、各種によって回収された増殖(OD600nm値)およびMBEC値においてより大きな変動性を示した(図4C−D)。この変動性は、BZKが十分に確立されたバイオフィルムを根絶するよりもバイオフィルム形成の予防に効果的であることを示す以前の研究に基づいて予想外ではない24,25,26。標準的なバイオフィルム装置を用いて、BZKで処理した緑膿菌バイオフィルムのみが、ディープウェル装置においてこの株について得られたMBEC値(20480μg/mL)よりも8倍低い一貫したMBEC値(2560μg/mL)を示した(表1、図4C)。これらの結果は、標準的な装置ペグと比較した場合、深くよく固定された表面およびプラスチック組成物上に形成される緑膿菌バイオマスの量の違いを反映し得る。ディープウェルと標準デバイスの両方で大腸菌によって形成されたバイオフィルムのBZK根絶は同等に貧弱であり、ディープウェルデバイスでは2560-40960μg/mL、標準デバイスでは320-10240μg/mLの広範囲のBZK MBEC値が得られました(図4D)。大腸菌の場合、この変動性は、1〜2個の複製ウェルが回収培地において低いが統計的に有意な成長を示し、いずれの装置でも誤差が増加し、BZK MBEC決定精度が低下した時折の事例によって説明された(図4D、表1)。この変動性は、以前に研究で指摘されたように、大腸菌バイオフィルムを根絶する際にBZKを使用することの非有効性を強調している24,25,26。対照的に、緑膿菌バイオフィルムは、両方の装置で定義された濃度でBZKによって確実に根絶することができたが、8倍のBZK濃度差を有する(図4C)。要約すると、緑膿菌によって形成されたバイオフィルムのBZK除菌MBEC値は、各装置で別個のMBEC値を示すが、しかしながら、両装置は、大腸菌の正確なBZK除菌表現型を区別するのに等しく劣っている。
したがって、本明細書に記載のディープウェルバイオフィルムデバイス法は、標準的なバイオフィルムデバイスと比較した場合、再現性のあるバイオフィルムを形成するのに同様に有効である。

図1.実験の概略概要。 凍結保存ストックからの単一コロニーの0日目の単離;単一コロニーによる成長培地の1日目接種;バイオフィルムプレートの2日目接種;3日目CV染色または抗菌チャレンジ;4日目バイオフィルム回収媒体への超音波処理;5日目に回収プレートのOD600nmを読み取ってMBEC値を求めた。セルヴィエ・メディカル・アート(smart.servier.com)が提供する図のいくつかの画像。 この図の拡大版を表示するには、ここをクリックしてください。

図2.プロトコルのさまざまなステップについて示されたプレートレイアウトの例。A) 2つの細菌株(大腸菌 および 緑膿菌)からの1日目の細菌培養物を使用して、それぞれ3つの生物学的複製を有する最初の24時間バイオフィルム増殖のための最終プレートセットアップ。陰性対照ウェル(灰色)は、滅菌対照(細菌無添加)として使用される。 B) バイオフィルムの抗菌性チャレンジのためのプレートセットアップ。色が濃くなると、抗菌濃度が増加することを示します。陰性対照は細菌を添加していない井戸(灰色)であり、陽性対照は抗菌暴露のないバイオフィルム(オレンジ色)である。パネルAから採取したバイオフィルムペグ蓋は、抗菌暴露のためにこの深いウェルプレートに移されます。 この図の拡大版を表示するには、ここをクリックしてください。
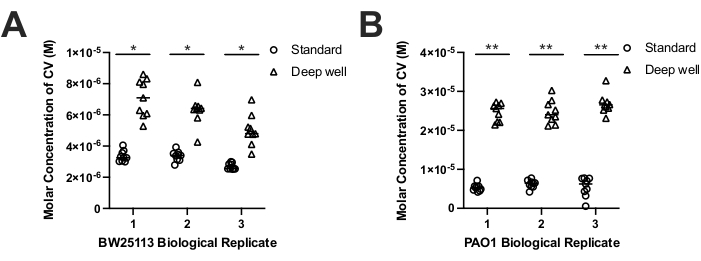
図3.CV染色した大腸菌BW25113のモル濃度(M)である。(A)および緑膿菌PAO1(B)バイオフィルムバイオマスは、標準(円)およびディープウェル(三角形)装置から回収される。CV染色は、550nm(A550nm)におけるCVの吸光度を読み取ることによって測定し、深いウェルA550nmの測定値は、デバイス間の体積差を説明するために3.809(800μL/210μL)の係数で調整した。CVモル濃度(M)は、ビール・ランバートの法則(CV濃度=A550nm/εl)によって決定した。ここで、96ウェル平底マイクロタイタープレートにおける210μLの経路長(l)は0.56cmであり、251500cm-1M-139のA550nmにおける水中でのCVの吸光係数(ε)を決定した。結果は、バイオフィルムとして増殖した各株の3つの生物学的反復からの9つの技術的反復を表し、各生物学的複製物の中央値は、各プロットにおいて水平バーとして示されている。装置間のバイオマスの統計的に有意な差を、両側対応t検定を用いて生物学的複製中央値間で決定した(大腸菌p=0.008-0.018(*);P. 緑膿菌 p= 0.002-0.009 (**)) をアスタリスクの付いたバーで示す。この図の拡大版を表示するには、ここをクリックしてください。
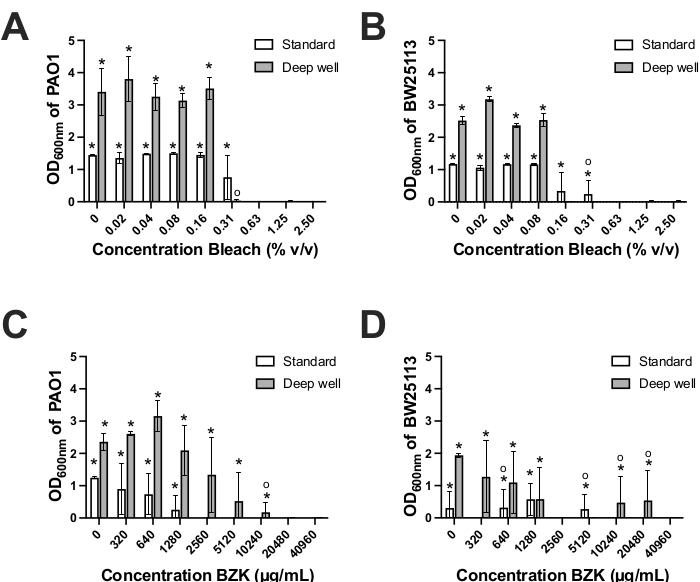
図4.抗菌MBEC濃度の測定。緑膿菌PAO1(A,C)および大腸菌BW25113(B,D)に対する漂白剤(A,B)およびBZK(C,D)に対する抗菌MBEC濃度の測定は、標準(白いバー)およびディープウェル(灰色のバー)バイオフィルムペッグ装置で増殖させた場合。結果は、回収培地への超音波処理および一晩インキュベーション後に回収されたバイオフィルムのOD600nmの読み取りによって決定された。ディープウェルOD600nmは、デバイス間の体積差を考慮して3.75倍(750 μL / 210 μL)で調整されました。結果は、3つの生物学的反復の代表であり、エラーバーは、各抗菌濃度における反復間の標準偏差を示す39。各棒グラフの上のアスタリスク(*)は、両側スチューデントのT検定計算を使用して、p値が0.05<ブランク対照からのOD600nm値の統計的に有意な差を示しています。各棒グラフの上の円記号(o)は、ブランク対照から統計的に有意なOD600nm値を有していた反復が1回または2回のみであった測定値を示す。この図の拡大版を表示するには、ここをクリックしてください。
| BZK MBEC (μg/mL) | 漂白剤 MBEC (% v/v) | |||
| ひずみ試験済み | ディープウェル装置 | 標準デバイス | ディープウェル装置 | 標準デバイス |
| 大腸菌 BW25113 · | 2560-40960 | 320-10240 | 0.156 | 0.625 |
| 緑膿菌 パオ1 | 20480 | 2560 | 0.313 | 0.625 |
| ディープウェル装置 | 標準デバイス | p値** | 折りたたみ交換(ディープウェル/スタンダード) | |
| ひずみ試験済み | 平均CV M*/mm2 ± SD | 平均CV M*/mm2 ± SD | ||
| 大腸菌 BW25113 · | 1.99 x 10-8 ± 3.25 x10-9 | 3.03 X 10-8 ± 3.31 X 10-9 | 0.0176 | -1.52 |
| 緑膿菌 パオ1 | 8.01 X 10〜8 ± 9.42 X 10〜9 | 5.72 x 10-8 ± 9.42 x 10-9 | 0.034 | 1.4 |
表 1. 大腸菌 BW25113および 緑膿 菌PAO1の要約は、様々な装置上のBZKおよび漂白剤のCV染色バイオマスM/mm2 値およびバイオフィルム除菌MBEC値を意味する。
*生物学的複製CV M値の中央値を用いて算出した平均CV M/mm2値は、CV M値を複製します(図3)。
**p値は両側スチューデントのT検定を使用して決定されました。
ディスカッション
この研究は、バイオフィルム形成のためにセミスカートPCRプレート蓋を取り付けたポリプロピレン製ディープウェルマイクロプレート(ディープウェルバイオフィルムデバイス;材料表)。この装置で生成したバイオフィルムを、市販のポリスチレン標準バイオフィルム装置と比較した(材料表)。ディープウェルデバイス法は、標準デバイスと同じ方法論的ステップと溶液を使用し17をディープウェルデバイス用に修正された調整された体積で使用し、このデバイスを大規模なバイオフィルム形成および実験分析に理想的にします。バイオフィルムを形成することが知られている2つのグラム陰性種である大腸菌BW25113および緑膿菌PAO1の増殖を、両方の装置を用いてバイオマス形成および消毒剤(BZK/漂白剤)MBEC値について調べた。各装置からのペグ上に形成されたCV染色バイオマスの比較は、大腸菌および緑膿菌の両方が、標準装置と比較した場合、ディープウェルバイオフィルム装置上により高いバイオマスを有するバイオフィルムを形成することを示した(図3A−B)。バイオフィルムバイオマスの増加は、標準的な装置ペグ表面積と比較した場合、ディープウェルペグのより大きな表面積を反映した。両装置でペグ表面積(mm2)の違いを考慮すると、バイオマス形成の違いが認められ、大腸菌は、ディープウェル装置のPCRチューブペグよりもポリスチレン標準装置ペグ上でmm2当たりのCVバイオマスを有意に多く形成した(表1)。緑膿菌は、標準的な装置と比較して、より大きなCV染色バイオマス/ペグmm2を形成した(表1)。この新知見は、異なるデバイス上のバイオフィルムバイオマス形成における種特異的な違いを浮き彫りにする可能性がある。
ディープウェル装置上の大腸菌および緑膿菌バイオフィルムの漂白剤除菌は、標準装置よりも2〜4倍低い濃度で起こったことに留意されたい(図4A−B、表1)。各デバイスから特定された漂白剤MBEC値の違いは、デバイスのペグ形状の違い(ディープウェルの「ペグ」はテーパチューブで標準ペグは円筒形)、プラスチック組成の違い(ポリプロピレン対ポリスチレン)、および体積の違い(750μL対200μL)によって影響を受ける可能性があります。例えば、緑膿菌は、標準的な装置と比較して、ディープウェル装置ペグ上でCV Mバイオマス/ mm2が大きかったが、大腸菌は深井戸ペグ上でバイオマス少なかった(図3)。これは、バイオフィルム根絶に必要な消毒剤濃度が、各種によって形成されるバイオマスおよび利用可能な表面積によって影響を受ける可能性があることを示唆している。さらに、装置ペグ形状の違いは、特定の種についての様々な成長条件に影響を与え得る。我々の研究では、緑膿菌は、通性嫌気性菌である大腸菌とは対照的に、この種が義務的なエアロベであるため、そのより大きな表面積および曝気のために、深い井戸ペグ上により大きなバイオマスを形成する可能性がある。今日まで、ポリプロピレン27、28、29およびポリスチレン30,31材料の両方について、大腸菌および緑膿菌バイオフィルム形成を直接比較した公表された研究は同定されていない。しかし、堅牢な大腸菌および緑膿菌バイオフィルム形成の報告は、ポリプロピレンまたはポリスチレン材料のいずれかを調べる独立した研究において注目されている。シュードモナスに関しては、多くのシュードモナス属は、ポリプロピレンなどのプラスチックを潜在的な炭素源として使用することができる32。したがって、このポリプロピレン製ディープウェルバイオフィルム装置の入手可能性は、静的バイオフィルム研究において有用な進歩である。ポリプロピレンはポリスチレンよりも化学的に耐久性があり、ヘルニアや骨盤手術のための医療用インプラント、縫合糸、メッシュに頻繁に使用されるため、臨床的に関連する材料です33,34。
バイオフィルムバイオマスは両方の装置によって形成されたが、ディープウェル装置は、漂白剤およびBZKに対するCV染色法およびOD600nmバイオフィルム除菌MBEC値に基づくバイオマスの変動性がわずかに高かった。これは、3つの主な要因によって説明することができます:1)ディープウェルデバイスは、標準デバイスペグと比較して角度が付いた標準デバイスよりもペグ表面積が大きい。2)試験された両方の種は、各装置のポリプロピレンおよびポリスチレン材料に接着する異なる能力を有し得る。3)各装置で使用される増殖培地の量(ウェルの深さ750 μL、標準で200 μL)および挿入されたペグとウェル側壁との間の間隔が異なる。これらの問題は、すべてのバイオフィルム実験に1種類のデバイスしか使用されていない場合は問題ではありませんが、両方のデバイスが選択されている場合は、ここで行った比較を実行して違いを特定する必要があります36,37。各デバイスで使用されるプラスチック材料の違いにより、CV染色されたバイオフィルムバイオマスおよびMBEC値は、異なるデバイス間で直接比較されるべきではない。しかし、方法と実験が同じ装置(ディープウェルまたは標準)で行われた場合、試験された種および抗菌剤について得られた結果は同等である。
このプロトコルは、自己組織化ディープウェルPCRプレート装置が、バイオフィルムの形成および根絶を測定するための大容量バイオフィルム装置であり、費用対効果も高いことを示している。コストの観点から見ると、96個のペッグされた蓋を備えた標準的なバイオフィルムデバイスは、デバイスあたり$ 29-36米ドル(USD)で販売されています(材料表)。ポリスチレン標準バイオフィルムデバイスはオートクレーブ可能ではなく、そのプラスチック化学的特性のために溶媒/酸に対する耐性が低い。本明細書に記載される自己組織化ポリプロピレン製ディープウェルプレートは、別個の半スカート付き96ウェルPCRプレート(材料表)を取り付け、組み立てられたデバイスあたり合計14米ドルの費用がかかり、これは標準的なバイオフィルムデバイスコストの半分である。価格は、地域、ディストリビューター、および可用性、および機関割引が$ 9 USD /ディープウェルデバイスに機能した後のコストによって異なる場合があります。これらの自己組織化ディープウェルポリプロピレンPCRプレートデバイスは、滅菌のためにオートクレーブ可能であるという追加の利点を有し、標準的なデバイスよりも2〜4倍のバイオフィルムバイオマスを提供する。
結論として、このプロトコルと、ディープウェルデバイスと標準的なバイオフィルムデバイスのバイオフィルム増殖比較からの代表的な知見は、両方のデバイスが細菌バイオフィルムを培養することができるが、ディープウェルデバイスは2〜4倍のバイオフィルムを形成することを示している。ディープウェルバイオフィルムデバイスは、薬物感受性スクリーニング研究などの大容量ハイスループットバイオフィルム形成実験のための実行可能で手頃な価格の代替手段を提供します。この技術は、分析のために大量のバイオフィルム材料を必要とする可能性のある下流の「-omics」抽出(プロテオミック、メタボロミック、トランスクリプトミクス)または実験アッセイ(酵素的、蛍光的)に有用なバイオフィルムを生成する可能性がある。ディープウェルバイオフィルムデバイスは、臨床的に関連性のある低コスト、大容量、化学的に耐久性のあるプラスチック材料を使用して、ハイスループット96ウェルアッセイでバイオフィルムを研究したいラボに推奨されます。
開示事項
著者らは開示する余地がない。
謝辞
この研究のための資金は、カナダ自然科学工学研究評議会ディスカバリーグラント(RGPIN-2016-05891)からDCBへの運営助成金と、カナダ政府ゲノミクス研究開発イニシアチブグラント(GRDI)プログラム(GRDI7 2254557)からMRMとGRGへの運営助成金によって提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 10 mL serological pipets, individ wrap paper/plastic (200/CS) | Fisher Scientific | 13-678-11F | disposable serological pipettes for aseptic media/ culture transfer |
| 2 mL serological pipets, individ wrap paper/plastic, 500/CS | Fisher Scientific | 13-678-11C | disposable serological pipettes for aseptic media/ culture transfer |
| Axygen Aerosol Filter Tips, Sterile, 5 racks/ PK, 1000 tips/rack | Fisher Scientific | 14-222-766 | sterile pipettor tips for media aliquoting |
| Axygen deep well storage microplates, round wells, 1.1 mL cap, 5/PK, P-DW-11-C | Fisher Scientific | P-DW-11-C | microplate for 96 well deepwell device biofilm cultivation |
| Axygen Filter tips, 350 µL tips racked, 96/rack, 10 racks, low retention barrier tips | Fisher Scientific | TF-350-L-R-S | sterile pipettor tips for media aliquoting |
| Basin/reservoir natural PS 50 mL, Sterile, 5/bag, 40 bags, CS200 | Avantor/ VWR | 89094-676 | sterile basins/ reservoirs for microplate preparation |
| BD Difco Dehydrated Culture Media: Granulated Agar, 500 g | Fisher Scientific | DF0145-17-0 | materials for LB agar preparation |
| Biotek Synergy Neo2 multimode plate reader | Biotek | NEO2MB | microplate UV/Vis region plate reader |
| Branson M3800 Ultrasonic Bath, 117 V | Avantor/ VWR | CPX-952-316R | sonicating water bath |
| crystal violet (CV), ACS grade, 100 g | Fisher Scientific | C581-100 | biofilm biomass stain |
| Dimethyl sulfoxide (DMSO), 1 L, ACS grade 99.9%, poly bottle, BDH | Avantor/ VWR | CABDH1115-1LP | media components for cryopreservation |
| Easypet 3, pipet controller | Avantor/ VWR | CA11027-980 | serological pipettor for aseptic media/ culture transfer |
| Eppendorf Research Plus 8 multi-channel pipettor , 10-100 µL | Avantor/ VWR | CA89125-338 | multichannel pipettes for aseptic media/ culture transfer |
| Eppendorf Research Plus 8 multi-channel pipettor , 30-300 µL | Avantor/ VWR | CA89125-340 | multichannel pipettes for aseptic media/ culture transfer |
| Glacial acetic acid, CAS 64-19-7, 2.5L, ACS grade | Fisher Scientific | A38-212 | CV destain |
| Glass test tubes, 150 mm x 18 mm, 72/Pack, PYREX | Fisher Scientific | 14957H/ 9820-18 | materials for cell culturing |
| Glycerol, 4 L glass bottle ACS | Fisher Scientific | BP229-4 | media components for cryopreservation |
| L-Cysteine, 98%, 250 g | Avantor/ VWR | 97061-204 | universal neutralizing solution |
| L-glutathione reduced, 98%, 25 g | Fisher Scientific | AAJ6216614 | universal neutralizing solution |
| L-Hisitidine, 98%, 100 g | Avantor/ VWR | CA97062-598 | universal neutralizing solution |
| MBEC Assay Inoculator with 96 well tray, 100/CS | Innovotech | 19112 | material for 96 well MBEC device biofilm cultivation |
| McFarland Standard, 0.5 EA | Fisher Scientific | R20410 | cell culture standardization |
| McFarland Standard, 1.0 EA | Fisher Scientific | R20411 | cell culture standardization |
| NUNC 96-well microtiter plates, w/lid, 50/CS | Fisher Scientific | 167008 | microplate for 96 well MBEC device biofilm cultivation and OD measurements |
| PCR plate, semi-skirted 96 well, fast PCR, polypropylene, 25ea/PK | Sarstedt | 72.1981.202 | pegged lid for 96 well deepwell device biofilm cultivation |
| Petri dish, 100 mm x 15 mm, semi-TK CS/500 | Fisher Scientific | FB0875712 | materials for LB agar preparation |
| Potassium phosphate dibasic, ACS 500 g | Fisher Scientific | P288-500 | PBS component/ buffer |
| Sodium chloride, ACS grade, 3 kg | Fisher Scientific | S2713 | media components for LB broth and PBS |
| sodium phosphate monobasic, 1 kg | Fisher Scientific | S369-1 | PBS component/ buffer |
| Syringe filters, Sterile, PES 0.45 um, 25 mm, PK50 | Avantor/ VWR | 28145-505 | non-autoclavable solution sterilization |
| Tin foil, heavy duty, 50 feet | Grocery store | --- | materials for deepwell device sterilization |
| Tryptone (peptone from casein), 2.2 kg/EA | Fisher Scientific | B11922 | media components for LB broth |
| Tween-20, 100 mL | Fisher Scientific | BP337-100 | recovery media solution |
| Ultra-deepwell, 2.5 mL deep well plates (square well), with lid, polypropylene, 10/CS | Avantor/ VWR | 37001-520 | materials for biofilm dilution preparation |
| Yeast Extract, Fisher Bioreagents, 500 g | Fisher Scientific | BP1422-500 | media components for LB broth |
参考文献
- Verderosa, A. D., Totsika, M., Fairfull-Smith, K. E. Bacterial Biofilm Eradication Agents: A Current Review. Frontiers in Chemistry. 7, 1-17 (2019).
- Sharma, D., Misba, L., Khan, A. U. Antibiotics versus biofilm: An emerging battleground in microbial communities. Antimicrobial Resistance and Infection Control. 8 (1), 1-10 (2019).
- Fux, C. A., Costerton, J. W., Stewart, P. S., Stoodley, P. Survival strategies of infectious biofilms. Trends in Microbiology. 13 (1), 34-40 (2005).
- Lagacé-Wiens, P. R. S., et al. Trends in antimicrobial resistance over 10 years among key bacterial pathogens from Canadian hospitals: results of the CANWARD study 2007-16. The Journal of Antimicrobial Chemotherapy. 74, 22-31 (2019).
- Karlowsky, J. A., et al. In vitro susceptibility of urinary Escherichia coli isolates to first- and second-line empirically prescribed oral antimicrobials: CANWARD surveillance study results for Canadian outpatients, 2007-2016. International Journal of Antimicrobial Agents. 54 (1), 62-68 (2019).
- Mah, T. F. Biofilm-specific antibiotic resistance. Future Microbiology. 7 (9), 1061-1072 (2012).
- Amato, S. M., et al. The role of metabolism in bacterial persistence. Frontiers in Microbiology. 5, 1-9 (2014).
- Flemming, H. -. C., Neu, T. R., Wozniak, D. J. The EPS matrix: The "house of biofilm cells.". Journal of Bacteriology. 189 (22), 7945-7947 (2007).
- Dela Fuente-Núñez, C., Reffuveille, F., Fernández, L., Hancock, R. E. W. Bacterial biofilm development as a multicellular adaptation: Antibiotic resistance and new therapeutic strategies. Current Opinion in Microbiology. 16 (5), 580-589 (2013).
- Høiby, N., et al. The clinical impact of bacterial biofilms. International Journal of Oral Science. 3 (2), 55-65 (2011).
- Merritt, J. H., Kadouri, D. E., O'Toole, G. A. Growing and analyzing static biofilms. Current Protocols in Microbiology. 01, (2005).
- Coffey, B. M., Anderson, G. G. Biofilm formation in the 96-well microtiter plate. Methods in Molecular Biology. 1149, 631-641 (2014).
- O'Toole, G. A. Microtiter dish Biofilm formation assay. Journal of Visualized Experiments. (47), e2437 (2010).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews in Microbiology. 43 (3), 313-351 (2017).
- Harrison, J. J., Turner, R. J., Ceri, H. High-throughput metal susceptibility testing of microbial biofilms. BMC Microbiology. 5 (53), (2005).
- Ceri, H., et al. The MBEC Assay System: Multiple Equivalent Bioffims for Antibiotic and Biocide Susceptibility Testing. Methods in Enzymology. 337, 377-385 (2001).
- Harrison, J. J., et al. Microtiter susceptibility testing of microbes growing on peg lids: a miniaturized biofilm model for high-throughput screening. Nature Protocols. 5 (7), 1236-1254 (2010).
- vanden Driessche, F., Rigole, P., Brackman, G., Coenye, T. Optimization of resazurin-based viability staining for quantification of microbial biofilms. Journal of Microbiological Methods. 98, (2014).
- Sabaeifard, P., Abdi-Ali, A., Gamazo, C., Irache, J. M., Soudi, M. R. Improved effect of amikacin-loaded poly(D,L-lactide-co-glycolide) nanoparticles against planktonic and biofilm cells of Pseudomonas aeruginosa. Journal of Medical Microbiology. 66 (2), 137-148 (2017).
- Thieme, L., et al. MBEC Versus MBIC: the Lack of Differentiation between Biofilm Reducing and Inhibitory Effects as a Current Problem in Biofilm Methodology. Biological Procedures Online. 21 (1), 18 (2019).
- Jennings, M. C., Ator, L. E., Paniak, T. J., Minbiole, K. P. C., Wuest, W. M. Biofilm-eradicating properties of quaternary ammonium amphiphiles: Simple mimics of antimicrobial peptides. Chembiochem. 15 (15), 2211-2215 (2014).
- Lineback, C. B., et al. Hydrogen peroxide and sodium hypochlorite disinfectants are more effective against Staphylococcus aureus and Pseudomonas aeruginosa biofilms than quaternary ammonium compounds. Antimicrobial Resistance & Infection Control. 7 (1), 154 (2018).
- Minbiole, K. P. C., et al. From antimicrobial activity to mechanism of resistance: The multifaceted role of simple quaternary ammonium compounds in bacterial eradication. Tetrahedron. 72 (25), 3559-3566 (2016).
- Mangalappalli-Illathu, A. K., Korber, D. R. Adaptive resistance and differential protein expression of Salmonella enterica serovar enteritidis biofilms exposed to benzalkonium chloride. Antimicrobial Agents and Chemotherapy. 50 (11), 3588-3596 (2006).
- El-Banna, T., Abd El-Aziz, A., Sonbol, F., El-Ekhnawy, E. Adaptation of Pseudomonas aeruginosa clinical isolates to benzalkonium chloride retards its growth and enhances biofilm production. Molecular Biology Reports. 46, 3437-3443 (2019).
- Ebrahimi, A., et al. Effects of benzalkonium Chloride on planktonic growth and biofilm formation by animal bacterial pathogens. Jundishapur Journal of Microbiology. 8 (2), 59764 (2015).
- Reśliński, A., et al. Evaluation of Staphylococcus aureus and Escherichia coli biofilm formation on the surface of polypropylene mesh. Medycyna doświadczalna i mikrobiologia. 63 (1), 21-27 (2011).
- Verhorstert, K. W. J., et al. In vitro bacterial adhesion and biofilm formation on fully absorbable poly-4-hydroxybutyrate and nonabsorbable polypropylene pelvic floor implants. Cite This: ACS Applied Materials & Interfaces. 12, 53646-53653 (2020).
- Arkatkar, A., Juwarkar, A. A., Bhaduri, S., Uppara, P. V., Doble, M. Growth of Pseudomonas and Bacillus biofilms on pretreated polypropylene surface. International Biodeterioration & Biodegradation. 64 (6), (2010).
- Jones, J. F., et al. Oriented adhesion of Escherichia coli to polystyrene particles. Applied and Environmental Microbiology. 69 (11), 6515-6519 (2003).
- Zameer, F., et al. Evaluation of adhesive and anti-adhesive properties of Pseudomonas aeruginosa biofilms and their inhibition by herbal plants. Iranian Journal of Microbiology. 8 (2), 108-119 (2016).
- Arkatkar, A., Juwarkar, A. A., Bhaduri, S., Uppara, P. V., Doble, M. Growth of Pseudomonas and Bacillus biofilms on pretreated polypropylene surface. International Biodeterioration and Biodegradation. 64 (6), 530-536 (2010).
- Dieterich, M., et al. Implant-Based Breast Reconstruction Using a Titanium-Coated Polypropylene Mesh (TiLOOP Bra). Plastic and Reconstructive Surgery. 132 (1), 8-19 (2013).
- Clavé, A., et al. Polypropylene as a reinforcement in pelvic surgery is not inert: comparative analysis of 100 explants. International Urogynecology Journal. 21 (3), 261-270 (2010).
- Zameer, F., et al. Evaluation of adhesive and anti-adhesive properties of Pseudomonas aeruginosa biofilms and their inhibition by herbal plants. Iranian Journal of Microbiology. 8 (2), 108-119 (2016).
- Chen, R., Liu, X., Han, L., Zhang, Z., Li, Y. Morphology, thermal behavior, rheological, and mechanical properties of polypropylene/polystyrene blends based on elongation flow. Polymers for Advanced Technologies. 31 (11), 2722-2732 (2020).
- Vial Loading Trays Polystyrene vs. polypropylene: Which tubes are best for your research. ChemTech International Available from: https://chemtech-us.com/polystyrene-vs-polypropylene-which-tubes-are-best-for-your-research/ (2020)
- Bock, L. J., Hind, C. K., Sutton, J. M., Wand, M. E. Growth media and assay plate material can impact on the effectiveness of cationic biocides and antibiotics against different bacterial species. Letters in Applied Microbiology. 66 (5), 368-377 (2018).
- . Crystal violet Available from: https://omic.org/spectra/PhotochemCAD/html/048.html (2017)
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved