このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
コヒーレントラマン散乱イメージングを用いた皮膚内の医薬品化合物の可視化と定量
要約
皮膚内の医薬品化合物を視覚化および定量化するためのコヒーレントなラマン散乱イメージング方法論が記載されている。この論文では、皮膚組織調製物(ヒトおよびマウス)および局所製剤の適用、時空間濃度プロファイルを定量化するための画像取得、および局所薬物送達を評価するための予備薬物動態解析について説明する。
要約
局所製剤適用後の皮膚薬物動態(cPK)は、局所バイオアベイラビリティ(BA)を機構的に理解するために、規制および医薬品開発科学者にとって特に関心のある研究分野となっている。テープストリッピング、真皮微量透析、または真皮開放流微小灌流などの半侵襲的技術はすべて、マクロスケールcPKを定量化する。これらの技術は膨大なcPKの知識を提供してきましたが、コミュニティは細胞レベルでの医薬品有効成分(API)の浸透と浸透に関する機械的な理解を欠いています。
マイクロスケールcPKに対処するための非侵襲的アプローチの1つは、コヒーレントラマン散乱イメージング(CRI)であり、外因性標識または化学修飾を必要とせずに、内因性分子振動を選択的に標的とする。CRIには、コヒーレント抗ストークスラマン散乱(CARS)と刺激ラマン散乱(SRS)の2つの主要な方法があり、APIまたは不活性成分の高感度かつ選択的な定量を可能にします。CARSは通常、構造皮膚情報を導き出したり、化学的コントラストを視覚化したりするために利用されます。対照的に、分子濃度と直線的なSRSシグナルは、皮膚層別化中のAPIまたは不活性成分を定量するために使用される。
マウス組織はCRIによるcPKに一般的に利用されてきたが、局所BAおよび生物学的同等性(BE)は、規制当局の承認前にヒト組織において最終的に評価されなければならない。この論文は、局所 BAおよびBE の評価における定量的薬物動態学的CRI研究に使用されるex vivo皮膚を調製および画像化するための方法論を提示する。この方法論は、時間の経過とともにヒトおよびマウスの皮膚内で信頼性が高く再現可能なAPI定量を可能にします。脂質が豊富なコンパートメントおよび脂質が乏しいコンパートメント内の濃度、ならびに経時的な総API濃度が定量化される。これらは、ミクロおよびマクロスケールのBAおよび潜在的にBEの推定に利用される。
概要
局所薬物製品適用後のcPKを評価するための方法論は、古典的なインビトロ浸透試験(IVPT)研究1,2,3,4,5およびテープストリッピング6,7,8から、オープンフロー微小灌流または皮膚微小透析9,10,11などの追加の方法論に拡大し、12,13,14。治療作用の潜在的に様々な局所部位が、関心のある疾患に応じて存在する。したがって、API が意図したローカル サイトに到達する速度と程度を評価するための、対応する数の方法論が存在する可能性があります。前述の方法論のそれぞれに利点がありますが、主な欠点は、マイクロスケールのcPK情報の欠如(つまり、APIがどこに行き、どのように浸透するかを視覚化できないこと)です。
局所BAおよびBEを推定するために関心のある非侵襲的方法論の1つはCRIであり、これはCARS顕微鏡とSRS顕微鏡の2つのイメージングモダリティに分解することができる。これらのコヒーレントなラマン法は、非線形ラマン効果を介して分子の化学的に特異的なイメージングを可能にする。CRIでは、2つのレーザーパルス列が集束され、サンプル内でスキャンされます。レーザー周波数間のエネルギーの差は、目的の化学構造に固有の振動モードをターゲットに設定するように設定されます。CRIプロセスは非線形であるため、信号は顕微鏡焦点でのみ生成され、組織の3次元薬物動態断層画像化を可能にする。cPKの文脈において、CASは、脂質に富む皮膚構造15の位置などの組織構造情報を得るために用いられてきた。対照的に、SRSは、そのシグナルが濃度と線形であるため、分子濃度を定量するために利用されてきた。エキソビボ皮膚標本の場合、透過モード17においてエピ方向16およびSRSにおいてCASを実施することが有利である。したがって、薄い組織サンプルはSRSシグナルの検出と定量を可能にします。
モデル組織として、ヌードマウスの耳は、軽微な欠点を有するいくつかの利点を提示する。1つの利点は、組織の厚さがすでに〜200〜300μmであり、さらなるサンプル調製を必要としないことである。さらに、いくつかの皮膚層形成は、1つの視野(例えば、角質層、皮脂腺(SG)、脂肪細胞、および皮下脂肪)を通して軸方向に焦点を合わせることによって見られる16,18。これにより、ヒト皮膚サンプルに移動する前の皮膚透過経路の予備的前臨床推定および局所BA推定が可能になります。しかしながら、ヌードマウスモデルは、皮膚構造の違いによるin vivoシナリオへの外挿の困難さなどの限界を提示する19。ヌードマウスの耳は予備的な結果を得るための優れたモデルですが、人間の皮膚モデルはゴールドスタンダードです。in vivo透過動態を正確に再現するための凍結ヒト皮膚の適合性および適用性に関する様々な解説があるが20、21、22、凍結ヒト皮膚の使用は、in vitro API透過動態の評価のための受け入れられた方法である23、24、25.このプロトコルは、マウスおよびヒトの皮膚のさまざまな皮膚層を視覚化し、脂質が豊富な構造と脂質が乏しい構造内のAPI濃度を定量化します。
CRIは、組織内の化合物を特異的に可視化するために多くの分野で利用されてきたが、局所適用された薬物製品のcPKを調査する努力は限られていた。CRIを用いて外用製品の局所BA/BEを評価するには、まず、正確な比較を行うための標準化されたプロトコルが必要です。皮膚への薬物送達にCRIを使用した以前の努力は、データ内の変動性を実証している。これはCRIの比較的新しいアプリケーションであるため、プロトコルを確立することは、信頼性の高い結果を得るために重要です18,26,27。このアプローチは、ラマンスペクトルの生物学的サイレント領域内の1つの特定の波数のみを標的とする。しかし、ほとんどのAPIと不活性成分には、指紋領域内にラマンシフトがあります。これは、指紋領域の組織から生じる固有のシグナルのために、以前は課題を提起していた。最近のレーザーおよび計算の進歩により、この障壁が取り除かれており、これは、ここで提示されたアプローチと組み合わせて利用することもできる28。ここで紹介するこのアプローチは、サイレント領域(2,000-2,300 cm-1)にラマンシフトを持つAPIの定量化を可能にします。これは、薬物の生理化学的特性に限定されず、これは、先に述べたいくつかのcPKモニタリング方法論29について当てはまるかもしれない。
このプロトコルは、厚いヒト皮膚サンプルが厚いサンプルによる光散乱による薬物製品適用後に最小限のシグナルを生成するため、さまざまな調製物の皮膚厚さのサンプル間の変動を低減する必要があります。この原稿の目標は、再現性のある画像化基準を保証する組織調製方法論を提示することです。さらに、CRIシステムは、潜在的な誤差源を低減し、信号対ノイズを最小限に抑えるために、説明どおりにセットアップされています。しかし、本稿では、CRI顕微鏡の指導原理や技術的メリットについては、これまで取り上げてきた30では触れない。最後に、実験の成功または失敗を判断するための結果の解釈を可能にするために、広範なデータ分析手順が検討されます。
Access restricted. Please log in or start a trial to view this content.
プロトコル
ヌードマウスの耳組織の使用は、マサチューセッツ総合病院施設動物ケアおよび使用委員会(IACUC)によって承認され、ヒト皮膚組織の使用はマサチューセッツ総合病院施設審査委員会(IRB)によって承認された。IACUCプロトコールに従って、新たに安楽死させたマウスを、ヌードマウスコロニーを有する協力者から得た。ヒト組織は、承認されたプロトコルを介してマサチューセッツ総合病院の選択的腹部形成術から調達された。さらに、腹部皮膚以外の特定の組織タイプは、IRB承認プロトコルを介しても、身体提供機関を介して取得された。
1. 組織の調製
- ヌードマウス耳皮膚組織の作製
- 収穫したてのヌードマウスの体を取得した後、鉗子と顕微手術はさみを使用して耳を取り除きます。片方の耳を小さなペトリ皿(35 mm x 10 mm)に入れます。ヌードマウスの体をバイオハザードバッグに入れ、地元のIACUCプロトコルに従って処分します。
- 各マウスの耳をリン酸緩衝生理食塩水(PBS)ですすぎ、タスクワイパーで軽く叩いて乾かします。2回繰り返して、画像品質に影響を与える可能性のある耳の汚れや破片を取り除きます( 図1参照)。
- 耳を24時間以内に使用する場合は、冷蔵庫(2〜8°C)の新鮮なPBSを入れた小さなペトリ皿(35 mm x 10 mm)に入れます。24時間の収穫後に耳を使用する場合は、PBSを含まないペトリ皿(35 mm x 10 mm)に入れ、皿をパラフィルムで覆い、-20°Cの冷凍庫に入れます。
- ヒト皮膚組織の調製
- ヒト組織の調達後、サンプル調製に十分なスペースを確保するために、生物学的フード内の大きなペトリ皿(すなわち、60mm x 15mm)に入れます。
- 皮下脂肪がアクセスしやすいように角質層側を下向きに置きます。
- 鉗子と顕微手術はさみを使用して、皮下脂肪を慎重に取り除き始めます。皮下脂肪をハサミで除去できなくなったら、10枚刃の使い捨てメス(または同等のメス)に切り替えて、残りの皮下脂肪を除去します。メスを皮膚に対して45°の角度で使用し、鉗子で皮膚を静止させます(図1参照)。
メモ: 高品質の伝送 SRS 画像を作成するには、サンプルを穿刺せずにできるだけ薄くする必要があります。
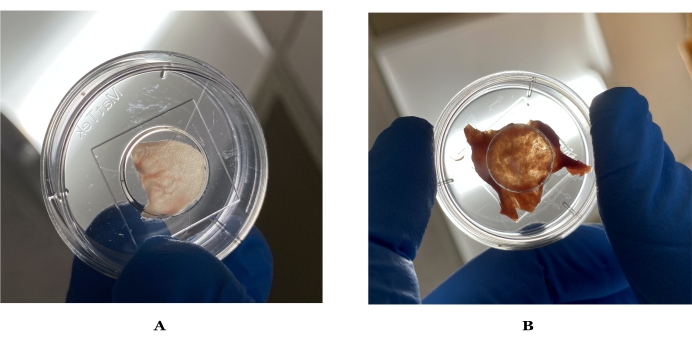
図1:マウスと人間の皮膚のイメージングに理想的な厚さの画像。 (A)マウスの耳の皮膚が光にかざされ、目に見える形で光が通る。(B)理想的なヒトの皮膚は、調製後に光に保持された。 この図の拡大版を表示するには、ここをクリックしてください。
- 人間の皮膚を1 cm x 1 cmの部分に切断します。
注:新鮮な皮膚は、前述のようにアガロースゲルベッドを使用せずに最大24時間使用することができる31。しかし、新鮮な皮膚は、アガロースゲルベッドに保たれれば、より長く利用され得る。皮膚を後で使用する場合は、皮を検体輸送バッグに入れ、-20°Cの冷凍庫に入れます。凍結した皮膚は、最適な結果を得るために以下の手順を使用して解凍する必要があります(ステップ3.1.2を参照)。
2. レーザーと顕微鏡のセットアップ
- イメージングの約30分前に、広く調整可能な超高速レーザー(以下、レーザーと呼ぶ)の電源を入れ、ウォームアップさせます。レーザー警告サイン/ロックシステムを有効にして、侵入時に潜在的な危険を外部の人員に通知します。
注:クラスIVレーザーを使用する場合は、常に適切な眼鏡を着用する必要があります。ここで使用される特定のレーザーの場合、推奨される適切な眼鏡は、レーザー800-1,300nmの動作範囲に対してOD ≥ 6です。 - レーザーがウォームアップしている間に、顕微鏡制御、CARS検出、およびSRS検出用の残りのハードウェアを有効にします。
- 顕微鏡を適切に整列させて、最適なイメージングを確保します。顕微鏡制御ソフトウェア(以下MCソフトウェア)の 画像取得制御 ウィンドウで、透過ランプをクリックすると、顕微鏡のトランスイルミネーション ランプ から光が送られます。
- 垂直軸に沿って顕微鏡を整列させるために正しいケーラー照明を確保する:アイピース32を通して最小量の光が見えるように虹彩を下方に閉じる。
- 接眼レンズを覗き込みながら、虹彩を開いて、ポリゴンがすべての辺に同時に接触するかどうかを確認します。虹彩を開く前にポリゴン形状が見えない場合は、コンデンサーの高さを調整します。
- 多角形の図形がすべての辺に同時に触れない場合は、調整ノブを使用して絞り位置合わせ位置を調整します。
注: 顕微鏡の詳細なセットアップについては、Sanderson et al.33 を参照してください。 - オイルサンプル(例えば、オイル内に多くの-CH2-結合があるため、オリーブオイル)を含むカバースリップと両面接着スペーサーを備えた顕微鏡スライドを顕微鏡ステージホルダー上に置きます。
- MCソフトウェアの集録設定ウィンドウで、顕微鏡ドロップダウンメニューを見つけ、顕微鏡対物レンズを20倍に設定します。
- CARS検出フィルタ(645nm/50nm)が、顕微鏡側ポート光電子増倍管に沿ってエピCARS信号を視覚化および測定する位置にあることを確認します。
注:この特定のフィルタは、ポンプ波長803nmおよびストークス波長1,040nmに対して652nmで生成される抗ストークスCARS信号として脂質をイメージングするために選択される(式(1)参照)。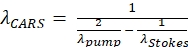 (1)
(1)
ここで、λ変数の単位はnmである。λポンプはポンプ ビーム波長です。λストークスはストークス ビーム波長である。 - 接眼レンズを通してオイルサンプルの端を見つけ、システムのアライメントを確認するために使用されます。
- 顕微鏡のフォーカスノブを使用してエッジがZフォーカスになっていることを確認し、ステージコントローラを調整してXYフォーカスを取得します。
- レーザーがウォームアップした後、レーザーのグラフィカルユーザーインターフェイスでモーターの微調整を50.0に設定して、ポンプビームを803nmに設定します。使用される正確なモーターの微調整は、セットアップごとに異なる場合があります。
注:ポンプビームは、ストークスビーム波長が1,040nmに固定されているため、このレーザーで調整可能な波長を持つ唯一のビームです。この構成は、2850 cm-1 の CH 振動をターゲットにしています (波数ターゲティングのポンプ波長を計算するには、式 (2) を参照してください)。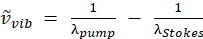 (2)
(2)
ここで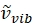 、 は相対波数 (cm−1) の単位を持ち、 λ 変数は cm 単位を持ちます。
、 は相対波数 (cm−1) の単位を持ち、 λ 変数は cm 単位を持ちます。 - イメージングする前に、顕微鏡へのレーザーの位置合わせを確認してください。レーザー経路の描写については、 図2 を参照してください。顕微鏡の初期セットアップ中に、顕微鏡への正しい位置合わせのためのガイドとして、ビーム経路に2つの虹彩を設置する。レーザーの光路は時間の経過とともにドリフトする可能性があるため、レーザービーム経路が虹彩の中心を横切り、顕微鏡に正しく入るようにしてください。
- IRビューアを使用して、すべての虹彩を完全に閉じ、ビームが両方に集中していることを確認します:最初にレーザーに最も近い虹彩に、最後に顕微鏡の入り口ポートで。
- まず、ポンプビームをチェックして、ビームが顕微鏡にまっすぐ入っていることを確認します。ポンプの位置が揃ったら、ストークスビームも顕微鏡に正しく入ることを確認します。
- ビームが虹彩を通して整列されていない場合は、ポンプとストークスのビームパス用の2つのミラーマウントのxとyの調整ノブを使用して、ビームを繰り返し虹彩を通して歩きます。
- 顕微鏡に入る前にビームスポットが重なったら、顕微鏡を正しく横断していることを確認してください。
- MC ソフトウェアの [画像集録制御] ウィンドウで、伝送用の TD チャンネル、コヒーレントなアンチストークス ラマン チャンネルの ALG1 (アナログ チャンネル 1)、刺激ラマン散乱チャンネルの ALG2 ( アナログ チャンネル 2) をクリックします。次の設定を使用します (このプロトコルの場合と同様): ALG1 の場合はゲイン 1 とオフセット -1、ALG2 の場合はゲイン 1.25、オフセット -2 です。
メモ: システム構成によっては、アナログチャンネルの番号付けがイメージングチャンネルごとに異なる場合があります。SRS検出器が所定の位置にある場合、光が通過できないため、伝送信号がありません(つまり、この設定ではTDとALG2で同時に画像を視覚化することはできません)。
- MC ソフトウェアの [画像集録制御] ウィンドウで、伝送用の TD チャンネル、コヒーレントなアンチストークス ラマン チャンネルの ALG1 (アナログ チャンネル 1)、刺激ラマン散乱チャンネルの ALG2 ( アナログ チャンネル 2) をクリックします。次の設定を使用します (このプロトコルの場合と同様): ALG1 の場合はゲイン 1 とオフセット -1、ALG2 の場合はゲイン 1.25、オフセット -2 です。
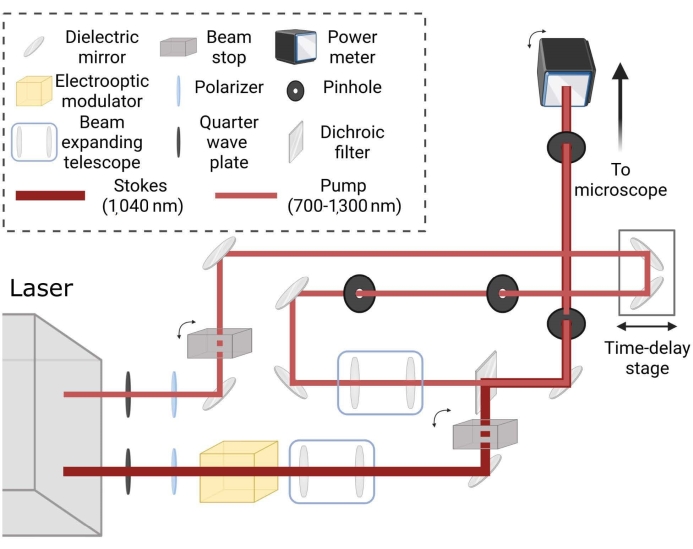
図2:コヒーレントラマンレーザーイメージングパスの概略レイアウト。 ビームはスポットサイズに対して独立して調整され、時間遅延段を介してマッチングされ、所望の同調周波数のサンプルにコヒーレントなラマン散乱を生成します。 この図の拡大版を表示するには、ここをクリックしてください。
- パワーメーターの電源を入れ、高出力火力センサーを使用して、実験のためにポンプとストークスビームの電力を個別に測定します。
注:この特定の例では、ポンプビーム出力は80mWであったが、ストークスビーム出力は顕微鏡への入り口の前に180mWであった。 - 画像 取得コントロール ウィンドウで、 フォーカスx2 ボタンをクリックして、MCソフトウェアで画像を表示します。
- [取得設定] ウィンドウで、ピクセル比と滞留時間が実験に必要なパラメーターに設定されていることを確認します。
注: このプロトコルでは、1,024 x 1,024 ピクセル比と 2 μs/ピクセルのドウェル時間を使用しました。 - ポンプビームのブロックを解除し、 TD チャンネルを見て、顕微鏡に対するレーザーの位置合わせを確認します。
メモ:ビームが正しい検出器設定で画像の中心に見える場合、レーザーは正しく整列します。 - それ以外の場合は、潜望鏡の X と Y 調整ノブを使用して、ビームを画像の中心に再配置します。
- レーザーと顕微鏡のアライメントを確認するには、CARSチャンネルとSRSチャンネルの両方で同じ画像を確認します。
- アライメント画像を取得するには、画像取得制御ウィンドウのXYスキャンボタンをクリックし、適切なフィルタモード(カルマンライン3など)を設定します。
- このイメージのセットをわかりやすいファイル名で保存して、時間の経過とともに比較し、システムのパフォーマンス/アライメントを確認します。
3. 脂質イメージング
- マウスの耳とヒトの組織
- 新鮮な組織を使用する場合は、手順3.1.2をスキップします。
- マウスの耳の皮膚を-20°Cの冷凍庫から取り出し、インキュベーションチャンバー(32°C)に10分間置きます。マウスの耳をインキュベーションチャンバーから取り外します。
メモ: ステップ 1.1.2 を参照してください。マウスの耳の皮膚調製用。組織の粗い取り扱いまたは掻き取りは、組織、特に角質層の機械的分解、破壊、または破壊をもたらし得る。 - ヌードマウスの耳を用いる場合は、耳の前部を35mmの0番皿のガラス底に向けて置く。人間の皮膚を使用する場合は、表面層からより深い層への薬物定量が可能になるため、角質層を裏返して配置します(図1)。
注:ヌードマウスの耳の後部は、ハウジングからの欠陥を起こしやすいです。人間の皮膚を倒立顕微鏡で角質層側を下に向けて置かないと、かなりの量の光が散乱し、角質層に浸透する薬が見えないため、真皮の向こう側を見ることができません。 - 組織がガラス底の中央に配置されたら、綿の先端のアプリケーターを使用して、皮膚が平らで、ガラス底の皿のカバースリップ表面と完全に接触していることを確認します。
注:これは、皮膚が完全に平坦でない場合、皮膚のイメージング中に困難を引き起こす可能性のある手順です。 - ワッシャーを皮膚の上に置き、イメージング中の動きを防ぎます。SRS透過検出のために、ワッシャーの中央の穴から組織が見えることを確認します。
- スライドステージインサートを取り外し、シングルディッシュインサートを備えたインキュベーションチャンバと交換します。
- 皮膚組織を有するガラス底ディッシュをインキュベーションチャンバの単一ディッシュアタッチメントに配置する。
注:または、6ウェルプレートを使用して、複数の皮膚サンプルおよび製剤を一度に画像化します。 - MCソフトウェアの[集録設定]ウィンドウでピクセル比を下げ(例:1,024 x 1,024から512 x 512に下げてガルボスキャン速度を速くし、Z深度を変更して角質層を見つけます(マウスの場合は図3A、人間の場合は図3Eを参照)。
- 角質層が見つかったら、その軸方向の位置をゼロ位置として 取得設定 ウィンドウに登録し、特定の実験ごとに画素比を変更します(例:1,024×1,024)。
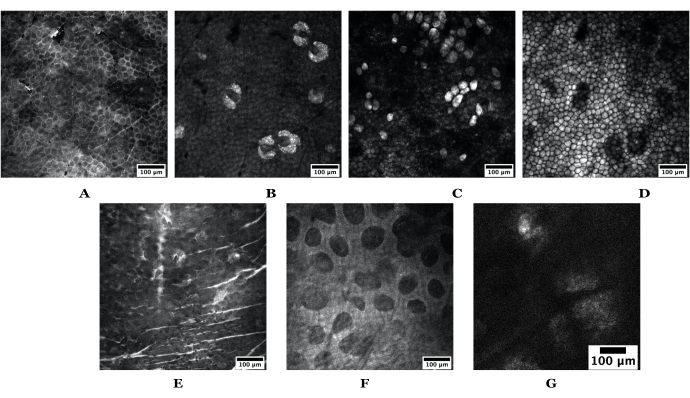
図3:SRSを使用して得られた表皮深さの例。 画像のトップセットは、ヌードマウスの耳の皮膚からのもので、(A)角質層、(B)皮脂腺、(C)脂肪細胞、(D)皮下脂肪を描写している。画像の一番下のセットは、(E)角質層、(F)乳頭真皮、および(G)皮脂腺を描いたヒトの皮膚から得られます。スケールバー = 100 μm。マウスと人間の両方の皮膚画像は、1024ピクセルx 1024ピクセルで20倍の対物レンズを使用して取得されました。ヒトSGは512 x 512ピクセルで撮影された。略語: SRS = 刺激ラマン散乱;SG = 皮脂腺。 この図の拡大版を表示するには、ここをクリックしてください。
4. 局所製剤の適用
- 所定の製剤用量を皮膚上にピペットで移す(例えば、10μL/cm2)。
注:製剤の粘度は、ピペットの選択において役割を果たします。クリームやゲルなどの粘性製剤には容積ピペット、溶液には空気置換ピペットの使用をお勧めします。この実験では、ルキソリチニブをプロピレングリコール(プロパン−1,2−ジオール)の単純な溶液中のモデル化合物とした。 - 注射器または手袋をはめた指からのプランジャー先端を使用して、製剤を時計回りの動きで30秒間こする。製剤が後のcPK分析のために適用される時間に留意されたい(下記のステップ6.15〜6.17を参照のこと)。
注:適用期間は実験に依存する。それぞれが異なる場合があります。 - 製剤が浸透するまでに割り当てられた時間が経過した後、余分な製剤を除去し、製剤側をガラス底皿に向けて皮膚を置く。
注:製剤は、繊細なタスクワイパーまたは小さな(〜1インチ)3Dプリントスキージを使用して、一方向(例えば、北から南へ)に除去されます。
5. 薬剤定量のための実験セットアップ
- ポンプビームを803nmに設定します。フォトダイオードでポンプとストークスビームのパワーをチェックして、それらが実験に必要なパワーであることを確認します。各ビームのブロックを個別に解除してパワーを測定し、ビームを再ブロックします。
注:この特定の例では、ポンプビーム出力は100mWであり、ストークスビーム出力は180mWであった。 - ガラス底ディッシュを、1つのガラス底ディッシュ用のインサートを備えたインキュベーションチャンバに入れます。画像撮影中の動きを防ぐために、皿をクリップで固定します。
- MCソフトウェアの送信ランプをオンにします。接眼レンズを通して、調整ノブで軸方向の焦点を調整して、組織の焦点が合っていることを確認します。
- ポンプビームとストークスビームの両方のブロックを解除します。ALG1 および ALG2 チャネルが有効になっていることを確認し、MC ソフトウェアで [ フォーカス x2 ] をクリックして、CARS チャネルと SRS チャネルのスキンを視覚化します。SRSフォトダイオードがコンデンサーの上の位置にあることを確認します。
- [デバイス] ドロップダウン メニューで、[ マルチエリア タイム ラプス (MATL)] をクリックします。 XYステージ警告 が表示されるのを探します。ステージが移動して機械的な原点を見つけたら、「 OK」をクリックします。
- MATLモジュールで、[表示]に移動し、MCソフトウェア内の[登録済みポイントリスト]をクリックします。1)皮膚内の特定の深さ(すなわち、脂質同調コントラストを有するライブイメージング中に決定された皮下脂肪)または2)深さスタック全体が撮影される場合はXY位置のいずれかを追加し始める。例については、図 3 を参照してください。
- 角質層が特定されたら、軸方向の焦点(またはz焦点)をスクロールして、上記の特定の組織層別化を同定する。ヒトとマウスの皮膚内の例については、 図 3 を参照してください。
- 完全な Z 深度スタックではなく、特定の深度をイメージングする場合、スキン層別化ごとに [登録ポイント] をクリックして MATL キューに追加します。深度スタックの場合は、集録パラメータウィンドウで深さを選択して各 XY 位置の「ポイントを登録」(Register Point) をクリックします。
- 目的の XY (完全な Z 深度スタック) または XYZ (特定のスキン層別) の位置がすべて MATL ソフトウェアに登録されたら、画像解析と cPK 解析の実験全体で一貫性のある方法でファイル ディレクトリと名前を変更します (手順 6.15 ~ 6.17 を参照)。
- MATL モジュールで繰り返し回数を 1 に設定し、「 準備完了」をクリックします。 Play がグレーから黒い矢印に変わり、ソフトウェアの準備ができたことを示すのを待ちます。 Play を押して、予備脂質スタックのイメージングを開始します (以下 、脂質画像)。
注:これは、分析中に個々の組織層別化の脂質が豊富な領域と脂質不足の領域を分離するために使用されます。サイクルと合計時間は、登録されたポイントリストの右下に表示されます。 - サイクルが完了したら、ポンプビームとストークスビームの両方をブロックします。レーザーグラフィカルユーザーインターフェイスの波長を、ターゲットの波数またはラマン振動に基づいて目的の波長に変更します。
メモ: たとえば、ポンプビームの 843 nm は、式 (2) を使用して 2,250 cm-1 をターゲットに使用され、モータの微調整は 50.1 に変更されます。ここで提示される薬物例、ルキソリチニブは、2,250cm−1を標的とすることができるニトリルを含有する。皮膚構造の対象となる波数は常に同じ(2,850 cm-1)になります。ただし、API の波数は任意の波数にすることができますが、事前に既知であるか、先験的に計算する必要があります。 - 手動の時間遅延段(図2)を調整して、新しい波長とポンプビーム出力に間に合うようにオーバーラップするようにします。 先験的に確立されている脂質イメージングとAPIイメージングの両方に同じパワーが使用されていることを確認します。
- サイクルあたりの継続時間を使用して、実験ごとに必要な繰り返しの合計数を計算します。実験の希望する時間経過の合計をサイクル期間で割るだけです。
注: サイクル継続時間は、画像サイズ、ピクセル滞留時間、カルマン平均化、およびサイクルあたりの画像数の関数です。これらのパラメータを最適化すると、サイクルタイムが短縮され、時間分解能が向上します。 - サイクルリピートの総数を選択したら、ポンプビームのブロックを解除し、フォトダイオードを使用して電力を確認し、目的の電力と一致することを確認します。最後に、ストークスビームのブロックを解除してイメージングを可能にします。
- 再生を押して、セットポイントの自動イメージングを開始します。
- MATLイメージングが完了したら、ポンプビームを803nmに戻し、ステップ5.1で使用した元の脂質イメージングパワーにパワーを戻します。
- 前の手順と同様に、試験全体を通して実験後の画像で一貫性があるようにファイル名を変更します。
- 繰り返し回数を 1 に設定します。
- [ |準備完了] をクリックします。再生 ボタンは、ポストタイムコースの脂質スタックを取得し、イメージング中に組織の動きがないことを確認します(図4)。

図4:皮脂腺を可視化して実証したヌードマウス耳皮膚における組織運動。 限定的な組織運動の例は A および Bに描かれ、一方、実質的な組織運動は C および Dに描かれる。(A)は製剤施用時及び(B)は施用後120分における同深さの皮脂腺を示す。(c)製剤施用量時および(D)製剤適用後120分時点のマウス皮脂腺;皮脂腺はほとんど見えず、これはこの実験が実験期間全体にわたって皮脂腺への取り込みを測定していなかったことを示している。スケールバー = 100 μm。画像は1024ピクセル×1024ピクセルです。 この図の拡大版を表示するには、ここをクリックしてください。
6. データ解析
- として画像を取得します 。OIB (または .OIR は顕微鏡およびMCソフトウェアに応じて)ファイルタイプがあり、各XYZ位置は別々のサブフォルダを有する。
- 脂質画像を API チャネル画像でコンパイルするには、脂質画像の名前を次の末尾の _lipid.oib に変更します。
- 各スキン層別化で次の手順を実行します (ここでは、わかりやすくするために SG 層別化のみを使用して示します。 図 3B を参照)。
- SG 脂質画像を ImageJ (またはフィジー) 34 にインポートし、[チャネルの分割] というラベルの付いたチェックボックスをオンにして、ファイルを CARS チャネルと SRS チャネルに分割 します。
注:フィジーは、チャンネル数にわたって実験中に取得した画像の数にファイルを分割します。 - 関心領域 (ROI) マネージャー を開くには、[ 分析] をクリック|ツールの|ROI マネージャー。
- SRS チャネル(C = 1 など)を使用して、イメージ内の SG を区切ります。
注:SGは、ターゲットを絞った-CH2-振動による明るい場所です。 - ROI マネージャーで [t] の追加 をクリックするか、キーボードの t キーを押して、これを ROI マネージャーに追加します。イメージ内の各 SG に対してこのプロセスを繰り返します。
- 脂質が豊富な領域をマスクするには、各ROIを選択し、[ その他 ]タブ をクリック|OR (結合) | ROI マネージャーに追加します。
- 脂質不足の領域をマスクするには、FIJIメニューの 長方形 ツールを使用して、画像全体の周りに正方形を描画します。これをROIマネージャに追加します。
- ROIマネージャですべての脂質リッチ領域を選択するROIに加えて、新しく追加された正方形ROIをクリックする。[ その他] で [ XOR ] を選択して脂質不良領域のマスクを生成し、ROI マネージャーに追加します。
- SG 脂質画像を ImageJ (またはフィジー) 34 にインポートし、[チャネルの分割] というラベルの付いたチェックボックスをオンにして、ファイルを CARS チャネルと SRS チャネルに分割 します。
- API イメージをフィジーに読み込みます。
- 次のメニューシーケンスを使用して、画像を番号順(つまり、Image0001、Image0002、Image0003など)に連結します: 画像|スタック|ツールの|連結。
- または、これらの画像をインポートするには、画像の1つをフィジーにロードし、セットアップページで同様の名前のファイルをグループ化するというオプションを選択します。
メモ: これにより、類似したファイル名を持つすべてのイメージをインポートし、自動的に連結することができます。
- または、これらの画像をインポートするには、画像の1つをフィジーにロードし、セットアップページで同様の名前のファイルをグループ化するというオプションを選択します。
- 連結された画像をアクティブにしたまま、ROI マネージャーに移動し、脂質が豊富な領域 (SG など) を選択し、[その他] をクリックして [マルチメジャー] を選択します。結果ウィンドウが表示されるのを待ちます。
- デフォルトの測定設定で「面積」、「平均」、「最小」、「最大」、および「中央値」を探します。分析に他のメトリックが必要な場合は、[測定値の設定] ウィンドウ ([分析] で関連するチェックボックスをオンにして、これらのオプションを有効にします|測定値を設定します...)。
- 「結果」ウィンドウからスプレッドシートにデータをエクスポートし、「地域」というタイトルの列を追加します。
- 脂質が豊富な領域のデータの各行に 脂質が豊富な 領域を追加します。脂質の外部にあった領域に 脂質不良 を加える。
- レイヤーというタイトルの列を追加し、分析した各レイヤーを追加します(補足表S1)。
- 適切なROIが選択されている間、脂質不良領域についてステップ6.5〜6.7を繰り返します。
- データを視覚化するには、スプレッドシートを保存し、JupyterLab (パッケージ matplotlib)35 または R (パッケージ ggplot2)36 にインポートします。画像を画像数対平均強度の関数としてプロットし、濃度-時間データを推定します。(図5)。
- スプレッドシートをRStudioにインポートして、CRIデータの薬物動態分析のための非コンパートメント分析(NCA)を実行します。
- time というタイトルの列を追加します。
- Image0001 の場合、製剤塗布と最初の画像との間の持続時間を計算します。
メモ: これは最初の時点です。サイクル期間は、時間の経過とともに増加する残りの画像(したがってタイムポイント)を計算するために使用されます。たとえば、適用からの時間が 30 分の場合、Image0001 のタイム ポイントは 30 分で、サイクル期間は 8 分、Image0002 のタイム ポイントは 38 分、Image0003 のタイム ポイントは 46 分というように続きます。 - スプレッドシートからインポートされた強度時間データに対して RStudio で (NonCompart パッケージを使用)37 で NCA を実行し、1 つのレイヤー/リージョンに対して次の呼び出しを行います。
sNCA(x = 時間、y = 平均、用量 = 1、タイムユニット = "s"、用量単位 = "mg")
ここで、xは時点を指し、yは強度を指し、用量は、製剤中の薬物のmM用量または製品用量として計算された1つとして残すことができる。
メモ: NCA 出力は、Cmax や AUC all などのパラメータを提供します。しかしながら、これは エクスビボ 皮膚であるため、これらのパラメータは、実際には、Jmax およびAUCフラックスオールである。 - JmaxとAUCフラックスのすべてのメトリックを、実験条件間での統計的比較に加えて、それらをプロットして視覚的に比較します(図6)。エキソビボCRI研究の分析例については図6を参照されたい。
注: 適切な統計検定は、特定のデータセットごとに異なります。また、すべての薬物動態パラメータは対数正規分布であり、すべての比較は対数変換(自然対数またはlog10)データを使用しなければならないことに注意することも重要です。
図5:強度と時間プロファイル (A)フラックスプロファイルが飽和に達し、強度の低下のみが見られる例。各ROIには異なるフラックスプロファイルがあり、取得する可能性のあるデータの異質性を示します。(B)イメージング開始後に上昇する濃度の例。各ROIは、同じ実験の同じ組織内の異なる視野(異なる色の痕跡によって示される)である。地球濃度に加えて、API/製剤が脂質リッチ領域と脂質不良領域によって示されるように、どの局所環境を好むかを解明する能力があります。 A に提示されたプロファイルは、APIがすでに浸透しており、イメージングが開始されると組織から出始めているため、組織への薬物の吸収がないことを示しています。しかし、 Bでは、組織は飽和に達しておらず、APIの吸収とそれに続く排除がまだある。画像を脂質リッチと脂質プリープにセグメンテーションすることは、API(または不活性物質)の局在化および皮膚への浸透経路(すなわち、角質層)の解明に役立つであろう。脂質が豊富な領域内のより高い濃度は、APIが調査中の層の脂質構造内に局在していることを示し、標的薬物送達情報を助ける。略語: ROI = 関心領域;API = 医薬品有効成分。 この図の拡大版を表示するには、ここをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
結果
イメージングは、実験終了時に組織が軸方向(<10μm)または横方向に有意に移動しなかった場合に成功したと見なされます(図4)。これは、対象のAPIのSRS測定が、定量化が層特異的である初期深さを代表していない場合の即時の指標です。これは、関心のある各XY位置のzスタックをイメージングすることによって軽減され、トレードオフは時間分解能です。凍結皮膚がこれ?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
局所BA/BEの評価は、単一の方法が in vivo cPK を完全に特徴付けることができないため、多面的なアプローチを必要とする研究分野である。このプロトコルは、コヒーレントラマンイメージングに基づく外用医薬品のBA/BEの評価のための方法論を提示する。見落とされがちな最初のポイントの1つは、特に定量透過SRSイメージングの場合、皮膚サンプルがどれほど薄くなければならないかと?...
Access restricted. Please log in or start a trial to view this content.
開示事項
CLEは、複数の顕微鏡メーカーにライセンス供与されているCARS顕微鏡の特許の発明者です。他のすべての著者は、開示する利益相反はありません。
謝辞
著者らは、この原稿の議論と校正に対して、エバンス・グループのフォティス・イリオプロス博士とダニエル・グリーンフィールド博士に感謝したい。さらに、著者らはレオ・ファーマからの支援に感謝したいと思います。 図 2 は、 BioRender.com で作成したものです。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Tissue Preparation | |||
| Autoclavable Biohazard Bags | FisherBrand | 22-044562 | As refered to in text: biohazard bags https://www.fishersci.com/shop/products/fisherbrand-polyethylene-biohazard-autoclave-bags-without-sterilization-indicator-8/22044562?searchHijack=true&searchTerm= 22044562&searchType=RAPID& matchedCatNo=22044562 |
| Cell Culture Buffers: Dulbecco's Phosphate-Buffered Salt Solution 1x | Corning | MT21030CV | As refered to in text: PBS https://www.fishersci.com/shop/products/corning-cellgro-cell-culture-buffers-dulbecco-s-phosphate-buffered-salt-solution-1x-8/MT21030CV?searchHijack=true&searchTerm= 21-030-cv&searchType= RAPID&matchedCatNo=21-030-cv |
| Disposable Scalpels | Exel International | 14-840-00 | As refered to in text: scalpel https://www.fishersci.com/shop/products/exel-international-disposable-scalpels-3/1484000?keyword=true |
| High Precision 45° Angle Broad Point Tweezers/Forceps | Fisherbrand | 12-000-132 | As refered to in text: forceps https://www.fishersci.com/shop/products/high-precision-45-angle-broad-point-tweezers-forceps/12000132#?keyword= |
| Kimwipes Delicate Task Wipers, 1-Ply | Kimberly-Clark Professional Kimtech Science | 06-666 | As refered to in text: task wiper https://www.fishersci.com/shop/products/kimberly-clark-kimtech-science-kimwipes-delicate-task-wipers-7/06666 |
| Parafilm M Laboratory Wrapping Film | Bemis | 13-374-12 | As refered to in text: parafilm https://www.fishersci.com/shop/products/curwood-parafilm-m-laboratory-wrapping-film-4/1337412 |
| Petri Dish (35 mm x 10 mm) | Fisherbrand | FB0875711YZ | As refered to in text: small petri dish https://www.fishersci.com/shop/products/fisherbrand-petri-dishes-specialty-6/FB0875711YZ?keyword=true |
| Petri Dish (60 mm x 15 mm) | Fisherbrand | FB0875713A | As refered to in text: large petri dish https://www.fishersci.com/shop/products/fisherbrand-petri-dishes-clear-lid-12/FB0875713A?keyword=true |
| Surgical Scissors | Roboz | NC9411473 | As refered to in text: scissors https://www.fishersci.com/shop/products/scissors-327/NC9411473?searchHijack=true&searchTerm= RS-5915SC&searchType=RAPID& matchedCatNo=RS-5915SC |
| Laser/microscope | |||
| 650/60 nm BrightLine single-band bandpass filter | Semrock | As refered to in text: CARS filter - CH2 vibrations (645nm/60nm filter) | |
| Control box IX2-UCB | Olympus | As refered to in text: Control Box | |
| D700/30m | Chroma | As refered to in text: CARS filter - deuterated band https://www.chroma.com/products/parts/d700-30m | |
| DeepSee Insight | Spectra-Physics | As refered to in text: Laser https://www.spectra-physics.com/f/insight-x3-tunable-laser | |
| Digital Handheld Optical Power and Energy Meter Console | ThorLabs | PM100D | As refered to in text: power meter https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=3341 |
| Fluoview Software | Olympus | As refered to in text: Microscope Control software | |
| Frosted Microscope Slides | FisherBrand | As refered to in text: microscope slides https://www.fishersci.com/shop/products/fisherbrand-frosted-microscope-slides-4/22265446 | |
| FV1000 | Olympus | As refered to in text: Microscope | |
| Incubation Chamber | Tokai Hit | GM-800 | As refered to in text: incubation chamber |
| Integrating Sphere Photodiode Power Sensor | ThorLabs | S142C | As refered to in text: photodiode https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=3341 |
| Power supply FV31-PSU | Olympus | As refered to in text: Power Supply | |
| Precision 4063, 80MHz Dual Channel Function Generator | BK Precision | As refered to in text: function generator | |
| ProScan – Precision Microscope Automation | Prior Scientific Instruments | As refered to in text: stage controller https://www.prior.com/microscope-automation/inverted-microscope-systems/proscan-linear-stage-highest-precision-microscope-automation | |
| SecureSeal Imaging Spacers | Grace Biolabs | 654004 | As refered to in text: spacer https://gracebio.com/product/secureseal-imaging-spacers-654004/ |
| SRS Detection Kit | APE | As refered to in text: SRS detector | |
| UPLSAPO 20X NA:0.75 | Olympus | As refered to in text: 20X Objective https://www.olympus-lifescience.com/en/objectives/uplsapo/ | |
| Lipid/Drug Imaging | |||
| 35 mm Dish, No. 0 Uncoated Coverslip, 14 mm Glass Diameter | MatTek Corporation | NC9711297 | As refered to in text: Glass bottom dish https://www.fishersci.com/shop/products/glass-bottom-mircrowell-dish/nc9711297 |
| Cotton-tipped applicators | FisherBrand | As refered to in text: Cotton-tipped applicator | |
| Distriman Postive Displacement Pipette | Gilson | As refered to in text: Postive Displacement Pipette https://www.fishersci.com/shop/products/gilson-distriman-positive-displacement-repetitive-pipette/F164001G#?keyword= | |
| Distriman Postive Displacement Pipette Tips | Gilson | As refered to in text: Tips for pipette https://www.fishersci.com/shop/products/gilson-distritip-syringes-6/f164100g?keyword=true | |
| Data Analysis | |||
| FIJI | Open-source | As refered to in text: FIJI/ImageJ https://imagej.net/software/fiji/ | |
| Jupyter-Lab | open-source | As refered to in text: JupyterLab https://jupyter.org/ | |
| Rstudio | Open-source | As refered to in text: Rstudio https://www.rstudio.com/ |
参考文献
- Finnin, B., Walters, K. A., Franz, T. J. In vitro skin permeation methodology. In Transdermal and topical drug delivery: principles and methodology. Transdermal and topical drug delivery: principles and practice. Benson, H. E., Watkinson, A. C. , John Wiley & Sons. Hoboken NJ USA. 85-108 (2012).
- Shin, S. H., et al. On the road to development of an in vitro permeation test (IVPT) model to compare heat effects on transdermal delivery systems: exploratory studies with nicotine and fentanyl. Pharmaceutical Research. 34 (9), 1817-1830 (2017).
- Hossain, A., et al. Preparation, characterisation, and topical delivery of terbinafine. Pharmaceutics. 11 (10), 548(2019).
- Santos, L. L., Swofford, N. J., Santiago, B. G. In vitro permeation test (IVPT) for pharmacokinetic assessment of topical dermatological formulations. Current Protocols in Pharmacology. 91 (1), 79(2020).
- Iliopoulos, F., Caspers, P. J., Puppels, G. J., Lane, M. E. Franz cell diffusion testing andquantitative confocal Raman spectroscopy: In vitro-in vivo correlation. Pharmaceutics. 12 (9), 887(2020).
- Cordery, S., et al. Topical bioavailability of diclofenac from locally-acting, dermatological formulations. International Journal of Pharmaceutics. 529 (1-2), 55-64 (2017).
- Pensado, A., et al. Stratum corneum sampling to assess bioequivalence between topicalacyclovir products. Pharmaceutical Research. 36 (12), 1-16 (2019).
- Zhang, Y., et al. Dermal delivery of niacinamide-in vivo studies. Pharmaceutics. 13 (5), 726(2021).
- Bodenlenz, M., et al. Open flow microperfusion as a dermal pharmacokinetic approach to evaluate topical bioequivalence. Clinical Pharmacokinetics. 56 (1), 91-98 (2017).
- Eirefelt, S., et al. Evaluating dermal pharmacokinetics and pharmacodymanic effect of soft topical PDE4 inhibitors:Open flow microperfusion and skin biopsies. Pharmaceutical Research. 37 (12), 1-12 (2020).
- Stagni, G., O'Donnell, D., Liu, Y. J., Kellogg, J. D. L., Shepherd, A. M. Iontophoretic current and intradermal microdialysis recovery in humans. Journal of Pharmacological and Toxicological Methods. 41 (1), 49-54 (1999).
- Garcia Ortiz, P., Hansen, S. H., Shah, V. P., Menne, T., Benfeldt, E. Impact of adultatopic dermatitis on topical drug penetration: assessment by cutaneous microdialysis and tape stripping. Acta Dermato-Venereologica. 89 (1), 33-38 (2009).
- Joshi, A., Patel, H., Joshi, A., Stagni, G. Pharmacokinetic applications of cutaneous microdialysis: Continuous+intermittent vs continuous-only sampling. Journal of Pharmacological and Toxicological Methods. 83, 16-20 (2017).
- Kuzma, B. A., et al. Evaluation of local bioavailability of metronidazole from topical formulations using dermal microdialysis: Preliminary study in a Yucatan mini-pig model. European Journal of Pharmaceutical Sciences. 159, 105741(2021).
- Begley, R., Harvey, A., Byer, R. L.Coherent anti-Stokes Raman spectroscopy. Applied Physics Letters. 25 (7), 387-390 (1974).
- Evans, C. L., et al. Chemical imaging of tissue in vivo with video-rate coherent anti-Stokes Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (46), 16807-16812 (2005).
- Hill, A. H., Manifold, B., Fu, D. Tissue imaging depth limit of stimulated Raman scattering microscopy. Biomedical Optics Express. 11 (2), 762-774 (2020).
- Feizpour, A., Marstrand, T., Bastholm, L., Eirefelt, S., Evans, C. L. Label-free quantification of pharmacokinetics in skin with stimulated Raman scattering microscopy and deep learning. Journal of Investigative Dermatology. 141 (2), 395-403 (2021).
- Ghosh, B., Reddy, L. H., Kulkarni, R. V., Khanam, J. Comparison of skin permeability of drugs in mice and human cadaver skin. Indian Journal of Experimental Biology. 38 (1), 42-45 (2000).
- Nielsen, J. B., Plasencia, I., Sørensen, J. A., Bagatolli, L. Storage conditions of skin affect tissue structure and subsequent in vitro percutaneous penetration. Skin Pharmacology and Physiology. 24 (2), 93-102 (2011).
- Barbero, A. M., Frasch, H. F. Effect of frozen human epidermis storage duration and cryoprotectant on barrier function using two model compounds. Skin Pharmacology and Physiology. 29 (1), 31-40 (2016).
- Babu, R., et al. The influence of various methods of cold storage of skin on the permeation of melatonin and nimesulide. Journal of Controlled Release. 86 (1), 49-57 (2003).
- Skelly, J. P., et al. FDA and AAPS report of the workshop on principles and practices of in vitro percutaneous penetration studies: relevance to bioavailability and bioequivalence. Pharmaceutical Research. 4 (3), 265-267 (1987).
- OECD. Guidance document for the conduct of skin absorption studies. OECD. , (2004).
- OECD. Test no. 428: Skin absorption: In vitro method. OECD. , (2004).
- Saar, B. G., et al. Video-rate molecular imaging in vivo with stimulated Raman scattering. Science. 330 (6009), 1368-1370 (2010).
- Saar, B. G., Contreras-Rojas, L. R., Xie, X. S., Guy, R. H. Imaging drug delivery to skin with stimulated Raman scattering microscopy. Molecular Pharmaceutics. 8 (3), 969-975 (2011).
- Pence, I. J., Kuzma, B. A., Brinkmann, M., Hellwig, T., Evans, C. L. Multi-windowsparse spectral sampling stimulated Raman scattering microscopy. Biomedical Optics Express. 12 (10), 6095-6114 (2021).
- Herkenne, C., et al. In vivo methods for the assessment of topical drug bioavailability. Pharmaceutical Research. 25 (1), 87-103 (2008).
- Alfonso-Garcıa, A., Mittal, R., Lee, E. S., Potma, E. O. Biological imaging with coherent Raman scattering microscopy: a tutorial. Journal of Biomedical Optics. 19 (7), 071407(2014).
- Osseiran, S., et al. Longitudinal monitoring of cancer cell subpopulations in monolayers, 3D spheroids, and xenografts using the photoconvertible dye DiR. Scientific Reports. 9 (1), 1-10 (2019).
- Evennett, P. Kohler illumination: a simple interpretation. Proceedings of the Royal Microscopical Society. 28 (4), 189-192 (1983).
- Sanderson, J. Fundamentals of microscopy. Current Protocols in Mouse Biology. 10 (2), 76(2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Hunter, J. D. Matplotlib: A 2D graphics environment. Computing in Science & Engineering. 9 (3), 90-95 (2007).
- Wickham, H. ggplot2: Elegant Graphics for Data Analysis. , Springer-Verlag. New York. (2016).
- Kim, H., Han, S., Cho, Y. S., Yoon, S. K., Bae, K. Development of R packages:'Non-Compart' and 'ncar' for noncompartmental analysis (NCA). Translational and Clinical Pharmacology. 26 (1), 10-15 (2018).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved