このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
インデンテーションと磁気共鳴エラストグラフィを用いた軟組織模倣ゼラチンファントムの粘弾性特性評価
要約
この記事では、軟部組織を模倣したゼラチンファントムを作るためのプロトコルのデモンストレーションと要約、およびインデンテーションと磁気共鳴エラストグラフィーを使用した対応する粘弾性特性評価を紹介します。
要約
軟部生体組織の生体力学的特性の特性評価は、組織力学を理解し、疾患、損傷、および発生の生体力学関連のメカニズムを探求するために重要です。機械的試験方法は、組織の特性評価のための最も簡単な方法であり、 in vivo 測定の検証と見なされます。多くの ex vivo 機械的試験技術の中で、押し込み試験は、特に脳組織などの小さく、固定が難しく、粘弾性のあるサンプルに対して、信頼性の高い方法を提供します。磁気共鳴エラストグラフィ(MRE)は、軟組織の生体力学的特性を測定するために臨床的に使用される方法です。MREを用いて記録した軟部組織における横波伝搬に基づいて、波動方程式に基づいて軟組織の粘弾性特性を in vivo で推定することができます。ここでは、2つの異なる濃度を有するゼラチンファントムの粘弾性特性をMREおよび圧痕により測定した。ファントム製造、テスト、および弾性率推定のプロトコルが提示されています。
概要
軟部生体組織のほとんどは、その損傷と発達を理解するために重要な粘弾性特性を持っているようです1,2。さらに、粘弾性特性は、線維症および癌3、4、5、6などの様々な疾患の診断において重要なバイオマーカーである。したがって、軟組織の粘弾性特性の特性評価は非常に重要です。使用される多くの特性評価技術の中で、組織サンプルのex vivo機械的試験および生物医学的イメージングを用いたin vivoエラストグラフィは、広く使用されている2つの方法である。
軟部組織の特性評価にはさまざまな機械的試験技術が使用されてきましたが、サンプルサイズと試験条件の要件を満たすことは容易ではありません。例えば、せん断試験は、せん断プレート7の間に試料を強固に固定する必要がある。二軸試験は膜組織により適しており、特定のクランプ要件があります8,9。圧縮試験は組織試験に一般的に使用されるが、1つのサンプル10内の特定の位置を特徴付けることはできない。押し込みテストには、組織サンプルを固定するための追加要件はなく、脳や肝臓などの多くの生物学的組織サンプルの測定に使用できます。さらに、小さな圧子ヘッドを使用して、サンプル内の領域特性をテストできます。そのため、押し込み試験は、種々の軟部組織1、3、11を試験するために採用されている。
生体内の軟組織の生体力学的特性を特徴付けることは、バイオメカニクスのトランスレーショナル研究および臨床応用にとって重要です。超音波(US)や磁気共鳴(MR)イメージングなどの生物医学イメージングモダリティは、最も使用されている技術です。米国のイメージングは比較的安価で簡単に実行できますが、コントラストが低く、脳などの臓器を測定することは困難です。深部構造をイメージングすることができるMRエラストグラフィ(MRE)は、様々な軟組織6,12、特に脳13,14を測定することができる。外部振動を加えることで、MREは特定の周波数で軟組織の粘弾性特性を測定できます。
研究によると、50-60 Hzでは、正常な脳のせん断弾性率は~1.5-2.5kPa 5,6,13,14,15であり、正常な肝臓では~2-2.5 kPaです16。したがって、同様の生体力学的特性を有するゼラチンファントムは、試験および検証のために軟組織を模倣するために広く使用されてきた17、18、19。このプロトコルでは、2つの異なる濃度のゼラチンファントムを調製し、試験した。ゼラチンファントムの粘弾性特性は、特注の電磁MRE装置14および圧痕装置1,3を用いて特徴付けた。テストプロトコルは、脳や肝臓などの多くの軟組織のテストに使用できます。
プロトコル
1.ゼラチンファントム調製
- ゼラチン、グリセロール、および水を 表1に従って計量します。ゼラチン粉末を水と混合してゼラチン溶液を得る。
注:2つのファントムを準備するための個々のコンポーネントの濃度を 表1に示します。ゼラチンの濃度が高いほど、ファントムは硬くなります。 - ゼラチン溶液を水浴中で60°Cに加熱する。温度を維持しながらゼラチン溶液にグリセロールを加える。
注:グリセロールは、ゼラチン混合物の融解温度とせん断弾性率を上げることにより、ゼラチン混合物を安定化させます17。 - 溶液をかき混ぜ、再び60°Cに加熱します。MREおよび圧痕テストに使用する容器に混合溶液を注ぎます。溶液を室温に冷却し、溶液が固まるまで待ちます。
2.MREテスト
- ゼラチンファントムの上に振動板を置きます。ファントムと振動板の接触がしっかりしていることを確認します(図1A)。
注意: 振動板はポリアミド製で、寸法は50 x 50 x 5 mm3です。 - ゼラチンファントムをヘッドコイルに配置します。ゼラチンファントムの周りにスポンジと土嚢を置き、ファントムがしっかりと配置されていることを確認します。伝送バー14、18を備えた特注の電磁アクチュエータを使用する。ヘッドコイルに電磁アクチュエータを取り付けます。トランスミッションバーを振動プレートに接続します(図1B)。
- アクチュエータの電源ラインをアンプに接続します。制御線をコントローラに接続します(図1C)。
- アクチュエータとMRIスキャンパラメータの設定
- 関数発生器で波形、振動周波数、振幅を設定します。パワーアンプを調整して、希望の振動振幅を設定します。
注:ここでは、波形は関数発生器で正弦波に設定されています。振動周波数は40Hzまたは50Hzに設定され、振幅は1.5Vppに設定されます。パワーアンプでは、増幅率は40%に設定されている。 - 関数発生器をトリガ・モードで動作するように設定します。トリガーラインをMRI装置の外部トリガーポートに接続します。
- MREスキャン(アクチュエータ)周波数を関数発生器と同じに設定し、モーションエンコーディング勾配が振動板の動きと同期するようにします。
- 関数発生器で波形、振動周波数、振幅を設定します。パワーアンプを調整して、希望の振動振幅を設定します。
- データ測定と分析
- 通常のイメージングポジショニング手順に従います。ゼラチンファントム20のイメージングに2Dグラジエントエコー(GRE)ベースのMREシーケンスを使用する。GRE-MREイメージングパラメータを次のように設定します:フリップ角度= 30°;TR/TE = 50/31 ミリ秒;視野= 300 mm;スライスの厚さ= 5 mm;ボクセルサイズ= 2.34 x 2.34 mm2。
- 1つの正弦波サイクルの4つの時間点で位相像を測定します。各時点で正と負の両方のモーションエンコーディンググラデーションを適用します。
- 取得した位相画像に基づいて、正負符号化位相画像を差し引いて背景位相を除去する。信頼性ソートベースのアルゴリズム21でフェーズをアンラップします。
- ラップされていない位相画像に高速フーリエ変換を適用して、モーションの主成分を抽出します。デジタルバンドパスフィルターで位相画像をフィルタリングします。2D直接反転(DI)アルゴリズムを使用してせん断弾性率を推定し、貯蔵弾性率G'と損失弾性率G''13,14を取得します。
注:バンドパスフィルタのカットオフ周波数は[0.04 0.08]です。DIアルゴリズムのフィットウィンドウのサイズは11 x 11です。
3.押し込みテスト
- 円形パンチまたは外科用ブレードを使用して、ゼラチンファントムをそれぞれ円筒形または直方体のサンプルにトリミングします。サンプルの厚さが3〜10 mmで、円筒形サンプルまたは直方体の長辺の直径が4 mmより大きいことを確認してください。鋭利な刃を使用してサンプルの表面をトリミングし、くぼみのためにできるだけ滑らかにします。
- 押し込みテスターの電源を入れます。圧子接触手順を自動化するように設計された圧子制御プログラム(カスタムプログラム、 部品表を参照)を使用して、以下を実行します。
- GUIの Backoff ボタンをクリックして、キャリブレーションプロセスを初期化します(図2B)。レーザー センサーから値を読み取り、[ ベースライン ] ボックスに値を入力します。
注意: キャリブレーションプロセス中に、レーザーセンサーとバッフルプレートの間の距離は、特定の事前定義された値に調整されます。 - バッフルプレートにスライドガラスを置き、レーザーセンサーによって示された値を記録します。次に、サンプルをスライドガラスに置き、バッフルプレートに一緒に置きます。レーザーセンサーから値を読み取り、この値を サンプル+スライド ボックスに入力します。
注意: レーザーセンサーは、くぼみの変位を記録するために使用されますが、テスト前にサンプルの厚さを測定するためにも使用されます。 - ステップ3.2.2で得られた2つの値の差を、関心領域(ROI)のサンプル厚さとして取ります。
- 圧子の真下に下にあるスライドガラスと一緒にサンプルを慎重に置き、[接触]ボタンをクリックして、圧子とサンプル表面の間の自動 接触 を開始します。
注意: 自動接触が十分でない場合、つまり圧子がサンプルの奥深くまで押し込まれるか、接触がない場合は、[ オフセット ]ボックスに0.05〜0.1 mmの範囲の値を入力して圧子の位置を調整し、手順1.2.1〜1.2.4を繰り返します。 - 測定されたサンプルの厚さ(ステップ3.2.3)に基づいて、厚さにくぼみのある試験ひずみを掛けて、押し込み変位(つまり、総押し込み深さ)を推定します(ここでは、押し込みを小さなひずみの仮定内に維持するために≤8%に設定されています)。
- 変位値(手順 3.2.5)を [変位 (mm)] ボックスに入力します。[ 滞留時間 ]ボックスで緩和時間を180秒に設定します。[ インデント ]ボタンをクリックします。ランプホールド手順中の変位と反力は自動的に記録され、指定された ファイルパスのファイルに保存されます。
注: ファイル パスは、テスト データを保存するための パス として事前に定義できます。
- GUIの Backoff ボタンをクリックして、キャリブレーションプロセスを初期化します(図2B)。レーザー センサーから値を読み取り、[ ベースライン ] ボックスに値を入力します。
- インデント データをスプレッドシートにエクスポートします。2項のProny級数
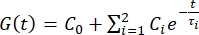 を使用して、力緩和曲線1、3、11を適合させます。
を使用して、力緩和曲線1、3、11を適合させます。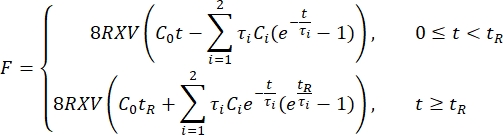
- 適合パラメータに基づいて瞬間せん断弾性率(G 0)と長期せん断弾性率(G∞)を推定します。
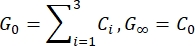
注:上記の式において、C0、Ci、およびτiはプロニー級数のモデルパラメータ、Fは押し込み力、Rは圧子の半径、Xは無限半空間仮定の補償係数、Vは押し込み速度、tは時間変数、tRはランプ時間です。
結果
MREプロトコルに従って、40Hzおよび50Hzでゼラチンファントム内の明確な横波伝播が観察されました(図3)。MREから測定した粘弾性特性、および押し込み試験を 図4に示します。各ファントムの各テストで推定されたG'およびG"値を 表2にまとめます。インデンテーションプロトコルに従って、各テストポイントにおける各ファントムの粘弾?...
ディスカッション
ゼラチンファントムは、アルゴリズムおよびデバイスの試験および検証のための組織模倣材料として一般的に使用される17、19、22、23、24、25、26、27。MREと動的せん断試験を比較するためにゼ?...
開示事項
著者は利益相反を宣言しません。
謝辞
中国国家自然科学基金会(助成金31870941)、上海自然科学基金会(助成金22ZR1429600)、上海市科学技術委員会(助成金19441907700)からの資金援助が認められています。
資料
| Name | Company | Catalog Number | Comments |
| 24-channel head & Neck coil | United Imaging Healthcare | 100120 | Equipment |
| 3T MR Scanner | United Imaging Healthcare | uMR 790 | Equipment |
| Acquisition board | Advantech Co | PCI-1706U | Equipment |
| Computer-Windows | HP | 790-07 | Equipment |
| Electromagnetic actuator | Shanghai Jiao Tong University | Equipment | |
| Function generator | RIGOL | DG1022Z | Equipment |
| Gelatin | CARTE D’OR | Reagent | |
| Glycerol | Vance Bioenergy Sdn.Bhd | Reagent | |
| Indenter control program | custom-designed | Software; accessed via: https://github.com/aaronfeng369/FengLab_indentation_code. | |
| Laser sensor | Panasonic | HG-C1050 | Equipment |
| Load cell | Transducer Technique | GSO-10 | Equipment |
| MATLAB | Mathworks | Software | |
| Power amplifier | Yamaha | A-S201 | Equipment |
| Voice coil electric motor | SMAC Corporation | DB2583 | Equipment |
参考文献
- Qiu, S., et al. Viscoelastic characterization of injured brain tissue after controlled cortical impact (CCI) using a mouse model. Journal of Neuroscience Methods. 330, 108463 (2020).
- Garcia, K. E., et al. Dynamic patterns of cortical expansion during folding of the preterm human brain. Proceedings of the National Academy of Sciences of the United States of America. 115 (12), 3156-3161 (2018).
- Qiu, S., et al. Characterizing viscoelastic properties of breast cancer tissue in a mouse model using indentation. Journal of Biomechanics. 69, 81-89 (2018).
- Yin, Z., et al. A new method for quantification and 3D visualization of brain tumor adhesion using slip interface imaging in patients with meningiomas. European Radiology. 31 (8), 5554-5564 (2021).
- Streitberger, K. -. J., et al. How tissue fluidity influences brain tumor progression. Proceedings of the National Academy of Sciences of the United States of America. 117 (1), 128 (2020).
- Bunevicius, A., Schregel, K., Sinkus, R., Golby, A., Patz, S. REVIEW: MR elastography of brain tumors. NeuroImage: Clinical. 25, 102109 (2020).
- Namani, R., et al. Elastic characterization of transversely isotropic soft materials by dynamic shear and asymmetric indentation. Journal of Biomechanical Engineering. 134 (6), 061004 (2012).
- Potter, S., et al. A novel small-specimen planar biaxial testing system with full in-plane deformation control. Journal of Biomechanical Engineering. 140 (5), 0510011 (2018).
- Zhang, W., Feng, Y., Lee, C. -. H., Billiar, K. L., Sacks, M. S. A generalized method for the analysis of planar biaxial mechanical data using tethered testing configurations. Journal of Biomechanical Engineering. 137 (6), 064501 (2015).
- Delaine-Smith, R. M., Burney, S., Balkwill, F. R., Knight, M. M. Experimental validation of a flat punch indentation methodology calibrated against unconfined compression tests for determination of soft tissue biomechanics. Journal of the Mechanical Behavior of Biomedical Materials. 60, 401-415 (2016).
- Chen, Y., et al. Comparative analysis of indentation and magnetic resonance elastography for measuring viscoelastic properties. Acta Mechanica Sinica. 37 (3), 527-536 (2021).
- Garteiser, P., Doblas, S., Van Beers, B. E. Magnetic resonance elastography of liver and spleen: Methods and applications. NMR in Biomedicine. 31 (10), 3891 (2018).
- Arani, A., Manduca, A., Ehman, R. L., Huston Iii, J. Harnessing brain waves: a review of brain magnetic resonance elastography for clinicians and scientists entering the field. British Journal of Radiolology. 94 (1119), 20200265 (2021).
- Qiu, S., et al. An electromagnetic actuator for brain magnetic resonance elastography with high frequency accuracy. NMR in Biomedicine. 34 (12), 4592 (2021).
- Hiscox, L. V., et al. Standard-space atlas of the viscoelastic properties of the human brain. Human Brain Mapping. 41 (18), 5282-5300 (2020).
- Seyedpour, S. M., et al. Application of magnetic resonance imaging in liver biomechanics: A systematic review. Frontiers in Physiology. 12, 733393 (2021).
- Okamoto, R. J., Clayton, E. H., Bayly, P. V. Viscoelastic properties of soft gels: comparison of magnetic resonance elastography and dynamic shear testing in the shear wave regime. Physics in Medicine and Biology. 56 (19), 6379-6400 (2011).
- Feng, Y., et al. A multi-purpose electromagnetic actuator for magnetic resonance elastography. Magnetic Resonance Imaging. 51, 29-34 (2018).
- Zeng, W., et al. Nonlinear inversion MR elastography with low-frequency actuation. IEEE Transactions on Medical Imaging. 39 (5), 1775-1784 (2020).
- Wang, R., et al. Fast magnetic resonance elastography with multiphase radial encoding and harmonic motion sparsity based reconstruction. Physics in Medicine and Biology. 67 (2), (2022).
- Herraez, M. A., Burton, D. R., Lalor, M. J., Gdeisat, M. A. Fast two-dimensional phase-unwrapping algorithm based on sorting by reliability following a noncontinuous path. Applied Optics. 41 (35), 7437-7444 (2002).
- Gordon-Wylie, S. W., et al. MR elastography at 1 of gelatin phantoms using 3D or 4D acquisition. Journal of Magnetic Resonance. 296, 112-120 (2018).
- McGarry, M., et al. Uniqueness of poroelastic and viscoelastic nonlinear inversion MR elastography at low frequencies. Physics in Medicine and Biology. 64 (7), 075006 (2019).
- Zampini, M. A., Guidetti, M., Royston, T. J., Klatt, D. Measuring viscoelastic parameters in Magnetic Resonance Elastography: a comparison at high and low magnetic field intensity. Journal of the Mechanical Behavior of Biomedical Materials. 120, 104587 (2021).
- Ozkaya, E., et al. Brain-mimicking phantom for biomechanical validation of motion sensitive MR imaging techniques. Journal of the Mechanical Behavior of Biomedical Materials. 122, 104680 (2021).
- Guidetti, M., et al. Axially- and torsionally-polarized radially converging shear wave MRE in an anisotropic phantom made via Embedded Direct Ink Writing. Journal of the Mechanical Behavior of Biomedical Materials. 119, 104483 (2021).
- Badachhape, A. A., et al. The relationship of three-dimensional human skull motion to brain tissue deformation in magnetic resonance elastography studies. Journal of Biomechanical Engineering. 139 (5), 0510021 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved