Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Viskoelastische Charakterisierung weichgewebenachahmender Gelatinephantome mittels Eindringung und Magnetresonanz-Elastographie
In diesem Artikel
Zusammenfassung
Dieser Artikel präsentiert eine Demonstration und Zusammenfassung von Protokollen zur Herstellung von Gelatinephantomen, die Weichteile nachahmen, und die entsprechende viskoelastische Charakterisierung mittels Eindringung und Magnetresonanzelastographie.
Zusammenfassung
Die Charakterisierung biomechanischer Eigenschaften von weichen biologischen Geweben ist wichtig, um die Gewebemechanik zu verstehen und die biomechanischen Mechanismen von Krankheit, Verletzung und Entwicklung zu erforschen. Die mechanische Testmethode ist der einfachste Weg zur Gewebecharakterisierung und gilt als Nachweis für die In-vivo-Messung . Unter den vielen ex vivo mechanischen Testtechniken bietet der Eindrucktest einen zuverlässigen Weg, insbesondere für kleine, schwer zu fixierende und viskoelastische Proben wie Hirngewebe. Die Magnetresonanz-Elastographie (MRE) ist eine klinisch eingesetzte Methode zur Messung der biomechanischen Eigenschaften von Weichteilen. Basierend auf der Ausbreitung von Scherwellen in Weichteilen, die mit MRE aufgezeichnet wurde, können viskoelastische Eigenschaften von Weichteilen in vivo basierend auf einer Wellengleichung geschätzt werden. Hier wurden die viskoelastischen Eigenschaften von Gelatinephantomen mit zwei unterschiedlichen Konzentrationen mittels MRE und Indentation gemessen. Die Protokolle der Phantomherstellung, des Testens und der Modulschätzung wurden vorgestellt.
Einleitung
Die meisten weichen biologischen Gewebe scheinen viskoelastische Eigenschaften zu haben, die wichtig sind, um ihre Verletzung und Entwicklung zu verstehen 1,2. Darüber hinaus sind viskoelastische Eigenschaften wichtige Biomarker bei der Diagnose einer Vielzahl von Krankheiten wie Fibrose und Krebs 3,4,5,6. Daher ist die Charakterisierung der viskoelastischen Eigenschaften von Weichteilen entscheidend. Unter den vielen verwendeten Charakterisierungstechniken sind die mechanische Ex-vivo-Prüfung von Gewebeproben und die In-vivo-Elastographie mit biomedizinischer Bildgebung die beiden weit verbreiteten Methoden.
Obwohl verschiedene mechanische Testtechniken für die Charakterisierung von Weichgewebe verwendet wurden, sind die Anforderungen an Probengröße und Testbedingungen nicht einfach zu erfüllen. Zum Beispiel müssen bei der Scherprüfung Proben fest zwischen den Scherplatten7 befestigt werden. Die biaxiale Prüfung ist besser für Membrangewebe geeignet und hat spezifische Klemmanforderungen 8,9. Ein Kompressionstest wird üblicherweise für Gewebetests verwendet, kann jedoch keine spezifischen Positionen innerhalb einer Probecharakterisieren 10. Der Eindrucktest hat keine zusätzlichen Anforderungen zur Fixierung der Gewebeprobe und kann zur Messung vieler biologischer Gewebeproben wie Gehirn und Leber verwendet werden. Zusätzlich konnten mit einem kleinen Eindringkörper regionale Eigenschaften innerhalb einer Stichprobe getestet werden. Daher wurden Eindringtests eingeführt, um eine Vielzahl von Weichteilen 1,3,11 zu testen.
Die Charakterisierung der biomechanischen Eigenschaften von Weichteilen in vivo ist wichtig für translationale Studien und klinische Anwendungen der Biomechanik. Biomedizinische Bildgebungsmodalitäten wie Ultraschall (US) und Magnetresonanztomographie (MR) sind die am häufigsten verwendeten Techniken. Obwohl die US-Bildgebung relativ billig und einfach durchzuführen ist, leidet sie unter geringem Kontrast und ist schwer zu messende Organe wie das Gehirn. Die MR-Elastographie (MRE) ist in der Lage, tiefe Strukturen abzubilden und könnte eine Vielzahl von Weichteilenmessen 6,12, insbesondere das Gehirn13,14. Mit angelegter externer Vibration könnte MRE die viskoelastischen Eigenschaften von Weichteilen bei einer bestimmten Frequenz messen.
Studien haben gezeigt, dass bei 50-60 Hz der Schermodul des normalen Gehirns ~1,5-2,5kPa 5,6,13,14,15 und ~2-2,5 kPa für normale Leber beträgt 16. Daher wurden Gelatinephantome, die ähnliche biomechanische Eigenschaften aufweisen, häufig zur Nachahmung von Weichgeweben für Tests und Validierung verwendet17,18,19. In diesem Protokoll wurden Gelatinephantome mit zwei verschiedenen Konzentrationen hergestellt und getestet. Viskoelastische Eigenschaften der Gelatinephantome wurden unter Verwendung einer speziell angefertigten elektromagnetischen MRE-Vorrichtung14 und einer Eindringvorrichtung 1,3 charakterisiert. Die Testprotokolle könnten zum Testen vieler Weichteile wie Gehirn oder Leber verwendet werden.
Protokoll
1. Gelatine-Phantom-Zubereitung
- Wiegen Sie Gelatine, Glycerin und Wasser gemäß Tabelle 1. Mischen Sie das Gelatinepulver mit Wasser, um die Gelatinelösung zu erhalten.
ANMERKUNG: Die Konzentrationen der einzelnen Komponenten zur Herstellung der beiden Phantome sind in Tabelle 1 dargestellt. Je höher die Konzentration der Gelatine, desto steifer das Phantom. - Die Gelatinelösung im Wasserbad auf 60 °C erhitzen. Fügen Sie der Gelatinelösung Glycerin hinzu, während Sie die Temperatur beibehalten.
HINWEIS: Glycerin stabilisiert Gelatinegemische, indem es deren Schmelztemperatur und Schermodul17 erhöht. - Die Lösung umrühren und nochmals auf 60 °C erhitzen. Gießen Sie die gemischte Lösung in einen Behälter, der für MRE- und Eindringtests verwendet wird. Kühlen Sie die Lösung auf Raumtemperatur ab und warten Sie, bis die Lösung erstarrt ist.
2. MRE-Test
- Legen Sie die Vibrationsplatte auf das Gelatinephantom. Stellen Sie sicher, dass der Kontakt zwischen dem Phantom und der Vibrationsplatte fest ist (Abbildung 1A).
HINWEIS: Die Vibrationsplatte besteht aus Polyamid mit einer Abmessung von 50 x 50 x 5 mm3. - Legen Sie das Gelatinephantom in die Kopfspule. Legen Sie Schwämme und Sandsäcke um das Gelatinephantom, um sicherzustellen, dass das Phantom fest platziert ist. Verwenden Sie einen speziell angefertigten elektromagnetischen Aktuator mit einer Übertragungsstange14,18. Montieren Sie einen elektromagnetischen Aktor an der Kopfspule. Schließen Sie die Übertragungsschiene an die Vibrationsplatte an (Abbildung 1B).
- Verbinden Sie die Stromleitungen des Aktors mit dem Verstärker. Verbinden Sie die Steuerleitungen mit dem Controller (Abbildung 1C).
- Parametereinstellungen für Aktor und MRT-Scan
- Stellen Sie die Wellenform, Vibrationsfrequenz und Amplitude im Funktionsgenerator ein. Stellen Sie die gewünschte Schwingungsamplitude ein, indem Sie die Endstufe einstellen.
HINWEIS: Hier wird die Wellenform im Funktionsgenerator auf sinusförmig eingestellt; Die Schwingungsfrequenz wird auf 40 Hz oder 50 Hz und die Amplitude auf 1,5 Vpp eingestellt. In der Endstufe ist das Verstärkungsverhältnis auf 40% eingestellt. - Stellen Sie den Funktionsgenerator so ein, dass er im Triggermodus arbeitet. Verbinden Sie die Triggerleitung mit dem externen Triggerport des MRT-Geräts.
- Stellen Sie die MRE-Abtastfrequenz (Aktorfrequenz) auf die gleiche wie die des Funktionsgenerators ein, so dass der Bewegungskodierungsgradient mit der Bewegung der Vibrationsplatte synchronisiert wird.
- Stellen Sie die Wellenform, Vibrationsfrequenz und Amplitude im Funktionsgenerator ein. Stellen Sie die gewünschte Schwingungsamplitude ein, indem Sie die Endstufe einstellen.
- Datenmessung und -analyse
- Befolgen Sie die routinemäßigen bildgebenden Positionierungsverfahren. Verwenden Sie eine 2D-Gradientenecho-basierte (GRE)-basierte MRE-Sequenz für die Bildgebung des Gelatinephantoms20. Stellen Sie die GRE-MRE-Bildgebungsparameter wie folgt ein: Flip-Winkel = 30°; TR/TE = 50/31 ms; Sichtfeld = 300 mm; Scheibendicke = 5 mm; Voxelgröße = 2,34 x 2,34 mm2.
- Messen Sie die Phasenbilder an vier zeitlichen Punkten in einem sinusförmigen Zyklus. Wenden Sie zu jedem Zeitpunkt sowohl positive als auch negative Bewegungskodierungsverläufe an.
- Entfernen Sie basierend auf dem aufgenommenen Phasenbild die Hintergrundphase, indem Sie die positiven und negativen kodierten Phasenbilder subtrahieren. Entpacken Sie die Phase mit einem auf Zuverlässigkeitssortierung basierenden Algorithmus21.
- Extrahieren Sie die Hauptkomponente der Bewegung, indem Sie eine schnelle Fourier-Transformation auf die unverpackten Phasenbilder anwenden. Filtern Sie das Phasenbild mit einem digitalen Bandpassfilter. Schätzen Sie den Schubmodul mit einem 2D-DI-Algorithmus (Direct Inversion), um den Speichermodul G' und den Verlustmodul G''13,14 zu erhalten.
HINWEIS: Die Grenzfrequenz des Bandpassfilters beträgt [0,04 0,08]. Die Größe des passenden Fensters des DI-Algorithmus beträgt 11 x 11.
3. Eindringprüfung
- Verwenden Sie einen kreisförmigen Stempel oder eine chirurgische Klinge, um das Gelatinephantom in eine zylindrische bzw. quaderförmige Probe zu trimmen. Stellen Sie sicher, dass die Probendicke zwischen 3 und 10 mm liegt und der Durchmesser der zylindrischen Probe oder der Längsseite des Quaders größer als 4 mm ist. Verwenden Sie eine scharfe Klinge, um die Oberfläche der Probe zu trimmen, um sie so glatt wie möglich für den Eindruck zu machen.
- Schalten Sie den Eindringtester ein. Führen Sie die folgenden Schritte mit dem Eindringkörpersteuerungsprogramm aus, das zur Automatisierung des Eindringkörperkontakts entwickelt wurde (benutzerdefiniertes Programm; siehe Materialtabelle).
- Klicken Sie in der grafischen Benutzeroberfläche auf die Schaltfläche Back off , um den Kalibrierungsvorgang zu initialisieren (Abbildung 2B). Lesen Sie den Wert vom Lasersensor, und geben Sie den Wert in das Feld BaseLine ein.
HINWEIS: Während des Kalibrierungsprozesses wird der Abstand zwischen dem Lasersensor und der Prallplatte auf einen bestimmten vordefinierten Wert eingestellt. - Legen Sie einen Objektträger auf die Prallplatte und notieren Sie den vom Lasersensor angezeigten Wert. Als nächstes legen Sie die Probe auf den Glasobjektträger und legen Sie sie zusammen auf die Prallplatte. Lesen Sie den Wert vom Lasersensor, und geben Sie diesen Wert in das Feld Sample+Slide ein.
HINWEIS: Der Lasersensor wird verwendet, um die Verschiebung des Eindrucks aufzuzeichnen, aber er wird auch verwendet, um die Probendicke vor dem Test zu messen. - Nehmen Sie die Differenz zwischen den beiden in Schritt 3.2.2 erhaltenen Werten als Probendicke im interessierenden Bereich (ROI).
- Legen Sie die Probe vorsichtig zusammen mit dem darunter liegenden Glasobjektträger direkt unter den Eindringkörper und klicken Sie dann auf die Schaltfläche Kontakt, um den automatischen Kontakt zwischen dem Eindringkörper und der Probenoberfläche zu initiieren.
HINWEIS: Wenn der automatische Kontakt nicht zufriedenstellend ist, d. h. der Eindringkörper tief in die Probe drückt oder keinen Kontakt hat, passen Sie die Position des Eindringkörpers an, indem Sie einen Wert im Bereich von 0,05-0,1 mm in das Feld Versatz eingeben und die Schritte 1.2.1-1.2.4 wiederholen. - Schätzen Sie auf der Grundlage der gemessenen Probendicke (Schritt 3.2.3) die Eindringverschiebung (d. h. die gesamte Eindringtiefe), indem Sie die Dicke mit der eingerückten Prüfdehnung multiplizieren (hier wird sie auf ≤8 % festgelegt, um den Eindruck innerhalb der Annahme einer kleinen Dehnung zu halten).
- Geben Sie die Verschiebungswerte (Schritt 3.2.5) in das Feld Wegraum (mm) ein. Stellen Sie die Entspannungszeit im Feld Verweilzeit auf 180 s ein. Klicken Sie auf die Schaltfläche Einrückung . Die Verschiebung und die Reaktionskraft während des Rampenhaltevorgangs werden automatisch aufgezeichnet und in einer Datei unter dem angegebenen Dateipfad gespeichert.
HINWEIS: Der Dateipfad kann als Pfad zum Speichern von Testdaten vordefiniert werden.
- Klicken Sie in der grafischen Benutzeroberfläche auf die Schaltfläche Back off , um den Kalibrierungsvorgang zu initialisieren (Abbildung 2B). Lesen Sie den Wert vom Lasersensor, und geben Sie den Wert in das Feld BaseLine ein.
- Exportieren Sie die Einzugsdaten in eine Tabelle. Verwenden Sie eine Prony-Serie
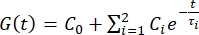 mit zwei Begriffen, um die Kraftrelaxationskurve 1,3,11 anzupassen:
mit zwei Begriffen, um die Kraftrelaxationskurve 1,3,11 anzupassen: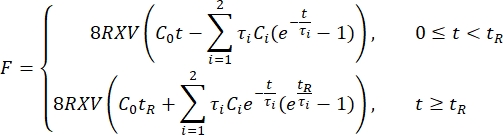
- Schätzen Sie den momentanen Schubmodul (G 0) und den Langzeitschubmodul (G∞) basierend auf den angepassten Parametern:
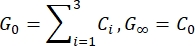
HINWEIS: In den obigen Gleichungen sind C 0, C i und τi Modellparameter der Prony-Reihe, F ist die Eindringkraft, R ist der Radius des Eindringkörpers, X ist der Kompensationsfaktor für die unendliche Halbraumannahme, V ist die Eindringgeschwindigkeit, t ist die Zeitvariable und t R ist die Rampenzeit.
Ergebnisse
Nach dem MRE-Protokoll wurde eine klare Scherwellenausbreitung in den Gelatinephantomen bei 40 und 50 Hz beobachtet (Abbildung 3). Die aus MRE und Eindringversuchen gemessenen viskoelastischen Eigenschaften sind in Abbildung 4 dargestellt. Die geschätzten G'- und G'-Werte bei jeder Prüfung für jedes Phantom sind in Tabelle 2 zusammengefaßt. Nach dem Eindringprotokoll sind die viskoelastischen Eigenschaften jedes Phantoms an jedem Prüfpunkt ...
Diskussion
Gelatinephantome werden üblicherweise als gewebenachahmende Materialien zum Testen und Validieren von Algorithmen und Geräten verwendet 17,19,22,23,24,25,26,27. Eine der bahnbrechenden Studien mit dem Gelatinephantom zum Vergleich von MRE und dynamischen ...
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Die finanzielle Unterstützung durch die National Natural Science Foundation of China (grant 31870941), die Natural Science Foundation of Shanghai (grant 22ZR1429600) und die Science and Technology Commission of Shanghai Municipality (grant 19441907700) wird anerkannt.
Materialien
| Name | Company | Catalog Number | Comments |
| 24-channel head & Neck coil | United Imaging Healthcare | 100120 | Equipment |
| 3T MR Scanner | United Imaging Healthcare | uMR 790 | Equipment |
| Acquisition board | Advantech Co | PCI-1706U | Equipment |
| Computer-Windows | HP | 790-07 | Equipment |
| Electromagnetic actuator | Shanghai Jiao Tong University | Equipment | |
| Function generator | RIGOL | DG1022Z | Equipment |
| Gelatin | CARTE D’OR | Reagent | |
| Glycerol | Vance Bioenergy Sdn.Bhd | Reagent | |
| Indenter control program | custom-designed | Software; accessed via: https://github.com/aaronfeng369/FengLab_indentation_code. | |
| Laser sensor | Panasonic | HG-C1050 | Equipment |
| Load cell | Transducer Technique | GSO-10 | Equipment |
| MATLAB | Mathworks | Software | |
| Power amplifier | Yamaha | A-S201 | Equipment |
| Voice coil electric motor | SMAC Corporation | DB2583 | Equipment |
Referenzen
- Qiu, S., et al. Viscoelastic characterization of injured brain tissue after controlled cortical impact (CCI) using a mouse model. Journal of Neuroscience Methods. 330, 108463 (2020).
- Garcia, K. E., et al. Dynamic patterns of cortical expansion during folding of the preterm human brain. Proceedings of the National Academy of Sciences of the United States of America. 115 (12), 3156-3161 (2018).
- Qiu, S., et al. Characterizing viscoelastic properties of breast cancer tissue in a mouse model using indentation. Journal of Biomechanics. 69, 81-89 (2018).
- Yin, Z., et al. A new method for quantification and 3D visualization of brain tumor adhesion using slip interface imaging in patients with meningiomas. European Radiology. 31 (8), 5554-5564 (2021).
- Streitberger, K. -. J., et al. How tissue fluidity influences brain tumor progression. Proceedings of the National Academy of Sciences of the United States of America. 117 (1), 128 (2020).
- Bunevicius, A., Schregel, K., Sinkus, R., Golby, A., Patz, S. REVIEW: MR elastography of brain tumors. NeuroImage: Clinical. 25, 102109 (2020).
- Namani, R., et al. Elastic characterization of transversely isotropic soft materials by dynamic shear and asymmetric indentation. Journal of Biomechanical Engineering. 134 (6), 061004 (2012).
- Potter, S., et al. A novel small-specimen planar biaxial testing system with full in-plane deformation control. Journal of Biomechanical Engineering. 140 (5), 0510011 (2018).
- Zhang, W., Feng, Y., Lee, C. -. H., Billiar, K. L., Sacks, M. S. A generalized method for the analysis of planar biaxial mechanical data using tethered testing configurations. Journal of Biomechanical Engineering. 137 (6), 064501 (2015).
- Delaine-Smith, R. M., Burney, S., Balkwill, F. R., Knight, M. M. Experimental validation of a flat punch indentation methodology calibrated against unconfined compression tests for determination of soft tissue biomechanics. Journal of the Mechanical Behavior of Biomedical Materials. 60, 401-415 (2016).
- Chen, Y., et al. Comparative analysis of indentation and magnetic resonance elastography for measuring viscoelastic properties. Acta Mechanica Sinica. 37 (3), 527-536 (2021).
- Garteiser, P., Doblas, S., Van Beers, B. E. Magnetic resonance elastography of liver and spleen: Methods and applications. NMR in Biomedicine. 31 (10), 3891 (2018).
- Arani, A., Manduca, A., Ehman, R. L., Huston Iii, J. Harnessing brain waves: a review of brain magnetic resonance elastography for clinicians and scientists entering the field. British Journal of Radiolology. 94 (1119), 20200265 (2021).
- Qiu, S., et al. An electromagnetic actuator for brain magnetic resonance elastography with high frequency accuracy. NMR in Biomedicine. 34 (12), 4592 (2021).
- Hiscox, L. V., et al. Standard-space atlas of the viscoelastic properties of the human brain. Human Brain Mapping. 41 (18), 5282-5300 (2020).
- Seyedpour, S. M., et al. Application of magnetic resonance imaging in liver biomechanics: A systematic review. Frontiers in Physiology. 12, 733393 (2021).
- Okamoto, R. J., Clayton, E. H., Bayly, P. V. Viscoelastic properties of soft gels: comparison of magnetic resonance elastography and dynamic shear testing in the shear wave regime. Physics in Medicine and Biology. 56 (19), 6379-6400 (2011).
- Feng, Y., et al. A multi-purpose electromagnetic actuator for magnetic resonance elastography. Magnetic Resonance Imaging. 51, 29-34 (2018).
- Zeng, W., et al. Nonlinear inversion MR elastography with low-frequency actuation. IEEE Transactions on Medical Imaging. 39 (5), 1775-1784 (2020).
- Wang, R., et al. Fast magnetic resonance elastography with multiphase radial encoding and harmonic motion sparsity based reconstruction. Physics in Medicine and Biology. 67 (2), (2022).
- Herraez, M. A., Burton, D. R., Lalor, M. J., Gdeisat, M. A. Fast two-dimensional phase-unwrapping algorithm based on sorting by reliability following a noncontinuous path. Applied Optics. 41 (35), 7437-7444 (2002).
- Gordon-Wylie, S. W., et al. MR elastography at 1 of gelatin phantoms using 3D or 4D acquisition. Journal of Magnetic Resonance. 296, 112-120 (2018).
- McGarry, M., et al. Uniqueness of poroelastic and viscoelastic nonlinear inversion MR elastography at low frequencies. Physics in Medicine and Biology. 64 (7), 075006 (2019).
- Zampini, M. A., Guidetti, M., Royston, T. J., Klatt, D. Measuring viscoelastic parameters in Magnetic Resonance Elastography: a comparison at high and low magnetic field intensity. Journal of the Mechanical Behavior of Biomedical Materials. 120, 104587 (2021).
- Ozkaya, E., et al. Brain-mimicking phantom for biomechanical validation of motion sensitive MR imaging techniques. Journal of the Mechanical Behavior of Biomedical Materials. 122, 104680 (2021).
- Guidetti, M., et al. Axially- and torsionally-polarized radially converging shear wave MRE in an anisotropic phantom made via Embedded Direct Ink Writing. Journal of the Mechanical Behavior of Biomedical Materials. 119, 104483 (2021).
- Badachhape, A. A., et al. The relationship of three-dimensional human skull motion to brain tissue deformation in magnetic resonance elastography studies. Journal of Biomechanical Engineering. 139 (5), 0510021 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten