Method Article
液体クロマトグラフィー-タンデム質量分析のためのシアノバクテリアからの非タンパク質アミノ酸の抽出(英語)
要約
本プロトコルは、液体クロマトグラフィー-タンデム質量分析を使用した分析前のトリクロロ酢酸(TCA)タンパク質沈殿および酸加水分解 を介した 生物学的マトリックスからの非タンパク質アミノ酸の抽出について説明しています。
要約
非タンパク質アミノ酸(NPAA)は、タンパク質への翻訳のために遺伝的にコードされていない大きなクラスのアミノ酸(AA)です。NPAAの分析は、細胞の取り込みおよび/または機能、代謝経路、および潜在的な毒性に関する重要な情報を提供することができます。β-メチルアミノ-L-アラニン(BMAA)は、さまざまな藻類種によって産生される神経毒性NPAAであり、神経変性疾患のリスクの増加と関連しており、重要な研究の関心につながっています。分析のためにAAを抽出する方法は数多くありますが、液体クロマトグラフィー-タンデム質量分析が最も一般的であり、タンパク質沈殿とそれに続くタンパク質ペレットの酸加水分解が必要です。藻類種におけるBMAAの存在に関する研究は、未検証のサンプル調製/抽出および分析の使用が主な原因であり、矛盾した結果を提供します。ほとんどのNPAAと同様に、10%水性TCAでのタンパク質沈殿および発煙HClによる加水分解は、BMAAおよびその異性体であるアミノエチルグリシン(AEG)および2,4-ジアミノ酪酸(2,4-DAB)の最も適切な抽出形態です。本プロトコルは、研究および教育ラボで一般的に使用される検証済みのNPAA抽出方法の手順を説明しています。
概要
アミノ酸は、少なくとも1つのアミンおよびカルボン酸官能基を含む化合物である。一部のアミノ酸には、カルボン酸以外の官能酸基であるイミノ基も含まれています。他のアミノ酸は、α炭素基1に結合していないアミン基を有する。500を超えるアミノ酸2があり、そのうち22はリボソームタンパク質合成における遺伝的コードに使用されるタンパク質アミノ酸として知られています3。これらの22個のアミノ酸は、必須および非必須にさらに細分することができる。必須アミノ酸は、生物が適切に機能するために必要であり、外部供給源によってのみ取得することができます。非必須アミノ酸は生物内で合成することができます。22個のアミノ酸の必須/非必須への分類は、個々の種に固有のものです。他のすべてのアミノ酸は、タンパク質合成用にコードされていない非タンパク質アミノ酸(NPAA)です。アミノ酸は、タンパク質であろうと非タンパク質であろうと、生物内でシグナル伝達の役割を果たし、代謝仲介者としても機能します4。それらの重要で多様な役割のために、アミノ酸レベルは生物の状態、機能、および代謝経路などへの洞察を提供することができます。アミノ酸をポリペプチド鎖に組み込むことができる2つの主要なメカニズムがあります:22個のアミノ酸をコードする際に利用するリボソームタンパク質合成と、タンパク質アミノ酸と一緒に合成にいくつかのNPAAの使用を可能にする非リボソームペプチド合成。特定のNPAAはタンパク質アミノ酸を模倣する可能性があり、ペプチドやタンパク質への誤取り込みにつながる可能性があります。誤取り込みはタンパク質のミスフォールディングを引き起こし、それが次に有害な影響を及ぼします5、チロシンの代わりにNPAA L-3,4ジヒドロキシフェニルアラニン(L-DOPA)の誤取り込みなど、細胞機能と健康に悪影響を及ぼします6,7。組み込まれたNPAAの追加の供給源は、アミノ酸残基の翻訳後修飾(PTM)によるものです。アミノ酸残基は、ペプチドまたはタンパク質の立体構造、安定性、および機能性の変化を含む様々な理由で修飾される。PTM含有タンパク質またはペプチドの加水分解により、これらの修飾アミノ酸残基はそれらの遊離NPAA形態8,9に放出される。
シアノバクテリア、珪藻、渦鞭毛藻10が産生するNPAA β-メチルアミノ-L-アラニン(BMAA)は、筋萎縮性側索硬化症/パーキンソニズム-認知症複合体(ALS-PDC)11,12、筋萎縮性側索硬化症、アルツハイマー病などのさまざまな神経変性疾患の一因として関与している疑いのある神経毒です13。.BMAAは、L-セリン14および/または他のタンパク質アミノ酸の代わりにタンパク質のポリペプチド鎖に誤って組み込まれていることが示唆されています。BMAAの誤取り込みは、タンパク質のミスフォールディングにつながり、ニューロン14にタンパク質凝集体の沈着をもたらす可能性があります。過去10年間で、BMAAへの関心は大幅に高まっています。淡水、海洋、および汽水環境からの広範囲のシアノバクテリア種がBMAA15を生成することが発見されており、さまざまな生態系に広く分布しています16,17。さらに、BMAAは、食物連鎖を通じてヒトの食物網に生物拡大することが示されています18,19。BMAA毒性の潜在的な健康への影響、理解の欠如、および不一致のため、BMAAの毒性が最終的に理解されるか、BMAAが安全であると見なされるまで、さらなる研究を継続することが不可欠です20,21。
生物学的サンプル中のアミノ酸の分析は、サンプル調製、アミノ酸誘導体化、分離と検出、同定と定量の4つの主要なステップに分けることができます。液体クロマトグラフィー-タンデム質量分析(LC-MS/MS)は、アミノ酸の標的で再現性のある分離と分析を提供するため、好ましい分析方法です。
シアノバクテリアやその他の藻類サンプルを分析するためのサンプル調製技術には、主に遊離およびタンパク質結合型のアミノ酸の抽出方法が含まれます。長年にわたり、抽出方法は、遊離アミノ酸を結合型から分離するためのサンプルの脱溶媒和、それに続くタンパク質沈殿および高温での塩酸(HCl)による加水分解による結合アミノ酸の放出を含む、一般的な要素と比較的一貫しています22。.この抽出形態は、タンパク質アミノ酸用に最適化されており、NPAAに採用されています。しかし、同じ種のシアノバクテリアにおけるBMAAとその異性体(図1)、アミノエチルグリシン(AEG)および2,4-ジアミノ酪酸(2,4-DAB)の検出と定量は、文献で一貫性のない結果を示しており、成長条件および/またはBMAAの量が異なるかまったく産生しない藻類の菌株の違いにある可能性があります23.BMAAおよびその異性体の検出および定量における不一致のより可能性の高い説明は、未検証の実験プロトコル、広範囲の分析技術の使用、および報告された方法における不十分な実験詳細によるものであると主張されている16,24再現不可能な実験室間データにつながる。しかし、Gloverら25およびBanack26は最近、国際分析化学者協会(AOAC)、米国薬局方、および単一実験室での検証に必要なFDAガイドラインに従って、超高速液体クロマトグラフィー(UPLC)-MS/MSを使用してBMAAとその異性体を検出および定量するための分析技術を開発し、検証しました。
これらの検証実験は、BMAAとその異性体の分離と検出に焦点を当てており、サンプル調製プロトコルの不一致には対処していませんでした。Lageら27は、LC-MS / MSを介してシアノバクテリアサンプル中のBMAAとその異性体を定量するための3つの一般的な抽出方法の性能を比較しました:遊離アミノ酸の固相抽出(SPE)28,29;メタノール抽出およびアセトン沈殿を含むタンパク質沈殿方法30;BMAAの最も一般的に使用される抽出方法であるトリクロロ酢酸(TCA)31によるタンパク質沈殿。彼らは、TCAタンパク質沈殿が最適なプロトコルであり、他の抽出方法と比較して試験サンプル中のより高いBMAA濃度をもたらすと結論付けました。彼らの研究は、シアノバクテリアマトリックス中の6-アミノキノリル-N-ヒドロキシスクシンイミジルカルバメート(AQC)を使用したBMAAの誘導体化によるTCA抽出を検証し、信頼性が高く再現性のあるBMAAデータを達成するための確立されたガイドを提供しました。TCAアミノ酸抽出は、他のマトリックスにも適用できる、受け入れられている一般的なサンプル調製技術です。しかしながら、加水分解中のアミノ酸の安定性は、分解または酸化を防止するために考慮する必要があり、これは化学修飾剤および還元剤32の使用によって克服することができる。TCA抽出は日常的に使用され、新しい研究生に教えられており、プロトコルは広く報告されていますが、この方法の適用における視覚的な補助は貴重なリソースであり、適切で一貫した実行を保証します。
逆相クロマトグラフィーはアミノ酸の分離に一般的に使用され、分析の前に誘導体化ステップが必要です。BMAAなどのアミノ酸の誘導体化により、クロマトグラフィーの保持が可能になり、異性体間の分離能が向上します。また、分子量を増加させ、質量分析計のイオン化を改善します。LC-MS/MSによるアミノ酸の分析には、クロロギ酸プロピル(PCF)33、6-アミノキノリル-N-ヒドロシスクシンイミジルカルバメート(AQC)27、クロロギ酸9-フルオレニルメチル(FMOC)34、塩化ダンシル(DC)35など、いくつかの誘導体化試薬が使用されています。ただし、BMAAを分析するための唯一の検証済みの手法では、誘導体化試薬としてPCF 36またはAQC24,26,37のいずれかを使用しました。
このプロトコルの範囲は、シアノバクテリアマトリックスからのNPAAのTCA抽出に焦点を当てています。これは労働集約的な方法であり、詳細が不足している可能性のある原稿に基づいて、学術および業界の研究所で日常的に使用され、教えられています。したがって、このプロトコルは、モデルアミノ酸としての遊離および結合BMAAの分析のためのサンプルの調製に関連する手順および技術の詳細を提供する。
プロトコル
シアノバクテリア種 メリスモペディア を本研究38に用いた。
1. 生サンプル調製
- 目的の水生源またはシアノバクテリア培養フラスコから藻類スカムを収集し、50mL遠沈管38に入れる。
注:後で抽出するためにサンプルを-20°Cで凍結し、次のステップの前に解凍する必要があります。 - サンプルの入ったチューブを3,500 x gで25°Cで10分間遠心分離します。上清を廃棄物容器にデカントし、生物学的廃棄物に廃棄します。
注:上清は、エキソソームの将来の分析のために予約される場合があります。 - サンプルペレットを含むチューブをシーリングフィルム( 材料の表を参照)でしっかりと覆い、鋭くて長いノーズピンセットを使用してフィルムにいくつかの穴を開けます。チューブを-80°Cで30分間直立させて保管します。
- 凍結乾燥機の電源を入れ、0.1 mbarおよび-80°C(~30分)で平衡化します。
注意: パラメータ(ステップ1.4)は、本研究で使用した凍結乾燥機用に最適化されています( 材料表を参照)。実験室で入手可能な凍結乾燥機モデルに従って標準的な操作手順に従うか、凍結乾燥機モデルが-80°Cまで低下しない場合は、可能な限り低い温度を設定してください。- 遠心チューブを直立させて凍結乾燥機のガラス容器に入れ、-80°Cの冷凍庫に5分間入れてジャーを冷却します。
- 冷凍庫からガラス容器を取り出し、ゴム製の蓋を取り付けます。
- 凍結乾燥機のゴム製バルブ出口のハンドルが大気に通気されている(上向き)ことを確認し、ガラス容器をしっかりと取り付けます。
- ゴム製バルブ出口のハンドルを非常にゆっくりと下向きの位置に回してジャーを真空にさらし、最大24時間の凍結乾燥を可能にして、すべての液体の昇華を確実にします。
- ジャー内の真空を解放するには、ハンドルを上向きの位置に回し、ガラス容器を取り外して、フリーズドライサンプルを取り除きます。
- 分析天びんを使用して、15〜50 mgの乾燥サンプルペレットを15 mLの遠沈管に計量します。
注:この段階でさらに処理しない場合、サンプルは-80°Cのストレージに入れることができます。
2. 遊離NPAAの細胞溶解と分画
- マイクロピペットを使用して、100 ng/mLのD5-2,4-DAB( 材料表を参照)標準物質を100 μLサンプルチューブに追加します(オプション)。
- D5-2,4-DAB標準を追加する場合は、それぞれ300〜600 μLの10%w / vトリクロロ酢酸水溶液(TCA、 材料表を参照)または300〜600 μLの11.7%〜13.3%TCAを追加します。
注意: ペレットを完全に覆う水性TCAの量を選択してください。 - 砕いた氷で満たされた容器にサンプルチューブを置きます。
- プローブ超音波処理器( 材料表を参照)を中高出力(70%)で使用し、以下の手順に従ってサンプルを1分間溶解します。
注意: ノイズキャンセリングイヤーマフを使用して、適切なPPEを確保してください。- 使用中の看板をドアに配置し、ヒュームフードで超音波処理を行い、ノイズキャンセリングイヤーマフを使用して、プローブ超音波処理器の使用に備えて適切な安全プロトコルに従ってください。
- 超音波処理器のスイッチを入れ、次のパラメータを入力します:振幅、70%;時間、1分。
- 糸くずの出ない紙のワイプ( 材料の表を参照)に70%エタノールをスプレーし、プローブを拭き取ります。
- プローブの端をサンプルに完全に浸し、 スタートを押します。
- プローブ超音波処理器が停止したら、サンプルを含む遠心管を氷上に1分間置きます。
- 細胞が溶解していることを確認するには、手順2.4.3〜2.4.5をもう一度繰り返します。
- サンプルを4°Cの冷蔵庫に12〜24時間入れて、タンパク質を沈殿させます。
- 10%水性TCAサンプルを3,500 x g で8°Cで15分間遠心分離します。
- マイクロピペットを使用して、上清を「遊離画分」とラベル付けされた2 mLチューブに移します。
- 残りのサンプルペレットを含む遠沈管に400μLの10%水性TCAのマイクロピペットを入れ、渦攪拌またはマイクロピペットチップでペレットを分解します。
- 手順2.6〜2.7を繰り返し、上清を同じ2 mLの「遊離画分」チューブに移します。
- マイクロピペット400 μLの10%TCA /アセトンを残りのペレットと一緒に遠沈管に入れ、ボルテックスまたはマイクロピペットチップでペレットを分解します。
- 10%TCA/アセトンサンプルを3,500 x gで8°Cで15分間遠心分離します。 マイクロピペットを使用して、上清を「遊離画分」とラベル付けされた2 mLチューブに移します。
- 蓋を開けた状態で「フリーフラクション」チューブを遠心蒸発器に入れます( 材料の表を参照)すべての揮発性液体が除去されるまで(少なくとも1時間)。
- サンプルに揮発性液体がなくなったら、チューブをシーリングフィルムでしっかりと覆い、鋭くて長いノーズピンセットを使用していくつかの穴でフィルムに穴を開けます。サンプルを-80°Cの冷凍庫に入れます。
- ステップ1.4のすべてのステップを繰り返して、「遊離画分」サンプルをフリーズドライします。
- 20 mM塩酸(HCl)のマイクロピペット200 μLを「遊離画分」チューブに入れて凍結乾燥サンプルを再構成し、-80°Cの冷凍庫保管場所に置きます。
注:サンプルの「遊離画分」は、ステップ4でろ過する準備ができています。残りのペレットは、タンパク質分画のために以下のステップでさらに処理されるであろう。
3. タンパク質結合NPAAの分画
- ガラス彫刻機を使用して、識別のためにガラスシェルバイアルにサンプルの詳細をラベル付けします。
注意: 強酸はインクラベルを消散させる可能性があります。したがって、ガラスにラベルを刻印することをお勧めします。 - 100 ng/mL D5-2,4-DAB標準品のマイクロピペット100 μLをサンプルペレットに(オプション)。
- 400 μLの100%アセトンをサンプルペレットにマイクロピペットで塗布し、ボルテックス攪拌またはマイクロピペットチップを使用してペレットを分解します。
- 1,000 μLにセットした1 mLマイクロピペットを使用して、洗浄および再懸濁したペレットを対応するガラスシェルバイアルに移します。
注:さらに400μLの100%アセトンを攪拌ペレットに添加して、ペレットをガラスシェルバイアルに完全に移すのを支援することができます。これは、必要に応じて3回繰り返すことができます。 - 8,000 x g で25°Cで5分間遠心分離し、液体を生物学的廃棄物にデカントします。
- 残りのペレットを遠心蒸発器に入れ、すべての液体が除去され、ペレットが乾くまで(~1時間)入れます。
- 加水分解バイアルの底に1 mLの6 M HClを加えて、真空加水分解バイアルを準備します。
- ピンセットを使用して、乾燥したサンプルを含むラベル付きシェルバイアルを加水分解バイアルに注意深く挿入し、直立した安定した位置を確保します。
注:サンプル数が加水分解バイアルの容量よりも少ない場合、空のシェルバイアルを使用してサンプルバイアルを直立させることができます。 - 蓋を加水分解バイアルに取り付け、蓋の赤いノブを押してバルブを閉じます。
- 真空ポンプをオンにし、真空管を加水分解バイアル蓋のヘッドに取り付け、蓋の緑色のノブを押してバルブを開きます。
- 真空ポンプ( 材料の表を参照)でバイアルから空気を1分間除去します。
- 加水分解バイアル蓋の赤いノブを押してバイアルを閉じ、真空ポンプをオフにして、真空管を取り外します。
- 実験台の窒素ガス栓にゴムチューブを取り付け、蛇口を少し開きます。チューブの端に親指を置き、密封し、圧力が上昇するにつれてガスが逃げ始めるまで数えます。これが次のステップの時間枠になります。ガス流量を適切な時間枠に調整します。
- ゴムチューブのもう一方の端を加水分解バイアル蓋のヘッドに取り付け、すぐに蓋の緑色のノブを押します。手順3.13で決定した時間まで数え、蓋の赤いノブをすばやく押して、ゴムチューブを取り外します。
- 手順3.10〜3.14を2回繰り返して、ガラス加水分解バイアルに空気がなく、窒素ガスで満たされていることを確認します。
- 加水分解バイアルを110°Cに設定した予熱オーブンに16〜18時間入れます。
- オーブン手袋を使用してガラス加水分解バイアルをオーブンから取り出し、ヒュームフード内で10分間冷却します。ヒュームフードの内側で、自分とは反対側を向いたまま、緑色のノブを押して圧力とガスを解放します。
- ピンセットを使用して、加水分解バイアルからシェルバイアルを取り外します。
- 20 mM HClの200 μLをシェルバイアルにマイクロピペッティングすることにより、加水分解されたサンプルペレットを再構成します。ボルテックスまたはピペットチップを使用してペレットが再懸濁されていることを確認します。
- 再構成されたサンプルペレットを含むシェルバイアルを5,300 x gおよび25°Cで2分間遠心分離します。
4. サンプルフィルタリング
- 0.2 μmの細孔メンブレンフィルターを含む2 mLフィルターチューブ( 材料の表を参照)に「遊離画分」および「タンパク質画分」というラベルを付けます。
- ステップ2.15(遊離画分)およびステップ3.20(タンパク質画分)から再構成されたサンプルを対応するフィルターチューブに移します。
- それらを5,000 x gおよび25°Cで30分間遠心分離機に入れます。
- フィルターチューブからフィルターを取り外し、キャップをします。これで、サンプルはステップ5でアミノ酸誘導体化の準備が整いました。
注:サンプルは-80°Cの冷凍庫に入れて保管し、後で誘導体化と分析を行うことができます。
5. アミノ酸誘導体化
- 製造元の指示に従って、クロロギ酸プロピル(PCF)39または6-アミノキノリル-N-ヒドロシスクシンイミジルカルバメート(AQC)40を使用してサンプルを誘導体化します(材料表を参照)。
結果
抽出プロトコルの図は、要約されたリファレンスガイドとして 図2 に示されています。Vioriら38 によって得られた結果は、シアノバクテリアからのBMAA異性体の分析のためのこの抽出プロトコルからの肯定的な結果を表すために選択された。19種のシアノバクテリアがオーストラリア東部の11の淡水サイトから培養されました。同じプロトコルを使用して、BMAA異性体を遊離画分およびタンパク質画分に抽出し、PCFで誘導体化し、LC-MS/MSを使用して分析しました。 シアノバクテリア分離株のうち17株はBMAA陽性であり、19株すべてに2,4-DAB異性体が含まれていました。検証済みのLC-MS/MS法を使用し、予想される保持時間で少なくとも3つの多重反応モニタリング(MRM)遷移(1つは定量イオンとして、2つは修飾子イオンとして)を観察することにより、陽性の結果が確認されます。BMAAとその異性体を含む標準物質の代表的なMRMクロマトグラムを、色分けされた線で示し、 図3に示します。全19サンプルにおけるBMAAおよび異性体の存在および濃度を、遊離画分および結合画分におけるBMAAおよび異性体濃度を示すために切片化し、 表1に要約した。リデル湖(オーストラリア、ニューサウスウェールズ州)から収集された メリズモペディア 種の遊離画分では、3つの異性体すべての陽性検出が観察され、遊離画分には、乾燥重量(DW)68.38 μg / g(DW)±2.25 μg / g DW、1,223.98 μg / g DW±20.7 μg / g DWの濃度の2,4-DABが含まれていました。 125.27μg/g DW±4.19μg/g DWの濃度のAEGを含む。クロマトグラフィーMRMを 図4に示します。サンプル中のBMAAおよびその異性体について否定的な結果を説明するために、ウォーカウォーターワークス(オーストラリア、ニューサウスウェールズ州)から収集された ミクロシスティスフロスアクアエ 種の結合画分を クロマトグラフィーで図5に示します。結合画分にはBMAA、2,4-DAB、および/またはAEGは含まれていませんでしたが、その遊離画分には3つの異性体がすべて含まれており、濃度はそれぞれ79.86 μg/g DW±1.59 μg/g DW、1,156.15 μg/g DW ± 8.46 μg/g DW、および433.83 μg/g DW ± 8.92 μg/g DWでした。
したがって、このプロトコルを使用して、Vioriら38 は、オーストラリア東部の淡水シアノバクテリアにおけるBMAA異性体の存在を確認し、どのシアノバクテリアが毒素産生能力を持っているかを決定しました。
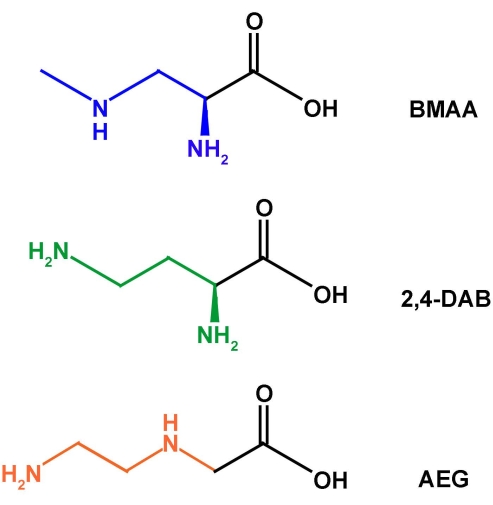
図1:BMAAとその異性体2,4-DABおよびAEGの化学構造。 この図の拡大版を表示するには、ここをクリックしてください。
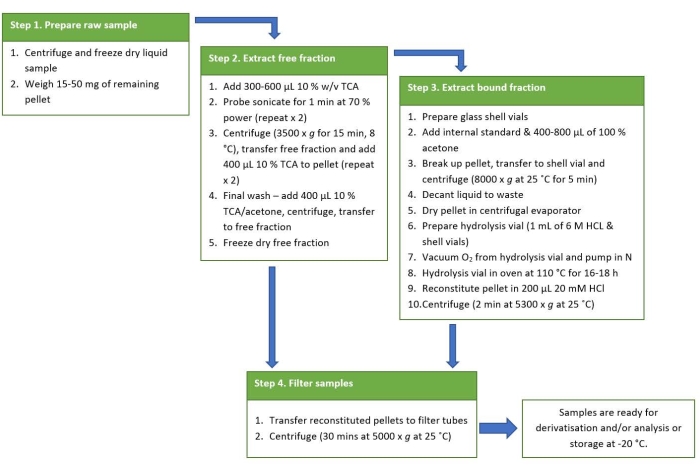
図2:抽出プロトコルの要約参照図。 この図の拡大版を表示するには、ここをクリックしてください。
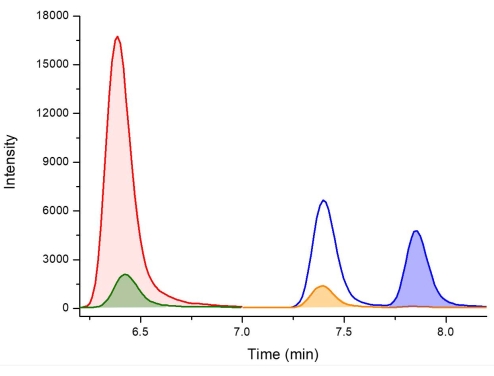
図3:保持に基づく異性体同定のためのD5-2,4-DAB、2,4-DAB、BMAA、およびAEGを含むキャリブレーションスタンダードのLC-MS/MSクロマトグラム、強調表示されたピークで示されます。 キー: D5-2,4-DAB 338.01 m/z > 278.10 m/z at 6.4 分 (赤)、2,4-DAB 333.01 m/z > 273.10 m/z at 6.4 分 (緑)、AEG 333.01 m/z > 88.00 m/z で 7.4 分 (オレンジ)、BMAA 333.01 m/z > 187.10 m/z at 7.8 分 (青)。 この図の拡大版を表示するには、ここをクリックしてください。
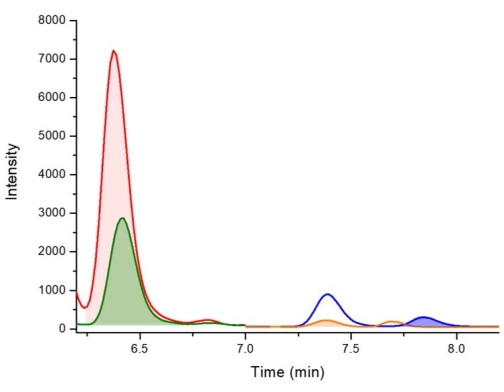
図4:リデル湖(オーストラリア、ニューサウスウェールズ州)から採取されたメリズモペディア種のD5-2,4-DAB、2,4-DAB、BMAA、およびAEGを検出するためのLC-MS/MSクロマトグラム(強調表示されたピークで示されています)。 キー: D5-2,4-DAB 338.01 m/z > 278.10 m/z at 6.4 分 (赤)、2,4-DAB 333.01 m/z > 273.10 m/z at 6.4 分 (緑)、AEG 333.01 m/z > 88.00 m/z で 7.4 分 (オレンジ)、BMAA 333.01 m/z > 187.10 m/z at 7.8 分 (青)。この図の拡大版を表示するには、ここをクリックしてください。
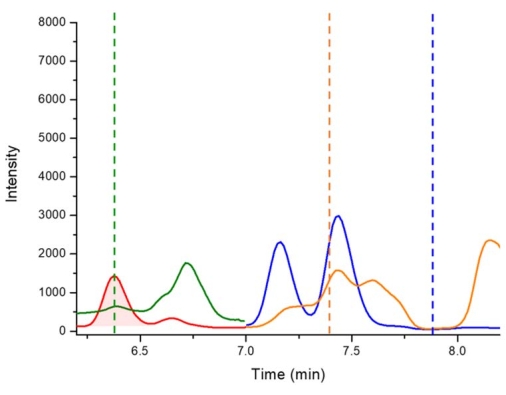
図5:ウォーカウォーターワークス(オーストラリア、ニューサウスウェールズ州)から収集された ミクロシスティスフロスアクアエ 種の結合画分における2,4-DAB、BMAA、およびAEGの陰性対照のLC-MS/MSクロマトグラム。 キー: D5-2,4-DAB 338.01 m/z > 278.10 m/z で 6.4 分 (赤 - ピーク強調表示)、2,4-DAB 333.01 m/z > 273.10 m/z で 6.4 分 (緑)、AEG 333.01 m/z > 88.00 m/z で 7.4 分 (オレンジ)、BMAA 333.01 m/z > 187.10 m/z で 7.8 分 (青)。破線は、欠落している2,4-DAB、AEG、およびBMAAの保持時間を表します。 この図の拡大版を表示するには、ここをクリックしてください。
表1:シアノバクテリア分離物中のBMAA、AEG、および2,4-DAB濃度。 濃度 ± 平均の標準誤差(n = 3)です。ND は検出されないことを示します。検出された各異性体の最高濃度は緑色で強調表示されます。この表は、Vioriら38の修正版です。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
NPAAの分析のためにここで概説されている抽出プロトコルは、生物学的サンプル中のあらゆるアミノ酸の分析に適用されます。シアノバクテリア株の単離と培養に関するガイドについては、Vioriらの研究で提示された方法を参照することができます38。プロトコルの最初のステップでは、乾燥重量に対するサンプル間の正規化を達成できるポイントまでサンプルを導きます。第2ステップは、分析物を解放するための細胞溶解であり、このプロトコルに記載されているプローブ超音波処理などの機械的破壊/溶解、凍結/解凍サイクル、粉砕およびビーズ粉砕、および酵素、洗剤および/または化学溶解などの非機械的破壊を含む一連の技術を使用して実行できます。機械的破壊は、細胞内結合およびタンパク質を無傷のままに保ちながらサンプルのより大きな能力を溶解することを可能にするので、非機械的破壊よりも有利であることが知られている41が、サンプルマトリックスは細胞溶解のための最適な方法を指示し得る。
タンパク質沈殿は、分析のためにアミノ酸を抽出する際のこのプロトコルの重要な第3ステップです。TCAは最も一般的に使用される溶媒です。ただし、過塩素酸、アセトン、メチルtert-ブチルエーテル(MTBE)、メタノール、および/またはアセトニトリル8,42も使用されており、各抽出溶媒は異なる基質を抽出して沈殿させることを目的としています。ここで説明するモデルは、シアノバクテリアマトリックスからNPAA BMAAとその異性体を抽出し、さまざまな溶媒が利用されていますが、最も一般的な2つは、水中(水性)中の10%TCAとアセトン中の10%TCAです。一般に、TCAによるタンパク質沈殿は、タンパク質結合アミノ酸から遊離アミノ酸を分画するためにアミノ酸を抽出するために一般的に使用される。さらに、TCA抽出により、総タンパク質含有量を決定し、遊離画分の汚染物質を減らし、タンパク質分解を最小限に抑えてプロテアーゼの活性を低下させることができます43。遊離画分のTCA抽出は、最初に有機物可溶性物質を洗い流し、沈殿物中にタンパク質や細胞壁残骸などの不溶性化合物を残し、次に強酸を使用してタンパク質結合アミノ酸(結合画分)を熱加水分解抽出することによって機能します。
超音波処理を加えた10%水性TCAによる遊離画分の分画は、他の有機溶媒44および最良のアミノ酸回収率42と比較して最も広範なタンパク質沈殿を生じる。いくつかの研究では、より小さなペプチド/生体分子を含むより多くの分子を沈殿させ、タンパク質の分解を最小限に抑え、塩43などの汚染物質を減らすために、有機溶媒(すなわち、アセトン43中の10%-20%TCA)と組み合わせて酸を使用することを選択します。アセトン中の10%TCAの別の利点は、加水分解用のペレットの調製における乾燥速度が速く、水分残留物を最小限に抑えてアミノ酸修飾を防ぐことです。しかしながら、10%水性TCAプラス超音波処理は、アセトン44単独の10%TCAと比較した場合、遊離アミノ酸のより良好な抽出効率を有する。さらに、10%水性TCA沈殿には、乾燥時間が長い、すべてのタンパク質または低分子ペプチド/生体分子を沈殿させることができない、および目的の分析物(すなわち、タンパク質またはアミノ酸)に応じて、酸化および分解を防ぐための添加剤および還元剤を必要とするなどの制限がある45,46。
このプロトコルは、アセトン中の10%水性TCAと10%TCAの組み合わせを使用して、タンパク質沈殿を増加させ、より小さなペプチド/生体分子を確実に沈殿させ、ペレット乾燥時間を短縮し、両方の溶媒抽出特性を利用して抽出効率を高めます。ただし、アセトン中の10%水性TCAと10%TCAの組み合わせは、アセトン上清中の10%TCAを水性遊離画分と組み合わせた後、遊離画分中に小さなペプチド/生体分子を沈殿させる可能性があります。この場合、沈殿物は加水分解のために結合画分に移されるべきである。
このプロトコルの後半は、無酸素環境での高温での酸蒸気加水分解 を介した タンパク質ペレットからのアミノ酸(すなわち、BMAA)の放出を含む。加水分解工程の主な制限要因は、調製に時間と労力がかかることです。一晩のインキュベーションにより、迅速かつ時間効率の良いサンプル調製と分析が妨げられます。さらに、遠心分離管からシェルバイアルへのペレットの定量的移送(ステップ3.4)は、乾燥重量に対する正確な正規化点を確実にするために勤勉さと忍耐を必要とする骨の折れるプロセスである。ユーザーが直面する可能性のある問題は、ペレットの不完全な移動、ピペットチップと元のチューブに付着する湿った沈殿タンパク質、およびピペットチップをブロックするペレットの固体粒子です。ペレットのより簡単な移動を支援するための実用的な提案は、ピペットチップの端から約0.3〜0.5mmをハサミで取り除き、より大きなペレット粒子を引き寄せてシェルバイアルに放出できるようにすることです。この転写法は、すべてのアミノ酸分析におけるタンパク質抽出の一般的な方法です。しかしながら、ペレットをシェルバイアルに定量的に移す効率および精度を改善するための改変が調査されるべきである。
タンパク質結合状態からアミノ酸を放出するために、液相加水分解と酸蒸気加水分解の2つの形態の加水分解技術を採用することができます。液相加水分解は、サンプルに6 M HClを添加し、110°Cのオーブンに一晩入れることを含み、このプロトコルで説明されている酸蒸気加水分解の代替手段です。液相加水分解を採用する抽出技術は、タグ付け40のための基本的な条件を必要とするので、特にAQC誘導体化が選択される場合、脱塩などのさらなる処理を必要とするかもしれない。酸蒸気加水分解は脱塩を回避し、ろ過前の最終ペレットの再構成時に誘導体化技術を自由に選択できます。さらに、選択した加水分解法とは無関係に、誘導体化技術および/または分析分析の選択に応じて、サンプルはマトリックス精製および濃縮のためのSPEなどのさらなる処理を必要とする場合があります29,47,48(例:逆相LC-MS/MS対親水性相互作用液体クロマトグラフィー[HILIC] LC-MS/MS 37).このプロトコルにおける20mM HCl中の最終ペレットの再構成は、市販のアミノ酸加水分解キット39(材料表参照)を介したPCF試薬48を用いた誘導体化に適している。AQCとPCFはどちらも、サンプルに存在するすべてのアミノ酸、タンパク質、および非タンパク質を誘導体化し、分析物の選択性は、LC-MS/MSの使用と、保持時間のマッチングと定量子と修飾子MRMの慎重な選択の組み合わせによって得られます38。
現在の加水分解プロトコルは、BMAA、2,4-DAB、およびAEGの放出に最適化されていませんが、タンパク質加水分解のための既存の方法に基づく22タンパク質アミノ酸に対して最適化されています32、18時間を超えるインキュベーションは特定のアミノ酸の分解と修飾をもたらし、LC-MS / MS分析に影響を与え、したがって得られた濃度に影響を与えます32。Beachら49は、BMAAおよびタンパク質新生アミノ酸を分析するための加水分解を最適化するために、経時的(0.5〜120時間)にわたる加水分解を調査した。彼らは、加水分解の最初の0.5時間の間にBMAAの早期の急速な放出があったが、BMAAレベルは加水分解時間が長くなるにつれて、5日後でも分解することなく増加し続けたことを発見した49。結合したBMAAとその異性体の本質についてもまだ異なる見解や疑問があり、BMAAが結合する50,51やタンパク質14への誤取り込みではなく、BMAAとタンパク質の会合が表面的であることを示唆する研究もあります52。ただし、「結合した」BMAAの分析における現在のコンセンサスでは、ペプチド/タンパク質を分解してアミノ酸を放出し、したがってBMAAとその異性体を放出する、検証され広く受け入れられている加水分解ステップが必要です。
20のタンパク質アミノ酸の回収率は、TCA抽出を用いたSedgwickらによる研究42で決定され、ほぼ100%の回収率をもたらしました。藻類マトリックスからのBMAAおよびその異性体の場合、さまざまな抽出溶媒を使用したBMAA抽出の効率を比較する研究では、10%TCAが遊離BMAA27に対して最も効率的であることがわかりました。液相加水分解を用いて抽出されたタンパク質結合BMAAの回収率は、Gloverら25およびFaassenら53による研究で確立され、精度はスパイク回収法によって決定され、平均BMAA回収率はそれぞれ108.6%および70%であった。Faassenらは、スパイク回収実験の手順を説明し、スパイクが作られた抽出プロセスの段階によって回収がどのように異なるかを示した53。Faassenらはさらに、ここに提示された酸-蒸気プロトコルの効率を決定し、抽出前にスパイクされたBMAA異性体では83.6%、加水分解前にスパイクされた異性体では68.6%の回収率を示した24。これらの回収率、抽出方法、および分析は、シアノバクテリアマトリックス中のBMAAの回収率が94%〜106%、相対標準偏差(%RSD)が5.6%〜20%で、精度54のFDA基準を満たし、Banack26によってさらに検証されました。各ラボは、スパイク回復実験を介してこのプロトコルを利用する前に、最初に回収率と精度を確立することをお勧めします。Faassen et al.53およびGlover et al.25で提示された回収方法は、ガイドとして従うことができる。
一晩オーブンによる加水分解の代わりに、分析種のタンパク質結合抽出を高速化するために、代替形態の加水分解技術を利用することができます。例えば、マイクロ波抽出器は、加水分解時間を24時間からわずか10分55時間に大幅に短縮することができる。アミノ酸のマイクロ波加水分解は、従来の熱法と同じ原理を使用し、グローブボックスを使用して無酸素環境でマイクロ波容器を調製および組み立て、6 M HClを追加します。気密になると、サンプルを含む容器はマイクロ波放射を受けます。マイクロ波加水分解は、さまざまなサンプルマトリックスからアミノ酸を抽出するために使用されています56,57,58;ただし、マイクロ波加水分解は、BMAAの分析のためにまだ開発および検証されていません。
結論として、10%水性TCAタンパク質沈殿は、シアノバクテリアマトリックス27から遊離の非タンパク質アミノ酸を抽出するための最適な方法であり、熱加水分解は、タンパク質結合画分の信頼性および再現性のある抽出を提供する。シアノバクテリアからNPAA BMAAとその異性体を抽出するこのプロトコルは検証され、広く受け入れられています。BMAAの抽出をさらに最適化するための将来の方向性は、22タンパク質アミノ酸の仕様に従って実行される加水分解ステップに焦点を当てます。ただし、ここで紹介する抽出プロトコルは、LC-MS/MS を介して BMAAとその異性体を分析するために効率的かつ効果的であると考える必要があります。
開示事項
著者は開示するものは何もありません。
謝辞
D.P.B.、K.J.R.、S.M.M.はイアン・ポッター財団の支援を受けており、J.P.V.はオーストラリア政府の研究トレーニングプログラムであるSbenefitendの受領者です。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL glass shell vials | SHIMADZU | REST-24663 | |
| 10% TCA solution | Dilute 100% (w/v) to 10% aqueous TCA | ||
| 100% TCA solution | Dissolve TCA in water according to the following ratio 2.2 g:1 mL (TCA:H2O) | ||
| 1000 µL micropipette | Ependorf/Sigma-Aldrich | Z683809 | |
| 13.3% TCA solution | Dilute 100% (w/v) to 13.3% aqueous TCA | ||
| 2 mL tubes | MERCK | BR780546-500EA | |
| 20 mM HCl | Chem-Supply Pty Ltd | 7647-01-0 | Made from stock |
| 20-200 µL micropipette | Ependorf/Sigma-Aldrich | Z740441 | |
| 6 M HCl | Chem-Supply Pty Ltd | 7647-01-0 | Made from stock |
| 70% ethanol | Supelco | 1.11727 | Dilute 70:1 Ethanol:water |
| -80 °C Freezer | Martin CHRIST | 102142 | Alpha 2-4 Ldplus |
| AccQ-Tag Ultra Derivatisation Kit | Waters | 186003836 | |
| Acetone | Chem-Supply Pty Ltd | 34967-2.5L | |
| Analytical Scale Balance | |||
| Centrifugal evaporator | Thermo Scientific | 13442549 | DNA120-115 SpeedVac Concentrator |
| Centrifuge | MERCK | EP022620100-1EA | |
| D5-2,4-DAB standard | CDN Isotopes | D-7568 | |
| Drying Oven | |||
| Ez:faastTM Amino Acid Analysis Kit | Phenomenex | CEO-8492 | |
| Falcon tube holder | |||
| Falcon Tubes | MERCK | T2318-500EA | Greiner centrifuge tubes |
| Filter Tubes | Sigma-Aldrich | CLS8161-100EA | Corning Costar Spin-X centrifuge tube filters (pore size 0.22 μm) |
| Glass engraver | |||
| Hydrolysis vial & Lid | Eldex Laboratories/Waters | WAT007568 & WAT007569 | |
| Ice and container | |||
| Lint-free paper wipe | Kimwipes/Sigma-Aldrich | Z188956 | |
| Milli-Q water | 18.2 MΩ.cm | ||
| Nitrogen tap with hose | |||
| P1000 Micropipette | MERCK | EP3123000063 | |
| P1000 pipette tips | MERCK | Z740127 | |
| P200 Micropipette | MERCK | EP3123000055-1EA | |
| P200 pipette tips | MERCK | Z740125 | |
| Parafilm | MERCK | P7793 | Sealing film |
| PPE - noise cancelling headphones | |||
| PPE - oven gloves | |||
| Probe sonicator | QSONICA Sonicators | Q125 Sonicator | Please ensure all appropriate PPE (i.e. noise cancelling headphones) |
| Sample transfer spatula | |||
| Trichloroacetic acid (TCA) | Sigma-Aldrich | T6399-1KG | |
| Tweezers | |||
| Vacuum Pump with hose |
参考文献
- Larsen, P. O., Miflin, B. J. Physical and Chemical Properties of Amino Acids. Amino Acids and Derivatives. , 225-269 (1980).
- Wagner, I., Musso, H. New naturally occurring amino acids. Angewandte International Edition in English. 22 (11), 816-828 (1983).
- Reeds, P. J. Dispensable and indispensable amino acids for humans. The Journal of Nutrition. 130 (7), 1835-1840 (2000).
- Bhagavan, N. V., Ha, C. -. E., Bhagavan, N. V., Ha, C. -. E. Amino Acids. Essentials of Medical Biochemistry (Second Edition). , 21-29 (2015).
- Rubenstein, E. Misincorporation of the proline analog azetidine-2-carboxylic acid in the pathogenesis of multiple sclerosis: A hypothesis. Journal of Neuropathology & Experimental Neurology. 67 (11), 1035-1040 (2008).
- Chan, S., Dunlop, R., Rowe, A., Double, K., Rodgers, K. l-DOPA is incorporated into brain proteins of patients treated for Parkinson's disease, inducing toxicity in human neuroblastoma cells in vitro. Experimental Neurology. 238 (1), 29-37 (2012).
- Rodgers, K. J., Hume, P. M., Morris, J. G., Dean, R. T. Evidence for L-dopa incorporation into cell proteins in patients treated with levodopa. Journal of Neurochemistry. 98 (4), 1061-1067 (2006).
- Violi, J. P., Bishop, D. P., Padula, M. P., Steele, J. R., Rodgers, K. J. Considerations for amino acid analysis by liquid chromatography-tandem mass spectrometry: A tutorial review. TrAC Trends in Analytical Chemistry. 131, 116018 (2020).
- Hashiguchi, A., Komatsu, S., Shukla, A. K. Posttranslational Modifications and Plant-Environment Interaction. Methods in Enzymology., Volume 586. , 97-113 (2017).
- Berntzon, L., Ronnevi, L. O., Bergman, B., Eriksson, J. Detection of BMAA in the human central nervous system. Neuroscience. 292, 137-147 (2015).
- Cox, P. A., Banack, S. A., Murch, S. J. Biomagnification of cyanobacterial neurotoxins and neurodegenerative disease among the Chamorro people of Guam. Proceedings of the National Academy of Sciences of the United States of America. 100 (23), 13380-13383 (2003).
- Cox, P. A., et al. Cyanobacteria and BMAA exposure from desert dust: A possible link to sporadic ALS among Gulf War veterans. Amyotrophic Lateral Sclerosis. 10, 109-117 (2009).
- Pablo, J., et al. Cyanobacterial neurotoxin BMAA in ALS and Alzheimer's disease. Acta Neurologica Scandinavica. 120 (4), 216-225 (2009).
- Dunlop, R. A., Cox, P. A., Banack, S. A., Rodgers, K. J. The non-protein amino acid BMAA is misincorporated into human proteins in place of l-serine causing protein misfolding and aggregation. PLoS One. 8 (9), 75376 (2013).
- Cox, P. A., et al. Diverse taxa of cyanobacteria produce β-N-methylamino-L-alanine, a neurotoxic amino acid. Proceedings of the National Academy of Sciences of the United States of America. 102 (14), 5074-5078 (2005).
- Faassen, E. J. Presence of the neurotoxin BMAA in aquatic ecosystems: What do we really know. Toxins. 6 (3), 1109-1138 (2014).
- Al-Sammak, M. A., Hoagland, K. D., Cassada, D., Snow, D. D. Co-occurrence of the cyanotoxins BMAA, DABA and anatoxin-a in Nebraska reservoirs, fish, and aquatic plants. Toxins. 6 (2), 488-508 (2014).
- Wang, C., et al. Food web biomagnification of the neurotoxin β-N-methylamino-L-alanine in a diatom-dominated marine ecosystem in China. Journal of Hazardous Materials. 404, 124217 (2021).
- Banack, S. A., Johnson, H. E., Cheng, R., Cox, P. A. Production of the neurotoxin BMAA by a marine cyanobacterium). Marine Drugs. 5 (4), 180-196 (2007).
- Jiang, L., Johnston, E., Åberg, K. M., Nilsson, U., Ilag, L. L. Strategy for quantifying trace levels of BMAA in cyanobacteria by LC/MS/MS. Analytical and Bioanalytical Chemistry. 405 (4), 1283-1292 (2013).
- Jonasson, S., Eriksson, J., Berntzon, L., Rasmussen, U., Bergman, B. A novel cyanobacterial toxin (BMAA) with potential neurodegenerative effects. Plant Biotechnology. 25 (3), 227-232 (2008).
- Cohen, S. Analytical techniques for the detection of α-amino-β-methylaminopropionic acid. Analyst. 137 (9), 1991-2005 (2012).
- Main, B. J., Rodgers, K. J. Assessing the combined toxicity of BMAA and its isomers 2,4-DAB and AEG in vitro using human neuroblastoma cells. Neurotoxicity Research. 33 (1), 33-42 (2018).
- Faassen, E. J., Gillissen, F., Lürling, M. A comparative study on three analytical methods for the determination of the neurotoxin BMAA in cyanobacteria. PLoS One. 7 (5), 36667 (2012).
- Glover, W. B., Baker, T. C., Murch, S. J., Brown, P. N. Determination of β-N-methylamino-L-alanine, N-(2-aminoethyl)glycine, and 2,4-diaminobutyric acid in food products containing cyanobacteria by ultra-performance liquid chromatography and tandem mass spectrometry: Single-laboratory validation. Journal of AOAC International. 98 (6), 1559-1565 (2015).
- Banack, S. A. Second laboratory validation of β-N-methylamino-L-alanine, N-(2aminoethyl)glycine, and 2,4-diaminobuytric acid by ultra-performance liquid chromatography and tandem mass spectrometry. Neurotoxicity Research. 39 (1), 107-116 (2021).
- Lage, S., et al. BMAA extraction of cyanobacteria samples: Which method to choose. Environmental Science and Pollution Research. 23 (1), 338-350 (2016).
- Jonasson, S., et al. Transfer of a cyanobacterial neurotoxin within a temperate aquatic ecosystem suggests pathways for human exposure. Proceedings of the National Academy of Sciences of the United States of America. 107 (20), 9252-9257 (2010).
- Spáčil, Z., et al. Analytical protocol for identification of BMAA and DAB in biological samples. Analyst. 135 (1), 127-132 (2010).
- Jiang, L., et al. Diatoms: A novel source for the neurotoxin BMAA in aquatic environments. PLOS One. 9 (1), 84578 (2014).
- Murch, S. J., Cox, P. A., Banack, S. A., Steele, J. C., Sacks, O. W. Occurrence of β-methylamino-l-alanine (BMAA) in ALS/PDC patients from Guam. Acta Neurologica Scandinavica. 110 (4), 267-269 (2004).
- Davidson, I., Smith, B. J. Hydrolysis of Samples for Amino Acid Analysis. Protein Sequencing Protocols. , 111-122 (2003).
- Esterhuizen-Londt, M., Downing, S., Downing, T. Improved sensitivity using liquid chromatography mass spectrometry (LC-MS) for detection of propyl chloroformate derivatised -N-methylamino-L-alanine (BMAA) in cyanobacteria. Water SA. 37 (2), 133-138 (2011).
- Kisby, G. E., Roy, D. N., Spencer, P. S. Determination of β-N-methylamino-l-alanine (BMAA) in plant (Cycas circinalis L.) and animal tissue by precolumn derivatization with 9-fluorenylmethyl chloroformate (FMOC) and reversed-phase high-performance liquid chromatography. Journal of Neuroscience Methods. 26 (1), 45-54 (1988).
- Lampinen Salomonsson, M., Hansson, A., Bondesson, U. Development and in-house validation of a method for quantification of BMAA in mussels using dansyl chloride derivatization and ultra performance liquid chromatography tandem mass spectrometry. Analytical Methods. 5 (18), 4865-4874 (2013).
- Main, B. J., et al. Detection of the suspected neurotoxin β-methylamino-l-alanine (BMAA) in cyanobacterial blooms from multiple water bodies in Eastern Australia. Harmful Algae. 74, 10-18 (2018).
- Combes, A., et al. Validation of the analytical procedure for the determination of the neurotoxin β-N-methylamino-l-alanine in complex environmental samples. Analytica Chimica Acta. 771, 42-49 (2013).
- Violi, J. P., Mitrovic, S. M., Colville, A., Main, B. J., Rodgers, K. J. Prevalence of β-methylamino-L-alanine (BMAA) and its isomers in freshwater cyanobacteria isolated from eastern Australia. Ecotoxicology and Environmental Safety. 172, 72-81 (2019).
- AccQ-Tag Ultra Derivatization Kit Care and. Waters Available from: https://www.waters.com/waters/support.htm?lid=10008559 (2014)
- D'Hondt, E., Gonzalez-Fernandez, C., Munoz, R., et al. Cell Disruption Technologies. Microalgae-Based Biofuels and Bioproducts. , 133-154 (2017).
- Sedgwick, G. W., Fenton, T. W., Thompson, J. R. Effect of protein precipitating agents on the recovery of plasma free amino acids. Canadian Journal of Animal Science. 71 (3), 953-957 (1991).
- Niu, L., et al. Modified TCA/acetone precipitation of plant proteins for proteomic analysis. PLOS One. 13 (12), 0202238 (2018).
- Fic, E., Kedracka-Krok, S., Jankowska, U., Pirog, A., Dziedzicka-Wasylewska, M. Comparison of protein precipitation methods for various rat brain structures prior to proteomic analysis. Electrophoresis. 31 (21), 3573-3579 (2010).
- Koontz, L. TCA precipitation. Methods in Enzymology. 541, 3-10 (2014).
- Novák, P., Havlíček, V., Ciborowski, P., Silberring, J. Protein Extraction and Preparation. Proteomic Profiling and Analytical Chemistry (Second Edition). , 51-62 (2016).
- Li, A., et al. Elucidation of matrix effects and performance of solid-phase extraction for LC-MS/MS analysis of beta-N-methylamino-L-alanine (BMAA) and 2,4-diaminobutyric acid (DAB) neurotoxins in cyanobacteria. Analyst. 137 (5), 1210-1219 (2012).
- Baker, T. C., Tymm, F. J. M., Murch, S. J. Assessing environmental exposure to β-N-methylamino-l-alanine (BMAA) in complex sample matrices: A comparison of the three most popular LC-MS/MS methods. Neurotoxicity Research. 33 (1), 43-54 (2018).
- Beach, D. G., Kerrin, E. S., Giddings, S. D., Quilliam, M. A., McCarron, P. Differential mobility-mass spectrometry double spike isotope dilution study of release of β-methylaminoalanine and proteinogenic amino acids during biological sample hydrolysis. Scientific Reports. 8, 117 (2018).
- Murch, S. J., Cox, P. A., Banack, S. A. A mechanism for slow release of biomagnified cyanobacterial neurotoxins and neurodegenerative disease in Guam. Proceedings of the National Academy of Sciences of the United States of America. 101 (33), 12228-12231 (2004).
- Banack, S. A., Murch, S. J., Cox, P. A. Neurotoxic flying foxes as dietary items for the Chamorro people, Marianas Islands. Journal of Ethnopharmacology. 106 (1), 97-104 (2006).
- van Onselen, R., Cook, N. A., Phelan, R. R., Downing, T. G. Bacteria do not incorporate β-N-methylamino-l-alanine into their proteins. Toxicon. 102, 55-61 (2015).
- Faassen, E. J., Gillissen, F., Zweers, H. A. J., Lürling, M. Determination of the neurotoxins BMAA (β-N-methylamino-L-alanine) and DAB (α-,γ-diaminobutyric acid) by LC-MSMS in Dutch urban waters with cyanobacterial blooms. Amyotrophic Lateral Sclerosis. 10, 79-84 (2009).
- Food and Drug Administration. Bioanalytical Method Validation. Guidance for Industry. U.S. U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research, Center for Veterinary Medicine. , (2018).
- Reichelt, M., Hummert, C., Luckas, B. Hydrolysis of microcystins and nodularin by microwave radiation. Chromatographia. 49 (11), 671-677 (1999).
- Marconi, E., Panfili, G., Bruschi, L., Vivanti, V., Pizzoferrato, L. Comparative study on microwave and conventional methods for protein hydrolysis in food. Amino Acids. 8 (2), 201-208 (1995).
- Chen, S. -. T., Chiou, S. -. H., Chu, Y. -. H., Wang, K. -. T. Rapid hydrolysis of proteins and peptides by means of microwave technology and its application to amino acid analysis. International Journal of Peptide and Protein Research. 30 (4), 572-576 (1987).
- Aviram, L. Y., McCooeye, M., Mester, Z. Determination of underivatized amino acids in microsamples of a yeast nutritional supplement by LC-MS following microwave assisted acid hydrolysis. Analytical Methods. 8 (22), 4497-4503 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved