Method Article
액체 크로마토그래피-탠덤 질량분석 분석을 위한 시아노박테리아에서 비단백질 아미노산 추출
요약
본 프로토콜은 액체 크로마토 그래피-탠덤 질량 분석법을 사용하여 분석하기 전에 트리클로로 아세트산 (TCA) 단백질 침전 및 산 가수 분해 를 통해 생물학적 매트릭스에서 비 단백질 아미노산을 추출하는 것을 설명합니다.
초록
비 단백질 아미노산 (NPAA)은 단백질로의 번역을 위해 유 전적으로 암호화되지 않은 아미노산 (AA)의 큰 부류입니다. NPAA 분석은 세포 흡수 및/또는 기능, 대사 경로 및 잠재적 독성에 대한 중요한 정보를 제공할 수 있습니다. β- 메틸 아미노 -L- 알라닌 (BMAA)은 다양한 조류 종에 의해 생성되는 신경 독성 NPAA이며 신경 퇴행성 질환의 위험 증가와 관련되어있어 상당한 연구 관심을 불러 일으켰습니다. 분석을 위해 AA를 추출하는 방법에는 여러 가지가 있으며, 액체 크로마토그래피-탠덤 질량분석법이 가장 일반적이며 단백질 침전과 단백질 펠릿의 산 가수분해가 필요합니다. 조류 종에서 BMAA의 존재에 대한 연구는 검증되지 않은 샘플 준비/추출 및 분석의 사용이 주요 원인인 모순된 결과를 제공합니다. 대부분의 NPAA와 마찬가지로 10 % 수성 TCA에서의 단백질 침전 및 발연 HCl로 가수 분해하는 것은 BMAA 및 그 이성질체 아미노 에틸 글리신 (AEG) 및 2,4- 디 아미노 부티르산 (2,4-DAB)에 가장 적합한 추출 형태입니다. 본 프로토콜은 연구 및 교육 실험실에서 일반적으로 사용되는 검증 된 NPAA 추출 방법의 단계를 설명합니다.
서문
아미노산은 적어도 하나의 아민 및 카르복실 작용기를 함유하는 화합물이다. 일부 아미노산은 또한 카르복실산 이외의 기능성 산 그룹인 이미노 그룹을 포함합니다. 다른 아미노산에는 α- 탄소 그룹1에 부착되지 않은 아민 그룹이 있습니다. 500개 이상의 아미노산2이 있으며, 그 중 22개는 리보솜단백질 합성3에서 유전자 코딩에 사용되는 단백질 아미노산으로 알려져 있습니다. 이 22 개의 아미노산은 필수 및 비 필수로 더 세분화 될 수 있습니다. 필수 아미노산은 유기체가 제대로 기능하는 데 필요하며 외부 공급원에서만 얻을 수 있습니다. 비 필수 아미노산은 유기체 내에서 합성 될 수 있습니다. 22 개의 아미노산을 필수 / 비 필수로 분류하는 것은 개별 종에 고유합니다. 다른 모든 아미노산은 단백질 합성을 위해 암호화되지 않은 비 단백질 아미노산 (NPAA)입니다. 단백질이든 비단백질이든 아미노산은 유기체 내에서 신호 전달 역할을 할 수 있으며 대사 매개체로 작용할 수있습니다4. 중요하고 다양한 역할로 인해 아미노산 수준은 유기체 상태, 기능 및 대사 경로 등에 대한 통찰력을 제공할 수 있습니다. 아미노산이 폴리펩티드 사슬에 통합될 수 있는 두 가지 주요 메커니즘이 있습니다: 암호화에 22개의 아미노산을 활용하는 리보솜 단백질 합성과 단백질 아미노산과 함께 합성에 일부 NPAA를 사용할 수 있는 비리보솜 펩티드 합성. 특정 NPAA는 단백질 아미노산을 모방하여 잠재적으로 펩타이드와 단백질에 잘못 통합될 수 있습니다. 잘못된 통합은 단백질의 잘못된 접힘을 유발하여 티로신 대신 NPAA L-3,4 디하이드록시페닐알라닌(L-DOPA)이 잘못 통합되어 세포기능과 건강에 부정적인 영향을 미치는 것과 같은 해로운 영향을 미칩니다5,7. 혼입된 NPAA의 추가 공급원은 아미노산 잔기의 번역후 변형(PTM)을 통한 것입니다. 아미노산 잔기는 펩티드 또는 단백질 형태, 안정성 및 기능성의 변화를 포함하는 다양한 이유로 변형된다. PTM 함유 단백질 또는 펩티드의 가수 분해시, 이들 변형 된 아미노산 잔기는 유리 NPAA 형태 8,9로 방출된다.
시아노박테리아, 규조류 및 편모충류10에 의해 생성되는 NPAA β-메틸아미노-L-알라닌(BMAA)은 근위축성 측삭 경화증/파킨슨증-치매 복합체(ALS-PDC)11,12, 근위축성 측삭 경화증 및 알츠하이머병13과 같은 다양한 신경퇴행성 질환의 기여 인자로 연루된 신경독으로 의심되는 신경독입니다. . BMAA가 L- 세린14 및 / 또는 다른 단백질 아미노산 대신에 단백질의 폴리펩티드 사슬에 잘못 통합되는 것이 제안된다. BMAA의 잘못된 혼입은 단백질의 미스폴딩으로 이어질 수 있고, 그 결과 뉴런14에 단백질 응집체가 침착될 수 있다. 지난 10 년 동안 BMAA에 대한 관심이 크게 증가했습니다. 담수, 해양 및 기수 환경의 광범위한 시아 노 박테리아 종이 BMAA15를 생성하는 것으로 발견되어 다양한 생태계16,17로 널리 분포합니다. 또한 BMAA는 먹이 사슬을 통해 인간 먹이 그물18,19로 생체 확대되는 것으로 나타났습니다. BMAA 독성의 잠재적 인 건강 영향, 이해 부족 및 불일치로 인해 BMAA의 독성이 궁극적으로 이해되거나 BMAA가 안전한 것으로 간주 될 때까지 추가 연구를 계속해야합니다20,21.
생물학적 샘플의 아미노산 분석은 샘플 준비, 아미노산 유도체화, 분리 및 검출, 식별 및 정량화의 네 가지 주요 단계로 나눌 수 있습니다. 액체 크로마토그래피-탠덤 질량분석법(LC-MS/MS)은 아미노산의 표적화되고 재현 가능한 분리 및 분석을 제공하므로 선호되는 분석 방법입니다.
시아노박테리아 및 기타 조류 샘플을 분석하기 위한 샘플 준비 기술은 주로 유리 및 단백질 결합 형태의 아미노산 추출 방법을 포함합니다. 수년에 걸쳐, 추출 방법은 결합 된 형태에서 유리 아미노산을 분리하기위한 샘플의 탈용매화, 단백질 침전 및 고온에서 염산 (HCl)으로 가수 분해를 통한 결합 된 아미노산의 방출을 포함하여 공통 요소와 비교적 일관되게 유지되었습니다22 . 이 추출 형태는 단백질 아미노산에 최적화되어 있으며 NPAA에 사용됩니다. 그러나 동일한 종의 시아 노 박테리아에서 BMAA 및 그 이성질체 (그림 1), 아미노 에틸 글리신 (AEG) 및 2,4- 디 아미노 부티르산 (2,4-DAB)의 검출 및 정량화는 문헌에서 일관성없는 결과를 보여 주었으며, 성장 조건 및 / 또는 BMAA의 양이 다양하거나 전혀없는 조류의 균주의 차이에 대한 설명이 있습니다23 . BMAA 및 그 이성질체의 검출 및 정량화의 불일치에 대한 더 가능성있는 설명은 검증되지 않은 실험 프로토콜, 광범위한 분석 기술의 사용 및보고 된 방법16,24의 불충분 한 실험 세부 사항으로 인해 재현 불가능한 실험실 간 데이터. 그러나 Glover et al.25 및 Banack 26은 최근 단일 실험실 검증에 필요한 국제 분석 화학자 협회 (AOAC), 미국 약전 및 FDA 지침에 따라 초 고성능 액체 크로마토 그래피 (UPLC) -MS / MS를 사용하여 BMAA 및 그 이성질체의 검출 및 정량화를위한 분석 기술을 개발하고 검증했습니다.
이러한 검증 실험은 BMAA와 그 이성질체의 분리 및 검출에 중점을 두었으며 샘플 준비 프로토콜의 불일치를 해결하지 못했습니다. Lage et al.27은 LC-MS/MS를 통해 시아노박테리아 샘플에서 BMAA 및 그 이성질체를 정량화하기 위한 세 가지 일반적인 추출 방법의 성능을 비교했습니다: 유리 아미노산의 고체상 추출(SPE)28,29; 메탄올 추출 및 아세톤 침전을 수반하는 단백질 침전 방법30; BMAA에 가장 일반적으로 사용되는 추출 방법, 트리클로로 아세트산 (TCA)을 사용한 단백질 침전31. 그들은 TCA 단백질 침전이 최적의 프로토콜이며 다른 추출 방법에 비해 테스트 샘플에서 더 높은 BMAA 농도를 산출한다고 결론지었습니다. 그들의 연구는 시아노박테리아 매트릭스에서 6-아미노퀴놀릴-N-하이드록시숙신이미딜 카바메이트(AQC)를 사용하여 BMAA를 유도체화하여 TCA 추출을 검증하여 신뢰할 수 있고 재현 가능한 BMAA 데이터를 달성하기 위한 확립된 가이드를 제공했습니다. TCA 아미노산 추출은 다른 매트릭스에도 적용할 수 있는 일반적인 샘플 준비 기술입니다. 그러나, 가수분해 동안 아미노산의 안정성은 분해 또는 산화를 방지하기 위해 고려될 필요가 있으며, 이는 화학적 개질제 및 환원제(32)의 사용으로 극복될 수 있다. TCA 추출은 일상적으로 사용되고 새로운 연구 학생들에게 가르쳐지며, 프로토콜이 널리 보고되고 있지만 이 방법의 적용에 대한 시각 자료는 적절하고 일관된 실행을 보장하는 귀중한 리소스입니다.
역상 크로마토그래피는 일반적으로 아미노산을 분리하는 데 사용되며 분석 전에 유도체화 단계가 필요합니다. BMAA와 같은 아미노산의 유도체화는 크로마토그래피 머무름을 허용하고 이성질체 사이의 분리능을 증가시킬 수 있습니다. 또한 분자 질량을 증가시키고 질량 분석기의 이온화를 향상시킵니다. 프로필 클로로포르메이트(PCF)33, 6-아미노퀴놀릴-N-하이드로시숙시이미딜 카바메이트(AQC)27, 9-플루오레닐메틸클로로포르메이트(FMOC)34 및 단실 클로라이드(DC)35를 포함하여 LC-MS/MS를 통한 아미노산 분석에 여러 유도체화 시약이 사용되었습니다. 그러나 BMAA 분석을 위해 검증된 유일한 기술은 PCF36 또는 AQC24,26,37을 유도체화 시약으로 사용했습니다.
이 프로토콜의 범위는 시아노박테리아 매트릭스에서 NPAA의 TCA 추출에 중점을 둡니다. 세부 사항이 부족할 수 있는 원고를 기반으로 학술 및 산업 연구 실험실에서 일상적으로 사용하고 가르치는 노동 집약적인 방법입니다. 따라서, 이 프로토콜은 모델 아미노산으로서 유리 및 결합 BMAA의 분석을 위한 샘플 제조에 관련된 절차 및 기술에 대한 세부사항을 제공한다.
프로토콜
시아노박테리아 종 Merismopedia 는 본 연구38에 사용되었습니다.
1. 원료 샘플 준비
- 관심있는 수생 공급원 또는 시아 노 박테리아 배양 플라스크에서 조류 쓰레기를 수집하여 50mL 원심 분리 튜브38에 넣습니다.
알림: 샘플은 나중에 추출하기 위해 -20 ° C에서 냉동하고 다음 단계 전에 해동해야합니다. - 시료가 들어 있는 튜브를 3,500 x g에서 25°C에서 10분 동안 원심분리합니다. 상청액을 폐기물 용기에 넣고 생물학적 폐기물로 버립니다.
참고: 상청액은 엑소좀의 향후 분석을 위해 예약될 수 있습니다. - 시료 펠릿이 들어 있는 튜브를 밀봉 필름( 재료 표 참조)으로 단단히 덮고 날카롭고 긴 노즈 핀셋을 사용하여 필름에 몇 개의 구멍을 뚫습니다. 튜브를 -80 ° C에서 30 분 동안 똑바로 세워 보관하십시오.
- 동결 건조기를 켜고 0.1mbar 및 -80°C(~30분)에서 평형을 이룹니다.
알림: 매개변수(1.4단계)는 본 연구에 사용된 동결 건조기에 최적화되어 있습니다( 재료 표 참조). 실험실에서 사용 가능한 동결 건조기 모델에 따라 표준 작동 절차를 따르거나 동결 건조기 모델이 -80 ° C만큼 낮아지지 않으면 가능한 최저 온도를 설정하십시오.- 원심 분리기 튜브를 동결 건조기 유리 용기에 똑바로 세우고 -80 ° C 냉동고에 5 분 동안 넣어 병을 식힌다.
- 냉동실에서 유리 용기를 꺼내 고무 뚜껑을 부착하십시오.
- 동결 건조기의 고무 밸브 배출구에있는 손잡이가 대기로 배출되었는지 (위쪽을 향하게) 유리 용기를 단단히 부착하십시오.
- 고무 밸브 배출구의 손잡이를 아래쪽을 가리키는 위치로 매우 천천히 돌려 용기를 진공에 노출시키고 최대 24 시간의 동결 건조를 허용하여 모든 액체의 승화를 보장합니다.
- 용기의 진공을 해제하려면 핸들을 위쪽을 가리키는 위치로 돌리고 유리 용기를 분리한 다음 동결 건조 샘플을 제거합니다.
- 분석 저울을 사용하여 15-50mg의 건조된 시료 펠릿을 15mL 원심분리 튜브에 칭량하십시오.
알림: 이 단계에서 더 이상 처리하지 않으면 샘플을 -80°C 저장소에 넣을 수 있습니다.
2. 유리 NPAA의 세포 용해 및 분획
- 마이크로피펫을 사용하여 100ng/mL의 D5-2,4-DAB( 재료 표 참조) 표준물질 100μL를 샘플 튜브(옵션)에 추가합니다.
- D300-600-DAB 표준을 추가하는 경우 각각 10% w/v 수성 트리클로로아세트산(TCA, 재료 표 참조) 300-600μL의 11.7%-13.3% TCA를 추가합니다.
알림: 펠릿을 완전히 덮는 수성 TCA의 부피를 선택하십시오. - 분쇄 된 얼음으로 채워진 용기에 샘플 튜브를 놓습니다.
- 프로브 초음파 처리기 ( 재료 표 참조)를 중간 - 높은 전력 (70 %)에서 사용하고 아래 단계에 따라 1 분 동안 샘플을 용해시킵니다.
주의 : 소음 제거 귀마개를 사용하여 적절한 PPE를 확인하십시오.- 문에 사용 중인 표지판을 배치하고, 흄 후드에서 초음파 처리를 수행하고, 소음 제거 귀마개를 사용하여 프로브 초음파 처리기의 사용을 준비하기 위해 적절한 안전 프로토콜을 따르십시오.
- 초음파 처리기를 켜고 다음 매개 변수를 입력하십시오 : 진폭, 70 %; 시간, 1 분.
- 보풀이 없는 종이 물티슈( 재료 표 참조)에 70% 에탄올을 뿌리고 프로브를 닦아냅니다.
- 프로브의 끝을 샘플에 완전히 담그고 시작을 누릅니다.
- 프로브 초음파 처리기가 멈 추면 샘플이 들어있는 원심 분리기 튜브를 얼음 위에 1 분 동안 놓습니다.
- 세포가 용해되었는지 확인하려면 2.4.3-2.4.5단계를 한 번 더 반복합니다.
- 단백질 침전을 허용하기 위해 샘플을 4°C의 냉장고에 12-24시간 동안 두십시오.
- 10% 수성 TCA 샘플을 3,500 x g 에서 8°C에서 15분 동안 원심분리합니다.
- 마이크로피펫을 사용하여 상청액을 "유리 분획"이라고 표시된 2mL 튜브로 옮깁니다.
- 10% 수성 TCA 400μL를 나머지 샘플 펠릿이 들어 있는 원심분리 튜브에 넣고 와류 교반 또는 마이크로피펫 팁으로 펠릿을 분해합니다.
- 2.6-2.7단계를 반복하여 상청액을 동일한 2mL "유리 분획" 튜브로 옮깁니다.
- 10% TCA/아세톤 400μL를 나머지 펠릿과 함께 원심분리 튜브에 넣고 볼텍싱 또는 마이크로피펫 팁으로 펠릿을 분해합니다.
- 10% TCA/아세톤 샘플을 3,500 x g에서 8°C에서 15분 동안 원심분리합니다. 마이크로피펫을 사용하여 상청액을 "유리 분획"이라고 표시된 2mL 튜브로 옮깁니다.
- 뚜껑이 열린 상태에서 "자유 분획" 튜브를 모든 휘발성 액체가 제거될 때까지(최소 1시간) 원심 증발기( 재료 표 참조)에 넣습니다.
- 샘플에 휘발성 액체가 없으면 밀봉 필름으로 튜브를 단단히 덮고 날카 롭고 긴 노즈 핀셋을 사용하여 몇 개의 구멍으로 필름을 뚫습니다. 샘플을 -80 °C 냉동고에 넣습니다.
- 1.4단계의 모든 단계를 반복하여 "유리 분획" 샘플을 동결 건조합니다.
- 20mM 염산(HCl) 200μL를 "자유 분획" 튜브에 마이크로피펫하여 동결 건조된 샘플을 재구성하고 -80°C 냉동 보관에 넣습니다.
참고: 샘플의 "자유 분획"은 4단계에서 여과할 준비가 되었습니다. 나머지 펠렛은 단백질 분획화를 위해 다음 단계에서 추가로 처리됩니다.
3. 단백질 결합 NPAA의 분획
- 유리 조각기를 사용하여 식별을 위해 샘플 세부 정보로 유리 쉘 바이알에 라벨을 붙입니다.
참고: 강산은 잉크 라벨링을 소멸시킬 수 있습니다. 따라서 유리에 라벨을 새기는 것이 좋습니다. - 100 ng/mL D5-2,4-DAB 표준물질 100 μL를 시료 펠릿에 마이크로피펫(옵션).
- 100% 아세톤 400μL를 샘플 펠릿 상에 마이크로피펫팅하고 와류 교반 또는 마이크로피펫 팁을 사용하여 펠릿을 분해한다.
- 1,000μL로 설정된 1mL 마이크로피펫을 사용하여 세척 및 재현탁된 펠릿을 해당 유리 쉘 바이알로 옮깁니다.
참고: 교반된 펠릿에 100% 아세톤 400μL를 추가로 추가하여 펠릿을 유리 쉘 바이알로 완전히 옮길 수 있습니다. 필요한 경우 세 번 반복 할 수 있습니다. - 25 ° C에서 5 분 동안 8,000 x g 에서 원심 분리하고 액체를 생물학적 폐기물로 따라 내십시오.
- 모든 액체가 제거되고 펠릿이 건조될 때까지(~1시간) 남은 펠릿을 원심 증발기에 넣습니다.
- 가수분해 바이알의 바닥에 6 M HCl 1 mL를 첨가하여 진공 가수분해 바이알을 준비한다.
- 핀셋을 사용하여 건조된 샘플이 들어 있는 라벨이 붙은 쉘 바이알을 가수분해 바이알에 조심스럽게 삽입하여 똑바로 세워 안정적인 위치를 보장합니다.
알림: 빈 쉘 바이알을 사용하여 샘플 수가 가수분해 바이알의 용량보다 적은 경우 샘플 바이알을 똑바로 유지할 수 있습니다. - 뚜껑을 가수분해 바이알에 부착하고 뚜껑의 빨간색 손잡이를 눌러 밸브를 닫습니다.
- 진공 펌프를 켜고 진공관을 가수분해 바이알 뚜껑의 헤드에 부착하고 뚜껑의 녹색 손잡이를 눌러 밸브를 엽니다.
- 진공 펌프( 재료 표 참조)가 바이알에서 공기를 1분 동안 제거하도록 합니다.
- 가수분해 바이알 뚜껑의 빨간색 손잡이를 눌러 바이알을 닫고 진공 펌프를 끄고 진공관을 제거합니다.
- 실험실 벤치의 질소 가스 탭에 고무 튜브를 부착하고 탭을 약간 엽니다. 엄지 손가락을 튜브 끝에 놓고 밀봉 한 다음 압력이 증가함에 따라 가스가 빠져 나가기 시작할 때까지 세십시오. 이것은 다음 단계의 기간이 될 것입니다. 가스 흐름을 적절한 시간대로 조정하십시오.
- 고무 튜브의 다른 쪽 끝을 가수분해 바이알 뚜껑의 머리에 부착한 다음 즉시 뚜껑의 녹색 손잡이를 밉니다. 3.13단계에서 결정한 시간까지 세고 뚜껑의 빨간색 손잡이를 빠르게 누르고 고무 튜브를 제거합니다.
- 3.10-3.14단계를 두 번 반복하여 유리 가수분해 바이알에 공기가 없고 질소 가스가 채워지도록 합니다.
- 가수분해 바이알을 110°C로 예열된 오븐에 16-18시간 동안 넣습니다.
- 오븐 장갑을 사용하여 오븐에서 유리 가수분해 바이알을 제거하고 흄 후드 내부에서 10분 동안 식히십시오. 흄 후드 내부에서 반대쪽을 향하게 한 상태에서 녹색 손잡이를 눌러 압력과 가스를 방출합니다.
- 핀셋을 사용하여 가수분해 바이알에서 쉘 바이알을 제거합니다.
- 20 mM HCl의 200 μL를 쉘 바이알에 마이크로 피펫팅하여 가수분해된 샘플 펠릿을 재구성합니다. 펠릿이 와류 또는 피펫 팁을 사용하여 재현탁되었는지 확인하십시오.
- 재구성된 샘플 펠릿을 포함하는 쉘 바이알을 5,300 x g 및 25°C에서 2분 동안 원심분리합니다.
4. 샘플 필터링
- 0.2μm 공극막 필터가 포함된 2mL 필터 튜브( 재료 표 참조)를 "유리 분획" 및 "단백질 분획"으로 표시합니다.
- 단계 2.15(유리 분획) 및 단계 3.20(단백질 분획)에서 재구성된 샘플을 해당 필터 튜브로 옮깁니다.
- 5,000 x g 및 25 ° C에서 30 분 동안 원심 분리기에 넣습니다.
- 필터 튜브에서 필터를 제거하고 캡을 덮으십시오. 이제 샘플은 5단계에서 아미노산 유도체화를 위한 준비가 되었습니다.
참고: 샘플은 나중에 유도체화 및 분석을 위해 보관을 위해 -80°C 냉동고에 넣을 수 있습니다.
5. 아미노산 유도체화
- 제조업체의 지침에 따라 프로필 클로로포르메이트(PCF)39 또는 6-아미노퀴놀릴-N-하이드로시숙신이미딜 카바메이트(AQC)40 을 사용하여 샘플을 유도체화합니다( 재료 표 참조).
결과
추출 프로토콜의 그림은 요약된 참조 가이드로 그림 2 에 제공됩니다. Violi et al.38 에 의해 얻어진 결과는 시아노박테리아로부터의 BMAA 이성질체 분석을 위한 이 추출 프로토콜로부터 양성 결과를 나타내도록 선택되었다. 19 종의 시아 노 박테리아가 11 개의 동부 호주 담수 지역에서 배양되었습니다. 동일한 프로토콜을 사용하여, BMAA 이성질체를 유리 및 단백질 분획으로 추출하고, PCF로 유도체화하고, LC-MS/MS를 사용하여 분석하였다. 시아노박테리아 분리물 중 17개는 BMAA에 대해 양성이었고, 19개 모두는 2,4-DAB 이성질체를 함유하였다. 양성 결과는 검증된 LC-MS/MS 방법을 사용하고 예상 머무름 시간에 정량 이온으로 1개, 한정 이온으로 2개 등 최소 3개의 다중 반응 모니터링(MRM) 전이를 관찰하여 확인됩니다. 색상으로 구분된 선으로 표시된 BMAA 및 그 이성질체를 포함하는 표준물질의 대표적인 MRM 크로마토그램이 그림 3에 나와 있습니다. 자유 및 결합 분획에서 BMAA 및 이성질체 농도를 보여주기 위해 절편된 모든 19개 샘플에서 BMAA 및 이성질체의 존재 및 농도는 표 1에 요약되어 있다. 리델 호수 (NSW, 호주)에서 수집 한 Merismopedia 종의 유리 분획에서 3 가지 이성질체 모두에 대한 양성 검출이 관찰되었으며, 유리 분획은 68.38 μg / g 건조 중량 (DW) ± 2.25 μg / g DW, 2,4-DAB 농도 1,223.98 μg / g DW ± 20.7 μg / g DW, 및 125.27 μg / g DW ± 4.19 μg / g DW의 농도를 가진 AEG. 크로마토그래피 MRM을 그림 4에 나타내었다. 샘플에서 BMAA 및 그 이성질체에 대한 음성 결과를 설명하기 위해 Walka Water Works (NSW, 호주)에서 수집 한 Microcystis flos-aquae 종의 결합 분획을 크로마토 그래피 적으로 그림 5에 제시합니다. 결합 분획에는 BMAA, 2,4-DAB 및 / 또는 AEG가 포함되어 있지 않지만 유리 분획에는 각각 79.86 μg / g DW ± 1.59 μg / g DW, 1,156.15 μg / g DW ± 8.46 μg / g DW 및 433.83 μg / g DW ± 8.92 μg / g DW의 농도로 3 가지 이성질체가 모두 포함되었습니다.
따라서이 프로토콜을 사용하여 Violi et al.38 은 동부 호주 담수 시아 노 박테리아에서 BMAA 이성질체의 존재를 확인하고 어떤 시아 노 박테리아가 독소 생성 능력을 가지고 있는지 결정했습니다.
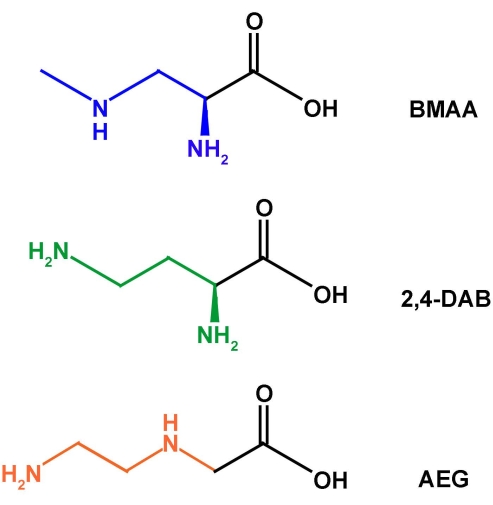
그림 1: BMAA와 그 이성질체 2,4-DAB 및 AEG의 화학 구조. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
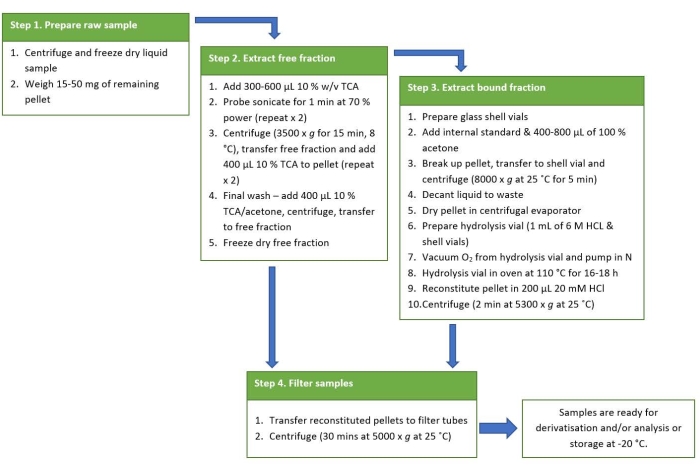
그림 2: 추출 프로토콜의 요약된 참조 다이어그램. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
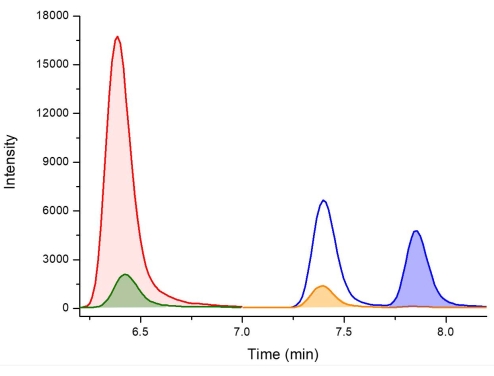
그림 3: 머무름을 기반으로 한 이성질체 식별을 위한 D5-2,4-DAB, 2,4-DAB, BMAA 및 AEG를 포함하는 교정 표준물질의 LC-MS/MS 크로마토그램(강조 표시된 피크로 표시됨). 키: 6.4분(빨간색)에서 D5-2,4-DAB 338.01m/z > 278.10m/z, 6.4분(녹색)에서 2,4-DAB 333.01m/z > 273.10m/z, 7.4분(주황색)에서 88.00m/z > AEG 333.01m/z, 7.8분(파란색)에서 BMAA 333.01m/z > 187.10m/z. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
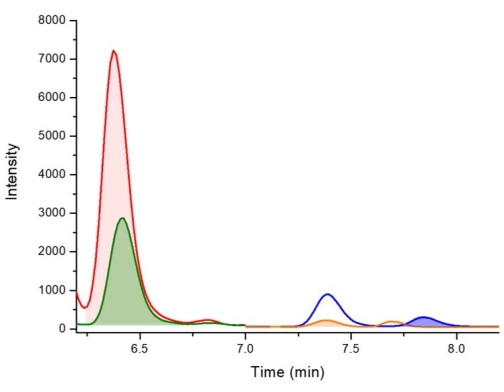
그림 4: 리델 호수(호주 NSW)에서 수집한 메리스모피디아 종에서 D5-2,4-DAB, 2,4-DAB, BMAA 및 AEG를 검출하기 위한 LC-MS/MS 크로마토그램(강조 표시된 피크로 표시됨). 키: 6.4분(빨간색)에서 D5-2,4-DAB 338.01m/z > 278.10m/z, 6.4분(녹색)에서 2,4-DAB 333.01m/z > 273.10m/z, 7.4분(주황색)에서 88.00m/z > AEG 333.01m/z, 7.8분(파란색)에서 BMAA 333.01m/z > 187.10m/z. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
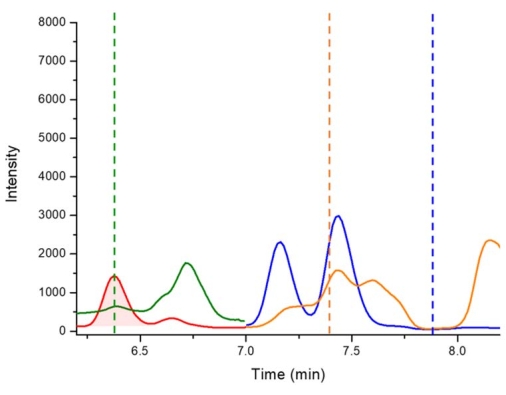
그림 5: Walka Water Works(NSW, 호주)에서 수집한 마이크로시스티스 플로스-아쿠아 종의 결합 분획에서 2,4-DAB, BMAA 및 AEG에 대한 음성 대조군의 LC-MS/MS 크로마토그램. 키 : 6.4 분 (빨간색 - 피크 강조 표시)에서 D5-2,4-DAB 338.01 m / z > 278.10 m / z (빨간색 - 피크 강조 표시), 2,4-DAB 333.01 m / z > 6.4 분 (녹색)에서 273.10 m / z, 7.4 분 (주황색)에서 88.00 m / z > AEG 333.01 m / z 및 7.8 분 (파란색)에서 187.10 m / z > BMAA 333.01 m / z. 파선은 누락된 2,4-DAB, AEG 및 BMAA의 보존 시간을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 시아노박테리아 분리물의 BMAA, AEG 및 2,4-DAB 농도. 농도 ± 평균의 표준 오차(n=3). ND는 감지되지 않음을 나타냅니다. 검출된 각 이성질체의 최고 농도는 녹색으로 강조 표시됩니다. 이 표는 Violi et al.38에서 수정 된 버전입니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
NPAA 분석을 위해 여기에 설명된 추출 프로토콜은 생물학적 샘플의 모든 아미노산 분석에 적용됩니다. 시아노박테리아 균주 분리 및 배양에 대한 지침은 Violi et al.38의 연구에서 제시된 방법을 참조할 수 있습니다. 프로토콜의 첫 번째 단계는 건조 중량에 대한 샘플 간의 정규화를 달성할 수 있는 지점까지 샘플을 가져옵니다. 두 번째 단계는 분석 물을 방출하기위한 세포 용해이며,이 프로토콜에 설명 된대로 프로브 초음파 처리와 같은 기계적 중단 / 용해, 동결 / 해동 사이클, 연삭 및 비드 밀링, 효소, 세제 및 / 또는 화학 용해와 같은 비 기계적 중단을 포함한 일련의 기술을 사용하여 수행 할 수 있습니다. 기계적 파괴는 샘플 매트릭스가 세포 용해를 위한 최적의 방법을 지시할 수 있지만, 세포 내 결합 및 단백질이 손상되지 않은 상태로 유지되도록 하면서 용해할 샘플의 더 큰 용량을 허용하기 때문에 비기계적인 것보다 유리한 것으로 알려져 있습니다(41).
단백질 침전은 분석을 위해 아미노산을 추출할 때 이 프로토콜의 중요한 세 번째 단계입니다. TCA는 가장 일반적으로 사용되는 용매입니다. 그러나, 과염소산, 아세톤, 메틸 tert- 부틸 에테르 (MTBE), 메탄올 및 / 또는 아세토 니트릴 8,42도 사용되었으며, 여기서 각 추출 용매는 상이한 기질을 추출하고 침전시키는 것을 목적으로한다. 여기에 설명 된 모델은 시아 노 박테리아 매트릭스에서 NPAA BMAA와 그 이성질체를 추출하며, 다양한 용매가 사용되었지만 가장 일반적인 두 가지는 물 (수성)의 10 % TCA와 아세톤의 10 % TCA입니다. 일반적으로 TCA를 사용한 단백질 침전은 단백질 결합 아미노산으로부터 유리 아미노산을 분획하기 위해 아미노산을 추출하는 데 일반적으로 사용됩니다. 추가적으로, TCA 추출은 총 단백질 함량을 결정하고, 유리 분획에 대한 오염 물질을 감소시키고, 최소 단백질 분해로 프로테아제의 활성을 감소시킨다(43). 유리 분획의 TCA 추출은 초기에 유기 용해성 물질을 헹구고 침전물에 세포벽 잔재물과 같은 단백질 및 불용성 화합물을 남긴 다음 강산을 사용하여 단백질 결합 아미노산 (결합 분획)의 열 가수 분해 추출에 의해 작동합니다.
10 % 수성 TCA와 초음파 처리로 자유 분획을 분획하면 다른 유기 용매44 및 최상의 아미노산 회수42에 비해 가장 광범위한 단백질 침전이 생성됩니다. 일부 연구에서는 유기 용매 (즉, 아세톤 43에서 10 % -20 % TCA)와 결합 된 산을 사용하여 더 작은 펩타이드 / 생체 분자를 포함하여 더 많은 분자를 침전시키고 단백질 분해를 최소화하며 염43과 같은 오염 물질을 줄입니다. 아세톤에서 10 % TCA의 또 다른 장점은 가수 분해를위한 펠릿 준비시 건조 속도가 빨라 수분 잔류 물을 최소화하여 아미노산 변형을 방지한다는 것입니다. 그러나 10 % 수성 TCA와 초음파 처리는 아세톤44 단독의 10 % TCA와 비교할 때 유리 아미노산의 추출 효율이 더 좋습니다. 또한, 10% 수성 TCA 침전은 긴 건조 시간, 모든 단백질 또는 작은 펩티드/생체 분자를 침전시킬 수 없음, 관심 분석물(즉, 단백질 또는 아미노산)에 따라 산화 및 분해를 방지하기 위해 첨가제 및 환원제를 필요로 하는 것과 같은 한계를 갖는다(45,46).
이 프로토콜은 아세톤에서 10% 수성 TCA와 10% TCA의 조합을 사용하여 단백질 침전을 증가시키고, 더 작은 펩타이드/생체 분자가 침전되도록 하고, 더 빠른 펠릿 건조 시간을 허용하고, 추출 효율성을 높여 용매 추출 특성을 모두 활용합니다. 그러나, 아세톤 중 10 % 수성 TCA와 10 % TCA의 조합은 아세톤 상청액의 10 % TCA가 수성 유리 분획과 결합 된 후 유리 분획에서 작은 펩티드 / 생체 분자를 침전 시킬 수있다. 이 경우, 침전물은 가수 분해를 위해 결합 된 분획으로 옮겨 져야한다.
이 프로토콜의 후반부는 무산소 환경에서 고온에서 산-증기 가수분해를 통해 단백질 펠릿으로부터 아미노산(즉, BMAA)을 방출하는 것을 포함한다. 가수 분해 단계에 대한 주된 제한 요소는 준비하는 데 시간이 많이 걸리고 힘들다는 것입니다. 야간 배양은 빠르고 시간 효율적인 샘플 준비 및 분석을 방해합니다. 또한 원심분리 튜브에서 쉘 바이알로 펠릿을 정량적으로 옮기는 것(3.4단계)은 건조 중량에 대한 정확한 정규화 지점을 보장하기 위해 근면과 인내가 필요한 힘든 과정입니다. 사용자가 직면할 수 있는 문제는 펠릿의 불완전한 이송, 피펫 팁과 원래 튜브에 달라붙는 습식 침전 단백질, 피펫 팁을 막는 펠릿의 고체 입자입니다. 펠릿을 더 쉽게 옮기는 데 도움이 되는 실용적인 제안은 가위로 피펫 팁 끝에서 약 0.3-0.5mm를 제거하여 더 큰 펠릿 입자를 끌어당겨 쉘 바이알로 방출하는 것입니다. 이 전달 방법은 모든 아미노산 분석에서 단백질 추출을 위한 일반적인 관행입니다. 그러나 펠릿을 쉘 바이알로 정량적으로 전달하는 효율성과 정확성을 개선하기 위한 수정을 조사해야 합니다.
단백질 결합 상태에서 아미노산을 방출하기 위해 두 가지 형태의 가수 분해 기술을 사용할 수 있습니다 : 액상 가수 분해 및 산-증기 가수 분해. 샘플에 6M HCl을 첨가한 다음 110°C 오븐에 밤새 두는 것을 포함하는 액상 가수분해는 이 프로토콜에 설명된 산-증기 가수분해의 대안입니다. 액상 가수 분해를 사용하는 추출 기술은 특히 AQC 유도체화가 선택된 경우태깅 (40)을위한 기본 조건을 필요로하기 때문에 담수화와 같은 추가 처리가 필요할 수 있습니다. 산-증기 가수 분해는 담수화를 방지하고 사용자가 여과 전에 최종 펠릿을 재구성 할 때 유도체 화 기술을 자유롭게 선택할 수 있도록합니다. 또한, 선택된 가수분해 방법과 무관하게, 유도체화 기술 및/또는 분석 분석의 선택에 따라 매트릭스 정제 및 농도 29,47,48을 위한 SPE와 같은 추가 처리가 샘플에 필요할 수 있습니다(예: 역상 LC-MS/MS 대 친수성 상호작용 액체 크로마토그래피[HILIC] LC-MS/MS 37 ). 이 프로토콜에서 20 mM HCl에서의 최종 펠렛의 재구성은 시판되는 아미노산 가수분해 키트(39)를 통해 PCF 시약 (48)을 사용한 유도체화에 적합하다 (재료 표 참조). AQC와 PCF는 모두 샘플에 존재하는 모든 아미노산, 단백질 및 비단백질을 유도체화할 것이며, 분석물의 선택성은 LC-MS/MS의 사용과 머무름 시간 일치 및 정량자 및 한정자 MRM의 신중한 선택의 조합을 통해 얻어진다38.
현재의 가수분해 프로토콜은 BMAA, 2,4-DAB 및 AEG의 방출에 최적화되어 있지 않지만, 단백질 가수분해를 위한 기존의 방법32에 기초한 22개의 단백질 아미노산에 대해 최적화되어 있으며, 여기서 18시간 이상 배양하면 특정 아미노산의 분해 및 변형이 발생하여 LC-MS/MS 분석 및 따라서 수득된 농도(32)에 영향을 미친다. Beach et al.49는 BMAA 및 단백질 생성 아미노산 분석을 위한 가수분해를 최적화하기 위해 시간(0.5-120시간)에 따른 가수분해를 조사했습니다. 그들은 가수 분해의 처음 0.5 시간 동안 BMAA의 조기 빠른 방출이 있었지만, 가수 분해 시간이 증가함에 따라 BMAA 수준이 5 일 후에도 분해없이 계속 증가한다는 것을 발견했습니다49. 결합 된 BMAA와 그 이성질체의 진정한 본질에 대한 다른 견해와 질문이 여전히 있으며, 일부 연구에서는 BMAA 결합50,51 또는 단백질14로의 잘못된 통합보다는 BMAA- 단백질 결합이 피상적 인 52라고 제안합니다. 그러나 "결합된" BMAA 분석에 대한 현재 합의는 펩타이드/단백질을 분해하여 아미노산, 따라서 BMAA 및 그 이성질체를 방출하는 검증되고 널리 인정되는 가수분해 단계를 필요로 합니다.
20 개의 단백질 아미노산의 회수율은 TCA 추출을 사용한 Sedgwick et al.42 의 연구에서 결정되어 약 100 % 회수되었습니다. 조류 매트릭스의 BMAA 및 그 이성질체의 경우, 다양한 추출 용매를 사용한 BMAA 추출의 효율을 비교하는 연구에서 10 % TCA가 유리 BMAA27에 가장 효율적이라는 것을 발견했습니다. 액상 가수 분해를 사용하여 추출 된 단백질 결합 BMAA의 회수율은 Glover et al.25 및 Faassen et al.53의 연구에서 확립되었으며, 여기서 정확도는 스파이크 회수 방법에 의해 결정되었으며 평균 BMAA 회수율은 각각 108.6 % 및 70 %입니다. Faassen 등은 스파이크-회수 실험을 위한 절차를 기술하고, 스파이크가 만들어진 추출 과정의 단계에 따라 회수가 어떻게 다른지를 설명하였다(53). Faassen et al.은 여기에 제시된 산-증기 프로토콜의 효율을 추가로 결정했으며, 추출 전에 급증한 BMAA 이성질체의 회수율은 83.6%, 가수분해 전에 스파이크된 이성질체의 회수율은 68.6%였습니다.24. 이러한 회수, 추출 방법 및 분석은 Banack 26에 의해 추가로 검증되었으며, 시아노박테리아 매트릭스에서 BMAA에 대한 회수율은 94%-106%이고 %상대 표준 편차(%RSD)는 5.6%에서20% 사이로 정확도54에 대한 FDA 기준을 충족합니다. 스파이크 복구 실험을 통해 이 프로토콜을 사용하기 전에 각 실험실에서 초기에 복구 속도와 정확도를 설정하는 것이 좋습니다. Faassen et al.53 및 Glover et al.25 에 제시된 복구 방법을 지침으로 따를 수 있습니다.
분석물의 빠른 단백질 결합 추출을 위해 야간 오븐 가수분해 대신 대체 형태의 가수분해 기술을 활용할 수 있습니다. 예를 들어, 마이크로파 추출기는 가수분해 시간을 24시간에서 10분55분으로 크게 줄일 수 있습니다. 아미노산에 대한 마이크로파 가수 분해는 글러브 박스를 사용하여 무산소 환경에서 마이크로파 용기를 준비 및 조립하고 6M HCl을 첨가하는 기존의 열 방법과 동일한 원리를 사용합니다. 일단 밀폐되면 샘플이 들어있는 용기는 마이크로파 방사선을받습니다. 마이크로파 가수 분해는 다양한 샘플 매트릭스56,57,58로부터 아미노산을 추출하는 데 사용되었습니다. 그러나 마이크로파 가수 분해는 아직 BMAA 분석을 위해 개발 및 검증되지 않았습니다.
결론적으로, 10% 수성 TCA 단백질 침전은 시아노박테리아 매트릭스27로부터 유리 비-단백질 아미노산을 추출하는 최적의 방법이며, 열가수분해는 단백질 결합 분획의 신뢰성 있고 재현 가능한 추출을 제공한다. 시아노박테리아에서 NPAA BMAA와 그 이성질체를 추출하는 이 프로토콜은 검증되고 널리 받아들여지고 있습니다. BMAA의 추출을 더욱 최적화하기 위한 향후 방향은 22개 단백질 아미노산의 사양에 따라 수행되는 가수분해 단계에 초점을 맞출 것입니다. 그러나 여기에 제시된 추출 프로토콜은 LC-MS / MS를 통해 BMAA 및 그 이성질체를 분석하는 데 여전히 효율적이고 효과적인 것으로 간주되어야합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
D.P.B., K.J.R. 및 SMM은 The Ian Potter Foundation의 지원을 받고 있으며 JPV는 호주 정부 연구 교육 프로그램 인 Stipend의 수혜자입니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 mL glass shell vials | SHIMADZU | REST-24663 | |
| 10% TCA solution | Dilute 100% (w/v) to 10% aqueous TCA | ||
| 100% TCA solution | Dissolve TCA in water according to the following ratio 2.2 g:1 mL (TCA:H2O) | ||
| 1000 µL micropipette | Ependorf/Sigma-Aldrich | Z683809 | |
| 13.3% TCA solution | Dilute 100% (w/v) to 13.3% aqueous TCA | ||
| 2 mL tubes | MERCK | BR780546-500EA | |
| 20 mM HCl | Chem-Supply Pty Ltd | 7647-01-0 | Made from stock |
| 20-200 µL micropipette | Ependorf/Sigma-Aldrich | Z740441 | |
| 6 M HCl | Chem-Supply Pty Ltd | 7647-01-0 | Made from stock |
| 70% ethanol | Supelco | 1.11727 | Dilute 70:1 Ethanol:water |
| -80 °C Freezer | Martin CHRIST | 102142 | Alpha 2-4 Ldplus |
| AccQ-Tag Ultra Derivatisation Kit | Waters | 186003836 | |
| Acetone | Chem-Supply Pty Ltd | 34967-2.5L | |
| Analytical Scale Balance | |||
| Centrifugal evaporator | Thermo Scientific | 13442549 | DNA120-115 SpeedVac Concentrator |
| Centrifuge | MERCK | EP022620100-1EA | |
| D5-2,4-DAB standard | CDN Isotopes | D-7568 | |
| Drying Oven | |||
| Ez:faastTM Amino Acid Analysis Kit | Phenomenex | CEO-8492 | |
| Falcon tube holder | |||
| Falcon Tubes | MERCK | T2318-500EA | Greiner centrifuge tubes |
| Filter Tubes | Sigma-Aldrich | CLS8161-100EA | Corning Costar Spin-X centrifuge tube filters (pore size 0.22 μm) |
| Glass engraver | |||
| Hydrolysis vial & Lid | Eldex Laboratories/Waters | WAT007568 & WAT007569 | |
| Ice and container | |||
| Lint-free paper wipe | Kimwipes/Sigma-Aldrich | Z188956 | |
| Milli-Q water | 18.2 MΩ.cm | ||
| Nitrogen tap with hose | |||
| P1000 Micropipette | MERCK | EP3123000063 | |
| P1000 pipette tips | MERCK | Z740127 | |
| P200 Micropipette | MERCK | EP3123000055-1EA | |
| P200 pipette tips | MERCK | Z740125 | |
| Parafilm | MERCK | P7793 | Sealing film |
| PPE - noise cancelling headphones | |||
| PPE - oven gloves | |||
| Probe sonicator | QSONICA Sonicators | Q125 Sonicator | Please ensure all appropriate PPE (i.e. noise cancelling headphones) |
| Sample transfer spatula | |||
| Trichloroacetic acid (TCA) | Sigma-Aldrich | T6399-1KG | |
| Tweezers | |||
| Vacuum Pump with hose |
참고문헌
- Larsen, P. O., Miflin, B. J. Physical and Chemical Properties of Amino Acids. Amino Acids and Derivatives. , 225-269 (1980).
- Wagner, I., Musso, H. New naturally occurring amino acids. Angewandte International Edition in English. 22 (11), 816-828 (1983).
- Reeds, P. J. Dispensable and indispensable amino acids for humans. The Journal of Nutrition. 130 (7), 1835-1840 (2000).
- Bhagavan, N. V., Ha, C. -. E., Bhagavan, N. V., Ha, C. -. E. Amino Acids. Essentials of Medical Biochemistry (Second Edition). , 21-29 (2015).
- Rubenstein, E. Misincorporation of the proline analog azetidine-2-carboxylic acid in the pathogenesis of multiple sclerosis: A hypothesis. Journal of Neuropathology & Experimental Neurology. 67 (11), 1035-1040 (2008).
- Chan, S., Dunlop, R., Rowe, A., Double, K., Rodgers, K. l-DOPA is incorporated into brain proteins of patients treated for Parkinson's disease, inducing toxicity in human neuroblastoma cells in vitro. Experimental Neurology. 238 (1), 29-37 (2012).
- Rodgers, K. J., Hume, P. M., Morris, J. G., Dean, R. T. Evidence for L-dopa incorporation into cell proteins in patients treated with levodopa. Journal of Neurochemistry. 98 (4), 1061-1067 (2006).
- Violi, J. P., Bishop, D. P., Padula, M. P., Steele, J. R., Rodgers, K. J. Considerations for amino acid analysis by liquid chromatography-tandem mass spectrometry: A tutorial review. TrAC Trends in Analytical Chemistry. 131, 116018 (2020).
- Hashiguchi, A., Komatsu, S., Shukla, A. K. Posttranslational Modifications and Plant-Environment Interaction. Methods in Enzymology., Volume 586. , 97-113 (2017).
- Berntzon, L., Ronnevi, L. O., Bergman, B., Eriksson, J. Detection of BMAA in the human central nervous system. Neuroscience. 292, 137-147 (2015).
- Cox, P. A., Banack, S. A., Murch, S. J. Biomagnification of cyanobacterial neurotoxins and neurodegenerative disease among the Chamorro people of Guam. Proceedings of the National Academy of Sciences of the United States of America. 100 (23), 13380-13383 (2003).
- Cox, P. A., et al. Cyanobacteria and BMAA exposure from desert dust: A possible link to sporadic ALS among Gulf War veterans. Amyotrophic Lateral Sclerosis. 10, 109-117 (2009).
- Pablo, J., et al. Cyanobacterial neurotoxin BMAA in ALS and Alzheimer's disease. Acta Neurologica Scandinavica. 120 (4), 216-225 (2009).
- Dunlop, R. A., Cox, P. A., Banack, S. A., Rodgers, K. J. The non-protein amino acid BMAA is misincorporated into human proteins in place of l-serine causing protein misfolding and aggregation. PLoS One. 8 (9), 75376 (2013).
- Cox, P. A., et al. Diverse taxa of cyanobacteria produce β-N-methylamino-L-alanine, a neurotoxic amino acid. Proceedings of the National Academy of Sciences of the United States of America. 102 (14), 5074-5078 (2005).
- Faassen, E. J. Presence of the neurotoxin BMAA in aquatic ecosystems: What do we really know. Toxins. 6 (3), 1109-1138 (2014).
- Al-Sammak, M. A., Hoagland, K. D., Cassada, D., Snow, D. D. Co-occurrence of the cyanotoxins BMAA, DABA and anatoxin-a in Nebraska reservoirs, fish, and aquatic plants. Toxins. 6 (2), 488-508 (2014).
- Wang, C., et al. Food web biomagnification of the neurotoxin β-N-methylamino-L-alanine in a diatom-dominated marine ecosystem in China. Journal of Hazardous Materials. 404, 124217 (2021).
- Banack, S. A., Johnson, H. E., Cheng, R., Cox, P. A. Production of the neurotoxin BMAA by a marine cyanobacterium). Marine Drugs. 5 (4), 180-196 (2007).
- Jiang, L., Johnston, E., Åberg, K. M., Nilsson, U., Ilag, L. L. Strategy for quantifying trace levels of BMAA in cyanobacteria by LC/MS/MS. Analytical and Bioanalytical Chemistry. 405 (4), 1283-1292 (2013).
- Jonasson, S., Eriksson, J., Berntzon, L., Rasmussen, U., Bergman, B. A novel cyanobacterial toxin (BMAA) with potential neurodegenerative effects. Plant Biotechnology. 25 (3), 227-232 (2008).
- Cohen, S. Analytical techniques for the detection of α-amino-β-methylaminopropionic acid. Analyst. 137 (9), 1991-2005 (2012).
- Main, B. J., Rodgers, K. J. Assessing the combined toxicity of BMAA and its isomers 2,4-DAB and AEG in vitro using human neuroblastoma cells. Neurotoxicity Research. 33 (1), 33-42 (2018).
- Faassen, E. J., Gillissen, F., Lürling, M. A comparative study on three analytical methods for the determination of the neurotoxin BMAA in cyanobacteria. PLoS One. 7 (5), 36667 (2012).
- Glover, W. B., Baker, T. C., Murch, S. J., Brown, P. N. Determination of β-N-methylamino-L-alanine, N-(2-aminoethyl)glycine, and 2,4-diaminobutyric acid in food products containing cyanobacteria by ultra-performance liquid chromatography and tandem mass spectrometry: Single-laboratory validation. Journal of AOAC International. 98 (6), 1559-1565 (2015).
- Banack, S. A. Second laboratory validation of β-N-methylamino-L-alanine, N-(2aminoethyl)glycine, and 2,4-diaminobuytric acid by ultra-performance liquid chromatography and tandem mass spectrometry. Neurotoxicity Research. 39 (1), 107-116 (2021).
- Lage, S., et al. BMAA extraction of cyanobacteria samples: Which method to choose. Environmental Science and Pollution Research. 23 (1), 338-350 (2016).
- Jonasson, S., et al. Transfer of a cyanobacterial neurotoxin within a temperate aquatic ecosystem suggests pathways for human exposure. Proceedings of the National Academy of Sciences of the United States of America. 107 (20), 9252-9257 (2010).
- Spáčil, Z., et al. Analytical protocol for identification of BMAA and DAB in biological samples. Analyst. 135 (1), 127-132 (2010).
- Jiang, L., et al. Diatoms: A novel source for the neurotoxin BMAA in aquatic environments. PLOS One. 9 (1), 84578 (2014).
- Murch, S. J., Cox, P. A., Banack, S. A., Steele, J. C., Sacks, O. W. Occurrence of β-methylamino-l-alanine (BMAA) in ALS/PDC patients from Guam. Acta Neurologica Scandinavica. 110 (4), 267-269 (2004).
- Davidson, I., Smith, B. J. Hydrolysis of Samples for Amino Acid Analysis. Protein Sequencing Protocols. , 111-122 (2003).
- Esterhuizen-Londt, M., Downing, S., Downing, T. Improved sensitivity using liquid chromatography mass spectrometry (LC-MS) for detection of propyl chloroformate derivatised -N-methylamino-L-alanine (BMAA) in cyanobacteria. Water SA. 37 (2), 133-138 (2011).
- Kisby, G. E., Roy, D. N., Spencer, P. S. Determination of β-N-methylamino-l-alanine (BMAA) in plant (Cycas circinalis L.) and animal tissue by precolumn derivatization with 9-fluorenylmethyl chloroformate (FMOC) and reversed-phase high-performance liquid chromatography. Journal of Neuroscience Methods. 26 (1), 45-54 (1988).
- Lampinen Salomonsson, M., Hansson, A., Bondesson, U. Development and in-house validation of a method for quantification of BMAA in mussels using dansyl chloride derivatization and ultra performance liquid chromatography tandem mass spectrometry. Analytical Methods. 5 (18), 4865-4874 (2013).
- Main, B. J., et al. Detection of the suspected neurotoxin β-methylamino-l-alanine (BMAA) in cyanobacterial blooms from multiple water bodies in Eastern Australia. Harmful Algae. 74, 10-18 (2018).
- Combes, A., et al. Validation of the analytical procedure for the determination of the neurotoxin β-N-methylamino-l-alanine in complex environmental samples. Analytica Chimica Acta. 771, 42-49 (2013).
- Violi, J. P., Mitrovic, S. M., Colville, A., Main, B. J., Rodgers, K. J. Prevalence of β-methylamino-L-alanine (BMAA) and its isomers in freshwater cyanobacteria isolated from eastern Australia. Ecotoxicology and Environmental Safety. 172, 72-81 (2019).
- AccQ-Tag Ultra Derivatization Kit Care and. Waters Available from: https://www.waters.com/waters/support.htm?lid=10008559 (2014)
- D'Hondt, E., Gonzalez-Fernandez, C., Munoz, R., et al. Cell Disruption Technologies. Microalgae-Based Biofuels and Bioproducts. , 133-154 (2017).
- Sedgwick, G. W., Fenton, T. W., Thompson, J. R. Effect of protein precipitating agents on the recovery of plasma free amino acids. Canadian Journal of Animal Science. 71 (3), 953-957 (1991).
- Niu, L., et al. Modified TCA/acetone precipitation of plant proteins for proteomic analysis. PLOS One. 13 (12), 0202238 (2018).
- Fic, E., Kedracka-Krok, S., Jankowska, U., Pirog, A., Dziedzicka-Wasylewska, M. Comparison of protein precipitation methods for various rat brain structures prior to proteomic analysis. Electrophoresis. 31 (21), 3573-3579 (2010).
- Koontz, L. TCA precipitation. Methods in Enzymology. 541, 3-10 (2014).
- Novák, P., Havlíček, V., Ciborowski, P., Silberring, J. Protein Extraction and Preparation. Proteomic Profiling and Analytical Chemistry (Second Edition). , 51-62 (2016).
- Li, A., et al. Elucidation of matrix effects and performance of solid-phase extraction for LC-MS/MS analysis of beta-N-methylamino-L-alanine (BMAA) and 2,4-diaminobutyric acid (DAB) neurotoxins in cyanobacteria. Analyst. 137 (5), 1210-1219 (2012).
- Baker, T. C., Tymm, F. J. M., Murch, S. J. Assessing environmental exposure to β-N-methylamino-l-alanine (BMAA) in complex sample matrices: A comparison of the three most popular LC-MS/MS methods. Neurotoxicity Research. 33 (1), 43-54 (2018).
- Beach, D. G., Kerrin, E. S., Giddings, S. D., Quilliam, M. A., McCarron, P. Differential mobility-mass spectrometry double spike isotope dilution study of release of β-methylaminoalanine and proteinogenic amino acids during biological sample hydrolysis. Scientific Reports. 8, 117 (2018).
- Murch, S. J., Cox, P. A., Banack, S. A. A mechanism for slow release of biomagnified cyanobacterial neurotoxins and neurodegenerative disease in Guam. Proceedings of the National Academy of Sciences of the United States of America. 101 (33), 12228-12231 (2004).
- Banack, S. A., Murch, S. J., Cox, P. A. Neurotoxic flying foxes as dietary items for the Chamorro people, Marianas Islands. Journal of Ethnopharmacology. 106 (1), 97-104 (2006).
- van Onselen, R., Cook, N. A., Phelan, R. R., Downing, T. G. Bacteria do not incorporate β-N-methylamino-l-alanine into their proteins. Toxicon. 102, 55-61 (2015).
- Faassen, E. J., Gillissen, F., Zweers, H. A. J., Lürling, M. Determination of the neurotoxins BMAA (β-N-methylamino-L-alanine) and DAB (α-,γ-diaminobutyric acid) by LC-MSMS in Dutch urban waters with cyanobacterial blooms. Amyotrophic Lateral Sclerosis. 10, 79-84 (2009).
- Food and Drug Administration. Bioanalytical Method Validation. Guidance for Industry. U.S. U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research, Center for Veterinary Medicine. , (2018).
- Reichelt, M., Hummert, C., Luckas, B. Hydrolysis of microcystins and nodularin by microwave radiation. Chromatographia. 49 (11), 671-677 (1999).
- Marconi, E., Panfili, G., Bruschi, L., Vivanti, V., Pizzoferrato, L. Comparative study on microwave and conventional methods for protein hydrolysis in food. Amino Acids. 8 (2), 201-208 (1995).
- Chen, S. -. T., Chiou, S. -. H., Chu, Y. -. H., Wang, K. -. T. Rapid hydrolysis of proteins and peptides by means of microwave technology and its application to amino acid analysis. International Journal of Peptide and Protein Research. 30 (4), 572-576 (1987).
- Aviram, L. Y., McCooeye, M., Mester, Z. Determination of underivatized amino acids in microsamples of a yeast nutritional supplement by LC-MS following microwave assisted acid hydrolysis. Analytical Methods. 8 (22), 4497-4503 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유