このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
高機能脳卒中患者の認知障害を検出するためのデュアルタスクストループパラダイム
要約
臨床評価尺度は、高機能脳卒中患者の認知機能障害に対して十分に敏感です。デュアルタスクパラダイムは、認知機能障害の評価と認知トレーニングにおいて利点と可能性を提示します。ここでの研究では、高機能脳卒中患者の認知機能障害を特定するためのデュアルタスクストループパラダイムを提案しています。
要約
一般的な臨床認知評価尺度は、高機能脳卒中患者の認知障害に対して十分に敏感ではありません。デュアルタスク評価は、高機能脳卒中患者の認知障害を特定するための利点があり、臨床評価と認知トレーニングに徐々に適用されています。さらに、Stroopパラダイムは、従来の臨床認知評価尺度よりも注意評価の感度と特異性が高くなっています。したがって、この研究は、高機能脳卒中患者の認知障害を特定するためのストループパラダイムに基づくデュアルタスク評価を提示します。本研究では、Stroopパラダイムに基づくシングルタスクおよびデュアルタスク評価を実証し、ケース実験と同期機能近赤外分光評価を通じてその実現可能性を確認します。ストループ反応時間と正解率は、被験者の認知レベルを評価するための主要な指標として使用されます。この研究プロトコルは、天井効果を理解するための新しいアイデアを提供することを目的としています 高機能脳卒中患者の一般的な臨床評価の失敗。
概要
脳卒中は人間の障害の主な原因であり1 、さまざまな程度の運動障害、認知障害、感情障害、およびその他の機能障害を引き起こす可能性があります2。予後が良く、わずかな機能障害しかない脳卒中患者の中には、日常生活においてより大きな機能的自律性を示すものもありますが、障害の機能状態は、仕事への復帰や以前の活動をサポートするのに十分ではない可能性があります。これらの患者は、高機能脳梗塞患者3、4と呼ばれる。軽度の機能障害のため、モントリオール認知評価(MoCA)5 や臨床認知症評価(CDR)6などの機能スケールの一般的な評価を通じて、特に認知機能の観点から機能障害を特定することは困難です。したがって、高機能脳卒中患者の認知機能障害を特定するための客観的かつ簡便な方法を開発する必要があります。
近年、評価とトレーニングにおけるデュアルタスクパラダイムの利点は徐々に評価されるようになりました7,8。例えば、患者は、単純な認知的単一タスク(例えば、計算)では正常に実行され得るが、追加のタスクが追加される9、10(例えば、カウントしながら歩く)場合には、様々な程度の認知低下を示す。Manafらは、脳卒中患者が認知運動の二重タスクを実行するときに、認知タスクのパフォーマンスを犠牲にして安定性を維持するなど、代償戦略を使用することが多いことを発見しました11。したがって、デュアルタスク評価は、高機能脳卒中患者の認知障害を特定する上で利点がある可能性があります。一方で、デュアルタスクアセスメントの内容は、周囲の環境を観察しながら歩いたり、話したり電話したりするなど、単一のタスクよりも日常生活に近いものです。以前の研究では、歩行+命名タスクと歩行+横断障害物タスクは、実際の環境での歩行をシミュレートするように設計されました12。
一方、デュアルタスクにおける実行能力は、分割注意(高度な認知機能のカテゴリーに属する)と密接な関係があります13。分割注意は、複数のタスクを同時に処理し、2つ以上のタスクに注意を割り当てる能力です14。この認知スキルは、日常活動の効率を向上させるために非常に重要です。したがって、デュアルタスク評価の結果は、個人の分割された注意を反映するために使用できます。通常、人々は日常生活の中で2つ以上の単純な作業を同時に処理することができ、邪魔されることはありません。しかし、脳機能が損なわれている場合、単純な二重タスクに直面したときに、より多くの二重タスク干渉があるかもしれません。すなわち、二重タスクを実行する場合、分割注意の減少は、1つまたは2つのタスクのパフォーマンスを障害させる可能性がある15。デュアルタスク実行は、高機能脳卒中患者の高度な認知機能障害を検出できる可能性が高いと結論付けられています。
ストループパラダイムは、ストループ効果(紛争効果としても知られている)16を研究するための古典的な実験パラダイムであり、認知機能テスト、特に注意抑制の分野での注意評価に広く使用されています17。古典的なストループ効果は、支配的な反応の干渉のために、個人が非支配的な刺激に迅速かつ正確に反応することが困難であるという事実を指す。これにより、非支配刺激に対する応答時間が長くなり、応答精度が低下します。支配的な反応と非支配的な反応の間の反応時間または正解率の差は、ストループ効果18です。したがって、ストループには高いレベルの注意が必要です19。ストループ効果が小さいほど注意抑制が高くなり、ストループ効果が大きいほど注意抑制の低下を表します18。
Stroopパラダイムは、高機能脳卒中患者の認知機能障害の評価に適している可能性があり、従来の臨床評価尺度20よりも注意評価に対する感度と特異性が高い。したがって、この研究では、高機能脳卒中患者の認知障害を特定するために、ストループパラダイムに基づくデュアルタスク評価を設計しました。プロトコルには、脳卒中患者の認知機能、下肢運動機能、およびバランス機能の臨床評価も含まれており、患者がデュアルタスク評価を完了できるようにします。機能的近赤外分光法(fNIRS)は、二重課題の下で高機能脳卒中患者の脳機能の活性化を検出するための脳機能の客観的評価ツールとして使用されました。Stroopパラダイムに基づくデュアルタスク評価スキームの有効性と実現可能性を、臨床診療に新たな側面を提供するニューロイメージングの観点から検証しました。
Access restricted. Please log in or start a trial to view this content.
プロトコル
このプロジェクトは、広州医科大学第5付属病院の医療倫理協会(番号KY01-2020-08-06)によって承認され、中国臨床試験登録センター(No. ChiCTR2000036514)。この研究でデータを使用するためのインフォームドコンセントが患者から得られました。
1. 採用情報
- 画像検査-診断によって確認された安定した状態の脳卒中患者を募集することは、中国医師会神経学支部(2005)の脳血管疾患の診断基準に準拠しています。ブルンストロームステージIV21で脳卒中の患者を選択してください。
- 患者が基本的な日常活動を独立して完了できることを確認します。患者に明らかな認知障害がなく、次の要件を満たしていることを確認します:正常範囲のMoCA。一方的な怠慢はありません(アルバートのテスト、省略の数≤2)22;言語障害などの他の神経疾患はありません。この研究を完了するために関連する指示に協力することができます。
- 被験者が自発的にテストに参加し、インフォームドコンセントフォームに署名することを確認します。
2. 臨床評価
- 名前、性別、生年月日、教育レベル、ボディマス指数、病歴、投薬歴などの被験者情報を記録します。
- 認知機能評価を実行します。
- 被験者の注意力と集中力、実行機能、記憶、言語、視覚構造スキル、抽象的思考、コンピューティング、およびオリエンテーションに対処する11の質問をすることにより、脳卒中患者に対してMoCA23 を実行します。
- MoCAの合計スコアは30で、これは教育レベルに関連しています。被験者が12年未満の教育を受けた場合は、MoCAの合計スコアに1ポイントを追加します。26以上のスコアを通常の23と見なします。
- 脳卒中患者にCDR24 を実行します。脳卒中患者とその家族への構造化されたインタビュー中に情報を収集し、記憶、方向性、判断と問題解決、仕事と社会的相互作用、家族生活と個人的な趣味、自立生活の6つの側面で被験者の能力を評価します。
- 可能な最高スコアは3です。得られたスコアを次のように評価します:合計スコア= 0は認知症がないことを示します。合計スコア= 0.5は認知症の疑いを示します。合計スコア= 1は軽度の認知障害を示します。合計スコア= 2は中等度の認知障害を示します。合計スコア=3は重度の認知障害24を示す。
- 脳卒中患者の片側空間無視(USN)の存在を検出するためにアルバートのテストを実行します。被験者に、一枚の紙にランダムな方向に置かれたすべての線を消すように依頼します。
- それぞれ長さ約2 cmの一連の40本の黒い線を、6列のx8.6サイズの紙の白い11枚のシートにランダムに向けて提示します。テストシートの両側に交差していない線の数に基づいて、USNの有無を評価します。いずれかの線が交差せずに残っており、これらの交差していない線の70%以上が運動障害と同じ側にある場合、これは一方的な空間無視を示しています。
- 運動機能評価を行います。
- 脳卒中患者に対してFugl-Meyer評価(FMA)を実行して、脳卒中後の片麻痺患者の運動機能、感覚、バランス、関節可動域、および関節痛を評価します。運動領域には、肩、肘、前腕、手首、手、腰、膝、足首の動き、協調、および反射作用を評価する項目が含まれます。
- 運動機能スコアは0(片麻痺)から100ポイント(正常な運動能力)の範囲で、上肢で66ポイント、下肢で34ポイントに分けられます。次のようにスコアを評価します:0〜49ポイントは重度の運動障害を示します。50〜84ポイントは、顕著な運動障害を示します。85〜95ポイントは中等度の運動障害を示します。96〜99ポイントは、わずかな運動障害を示します。
- バランス関数評価を実行します。
- 脳卒中患者にベルクバランススケール(BBS)27 を行い、座位バランス、立位バランス、体移動、回転、片足立位など、簡単なものから難しいものまで合計14項目あります。
- 次のようにスコアを評価します:スケールの最高スコアは56です。合計スコア<40ポイントは、転倒のリスクを示唆しています。得点が0〜20ポイントは、バランス機能が悪く、車椅子が必要であることを示します。得点された21〜40ポイントは、被験者が一定のバランス機能を有し、補助を受けて歩く必要があることを示唆している。41〜56点の得点は、良好なバランス関数を示唆し、被験者は独立して歩くことができることを示唆している28。
- 評価が下がるリスクを実行します。
- 脳卒中患者に対してタイムアップアンドゴーテスト(TUGT)29 を実行します。被験者に椅子から立ち上がって3m歩き、体を回してから戻って快適な速度で椅子に座るように依頼し、安全を確保します。同時に、評価者に出発命令の発行から椅子に座るまでのプロセス全体の時間を計るように依頼します。
- 被験者がTUGTを完了するための合計時間が≥14秒である場合、被験者が転倒するリスクがあることを示しています29。
3.ストループタスクの評価
- ストループ単一タスク評価を実行します (ストループ タスクのみ。 図1)。
- 患者に安定した椅子に座るように依頼します。
- 市販の刺激提示ソフトウェアを実行し、合同テストトライアルを選択します。患者の新しいプロファイルを作成します。Stroopタスクの合同検定試行を選択し、3つの試行を繰り返します。
- 次の実験パラダイムを実行します。患者の休息時間を10秒にして実験を計画し、患者に合計3回の試行で6秒の頻度で1回の認知テストを実行し、各試行に60秒の刺激+60秒の休息を行うように依頼します。
- 実験の合計時間を 370 秒に設定します (具体的なプロセスを 図 1 に示します)。休息段階では、患者にリラックスするように依頼します。実験が刺激段階にあるとき、患者に注意関連のテストを実行し、6秒でタスクを完了し、60秒で10倍を完了するように依頼します。
- 以下に説明するように、2つのテストトライアルの指示に従うように患者に依頼します。.
- 合同テストトライアルを選択します。をクリックすると、できるだけ早く左 (←)
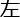 の矢印ボタンが正方形の左側に表示されます。正方形の右側に表示されたら
の矢印ボタンが正方形の左側に表示されます。正方形の右側に表示されたら 、できるだけ早く右(→)の矢印ボタンをクリックします。
、できるだけ早く右(→)の矢印ボタンをクリックします。 - 合同検定試行と同じステップを共有する不一致検定試行を選択します。が正方形の左側に表示されたら
 、できるだけ早く左(←)の矢印ボタンをクリックし、文字の意味を無視してその位置に焦点を合わせます。
、できるだけ早く左(←)の矢印ボタンをクリックし、文字の意味を無視してその位置に焦点を合わせます。 - 矢印ボタンをできるだけ早く右 (→) にクリックし、正方形の右側に表示され、
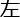 文字の意味を無視してその位置に焦点を合わせます。タスクを完了し、データを保存し、データを自己構築データベースにエクスポートします。
文字の意味を無視してその位置に焦点を合わせます。タスクを完了し、データを保存し、データを自己構築データベースにエクスポートします。
- 合同テストトライアルを選択します。をクリックすると、できるだけ早く左 (←)
- Stroop デュアルタスク評価 (Stroop タスク + バランス制御) を実行します。
- 患者にバランスボールに座るように依頼し、セラピストが患者の保護を担当します。患者に上記のステップ(ステップ3.1.1.-3.1.5)でStroop実験パラダイムを完了させます。
- 実験が休息段階にあるときは、バランスを保ち、バランスボールでできるだけリラックスするように患者に依頼します。実験が刺激の状態になったら、できるだけバランスボールのバランスを保ちながら注意関連テストを行うよう患者に依頼する。
- 患者にバランスボールに座るように依頼し、セラピストが患者の保護を担当します。患者に上記のステップ(ステップ3.1.1.-3.1.5)でStroop実験パラダイムを完了させます。
4. fNIRS評価
- fNIRSテストキャップに10個の光源と12個のレシーバーを配置して、左前頭前野(LPFC)、右前頭前野(RPFC)、左プロモーター皮質(LPMC)、および右プロモーター皮質(RPMC)を含むこの研究の4つの関心領域(ROI)に対応します。
- 主題の準備
- 被験者に実験目的を伝え、患者を観察します。
- テストキャップの上部、額からフルキャップの正中線の後頭葉までの4番目のポイントにあるCzサイトを確認します。接続の中点が、鼻根から後頭隆起の下端まで、鼻根から後頭隆起への接続の交点、または両耳の上耳介窩(貝殻)間の接続にあることを確認します。
- 被験者の頭にキャップを置き、被験者の頭のCzポイントがキャップのCzポイントと一致するようにキャップの位置を調整します。キャップの両側のネクタイを締め、被験者の耳が隙間から突き刺さるようにします。キャップの前面は自然に額に取り付けられ、背面は自然に後頭部に取り付けられます。
- 取得と事前取得
- ソフトウェアを開き、実験対象を選択し、患者の基本情報を入力します。サンプリング周波数を 11 Hz に設定します。
- [事前集録]ボタンをクリックして、 事前集録 を開始し、テスト信号を較正します。機能性近赤外分光法で表示される各点の信号強度に応じて、キャップを動かしたり、さらに頭皮を露出させたりして、微弱な信号点を調整します。キャップによって収集された各ポイントの信号強度が安定する傾向がある場合は、事前収集を停止し、自動ゲインボタンをクリックします。[ スタート ]ボタンをクリックして、信号を収集します。
メモ: 次のように、集録および事前集録の信号品質を確認してください。元の光強度信号曲線は安定している必要があり、1〜2 Hzの心拍信号の変動を伴い、値は機器によって設定された合理的なしきい値を満たしている必要があります。信号の強度は色で示すことができ、灰色の表示信号強度は低く、黄色は良好、緑は優れており、赤は強すぎます。
- fNIRSと同期したストループ単一タスク評価を実行します。次に、fNIRSと同期したStroopデュアルタスク評価を実行します。
5. データ処理と分析
- 患者の一般情報と臨床評価データを処理します。
- MATLABのNirSparkソフトウェアパッケージを使用して近赤外データを分析します。
- データの事前処理を実行します。
- [ 除外 ] ボタンをクリックして、実験に関係のない時間間隔を削除します。[モーション ] ボタンをクリックして、呼吸、心拍、脈拍などの生理学的活動、およびまばたき、飲み込むなどの不随意活動によって引き起こされるモーションアーティファクトを排除し、光強度信号を光密度信号に変換します。
- [フィルター]ボタンをクリックして、生理学的および機器のノイズを除去するバンドパスフィルター(0.01〜0.2 Hz)を選択します。ヘモボタンをクリックして、修正されたランベルトベールの法則に従ってオキシヘモグロビン(HbO2)とデオキシヘモグロビン(HbR)の相対変化を計算し、光学濃度信号を血中酸素濃度信号に変換します。
注:HbO 2はHbRよりも条件間の変化に敏感であるため、その後の分析では、この研究プロトコルではHbO2データのみを使用します。
- 一般線形モデル (GLM) の構築
- 分析データとしてヘモタイプのHbO2を選択します。[仕様]ボタンをクリックして、時間単位として秒を取り、標準 HRF タイプを基本関数として選択します。次に、残りの段階を排除してGLM計画マトリックスを確立し、実験計画に従ってタスクの刺激段階を選択します。
- 推定ボタンをクリックして、確立された計画マトリックスを収集したデータに適合させます。[表示] ボタンをクリックして、計算されたβ値を確認します。
注:GLMは、興味深い回帰(タスク変数)、冗長共変量(短距離チャネルで測定された表面ノイズなど)、および誤差項として観察された血行動態信号(従属変数)の線形結合です。
- β値は次のように計算します。確立された線形相関モデルを使用して、ROIの実験データを計算します。必要なチャネルのGLMパラメータを取得し、分析のために各実験条件下での脳活性化のβ値(つまり、線形モデルの重み係数)を導き出します。
- データの事前処理を実行します。
- 市販の刺激提示ソフトウェアを実行して、Stroopタスクの認知タスクのパフォーマンスデータをエクスポートし、最終データ分析の精度(ACC)と反応時間(RT)を取得します。
Access restricted. Please log in or start a trial to view this content.
結果
本研究では,2年前に左片麻痺を伴う虚血性脳卒中を呈した71歳の男性であった高機能脳卒中患者の結果を提示する。磁気共鳴画像法(MRI)は大脳基底核から放射冠までの両側性慢性梗塞を呈した.彼は地域社会で独立して歩き、生活することができましたが、彼の認知回復に満足していませんでした。しかし、機能評価はすべて正常範囲内でした:FMA = 100、BBS = 56/56、TUGT = 6、MoCA = 26/30、CDR = 0.5、ア?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
私たちの研究では、高機能脳卒中患者のための日常的な臨床認知評価尺度の結果は、有意な認知障害を示しませんでした。ただし、これらの評価尺度は天井効果を示し、高機能脳卒中患者の軽度の認知障害を特定するための感度が低い可能性があります。したがって、このプロトコルは、高機能脳卒中患者の認知障害を特定するための主要な指標として、ストループパラダイムに基づくデュ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は開示するものは何もありません。
謝辞
本研究は、中国国家自然科学基金会(第81804004号、81902281号)、中国ポスドク科学基金会(第2018M643207号)、深セン市衛生健康委員会プロジェクト(第2018005号)、深セン科学技術プロジェクト(第201604281号74825490号)、広州市保健家族計画総合指導プログラム(第20211A010079号、20211A011106号)、広州大学基金会(第202102010100号)、 広州医科大学基金会(番号PX-66221494)、広東省高等教育機関の主要研究所[助成金番号:2021KSYS009]および広東省教育省[助成金番号:2021ZDZX2063]。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Balance Ball | Shanghai Fanglian Industrial Co, China | PVC-KXZ-EVA01-2015 | NA |
| E-Prime 3.0 | Psychology softwares Tools | commercial stimulus presentation software | |
| fNIRS | Hui Chuang, China | NirSmart-500 | NA |
参考文献
- Dichgans, M., Pulit, S. L., Rosand, J. Stroke genetics: Discovery, biology, and clinical applications. The Lancet. Neurology. 18 (6), 587-599 (2019).
- Chen, G., Leak, R. K., Sun, Q., Zhang, J. H., Chen, J. Neurobiology of stroke: Research progress and perspectives. Progress In Neurobiology. 163-164, 1-4 (2018).
- Maratos, M., Huynh, L., Tan, J., Lui, J., Jarus, T. Picture this: Exploring the lived experience of high-functioning stroke survivors using photovoice. Qualitative Health Research. 26 (8), 1055-1066 (2016).
- Platz, T., Prass, K., Denzler, P., Bock, S., Mauritz, K. H. Testing a motor performance series and a kinematic motion analysis as measures of performance in high-functioning stroke patients: reliability, validity, and responsiveness to therapeutic intervention. Archives of Physical Medicine and Rehabilitation. 80 (3), 270-277 (1999).
- Trzepacz, P. T., Hochstetler, H., Wang, S., Walker, B., Saykin, A. J. Relationship between the Montreal Cognitive Assessment and Mini-mental State Examination for assessment of mild cognitive impairment in older adults. BMC Geriatrics. 15, 107(2015).
- McDougall, F., et al. Psychometric properties of the Clinical Dementia Rating - Sum of boxes and other cognitive and functional outcomes in a prodromal Alzheimer's disease population. The Journal of Prevention of Alzheimer's Disease. 8 (2), 151-160 (2021).
- McHorney, C. A., Tarlov, A. R. Individual-patient monitoring in clinical practice: Are available health status surveys adequate. Quality of Life Research. 4 (4), 293-307 (1995).
- Silsupadol, P., et al. Effects of single-task versus dual-task training on balance performance in older adults: a double-blind, randomized controlled trial. Archives of Physical Medicine and Rehabilitation. 90 (3), 381-387 (2009).
- Feld, J. A., et al. Relationship between dual-task gait speed and walking activity poststroke. Stroke. 49 (5), 1296-1298 (2018).
- Liu, Y. -C., Yang, Y. -R., Tsai, Y. -A., Wang, R. -Y. Cognitive and motor dual task gait training improve dual task gait performance after stroke - A randomized controlled pilot trial. Scientific Reports. 7 (1), 4070(2017).
- Manaf, H., Justine, M., Ting, G. H., Latiff, L. A. Comparison of gait parameters across three attentional loading conditions during timed up and go test in stroke survivors. Topics In Stroke Rehabilitation. 21 (2), 128-136 (2014).
- Ou, H., et al. Motor dual-tasks for gait analysis and evaluation in post-stroke patients. Journal of Visualized Experiments. (169), e62302(2021).
- Hirano, D., Goto, Y., Jinnai, D., Taniguchi, T. Effects of a dual task and different levels of divided attention on motor-related cortical potential. Journal of Physical Therapy Science. 32 (11), 710-716 (2020).
- Loetscher, T., Potter, K. -J., Wong, D., das Nair, R. Cognitive rehabilitation for attention deficits following stroke. The Cochrane Database of Systematic Reviews. 2019 (11), (2019).
- Chen, C., Leys, D., Esquenazi, A. The interaction between neuropsychological and motor deficits in patients after stroke. Neurology. 80, Suppl 2 27-34 (2013).
- Puglisi, G., et al. Frontal pathways in cognitive control: Direct evidence from intraoperative stimulation and diffusion tractography. Brain. 142 (8), 2451-2465 (2019).
- MacLeod, C. M. Half a century of research on the Stroop effect: An integrative review. Psychological Bulletin. 109 (2), 163-203 (1991).
- Su, M., Wang, R., Dong, Z., Zhao, D., Yu, S. Decline in attentional inhibition among migraine patients: An event-related potential study using the Stroop task. The Journal of Headache and Pain. 22 (1), 34(2021).
- Tsang, C. S. L., Chong, D. Y. K., Pang, M. Y. C. Cognitive-motor interference in walking after stroke: test-retest reliability and validity of dual-task walking assessments. Clinical Rehabilitation. 33 (6), 1066-1078 (2019).
- Bai, Q., Hu, J., Zhang, L. J., Chen, Y., Zhang, Y. H., Wang, X. C., Chi, L. Y. Application value of Stroop test in the evaluation of cognitive function in asymptomatic cerebral infarction. China Journal of Alzheimer's Disease and Related Disorders. 4 (4), 269-274 (2021).
- Pandian, S., Arya, K. N. Stroke-related motor outcome measures: Do they quantify the neurophysiological aspects of upper extremity recovery. Journal of Bodywork and Movement Therapies. 18 (3), 412-423 (2014).
- Albert, M. L. A simple test of visual neglect. Neurology. 23 (6), 658-664 (1973).
- Nasreddine, Z. S., et al. The Montreal Cognitive Assessment, MoCA: A brief screening tool for mild cognitive impairment. Journal of the American Geriatrics Society. 53 (4), 695-699 (2005).
- Morris, J. C. The Clinical Dementia Rating (CDR): Current version and scoring rules. Neurology. 43 (11), 2412-2414 (1993).
- Sullivan, K. J., et al. Fugl-Meyer assessment of sensorimotor function after stroke: Standardized training procedure for clinical practice and clinical trials. Stroke. 42 (2), 427-432 (2011).
- Sanford, J., Moreland, J., Swanson, L. R., Stratford, P. W., Gowland, C. Reliability of the Fugl-Meyer assessment for testing motor performance in patients following stroke. Physical Therapy. 73 (7), 447-454 (1993).
- Downs, S. The Berg Balance Scale. Journal of Physiotherapy. 61 (1), 46(2015).
- Blum, L., Korner-Bitensky, N. Usefulness of the Berg Balance Scale in stroke rehabilitation: A systematic review. Physical Therapy. 88 (5), 559-566 (2008).
- El Said, S. M. S., Adly, N. N., Abdul-Rahman, S. A. Executive function and physical function among community-dwelling Egyptian older adults. Journal of Alzheimer's Disease. 80 (4), 1583-1589 (2021).
- Al-Yahya, E., et al. Prefrontal cortex activation while walking under dual-task conditions in stroke: A multimodal imaging study. Neurorehabilitation and Neural Repair. 30 (6), 591-599 (2016).
- Matjacic, Z., Zadravec, M., Olensek, A. Feasibility of robot-based perturbed-balance training during treadmill walking in a high-functioning chronic stroke subject: A case-control study. Journal of Neuroengineering and Rehabilitation. 15 (1), 32(2018).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved