Method Article
低侵襲法に基づくマウス挫傷脊髄損傷モデルの確立
要約
低侵襲技術とシンプルな実験装置は、実験動物への手術損傷を減らし、解剖学的形態の維持を可能にすることにより、脊髄損傷モデルの再現性を向上させます。信頼性の高い結果と再現可能な手順により、病気の修復のメカニズムの調査が容易になるため、この方法は価値があります。
要約
低侵襲法を使用して脊髄損傷(SCI)をモデル化することで、実験動物間の行動的および組織学的差異を最小限に抑えることができ、それによって実験の再現性が向上します。
これらの方法は、外科的解剖学的経路の明瞭さと実験装置の単純さと利便性という2つの要件を満たす必要があります。オペレーターにとって重要なことは、明確な解剖学的経路が低侵襲曝露を提供し、外科的処置中の実験動物への追加の損傷を回避し、動物が実験中に一貫した安定した解剖学的形態を維持することを可能にすることです。
この研究では、小動物の脊髄損傷のためのSCI同軸プラットフォームと呼ばれる新しい統合プラットフォームを使用して、T9レベルの脊髄を低侵襲に露出させ、脊椎安定剤を使用してマウスの椎骨を安定化および固定することを研究し、最後に、同軸重力インパクターを使用してマウスの脊髄を挫傷し、さまざまな程度のT9脊髄損傷に近づきます。最後に、組織学的結果が読者の参照として提供されます。
概要
外傷性脊髄損傷(SCI)は、個人を深刻な結果に容易にかかりやすくします1。それにもかかわらず、現在のところ有効な治療法はありません1,2。動物の挫傷モデルは、SCI 3,4を研究するための主要な方法の1つです。
2004年から2014年4まで、ラットは407件の研究のうち289件(71%)で、マウスは69件(16.9%)でモデル生物として使用されました。実際、マウスを用いた実験の割合は、他のモデルに対する利点、特に遺伝子調節研究の大きな可能性のために、長年にわたって徐々に増加しています3,4,5。したがって、モデルの一貫性が非常に重要であるため、マウスをモデルとしてより多くの研究を行うには、より互換性のあるツールが必要です6。以前の研究で報告されている一般的なデバイスは、基本的にアレンの脊髄衝撃原理に基づいており、たとえば、基本的な体重減少インパクター7,8、ニューヨーク大学(NYU)/多施設動物脊髄損傷研究(MASCIS)インパクター1,9、およびインフィニットホライズン(IH)インパクター10,11.ウェイトドロップインパクターとNYU / MASCISインパクターは、標的の脊髄を狙い、異なる高さから固定ウェイトを落下させて異なる損傷の重症度を作るという同じ原理を共有しています。IHインパクターは、さまざまな力に応じて脊髄損傷を引き起こします。
SCI研究でマウスモデルを使用する際の便宜と効果的な治療法の基礎を確立するために、脊髄損傷同軸プラットフォーム(SCICP)と呼ばれる統合されたマウス脊髄衝撃損傷プラットフォームが開発されています。プラットフォームは4つの主要コンポーネントで構成されています:(1)操作されたマウスに適した位置用に設計された動物手術台は、非常にコンパクトで、位置制限のない利便性を提供します。(2)手術中に傍脊椎筋を保持するための両側のマイクロリトラクター。(3)SCIの手順の前に椎骨を保持するための椎体安定化装置(ラットなどの大型動物での手術には2つの椎骨安定化装置が利用可能)。(4)スリーブ、インパクターチップ、ウェイト、プルピン。3つの部品は、取り外し可能なX-Y-Zアームに組み立てる必要があります。正確なターゲティングのために、インパクターチップを脊髄の表面に置き、インパクターチップとスリーブの間のマークの助けを借りて、X-Y-Zアームを予想される高さまでゆっくりと下降させます。インパクターチップは0.12gのアルミニウム合金でできており、手術前の大きな重量圧縮に起因する脊髄の損傷を防ぎます。プルピンは、ウェイトドロップを準備するためにスリーブの上部にウェイトを保持するためのものです(図1)。
以前の研究では、衝撃力の分割は、IHデバイスの衝撃力データ(それぞれ30 Kdyn、50 Kdyn、および70 Kdyn)に従って定義されていました6,10。研究の過程で、SCIモデルの連続度は、さまざまな研究で使用できるSCICPに基づいて確立されることが証明されました。したがって、正式に実験を開始する前に、異なる質量のさまざまな重量によって生成される衝撃力をピーク圧力試験装置を使用してテストしました。その結果、3つの標準化された代表的なSCIマウスモデルを、それぞれ軽度、中等度、重度のグループを含む3つの異なる程度の損傷として選択し6,10、同じ高さで、軽度で1.3 g、中等度で2.0 g、重度の損傷で2.7 gのウェイトをリリースしました。
操作性と精度を保証する別の方法として、新規で低侵襲の手術アプローチが報告されています。正常マウスの解剖学的構造を研究することにより、T12-T13の棘間腔を見つける新しい方法が見出されました。手術ステップでの椎骨の位置特定方法は習得が容易で正確であり、低侵襲手術のための正確な位置決めを保証します。
うまくいけば、この挫傷の技術は、病態生理学の理解、管理評価などを含む脊髄損傷の研究と理解に役立つ可能性があります。
プロトコル
注:すべての実験は、山東大学チールー医科大学の実験動物倫理福祉委員会(承認番号:21L60)によって承認され、国立衛生研究所が発行した実験動物の世話と使用に関するガイド(NIH出版物第85-23号、改訂1996)に従って実施されました。
1.脊髄損傷同軸プラットフォームのメカニズムと機械的試験
- 外科手術台、脊椎安定装置、およびインパクターチップでプラットフォームを組み立てます(図1)。
注意: 重量落下やスリーブの汚れがプラットフォームの精度に影響を与える可能性があるため、重量が気流に遭遇するのを防ぐ重量落下スロットと排気スロットを清潔に保ちます。 - 正確な脊髄の位置特定を可能にする先端をスリーブに入れます。
- 実験の体重減少の適切な質量(軽度、中等度、重度のグループでそれぞれ1.3 g、2.0 g、2.7 g)を選択します。
- プルピンをウェイトドロップの穴に差し込みます。
- X-Y-Zアームの溝にプルピンを取り付けて、ウェイトドロップをスリーブの上部に組み立て、位置決めが完了すると、ウェイトが解放されてインパクターの先端に当たり、その結果、脊髄が擦り傷になり、脊髄の変化が顕微鏡で観察されます。
- 取り外し可能な0.1mm精密X-Y-Zアームをオペレーターの便宜に合わせて調整し、十分な作業スペースを確保します(図1D、E)。
注意: 研究結果の一貫性を確認するために、実験を開始する前に、ピーク圧力検出装置を使用して、ウェイトがスリーブ内に落下したときに発生する力を測定します。確認の繰り返しは、将来の研究には必要ありません。 - デバイスの電源を入れ、金属圧力受容体を先端の下に置き、アダプターをゼロにし、プルピンを解放し、実際の衝撃力を記録します。
2. 第9胸椎(T9)の位置特定と椎弓切除術
注:9〜10週齢の雌C57BL / 6Jマウスは、済南彭越実験動物会社(中国済南)から購入しました。
- 実験用の一連の手術器具をオートクレーブし、手術前に手術台を75%アルコールで滅菌します。
- 鎮痛のためにブプレノルフィンを注射します (0.05-2.0 mg / kg, SQ) 傷害手術のための麻酔の30分前に.次に、マウスをイソフルランで麻酔します(誘導:~3%-5%、維持:~1.5%-2%)。動物が尾またはつま先のつまみの反射によって完全に麻酔されているかどうかを確認します。麻酔が有効になったら、マウスを手術台の指定された部分に腹臥位に置き、角膜に眼軟膏をコーティングします(手術中の目の乾燥を防ぐために角膜に眼軟膏を塗布します)。
- 胸腰椎の上に電気シェーバーで尾から吻側まで髪を剃ります。ヨードフォアで30秒間円運動で皮膚を数回殺菌し、続いて75%アルコールを殺菌します。滅菌外科用ドレープを適用し、メスと刃で約T6からT13までの皮膚に約1.5 cmの縦切開を行います。
注:T12-T13棘間腔が位置する正中線までの肋骨縁に沿って触診します。吻側に1.5 cmの切開を行い、切開はT6-T13椎骨とほぼ同じ高さになります。
- 胸腰椎の上に電気シェーバーで尾から吻側まで髪を剃ります。ヨードフォアで30秒間円運動で皮膚を数回殺菌し、続いて75%アルコールを殺菌します。滅菌外科用ドレープを適用し、メスと刃で約T6からT13までの皮膚に約1.5 cmの縦切開を行います。
- 手術顕微鏡下で骨部分から片側の13番目の肋骨を探索します。正中線の棘突起を調べるには、肋骨角の領域に軽く触れ、次に吻側に向かってT12-T13の棘間腔を見つけます。T9-T10の棘間空間をT12-T13の空間から吻側まで探索します。(図2A、3A)
- T9の棘突起に沿って傍脊髄筋をマイクロハサミで両側の前部および後部の椎間関節まで解剖します(図3B)。マイクロリトラクターで傍脊髄筋を引っ込め、マイクロハサミで椎弓板上およびT8-T9およびT9-T10の棘間腔内の軟組織を洗浄します。
- T9椎弓切除術を行い、顕微手術鉗子でT9の棘突起をクランプし、わずかに持ち上げ、脊髄の損傷を避けて椎弓板の右側に沿ってマイクロハサミを平行に挿入し、マイクロハサミで椎弓板を切り取ります。左側で繰り返すと、脊髄が露出する可能性があります(図2B、3C)。
- 椎骨を固定する前に、ユニバーサルアームを緩め、椎骨安定化装置のマイクロ蚊鉗子で椎骨の両側にある9番目から10番目のファセットジョイントをゆっくりとクランプします。マイクロ蚊鉗子のネジを締めると、椎骨が安定します。脊髄を水平面に調整し、ユニバーサルアームを締めると、椎骨が固定されます(図3D)。
3. T9挫傷
- T9レベルの脊髄が露出し、椎骨が固定されたら、手術顕微鏡の下のスリーブの内側の先端で脊髄を狙います(図3E)。
- 脊髄と先端の関係を顕微鏡で観察しやすく、手術台を回しやすいため、脊髄の後部と外側から先端の表面が脊髄と平行になっているか確認してください。
- 脊髄に平行な自然な基準面であるため、椎弓切除後に先端が脊髄と接触する前に、先端の表面が温存椎弓板の両側境界と平行であるかどうかを確認してください。
- T12-T13の棘間腔を見つけた後、インパクターの端が観察窓のマークと一致し、指定された高さ22mmに達するまでスリーブを下げます。プルピンを引き出して重量を解放します(グループに応じて1.3 g、2.0 g、または2.7 g、各グループには3匹のマウスが含まれ、各グループは各時点で1匹のマウスを持ちます)。
注意: 脊髄は地面と平行で先端に垂直である必要があります。テーブルは非常にコンパクトなので、顕微鏡の視野を確保するために手術台を動かしてください。 - 挫傷が終わったらインパクターを取り外し、手術顕微鏡でSCIの程度を観察します。軽度のグループでは、淡赤色の色の変化が見られますが、中等度のグループでは、損傷部位は3〜4秒で暗赤色を示し、おそらく隆起が観察されます。重症群では、暗赤色の徴候がすぐに現れ、硬膜の明らかな隆起が現れることがありますが、硬膜はまだ一貫した形状です(図3F)。
- 表在性筋膜および皮膚を縫合糸(ポリプロピレン非吸収性縫合糸、サイズ:6〜0)で縫合する。
- 縫合が完了したら、手術領域を滅菌し、完全な意識が回復するまで温度制御されたパッドにマウスを置き、マウスをマウスケージに入れます。
4.動物の世話
- 回復のために動物を加熱パッドの上に置き、両方の後肢の動きを観察します。
注:手術を受けた動物は、完全に回復するまで他の動物と一緒に戻さないでください。 - 動物が簡単に食べ物に届くように、ケージの床に高水分の食事を置きます。または、下部の給餌テーブルを備えたケージを使用してください。
- 中等度および重度の損傷グループが膀胱機能を回復することは困難であるため、手術後にマウスの膀胱を1日2回空にします。鎮痛のためにブプレノルフィンを注射します (0.05-2.0 mg / kg, SQ) 8-12 時間 / 日 3日間.
5.経心灌流、染色、免疫染色
- 受傷後1日目、28日目、56日目に、灌流により各群のマウスをそれぞれ1匹ずつ屠殺する。
- 過度の麻酔後、60 mLのリン酸緩衝生理食塩水(PBS)と20 mLの4%パラホルムアルデヒド(4%〜6%イソフルラン)でマウスを灌流します。
- 背骨をマイクロハサミで集め、病変の中心から吻側と尾側にそれぞれ1 cm伸ばします。
- 余分な筋肉を切除し、器具がステップ5.1.4で保持できるように部分的な肋骨で無傷の脊椎セグメントを予約し、4%パラホルムアルデヒドに24時間浸します。
- 固定のために止血鉗子で肋骨をクランプし、切除された椎弓板と脊髄の病変中心の色の変化に従って顕微鏡下で病変の中心を定義します。
- 尾からマイクロハサミですべての椎弓板と関節突起を切除します。
- マイクロハサミで神経根を切り取り、脊髄を取り出します。
- マイクロハサミで病変の中心からそれぞれ尾側と吻側に伸びる0.5 cmの脊髄を収集します。
- 脊髄を30%スクロースに4°Cで48時間入れます。
- 組織学的検査の種類に従って、凍結後に組織を6μmの厚さの切片に切断します。
- ヘマトキシリンおよびエオジン(H&E)染色を行う。
- 切片を室温に再加熱し、厚さ6 μmの切片を4%ホルムアルデヒドに約15分間浸した後、1x PBSに1分間4回浸して残留OCTを除去します。
- 切片をヘマトキシリンで90秒間染色し、二重蒸留水ですすいでください。
- 次に、切片を流水で3分間洗います。
- エオジンで4分間染色し、95%アルコールに30秒間2回浸して、余分なエオジンを洗い流します。
- 最後に、勾配アルコール(95%アルコールと50%アルコールを連続して1回ずつ)で30秒間脱水し、キシレンに浸して透明化を2分間行います。その後、試験片を樹脂ゲルで密封する(冠状面断面:図 4;矢状面断面: 図5)。
- 免疫蛍光染色を行う。
- 切片を室温に再加熱し、厚さ6 μmの切片を4%ホルムアルデヒドに約2分間浸します。
- 切片をTBSTで5分間3回洗浄します。
- 切片をブロッキング溶液(PBS中の10%ヤギ正常血清)でインキュベートし、1時間ブロックして免疫グロブリンの非特異的結合をブロックします。
- マウス抗グリア線維性酸性タンパク質(GFAP、反応性アストロサイトのマーカー)、ポリクローナル抗体(1:600)、およびニューロフィラメントのマーカーであるウサギ抗NF200抗体(1:2000)の両方を0.4 mLのブロッキング溶液中で脊髄切片を4°Cで一晩インキュベートします。
- 切片をPBSですすぎ、ヤギ抗ウサギAlexa 594結合IgG(1:1,000)およびヤギ抗マウスAlexa 488結合IgG(1:1,000)二次抗体を含むブロッキング溶液0.4 mLを室温で1時間加えます。
- 蛍光顕微鏡で10倍の波長594nmと488nmの自動パノラマスキャンで撮影します(図6)。
- 蛍光顕微鏡の電源を入れ、スライドを顕微鏡ステージに置き、蛍光チャンネルに切り替え、ポジショニングキーを使用して組織上の3〜4点を配置し、焦点を合わせて撮影を完了します。撮影が終了したら、さまざまなチャンネルの画像を目的の形式で保存し、マージされた画像を保存します。
結果
装置の精度をテストするために、同じ高さから作られた3つの異なる質量の重りがピーク圧力試験装置を使用して測定された力。さまざまな重みのグループで24の試験を実施し、(平均±SD)1.3 gの重みで0.323 N ± 0.02 N、2.0 gの重みで0.543 N ± 0.15 N、2.7gの重みで0.723 N ± 0.26 Nが得られました(図7)。以前の研究では、挫傷強度を測定するための単位としてダイン(dyn)またはキロダイン(Kdyn)が採用されていました。以前の研究とのより良い比較のために、ニュートン(N)とダイン/キロダインの間の変換がリストされています(1 N = 1 kg × 1 m / s 2 = 1 × 10 3 g × 1 × 100 cm / s2 = 1 ×10 5 dyn;0.323 N = 32.3 Kdyn;0.543 N = 54.3 Kdyn;0.723 N = 72.3 Kdyn)。
表1 および 図4 は、冠状切片における軽度、中等度、および重度の群の病変のデータを示す。 図4から判断すると、受傷後28日目に、軽度、中等度、重度のグループで区別可能な灰白質境界と白質境界の連続性は順次減少し、瘢痕組織の面積が大きくなり、病変中心の断面に割合が増加しました。正常群と比較して、すべての実験群に明らかな形態学的差異があった。これは、実験グループにおける傷害度の分割の合理性を証明した。
表2 および 図5 は、矢状切片の損傷後1日目および56日目の脊髄の損傷について説明しています。受傷後1日目に軽度群から重度群へと病変面積が徐々に有意に増加していることがわかる。一方,脊髄両側の白質の連続性は軽度群で良好であり,間質性浮腫の特徴である小さな丸い液胞が観察できた。中等度群では、白質は連続性が悪く、腹側白質の構造は秩序化されていなかった。重症群では、腹側白質がより重度の破壊を示し、損傷の中心に空洞の広い領域が現れました。さらに、周囲の組織は赤血球の明らかな充満を示し、中央管近くの赤血球はストリップに集まりました。受傷後56日目に3群の受傷中心に瘢痕形成が認められ,受傷の重症度に応じて面積が増加した。
損傷後56日目の脊髄ニューロフィラメントの完全性は、免疫蛍光染色結果の分析からも導き出すことができます(図6)。この図はまた、3つの損傷グループすべての中央に重なり合う瘢痕形成星状細胞が見られ、損傷領域の長さは損傷の重症度とともに増加し、瘢痕直径は減少したことを示しています。これは瘢痕拘縮の存在を示唆しており、脊髄径の減少につながる可能性があります。

図1:脊髄損傷同軸プラットフォームの全体と部品の展示 。 (A)X-Y-Zアームと手術台を分離できるため、小動物の脊髄が露出する手術手順に十分なスペースがあります。操作テーブルは操作中に自由に動かすことができ、位置制限に起因する潜在的な操作の難しさを軽減します。椎骨安定化装置の本体には、方向補助用の3関節ユニバーサルアームがあり、柔軟性が高まります。(B)インパクターの先端をスリーブに入れ、後者をX-Y-Zアームに組み立てます。プルピンの先端を重りの穴に入れて重りが落ちないようにし、重りをスリーブに入れます。部品を組み立てたら、顕微鏡下で目的の損傷領域を見つけます。次に、インパクター先端の端が観察窓の下のレベルと一致するまでX-Y-Zアームを下げ、統一された挫傷の高さに達したことを示します(落下開始時のウェイトとインパクター先端の間の高さは22mmです)。プルピンを引くと、衝撃が起こります。(C)損傷領域が露出したら、クリップを使用してマウスの背骨と締め付けボルトをクランプして固定し、椎骨安定装置を安定させます。(D)手術台の溝の推奨機能。実験動物は、斜面の前胸部に向かって、中央の溝に置かれることになっています。X-Y-Zアームは手術台から分離されています。(E)組み立てられたSCICPの表示。矢印は部品を示します。先端がターゲットの挫傷領域を狙った状態で、挫傷を開始するには、プルピンを引き出すと、体重がインパクターの先端に落ちて脊髄を挫傷します。 この図の拡大版を表示するには、ここをクリックしてください。

図2:T13肋骨椎骨位置特定法のイメージンググラフ 。 (A)13番目の肋骨とT13は比較的一定の解剖学的構造です。T13肋骨角は顕微鏡で簡単に検出でき、そこからオペレーターは棘突起に向かってプローブし、T12-T13棘間腔を見つけることができます。次に、吻側に向かって順次プローブして、標的の損傷椎骨(例えば、T9)を見つける。(B)低侵襲の第9胸椎弓切除術は、隣接する椎体間の適切な椎弓板および椎間関節を維持することができます。 この図の拡大版を表示するには、ここをクリックしてください。
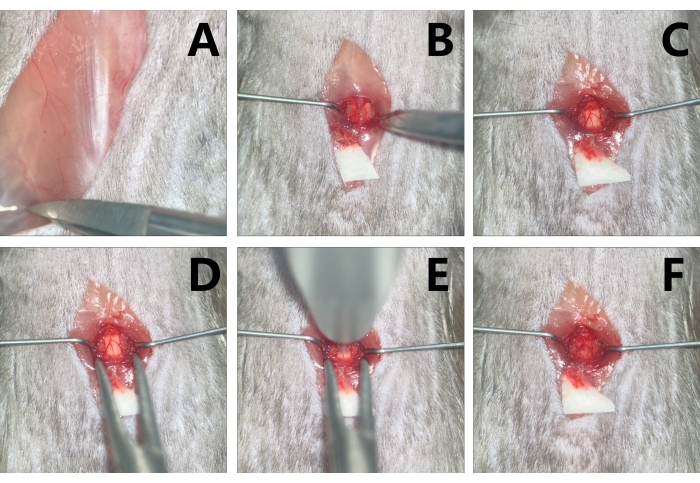
図3:マウスにおけるT9レベルの脊髄の露出と挫傷 。 (A)T13肋骨角を調べます。(B)傍脊髄筋をマイクロリトラクターで引っ込めて、操作のための十分なスペースを作り、T9を露出させます。(C)マイクロハサミでT9椎弓切除術を行います。(D)椎骨安定化装置のクリップで椎骨を安定させます。(E)インパクターの先端でターゲットの挫傷領域を狙います。(F)挫傷後の損傷領域に浮腫とうっ血が見られます。 この図の拡大版を表示するには、ここをクリックしてください。
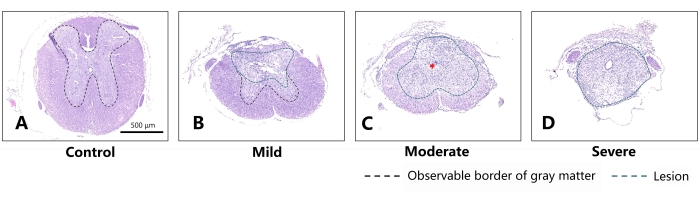
図4:マウスにおける異なる程度のSCI後28日目の代表的な切片(冠状切片)。 (A)マウスの正常な胸部脊髄。スケールバー= 500μm。 (B)軽度群では、脊髄の背側に軽傷が認められるが、温存白質および灰白質の形態はほぼ維持されている。(C)中等度のグループの場合、脊髄に明らかな瘢痕組織が観察されます(赤いアスタリスクで示されます)。白質と灰白質の差別化特性はほとんど区別できません。(D)比較すると、重症グループの脊髄は元の形態をほとんど失い、ほとんど瘢痕組織に置き換えられています。緑の破線は損傷の領域を示し、黒い破線は観察可能な灰白質の境界を示します。損傷の重症度が増すにつれて、マウスの脊髄により大きな病変とより少ない予備の構造が現れ、灰白質の境界はほとんど区別できませんでした。 この図の拡大版を表示するには、ここをクリックしてください。
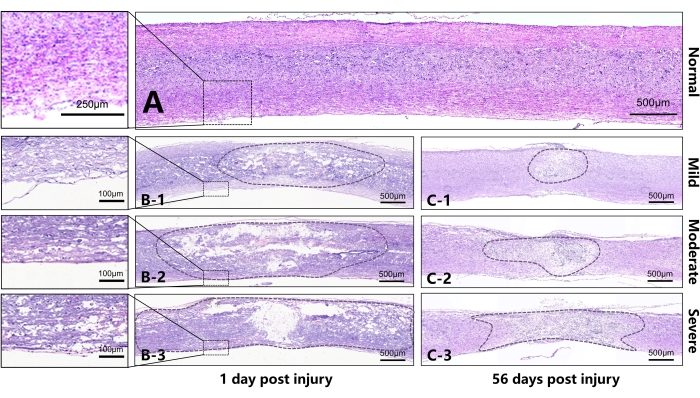
図5:マウスの脊髄損傷後1日目および56日目の代表的な切片(矢状切片)。 (A)マウスの正常な胸部脊髄。(B)B1-B3は、軽度、中等度、重症群の受傷後1日目の脊髄をそれぞれ表す。損傷が増加するにつれて、病変の中心でより広い領域が破壊または液状化したことがわかります。腹側脊髄の白質の連続性は、損傷強度が異なるために異なっていました。B1は、腹側脊髄の白質がわずかな浮腫を伴うより良い連続性を有することを示す。B2は腹側脊髄の白質の連続性が悪く、浮腫がひどい。B3 SCIの中心にある組織はほとんどすべての連続性を失っており、損傷の中心の外側の領域に広範囲の浮腫があります。(C)C1-C3は、軽度、中等度、および重度のグループの損傷後56日目の脊髄をそれぞれ表します。異なるグループ間の損傷センターに異なる程度の瘢痕拘縮が現れ、損傷領域の直径に有意差がありました。スケールバー= 500μm。 この図の拡大版を表示するには、ここをクリックしてください。
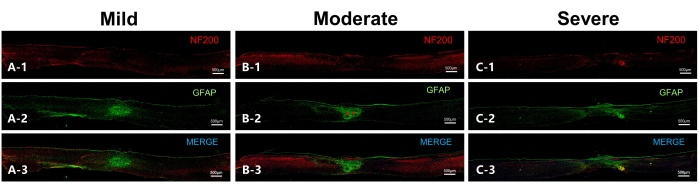
図6:マウスにおける脊髄損傷後56日目の代表的な切片(矢状切片)。 (a)軽度の群の代表部。NF200はニューロフィラメントを示し、GFAPは星状細胞を示します。重なり合う星状細胞が病変震源地で観察され、脊髄の腹側のニューロフィラメントは良好な連続性にあります。(B)穏健派の代表部。重なり合う星状細胞に加えて、2つの瘢痕中心(赤いアスタリスクで示される)が観察されますが、腹側のニューロフィラメントには連続性があります。(C)重症群の代表的なセクションであり、病変範囲が大きく、瘢痕形成星状細胞が巨大です。明らかな瘢痕中心は観察されず、ニューロフィラメントは連続性が悪い。スケールバー= 500 μm。 この図の拡大版を表示するには、ここをクリックしてください。
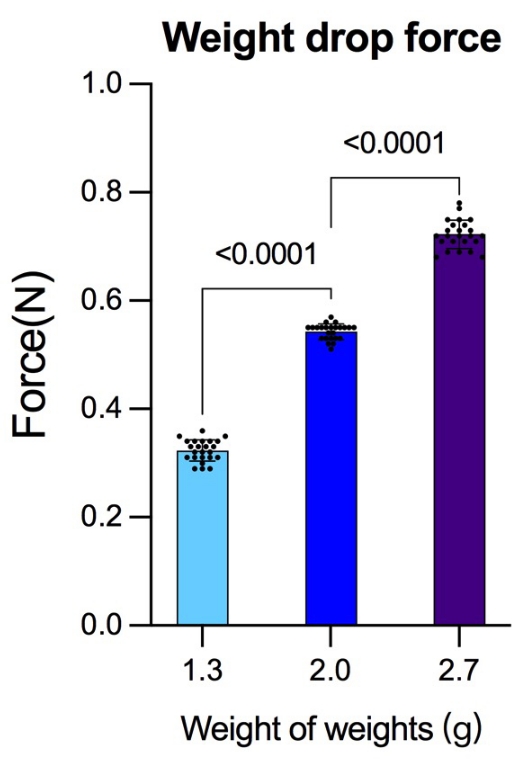
図7:同じ高さから異なる重量で生成された力。 実験の前に、同じ高さから放出された異なる質量の重りによって生成された力をピーク圧力検出装置を使用して検出した。各グループが24の検出を完了した後、打撃力の基準として、より信頼性の高い重力データが取得されました。データは統計ソフトウェアSPSS19.0を使用して分析されました。データは、各群において平均±SDとして表され、n = 24である。より多くのグループ間の比較は、差を検定するために使用された一元配置分散分析(ANOVA)に基づいていました。 p < 0.05は統計的に有意であると考えられた。 この図の拡大版を表示するには、ここをクリックしてください。
| 28デシミリ | |||
| 群 | グリメンタル(%) | WMR (%) | DR (%) |
| 正常 | 35.44 | 64.57 | 0 |
| 軽度 | 11.59 | 64.88 | 23.53 |
| 適度 | 0 | 41.14 | 58.86 |
| 重度 | 0 | 0 | 100 |
表1:受傷後28日目の白質、灰白質、および損傷の割合。 略語:dpi =損傷後の日数、DA =損傷領域。GMR =灰白質率;WMR = 白質率;DR = 損傷率。
| 群 | 1dpi DA (μm2) | 56dpi DA (μm2) |
| 正常 | 0 | 0 |
| 軽度 | 2391250 | 666091 |
| 適度 | 4383381 | 1263191 |
| 重度 | 5118833 | 1943962 |
表2:受傷後1日目と56日目の矢状切片の病変の比較。
ディスカッション
標準化された手順により、特に小動物の in vivo 実験において安定したデータが得られ、動物間の個人差による結果の偏差を最小限に抑えることができます。上記の条件と便利なアプリケーション機器に基づいて、標準化された、低侵襲で、正確で、再現性のあるSCIモデルを確立することができます。
その実用性と利便性のために、以前は、重量低下インパクターは主に使用されていました3。本研究で紹介したインパクターは、アレンのモデル12と同じ原理を共有しています。幸いなことに、最新の機械加工技術の正確な製造上の利点により、研究チームは、操作が簡単で、非常に安定しており、不正確になることはめったにないという利点を備えた減量インパクターを設計しました。ピーク圧力検出装置を使用して、さまざまな重量の重力を測定しました。Infinite Horizonsインパクターに関する先行研究6,10は、意図した力から逸脱する±5 Kdynの範囲の力が30 Kdyn、50 Kdyn、および70 Kdynグループで受け入れられることを報告しており、これはグループ分割と挫傷度の選択の観点から本研究の参考になります。本研究では、異なるグループの可能な力を事前に測定し、より正確なデータを得ることができました。
動物モデル実験において、デバイスよりも重要なのは、マウスの解剖学の理解と利用です。解剖学をうまく利用することで、手順を低侵襲にすることができます。低侵襲手術は、実験動物の機能状態の安定性およびその後のマウス回復の一貫性に直接影響する。以前の研究では、SCIモデルの低侵襲樹立により、脊椎構造の安定性が高まり、ラットの回復中の脊椎不安定性によって引き起こされる追加の損傷が回避されることが示されています1。低侵襲手術の前提は、自然な解剖学的構造の合理的な使用です。したがって、脊髄セグメントの迅速かつ正確な位置特定は、マウスの解剖学的構造に従って行われるべきである。報告されているように、イメージング法は、椎骨13を見つけるために使用された。高精度ですが、実際の実験操作プロセスでは、位置を特定するためのイメージング方法には、操作が不便、長い操作時間、複雑な機器の取得、および高い機器精度の要件という欠点があります。McDonoughらは、肩甲骨14の下角を通してT7の位置を特定することを説明したが、マウスは横筋の衰弱で行動するため、言及された下角は後角であると想定されている。さらに、肩甲骨下部の先端を使用してT7を見つけることは、人体解剖学15の特定の位置の特定の位置を特定する方法であり、マウスには適していません。最後に、Micro-CTデータは、マウスが自然な体位にあるか特定の体位にあるかに関係なく、肩甲骨の後角がT7と同じ高さではないという仮説も検証しました。McDonoughら14 はまた、マウスがアーチ状になっているときに背中の最高点を特定し、最高点をT12と定義することに言及した。これに対し、本研究では、T9はT12-T13の棘間腔の助けを借りて位置しており、マウスの姿勢とは関係がなく、影響を受けません。さらに、この方法では、ターゲット椎骨を簡単に見つけて操作することができます。顕微鏡下で13番目の肋骨を調べ、肋骨角の領域にそっと触れ、棘突起に向かって線を引き、次にT12-T13の棘突起間の空間を頭に向かって調べる必要があります。研究チームは、T12-T13棘間腔を使用して、12匹のマウスのT9を見つけました。最後に、12匹の雌C57BL/6Jマウスが、T9位置と椎弓切除術の後にマイクロCTスキャンを受けました。マイクロCTスキャンの結果、12匹すべてのマウスで除去された椎弓板はT9であることが示されました。マイクロCTの結果、すべてのT9が正確に位置特定され、肩甲骨位置特定法よりも精度が有意に高いことが示されました。この方法は、迅速かつ正確な位置特定方法を提供し、傷害モデルの一貫性に貢献します。
本プロトコルの最小侵襲性は、主に3つの側面で顕著である。まず、位置を特定した後、T9レベルの傍脊髄筋は、T8またはT10レベルの筋肉に損傷を与えることなく、マイクロリトラクターによってのみ引っ込められます。その上、マイクロリトラクターによる椎弓板の露出は視野を妨げません。第二に、海綿骨からの血液流出を引き起こす可能性のある椎弓切除術による失血は、手術手順では非常に少なく、2 mm x 2 mm x 3 mmの三角形の綿を染色する体積にほとんど過ぎません。第三に、椎弓切除術は必要な領域に限定して行われ、椎弓板の外側部分の連続性を維持し、椎骨の不安定性を大幅に減弱させた。以前のプロトコル16、17と比較して、現在のプロトコルは多くの不必要な損傷を低減する。
異なる程度のSCIを評価するために、組織病理学におけるすべてのグループ間の結果を、以前の研究がすでに示しているものと比較しました9,11,18。これらの結果は、さまざまな程度の損傷とさまざまな期間の変化の観察研究を完了するのに十分です。HEおよび免疫蛍光は、SCIの重症度の増加とともに、脊髄組織により多くの異常な形態が現れ、損傷の程度の増加は脊髄の構造的障害の程度の増加にもつながることを示した。組織形態観察の観点から、本研究における各実験群における組織形態変化の程度と規則性は、先行研究と非常に一致しています。
現在の組織学的検査結果によれば、異なる程度の外傷性SCI後の様々な指標の明確な変化が示されており、これはこの研究で確立されたモデルの信頼性をさらに確認する。
この手法は正確かつ効果的ですが、メソッドには潜在的な制限が存在する可能性があります。椎弓切除術に関しては、オペレーターは、脊髄が誤って損傷するのを防ぐために、顕微鏡下での操作に熟練している必要があります。また、プラットフォーム全体のセットアップは機械構造に基づいているため、自動化された機器と比較してオペレーターの需要が高くなります。実際、前述のすべての問題は、操作のトレーニングを繰り返すことで改善できます。
低侵襲で標準化されたモデリングは、結果をより均一で安定した再現性のあるものにし、さまざまな治療計画の有効性を正確に評価し、外傷性SCIの研究計画を最適化するのに有益であることがわかります。
開示事項
Shiqing Feng教授は、脊髄損傷同軸プラットフォームの所有権を持っています。
謝辞
この研究は、中国国家自然科学国家重点プログラム(81930070)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 4% fixative solution | Solarbio | P1110 | 4% |
| Anti-Neurofilament heavy polypeptide antibody | abcam | ab8135 | Dilution ratio (1: 2000) |
| Eosin Staining Solution (water soluble) | biosharp | BL727B | |
| Ethanol | Fuyu Reagent | 64-17-5 | |
| Fluorescent microscope | KEYENCE | BZ-X800 | |
| Frozen Slicer | leica | CM3050 S | |
| GFAP (GA5) Mouse mAb | Cell Signaling TECHNOLOGY | #3670 | Dilution ratio (1: 600) |
| Goat anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | ThermoFisher SCIENTIFIC | A32723TR | Dilution ratio (1: 1000) |
| Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 594 | ThermoFisher SCIENTIFIC | A32740 | Dilution ratio (1: 1000) |
| Hematoxylin Staining Solution | biosharp | BL702A | |
| Mice | Jinan Pengyue Experimental AnimalCompany | C57BL/6J | |
| Microsurgery apparatus | Shandong ULT Biotechnology Co., Ltd | All the surgey instruments are custom-made | Ophthalmic scissors, micro mosquito forceps, microsurgery forceps, micro scissors |
| Normal sheep serum for blocking (working solution) | Zhong Shan Jin Qiao | ZLI-9022 | working solution |
| O.C.T. Compound | SAKURA | 4583 | |
| PBS (phosphate buffered solution) | Solarbio | P1020 | pH 7.2-7.4 |
| RWD Laboratory inhalation anesthetic station | RWD Life Science Co., Ltd | R550 | |
| Small animal in vivo microCT imaging system | PerkinElmer | Quantum GX2 | |
| Spinal cord injury coaxial platform | Shandong ULT Biotechnology Co., Ltd | Custom-made(Feng's standard) | (https://shop43957633.m.youzan.com/wscgoods/detail/367x5ovgn69q18g?banner_id=f.81386274~goods.7~1~ b0yRFKOq&alg_id=0&slg=tagGood List-default%2COpBottom%2Cuuid %2CabTraceId&components_style_ layout=1&reft=1659409105184&sp m=g.930111970_f.81386274&alias =367x5ovgn69q18g&from_uuid=136 2cc46-ffe0-6886-2c65-01903dbacbb a&sf=qq_sm&is_share=1&shopAuto Enter=1&share_cmpt=native_ wechat&is_silence_auth=1) |
| Surgery microscope | Zumax Medical Co., Ltd. | zumax, OMS2355 | |
| TBST (Tris Buffered Saline+Tween) | Solarbio | T1082 | Dilution ratio (1: 19) |
| Xylene | Fuyu Reagent | 1330-20-7 |
参考文献
- Duan, H., et al. A novel, minimally invasive technique to establish the animal model of spinal cord injury. Annals of Translational Medicine. 9 (10), 881 (2021).
- Piao, M. S., Lee, J. -. K., Jang, J. -. W., Kim, S. -. H., Kim, H. -. S. A mouse model of photochemically induced spinal cord injury. Journal of Korean Neurosurgical Society. 46 (5), 479-483 (2009).
- Sharif-Alhoseini, M., et al. Animal models of spinal cord injury: A systematic review. Spinal Cord. 55 (8), 714-721 (2017).
- Zhang, N., Fang, M., Chen, H., Gou, F., Ding, M. Evaluation of spinal cord injury animal models. Neural Regeneration Research. 9 (22), 2008-2012 (2014).
- Borges, P. A., et al. Standardization of a spinal cord lesion model and neurologic evaluation using mice. Clinics. 73, 293 (2018).
- Ghasemlou, N., Kerr, B. J., David, S. Tissue displacement and impact force are important contributors to outcome after spinal cord contusion injury. Experimental Neurology. 196 (1), 9-17 (2005).
- Siddall, P., Xu, C. L., Cousins, M. Allodynia following traumatic spinal cord injury in the rat. Neuroreport. 6 (9), 1241-1244 (1995).
- Ford, J. C., et al. MRI characterization of diffusion coefficients in a rat spinal cord injury model. Magnetic Resonance in Medicine. 31 (5), 488-494 (1994).
- Basso, D. M., Beattie, M. S., Bresnahan, J. C. Graded histological and locomotor outcomes after spinal cord contusion using the NYU weight-drop device versus transection. Experimental Neurology. 139 (2), 244-256 (1996).
- Nishi, R. A., et al. Behavioral, histological, and ex vivo magnetic resonance imaging assessment of graded contusion spinal cord injury in mice. Journal of Neurotrauma. 24 (4), 674-689 (2007).
- Ma, M., Basso, D. M., Walters, P., Stokes, B. T., Jakeman, L. B. Behavioral and histological outcomes following graded spinal cord contusion injury in the C57Bl/6 mouse. Experimental Neurology. 169 (2), 239-254 (2001).
- Allen, A. R. Surgery of experimental lesion of spinal cord equivalent to crush injury of fracture dislocation of spinal column. The Journal of the American Medical Association. (11), 878-880 (1911).
- Kuhn, P. L., Wrathall, J. R. A mouse model of graded contusive spinal cord injury. Journal of Neurotrauma. 15 (2), 125-140 (1998).
- McDonough, A., Monterrubio, A., Ariza, J., Martinez-Cerdeno, V. Calibrated forceps model of spinal cord compression injury. Journal of Visualized Experiments. (98), e52318 (2015).
- Ernst, M. J., Rast, F. M., Bauer, C. M., Marcar, V. L., Kool, J. Determination of thoracic and lumbar spinal processes by their percentage position between C7 and the PSIS level. BMC Research Notes. 6, 58 (2013).
- Wu, X., et al. A tissue displacement-based contusive spinal cord injury model in mice. Journal of Visualized Experiments. (124), e54988 (2017).
- Bhalala, O. G., Pan, L., North, H., McGuire, T., Kessler, J. A. Generation of mouse spinal cord injury. Bio-protocol. 3 (17), 886 (2013).
- Shinozaki, M., et al. Novel concept of motor functional analysis for spinal cord injury in adult mice. Journal of Biomedicine and Biotechnology. 2011, 157458 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved