このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
コラーゲンの表面固定化およびコラーゲン結合アッセイのための最適化された方法
* これらの著者は同等に貢献しました
要約
この研究では、I型およびIII型コラーゲンをマイクロプレート上に再現性よく固定化および定量するための最適化されたプロトコルと、その後、時間分解蛍光法を使用してコラーゲン-化合物相互作用を研究するための改良された in vitro 結合アッセイプロトコルを示します。その後のステップバイステップのデータ分析とデータ解釈が提供されます。
要約
線維症は、損傷や損傷に対する修復反応として、さまざまな組織で発生します。しかし、線維化が過剰になると、組織の瘢痕化や臓器不全を引き起こす可能性があり、これは高い罹患率と死亡率に関連しています。コラーゲンは線維症の主要な推進力であり、I型およびIII型コラーゲンは多くの線維性疾患に関与する主要なタイプです。他のタンパク質(エラスチン、アルブミン、フィブロネクチンなど)を固定化するために使用される従来のプロトコルとは異なり、安定したコーティングを生成するためにさまざまな種類のコラーゲンを再現性よく固定化するための包括的なプロトコルは容易には利用できません。コラーゲンの固定化は、コラーゲンの種類、pH、温度、使用するマイクロプレートの種類など、複数の実験条件が固定化の効率に影響を与える可能性があるため、驚くほど困難です。ここでは、I型およびIII型コラーゲンを再現性よく固定化および定量し、安定で再現性のあるゲル/フィルムを得るための詳細なプロトコルを提供します。さらに、この研究では、コラーゲンと候補コラーゲン結合化合物(例えば、ユーロピウム[Eu(III)]などの金属キレートに結合したペプチド)との間の相互作用を調査するために、 in vitro 時間分解蛍光結合研究を実施、分析、および解釈する方法を示します。このようなアプローチは、標的イメージングプローブを開発するための分子イメージングの分野、医薬品開発、細胞毒性研究、細胞増殖研究、イムノアッセイなど、さまざまな生物医学的アプリケーションに広く適用できます。
概要
組織損傷後の自然な創傷治癒過程の一部としての線維性結合組織の蓄積は、線維症として知られています。しかし、線維性組織の沈着が終わらず、組織修復に必要な量を超えて続くと、線維化は過剰になります1,2。過度の線維症は臓器の生理機能と機能を損ない、臓器の損傷や潜在的に臓器不全につながる可能性があります3,4,5。線維症の2つの主要な要因は、細胞外マトリックス(ECM)タンパク質であるI型コラーゲンとIII型6です。コラーゲンは、さまざまな臓器に見られる構造タンパク質で、人体の総タンパク質含有量の約3分の1を占めています1。ヒトゲノムシークエンスによって同定されたコラーゲンには28種類あり、その中でも最も多く存在するのが原線維性コラーゲン7です。主要な線維性コラーゲンはI型コラーゲンであり、ECMに引張強度と変形に対する耐性を提供します8。III型コラーゲンは、弾力性を提供し、I型コラーゲンと共局在する構造成分です。胚発生時に発現し、成体の皮膚、筋肉、血管に少量自然に見られます9。
In vivoでのコラーゲン合成は、mRNAが核内で転写され、その後細胞質に移動して翻訳される細胞内プロセスから始まります。翻訳後、形成された鎖は小胞体で翻訳後修飾を受け、そこでプロコラーゲン(コラーゲンの前駆体)が形成されます。その後、プロコラーゲンは、細胞外空間に排泄される前に、最終修飾のためにゴルジ装置に移動する10。タンパク質分解による切断により、プロコラーゲンはトロポコラーゲンに変換されます。次いで、これは、酵素リシルオキシダーゼ(LOX)によって触媒される酵素媒介性架橋経路を介して、またはメイラード反応11が関与する非酵素媒介性架橋経路を介して架橋される。コラーゲンを固定化するためのin vitroプロトコルは、主にコラーゲンの自己組織化能力に依存しています。コラーゲンは、その溶解性に基づいて組織から抽出されますが、これは個々のコラーゲン線維の架橋の程度に大きく依存します7。線維性コラーゲンは酢酸に溶解しており、pHと温度を調整すると線維性が再形成されることがある12。In vitroでは、コラーゲンの線維形成は2段階のプロセスと見なすことができます7。最初の段階は核形成期で、コラーゲン繊維が二量体と三量体線維を形成した後、再配列されて三重らせん構造を形成します。第2段階は成長期であり、そこでは線維が横方向に成長し始め、一般に濁度7の変化によって観察される特徴的なDバンド形成をもたらす。原子間力顕微鏡(AFM)の研究により、I型コラーゲンとIII型コラーゲンは異なる特性を持っていることも明らかになりました(表1)13。
コラーゲンと他の化合物との結合相互作用を研究するためには、コラーゲンをマイクロプレートのウェルに再現性よく固定化する必要があります。可溶性コラーゲンを固定化するためのさまざまなプロトコルがあります14,15,16。コラーゲンでプレコートされた市販のマイクロプレートは、通常、細胞培養に使用されます。しかし、プレコートされたマイクロプレートは、ウェル上にコーティングされたコラーゲンの量が非常に薄い層であるため、in vitro結合アッセイには適していません。コラーゲンをプレートウェルに固定する際には、いくつかの課題があります。I型やIII型のコラーゲンなど、種類によって化学的性質が異なるため、マイクロプレートの材質によってより安定して効果的に固定化されるため、適切なタイプのマイクロプレートを選択することが重要な課題の1つです。もう一つの課題は、固定化プロトコルの実験条件であり、線維化のプロセスは、温度、pH、コラーゲンのストック濃度、および緩衝液のイオン濃度など、複数の要因に依存する。
コラーゲン(標的)と他の化合物(すなわち、標的ペプチド)との間の相互作用を研究するためには、解離定数Kdを測定することにより、標的に対する化合物の特異性と選択性を調査する堅牢なスクリーニングアッセイを開発する必要があります。タンパク質(コラーゲン)とリガンドとの間の二分子複合体の形成の平衡の位置は、結合親和性に比例する大きさの会合定数Kaで表されます。しかし、最も一般的には、生化学者は、Kd = 1/Ka(KDおよびKaの逆数)として定義される二分子複合体の平衡解離定数KDに関して親和性関係を表現する。KD値が低いほど、タンパク質とリガンドとの間の結合強度が強くなります。Kdを使用して、同じタンパク質に対する異なるリガンドの結合親和性を比較する(またはその逆)利点は、二分子複合体のKdの単位がmol/L(つまり、濃度単位)であるという事実に関連しています。ほとんどの実験条件下では、KD値は、平衡17,18でターゲット上の利用可能な結合部位の50%の飽和につながるリガンド濃度に対応する。解離定数は、通常、リガンド濃度の関数として、占有されている結合部位と利用可能な総結合部位との間の比率として定義される受容体のフラクショナル占有率(FO)を分析することによって抽出されます。これは、結合したリガンドの量を区別して測定できる分析アッセイが利用可能であれば可能です。
In vitro リガンド結合アッセイは、光測光法、放射性リガンド法、誘導結合プラズマ質量分析法(ICP-MS)、表面プラズモン共鳴法(SPR)など、さまざまなバイオアナリシス法を用いて実施できます。測光法の中でも、蛍光発光に基づく法典では、通常、感度を高め、アッセイの検出限界を改善するために、リガンドまたはタンパク質を蛍光色素で標識する必要があります。Eu(III)などの特定のランタニド(III)イオンのキレートは、ストークスシフトが大きく、発光帯域が狭く(良好なS/N比を提供)、光退色が限定的、発光寿命が長いため、蛍光色素として非常に魅力的です。重要なことに、後者の特性は、Eu(III)蛍光色素からの時間分解蛍光(TRF)の使用を可能にし、バックグラウンドの自家蛍光19を廃止する。Eu(III)ベースのTRFアッセイの解離増強ランタノイノイノアッセイ(DELFIA)バージョンでは、非発光性のEu(III)-キレートで標識されたリガンドをインキュベートし、受容体をマイクロプレートに固定化します。標識されたリガンド/受容体複合体を非結合リガンドから分離し、酸性pHでEu(III)複合体を解離することによりEu(III)蛍光を活性化し、続いて蛍光増強キレート剤と再錯体化して、ミセル包埋の高蛍光Eu(III)複合体を形成する20。
脱錯ステップは、迅速な脱錯速度を示すジエチレントリアミンペンタアセテート(DTPA)などのキレート剤を使用して合理的に達成できます。しかし、Eu(III)とDOTA(1,4,7,10-テトラアザシクロドデカン1,4,7,10-テトラ酢酸)やそのモノアミド誘導体(DO3AAm)などの特定の大環状キレート剤との錯体は、高い熱力学的安定性と非常に高い速度論的不活性を示します。この場合、Eu(III)ベースのTRF21の十分で再現性のある活性化を達成するために、脱複合体化ステップを正確に最適化する必要があります。ランタニド(Ln(III))-DOTAおよびLn(III)-DO3AAm錯体は、磁気共鳴画像法(MRI)技術によるin vivo分子イメージングの造影剤として最も一般的に使用されるものであることは注目に値する22。したがって、Ln(III)ベースのTRFアッセイは、MRI分子プローブと目的の生物学的標的との結合親和性をin vitroで研究するための最適なツールです。現在、I型およびIII型コラーゲンを固定化するための包括的で再現性のあるプロトコル、およびin vitro結合Eu(III)TRF実験を実施するための再現性のあるパイプラインが不足しています。これらの制限を克服するために、in vitro結合アッセイに必要な十分な濃度のコラーゲンを使用して、I型およびIII型コラーゲンを自己組織化および固定化し、それぞれ安定したゲルおよびフィルムを生成する再現性のある方法が開発されました。非常に不活性なEu(III)-DO3Aamベースの複合体のEu(III)TRFに最適化されたプロトコルが提示されます。最後に、固定化されたI型およびIII型コラーゲンに対するEu(III)標識リガンドのKdを測定するための最適化されたin vitroマイクロプレートEu(III)TRFアッセイが実証されています(図1)。
プロトコル
注意: この作業に使用されたすべての製品情報は、 資料の表に記載されています。
1.コラーゲン固定化
注:結合アッセイ中に使用されるマイクロプレートの各ウェルには、交差蛍光を避けるために隣接するウェルが空いていることを確認してください。プロトコルのこの部分は、コラーゲンが温度とpHレベルが上昇すると自己組織化するため、氷上で行ってください。この手順は、組織培養フード内で無菌条件下で行ってください。これは、マイクロプレートがその後、組織培養(TC)インキュベーターでインキュベートされるためです。
- 96ウェルマイクロプレート上のI型コラーゲンの固定化(図2)
1日目- 氷を入れたシリコントレイを用意します。I型コラーゲン、冷たい10倍リン酸緩衝生理食塩水(PBS)、およびマイクロプレートが入ったバイアルを氷の上に置き、すべてに70%エタノールをスプレーします。TCフードの下に材料を置きます。
- 等量のI型コラーゲンと10x PBS(pH 7.4)を使用してコラーゲンを中和します。
- 溶液を数回反転させ、気泡が形成されないようにします。
- 中和したコラーゲン100μLをマイクロプレートの他のすべてのウェルおよび他のすべての列に加え、37°Cで18〜20時間インキュベートしてコラーゲンを蒸発させて乾燥させます。
2日目 - マイクロプレートを1x PBS(pH 7.4)100 μLで2回洗浄し、未結合のコラーゲンを除去します。
- マイクロプレートを37°Cのインキュベーターに移し、さらに2時間乾燥させてから、さらなる結合実験に使用します。
- III型コラーゲンの96ウェルマイクロプレートへの固定化(図3)
1日目- 氷を入れたシリコントレイを用意します。III型コラーゲン、冷たくした10x PBS、マイクロプレートが入ったバイアルを氷の上に置き、すべてに70%エタノールをスプレーします。TCフードの下に材料を置きます。
- 等量のIII型コラーゲンと10x PBS(pH 7.4)を使用してコラーゲンを中和します。
- 中和したコラーゲン70 μLをマイクロプレートの他のすべてのウェルおよび1列ごとに加え、マイクロプレートを組織培養フードの下に置いて37°Cで2時間インキュベートし、コラーゲンを蒸発させて乾燥させます。
2日目 - マイクロプレートを1x PBS(pH 7.4)70 μLで2回洗浄し、未結合のコラーゲンを除去します。
- マイクロプレートをインキュベーターに37°Cで1時間移し、次にベンチに移し、1時間乾燥させてから、さらなる結合実験に使用します。
2. 固定化コラーゲンゲル/フィルムの安定性評価
- PBSで1時間インキュベーション
注:結合実験中に、固定化コラーゲンを目的の化合物とインキュベートします。得られたコラーゲンゲルまたはフィルムの安定性を調査することが重要です。これを行うには、3つの条件の安定性を測定します: 洗浄なし =インキュベーション直後に固定化されたコラーゲンを測定します。 洗浄 =プレートを100μLのPBSで2回洗浄した後、固定化されたコラーゲンを測定します。1 時間PBS模倣&洗浄 =PBSで1時間インキュベートした後、PBSで2回洗浄した後、固定化コラーゲンを測定します。以下では、PBSのインキュベーション方法について説明する。- コラーゲンでコーティングした各ウェルに70 μLのPBS(1x)を加え、マイクロプレートを室温で1時間インキュベートします。
- ピペットを使用して各ウェルから余分な液体を吸引し、PBS(1x)で2回洗浄してから、以下に説明するタンパク質定量アッセイを実施します。
- ビシンコニン酸アッセイ(BCA)を用いた固定化コラーゲン量の定量
注:Pierce BCA Protein Assay Kit(材料表)は、製造元の指示に従って使用してください。このアッセイのコラーゲン標準試料をそれぞれ作成してください。コラーゲンIの濃度範囲は0〜3,000μg/mL、IIIのコラーゲン濃度は0〜750μg/mLです。合計で、コラーゲンごとに11の標準を作ります。- 必要な作業試薬(WR)の総量を、製造元の指示に従って調製します。
- 各コラーゲン標準試料を25 μLをマイクロプレートウェルに(二重に)加えます。これらの解は、標準曲線を描画するために使用されます。
- 標準物質を含むウェルと、濃度不明のコラーゲンでコーティングされたウェルのそれぞれに、200 μLの作業試薬溶液を添加します。
- マイクロプレートをプレートシェーカーに30秒間置きます。マイクロプレートを覆い、37°Cで30分間インキュベートします。
- マイクロプレートを取り外し、室温で冷まします。プレートリーダーを使用して560nmでの吸光度を測定します。
- 11種類の標準溶液の濃度(μg/mL)に対してA560 (AU)をプロットして検量線をプロットし、検量線を使用してコラーゲンの量を計算します。
3. Europium(III) TRFリガンド結合アッセイ(図1)
注:使用される化合物は、Eu(III)-DO3AAm-CBPと呼ばれる単一のEu(III)-DO3AAm複合体で標識された候補コラーゲン結合ペプチド(CBP)です(図4)。
- コラーゲンコーティングプレートとEu(III)-DO3AAm-CBP化合物とのインキュベーション
- 0.1-15 μM(0.1 μM、0.5 μM、1 μM、3 μM、5 μM、7 μM、10 μM、および15 μM)の範囲の濃度のEu(III)-DO3AAm-CBP化合物の溶液を1x PBSで調製します。
- 各濃度の化合物75μLをコラーゲンコーティングウェル(プレートA)に加えます。実験を3回に分けて行い、コラーゲンに結合する化合物の量を計算します。
- 2 枚目のコーティングされていないプレート (プレート B) を使用し、各化合物を 75 μL を空のウェルに加えて、化合物のプレートへの非特異的結合を計算します。濃度ごとにトリプリケートを使用します。
- マイクロプレートを室温で1時間インキュベートします。
- ピペットを使用して、各ウェルから余分な溶液を吸引して廃棄し、ウェルを1x PBSで2回洗浄して、余分な未結合化合物を取り除きます。このステップは、コラーゲンコーティングされたマイクロプレートとコーティングされていないマイクロプレートの両方を使用して実行します。
- 3枚目のコーティングされていないプレート(プレートC)に、同じ範囲のEu(III)-DO3AAm-CBP濃度の10μLを(重複して)加えます。溶液中のEu(III)-DO3AAm-CBPからの蛍光測定値を使用して、検量線を作成します。
注意: このプレートから溶液を洗ったり吸引したりしないでください。
- ユーロピウム(III)および時間分解蛍光(TRF)測定値の酸抽出
注:酸性溶液(AS)および緩衝液(BS)の体積の調製および校正に関する補足情報を参照してください。この研究では、最適なpHを再現性よく達成するために必要なASとBSの容量は、それぞれ54 μLと46 μLでした。プレートA、プレートB、プレートCで次の操作を行います。- 各ウェルに54 μLの酸性溶液(AS)を加え、プレートをインキュベーターに37°Cで90分間置き、蒸発を防ぐためにマイクロプレートをホイルで覆います。再現性のある脱複合体化を達成するためには、温度とインキュベーション時間を慎重に制御する必要があります。
- 各ウェルに46 μLの緩衝液(BS)を加え、プレートを30秒間静かに振とうします。
- 100 μLのエンハンスメント溶液(ES)を加え、プレートを30秒間振とうします。
- 30分待ってから、TRFプレートリーダーを使用してプレートを読み取ります。 表 2 にリストされているパラメータを使用します。
4. データ分析
- ウェルに固定化されたコラーゲンの濃度の定量化
- A560 (AU)の検量線と 11 種類の標準溶液の濃度(μg/mL)の式を求めます。
- コラーゲン標準物質を含むウェルから取得した吸光度測定値を使用してください。
- 重複ウェルの平均値を表にし、既知のタンパク質(コラーゲン)濃度(μg/mL)に対する平均吸光度をプロットして、標準曲線の式を求めます。
- 吸光度の値を使用して、固定化コラーゲンの質量(μg)と濃度(M)を計算します。
- 固定化コラーゲンを含む3つのウェル全体の平均吸光度値を計算し、標準偏差を記録します。
- コラーゲン標準曲線から得られた標準曲線方程式(ステップ2.2.6)を使用して、コラーゲン被覆ウェルから測定された吸光度を協調に変換します。これから、実験ウェル内で固定化されたコラーゲンの濃度をμg/mLで計算します。
- ステップ 4.1.2.2 で計算した濃度 (μg/mL) を最初にグラム/リットルに変換し、次にコラーゲンの分子量に基づいてモル (M) に変換します。
- 最後に、濃度をウェルに添加したコラーゲンの量(I型コラーゲンは100μL、III型コラーゲンは70μL)で割って、各ウェルに固定化されたコラーゲンの質量を計算します。
- A560 (AU)の検量線と 11 種類の標準溶液の濃度(μg/mL)の式を求めます。
- 解離定数(Kd) (図 4)
- 蛍光測定値を抽出します。
- プレートリーダーからの蛍光測定値をスプレッドシートにエクスポートします。
注:結合アッセイでは、プレートのプラスチック表面への化合物の潜在的な非特異的結合を考慮することが重要です。 - コーティングされたウェルからの特異的結合測定値(プレートA)、コーティングされていないウェルからの非特異的結合(プレートB)、およびコーティングされていないウェル内の溶液中の総Eu(III)-DO3AAm-CBP(プレートC)の3つの異なるプレートの各化合物濃度から、各化合物濃度から三重測定の平均値を計算します。
- コーティングされたウェル(プレートA)の蛍光測定値からコーティングされていないウェル(プレートB)の蛍光測定値を差し引くことにより、結合化合物の蛍光値を決定します。
式1:束縛された蛍光17の決定:
結合蛍光 = 特異的 (コーティングされたウェル) - 非特異的 (コーティングされていないウェル) - 溶液中のEu(III)標識化合物(プレートC)からの読み取り値を使用して、検量線を生成します。Eu(III)標識化合物の濃度に対して得られた蛍光測定値をプロットします。線形回帰近似を実行します。
- プレートリーダーからの蛍光測定値をスプレッドシートにエクスポートします。
- 蛍光測定値を濃度に変換します。
- 結合した蛍光の読み取り値(ステップ4.2.3)を、溶液中の化合物濃度を使用して生成されたデータから標準蛍光曲線を使用して濃度に変換します(ステップ4.2.1.4)。
注:異なる濃度で固定化する異なる標的タンパク質に対する1つの化合物の結合特性を比較する場合、標的に結合した化合物(すなわち、結合化合物/タンパク質)の量を計算する際には、後者を考慮する必要があります。 - 結合した化合物の濃度を、ウェルに固定化されたタンパク質の濃度で割ります。
注:この計算には、ウェルをPBSと1時間インキュベートした後に計算された固定化コラーゲンの濃度を使用します(いわゆるPBS模倣実験;上記のセクション2.1)。これは、インキュベーションステップと洗浄ステップ中にコラーゲンが損失する可能性があり、最終的な蛍光シグナルに寄与しないことを説明するためです。 - x軸(μM)に化合物の濃度、y軸に結合した化合物/タンパク質の濃度を持つ散布図を使用してデータをプロットします。
- 結合した蛍光の読み取り値(ステップ4.2.3)を、溶液中の化合物濃度を使用して生成されたデータから標準蛍光曲線を使用して濃度に変換します(ステップ4.2.1.4)。
- KD値を取得します。
- ステップ4.2.2.3で取得したデータを、2つの可能な結合速度論モデル(1サイト結合と丘陵斜面との1サイト結合)を使用して適合させます。各モデルの方程式を 図 6 に示します。
- データの適合時に、最大のR二乗値を持つ曖昧さのない適合を提供するモデルを選択します。
- プレートあたりの濃度あたりの蛍光測定値の各セットの外れ値を除外します。
- 最終的な Kd 値を計算し、データを独立した実験の平均±標準偏差として表示します。
注:堅牢な結果を得るには、各プレート内で3回測定を行い、異なるマイクロプレートで少なくとも3つの独立した実験を行います。
- フラクショナル占有率 (FO) を計算します。
注:式2から、ターゲットの濃度は不明であるため、式3から代数とKdを使用すると、式4の形で分数占有率を計算するための実行可能な方程式が生じます。
式2:フラクショナル占有の定義17:
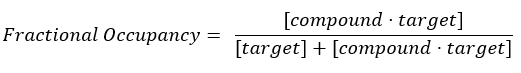
式3:解離定数KDは、化合物が平衡17でターゲットの50%を占める濃度です。
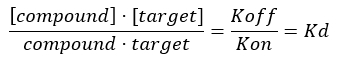
式 4: FO 式17 を計算するために方程式を並べ替えました。
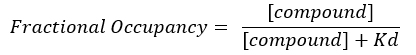
- 個々のプレートごとに得られた独立したKD 値を使用してFOを計算します。化合物の濃度に対するFOの結果、平均、および標準偏差をプロットします。
- 0 から 1 の範囲の値で FO を報告するか、0% から 100% の範囲の値でパーセンテージで報告します。
- 蛍光測定値を抽出します。
結果
ゲル/フィルムに固定化されたI型およびIII型コラーゲンの安定性と濃度の評価
ウェルごとに固定化されたコラーゲン濃度の定量化は、3つの異なる条件を使用して行われました:a)タンパク質を固定化した後(洗浄なし)にPBSで洗浄せずにウェルで。b)固定化後に洗浄ステップ(PBSで2回)を備えたウェルで、コーティングされていないタンパク質を除去します?...
ディスカッション
この研究は、I型およびIII型コラーゲンを固定化するための再現性のある方法を提示します。また、in vitro Eu(III) TRF結合データを取得、分析、解釈して、I型およびIII型コラーゲンに対する候補リガンドの結合特性を特徴付けるためのプロトコルも示しています。ここで紹介するI型およびIII型コラーゲンを固定化するためのプロトコルは、in vitro
開示事項
著者には、開示すべき利益相反はありません。
謝辞
この作業を支援してくださった以下の資金提供者に感謝します:(1)英国医学研究評議会(MR/N013700/1)およびキングスカレッジロンドンのMRC生物医学博士課程トレーニングパートナーシップのメンバー。(2)BHFプログラム助成金RG / 20/1/34802;(3)BHFプロジェクト助成金PG / 2019/34897;(4)King's BHF Centre for Research Excellence助成金RE / 18/2/34213;(5)ANIDミレニアム科学イニシアチブプログラム-ICN2021_004;(6)ANID基礎助成金FB210024。
資料
| Name | Company | Catalog Number | Comments |
| 10x PBS | Gibco | 14200075 | Use this to make 1x PBS by diluting in water (1:10) |
| 10x PBS | Gibco | 14200075 | Use this to make 1x PBS by diluting in water (1:10) |
| 2M HCL | Made in house and details are in the supporting document | ||
| 2M HCL | Made in house and details are in the supporting document | ||
| 2M Sodium hydroxide +2M Glycine | Made in house and details are in the supporting document | ||
| 2M Sodium hydroxide +2M Glycine | Made in house and details are in the supporting document | ||
| Cell-star 96 well microplate | Greiner Bio-One | 655 160 | |
| Cell-star 96 well microplate | Greiner Bio-One | 655 160 | |
| DELFIA enhacement solution | Perkin Elmer | 1244-104 | |
| DELFIA enhacement solution | Perkin Elmer | 1244-104 | |
| Ice | |||
| Ice | |||
| Infinite 200 PRO NanoQuant microplate reader | TECAN | ||
| Infinite 200 PRO NanoQuant microplate reader | TECAN | ||
| Non-binding (NBS) 96 well microplates | Corning | 3641 | |
| Non-binding (NBS) 96 well microplates | Corning | 3641 | |
| pH electrode Inlab Routine | Mettler Toledo | 51343050 | |
| pH electrode Inlab Routine | Mettler Toledo | 51343050 | |
| pH meter (sevenCompact) | Mettler Toledo | ||
| pH meter (sevenCompact) | Mettler Toledo | ||
| Pierce BCA protein assay kit | Thermofisher | 23227 | |
| Pierce BCA protein assay kit | Thermofisher | 23227 | |
| Tissue culture incubator (37 °C, 5% CO2) | |||
| Type I bovine collagen, 3 mg/mL | Corning | 354231 | |
| Type III human placenta collagen, 0.99 mg/mL | Advanced Biomatrix | 5021 |
参考文献
- Distler, J. H. W., et al. Review: Frontiers of antifibrotic therapy in systemic sclerosis. Arthritis and Rheumatology. 69 (2), 257-267 (2017).
- Wynn, T. A. Fibrotic disease and the TH1/TH2 paradigm. Nature Reviews Immunology. 4 (8), 583-594 (2004).
- Saha, P., et al. Magnetic resonance T1 relaxation time of venous thrombus is determined by iron processing and predicts susceptibility to lysis. Circulation. 128 (7), 729-736 (2013).
- Mirshahi, M., et al. Defective thrombolysis due to collagen incorporation in fibrin clots. Thrombosis Research. 8, 73-80 (1988).
- Comerota, A. J. The ATTRACT trial: Rationale for early intervention for iliofemoral DVT. Perspectives in Vascular Surgery and Endovascular Therapy. 21 (4), 221-225 (2009).
- Bateman, E. D., Turner-Warwick, M., Adelmann-Grill, B. C. Immunohistochemical study of collagen types in human foetal lung and fibrotic lung disease. Thorax. 36 (9), 645-653 (1981).
- Pawelec, K. M., Best, S. M., Cameron, R. E. Collagen: A network for regenerative medicine. Journal of Materials Chemistry B. 4 (40), 6484-6496 (2016).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Copes, F., Pien, N., Van Vlierberghe, S., Boccafoschi, F., Mantovani, D. Collagen-based tissue engineering strategies for vascular medicine. Frontiers in Bioengineering and Biotechnology. 7, 166 (2019).
- Veis, A. The biochemistry of collagen. Annals of Clinical and Laboratory Science. 5 (2), 123-131 (1975).
- Bielajew, B. K., Hu, J. C., Athanasiou, K. A. Collagen: Quantification, biomechanics, and role of minor subtypes in cartilage. Nature Reviews Materials. 5, 730-747 (2020).
- Zhao, Z., et al. Structural and functional plasticity of collagen fibrils. DNA and Cell Biology. 38 (4), 367-373 (2019).
- Eryilmaz, E., Teizer, W., Hwang, W. In vitro analysis of the co-assembly of type-I and type-III collagen. Cellular and Molecular Bioengineering. 10 (1), 41-53 (2017).
- Jagnow, J., Clegg, S. Klebsiella pneumoniae MrkD-mediated biofilm formation on extracellular matrix- and collagen-coated surfaces. Microbiology. 149 (9), 2397-2405 (2003).
- O'Sullivan, D., O'Neill, L., Bourke, P. Direct plasma deposition of collagen on 96-well polystyrene plates for cell culture. ACS Omega. 5 (39), 25069-25076 (2020).
- Caravan, P., et al. Collagen-targeted MRI contrast agent for molecular imaging of fibrosis. Angewandte Chemie - International Edition. 46 (43), 8171-8173 (2007).
- Copeland, R. A. . Enzymes: A Practical Introduction to Structure, Mechanism, and Data Analysis. , (2000).
- Salahudeen, M. S., Nishtala, P. S. An overview of pharmacodynamic modelling, ligand-binding approach and its application in clinical practice. Saudi Pharmaceutical Journal. 25 (2), 165-175 (2017).
- Bünzli, J. C. G., Piguet, C. Taking advantage of luminescent lanthanide ions. Chemical Society Reviews. 34 (12), 1048-1077 (2005).
- Hemmilii, I. Luminescent lanthanide chelates - A way to more sensitive diagnostic methods. Journal of Alloys and Compounds. 225 (1-2), 480-485 (1995).
- De Silva, C. R., Vagner, J., Lynch, R., Gillies, R. J., Hruby, V. J. Optimization of time-resolved fluorescence assay for detection of europium-tetraazacyclododecyltetraacetic acid-labeled ligand-receptor interactions. Analytical Biochemistry. 398 (1), 15-23 (2010).
- Digilio, G., Lacerda, S., Lavin Plaza, B., Phinikaridou, A. Extracellular matrix targeted MRI probes. Analysis & Sensing. 3 (1), (2022).
- Phinikaridou, A., et al. Tropoelastin: A novel marker for plaque progression and instability. Circulation. Cardiovascular imaging. 11 (8), 007303 (2018).
- Guzaeva, T. V., et al. Protein A used in DELFIA for the determination of specific antibodies. Immunology Letters. 35 (3), 285-289 (1993).
- Nasiri, A. H., Nasiri, H. R. Polymerase assays for lead discovery: An overall review of methodologies and approaches. Analytical Biochemistry. 563, 40-50 (2018).
- Capuana, F., et al. Imaging of dysfunctional elastogenesis in atherosclerosis using an improved gadolinium-based tetrameric MRI probe targeted to tropoelastin. Journal of Medicinal Chemistry. 64 (20), 15250-15261 (2021).
- Drescher, D. G., Drescher, M. J., Ramakrishnan, N. A. Surface plasmon resonance (SPR) analysis of binding interactions of proteins in inner-ear sensory epithelia. Methods in Molecular Biology. 493, 323-343 (2009).
- Murali, S., Rustandi, R. R., Zheng, X., Payne, A., Shang, L. Applications of surface plasmon resonance and biolayer interferometry for virus-ligand binding. Viruses. 14 (4), 717 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved