このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
結核ワクチンの有効性評価のためのマイクロコロニー形成ユニットアッセイ
要約
コロニー形成単位(CFU)の測定は、目に見えるコロニーを形成するのに数週間かかる結 核菌 を含む細菌を定量するためのゴールドスタンダード技術です。ここでは、時間効率の向上、ラボのスペースと試薬コストの削減、ミディアムおよびハイスループット実験へのスケーラビリティを備えたCFU測定用のマイクロCFUについて説明します。
要約
感染性病原体による世界の死因の第1位である結核(TB)は、2022年に160万人が死亡しましたが、2019年から2021年のパンデミック時にCOVID-19によってのみ上回りました。この病気は、 結核菌 (M.tb)によって引き起こされます。唯一の結核ワクチンである マイコバクテリウム・ウシ・バ チルス・カルメット・ゲラン(BCG)は、世界最古の認可済みワクチンであり、現在も使用されています。現在、12種類のワクチンが臨床試験中であり、数十種類のワクチンが前臨床開発中です。前臨床試験で結核ワクチンの有効性を評価するために使用される方法は、コロニー形成ユニット(CFU)アッセイによる細菌コロニーの列挙です。この時間のかかるアッセイは、結論が出るまでに4〜6週間かかり、ラボとインキュベーターのスペースがかなり必要で、試薬コストが高く、汚染されやすいです。ここでは、 M.tb ワクチンの有効性結果を分析するためのシンプルで迅速なソリューションを提供する、コロニーの計数に最適化された方法であるmicro-CFU(mCFU)について説明します。mCFUアッセイは、必要な試薬を10倍に減らし、インキュベーション期間を3倍に短縮し、結論までに1〜2週間かかり、ラボのスペースと試薬コストを削減し、多数の M.tbを扱うことに関連する健康と安全のリスクを最小限に抑えます。さらに、結核ワクチンの有効性を評価するために、マイコバクテリアに感染したワクチン接種動物の組織など、さまざまなソースからサンプルを採取することができます。また、感染研究のために単細胞で均一で高品質のマイコバクテリア培養物を製造するための最適化された方法についても説明します。最後に、これらの手法をワクチンの有効性判定の前臨床試験に普遍的に採用し、最終的に結核ワクチン開発の時間を短縮することを提案します。
概要
結核(TB)は、単一の感染性病原体である 結核菌 (M.tb)による世界の主要な死因であり、他のどの病原体よりも多くの死者を出しています。2021年、結核は160万人の死亡者を出し、2019年から2021年のパンデミック1ではCOVID-19に抜かれました。さらに、世界保健機関(WHO)の2022年のグローバル結核報告書によると、COVID-19のパンデミックが新規結核患者の増加の原因となっています。また、WHOは、この期間に結核と診断された人の数が大幅に減少したと報告しており、結核の症例数がさらに増加する可能性があります1。
カルメット・ゲラン菌(BCG)は、100年以上前に初めてワクチンとして使用された病原性マイコバクテリウム・ウシの弱毒生株です。これは結核に対する唯一のワクチンであり、現在も使用されている世界最古の認可ワクチンです2,3。現在、臨床試験の異なる段階にある12のワクチン4があり、数十のワクチンが前臨床開発中である5,6。結核ワクチンの前臨床評価には、ゼブラフィッシュ、マウス、モルモット、ウサギ、ウシ、ヒト以外の霊長類などの多様な動物モデルで得られる安全性と免疫原性の評価7が含まれる8,9,10。さらに、M.tb感染および/または伝播に対する防御を誘導するワクチンの能力、すなわちワクチンの有効性を評価するには、in vivoでのM.tbチャレンジが必要です5,11。興味深いことに、BCGワクチン接種は、訓練された免疫のメカニズムを通じて、他の細菌およびウイルス病原体の生存に影響を与える非特異的効果を誘発します12,13。感染した動物の生存可能な細菌負荷を定量化するために選択する方法は、コロニー形成単位(CFU)アッセイ5,15による細菌コロニーの列挙です。CFUは、特定の増殖条件下でコロニーを形成する微生物(細菌または真菌)の数を推定する単位です。CFUは生存可能な複製微生物に由来し、各コロニー内の生きた微生物の絶対数を推定することは困難です。コロニーが1つ以上の微生物に由来するかどうかは不明です。CFU単位はこの不確実性を反映しているため、同じサンプルの繰り返しで大きなばらつきが観察されます。この時間のかかるアッセイは、バイオセーフティレベル3(BSL3)施設、十分な実験室とインキュベータースペースで働くように訓練された専門技術者を必要とし、結論が出るまでに4〜6週間かかり、汚染されやすいです。
この研究では、コロニーの計数に最適化された方法であるマイクロCFU(mCFU)について説明し、結果を分析するためのシンプルで迅速なソリューションを提供します15、16、17、18、19、20。mCFUアッセイは、必要な試薬を10倍に減らし、インキュベーション期間を3倍に短縮し、結論までに1〜2週間かかり、ラボのスペースと試薬コストを削減し、多数のM.tbを扱うことに関連する健康と安全のリスクを最小限に抑えます。私たちは、この方法をワクチンの有効性判定の前臨床試験に広く採用し、最終的に結核ワクチンの開発期間を短縮することを提案します。最後に、この最適化されたCFU計数法は、マイコバクテリアだけでなく、大腸菌やRalstonia solanacearumなどの他の細菌の定量にも使用されています21。
プロトコル
注:ここで説明するプロトコルはBCG用ですが、あらゆるマイコバクテリアに適用できます。BCGは、BSL3施設が利用できない場合に結核実験の代理細菌として使用することができます22。BCGを使用した以下の手順は、バイオセーフティレベル2(BSL2)の実験室で実行し、危険群2の微生物を操作するための適切なバイオセーフティガイドラインと適切な実験室慣行に従う必要があります。
1. 培地の調製
- サプライヤーの指示に従って、10%(v/v)オレイン酸、アルブミン、デキストロース、カタラーゼ(OADC)濃縮を添加したMiddlebrook 7H9ブロスを調製します。スープに0.05%(v / v)のチロキサポールを補給します。.
注:チロキサポールは、細菌の凝集塊形成を防ぐための界面活性剤として使用されている非イオン性液体ポリマーです16。 - サプライヤーの指示に従って、10%(v/v)OADC濃縮を添加したMiddlebrook 7H10固体培地を調製します。
- 正方形のペトリ皿(120 mm x 120 mm)あたり40 mLの培地を分配します。寒天の表面での結露を最小限に抑えるために、プレートを乾燥させます。
注:この特定のサイズのペトリ皿は、96ウェルプレートから少なくとも96滴の直接転位を可能にするための基本です。プレートを効果的に乾燥させることで、細菌懸濁液の小さな液滴のメッキが容易になり、液滴が広がるのを防ぐことができます。 - Roswell Park Memorial Institute Medium(RPMI 1640)またはDulbecco's Modified Eagle Medium(DMEM)のいずれかを調製して、感染培地を製造します。いずれの場合も、10%ウシ胎児血清、1%L-グルタミン、および1 mMピルビン酸ナトリウムを培地に添加します。ペニシリンとストレプトマイシンを培地に添加しないでください。
2. サンプル調製
- さまざまなソースからサンプルを入手します。通常、結核ワクチンの有効性を評価するためにCFUを定量化するには、ワクチン接種済みおよび未接種の動物組織からサンプルを採取します。例えば、マウスの肺および脾臓11またはマカクの肺、胸部および末梢リンパ節、脾臓、肝臓、皮膚、血液、骨髄、および気管支肺胞洗浄液23。あるいは、BCG 18,19,20,24,25,26に感染したマクロファージ/樹状細胞/好中球のin vitro培養からサンプルを入手します。
3. BCG培養物の生産
注:結核ワクチンのin vivo試験では、BCGの有効性を向上させることを目的としています。したがって、BCGワクチン接種群は通常、対照として使用されます。ヒトワクチン接種に使用されるBCG株は、動物モデルでの試験に最適です。この場合、BCGの培養物は、供給業者の指示に従って再構成されなければならない27。ただし、in vivo研究用のBCG培養物は、社内で製造することもできます11。in vitro感染プロトコル用の単細胞、均一、高品質のBCG培養物の生産は、動物チャレンジ研究にも使用できる次のプロトコルを使用して、いくつかの研究11,16,18,19,20,26,28,29で非常に成功裏に製造されています。
- 50 mL の BCG を 7H9 ブロス中で 37 °C で 200 rpm で撹拌しながら培養します。実験のニーズに応じて容量を変えます。
- 毎日、8〜10日間、100μLの培養液を採取し、1mLのキュベットに900μLのPBSを加えて希釈します。次に、バクテリアの光学密度(λ=600nmでのOD;OD600)を分光光度計で測定します。これらの値から成長曲線を描きます。培養の中間対数段階 (OD が単位時間あたり一貫して 2 倍になっている場合) を特定します。
- その後の培養液を調製し、ステップ3.1および3.2のように、中期/後期の丸太成長段階に達するまでインキュベートします。前の手順で取得した値をガイダンスとして使用します。培養物が固定増殖期(ODが安定し始めるとき)に達しないようにして、生菌の良質な培養を維持します。
- 中期/後期の丸太成長段階で培養物を収集します。3000 x g で10分間遠心分離します。上澄みを取り除きます。
- 10 mLのPBSを加えてバクテリアを洗浄します。3000 x g で10分間遠心分離します。上澄みを取り除きます。
- 細菌を5 mLの感染培地で再懸濁します。チューブを超音波浴に15分間入れ、80Hzでフルパワーにします。
- 1000 x g で10分間遠心分離します。上澄み液は、高品質のBCG培養で避けるべき細菌の塊が豊富にあるため、ペレットを避けて回収し、廃棄します。
- 上澄み液のODを測定します。ここで、OD600 が 0.1 の指数関数的増殖期の培養物は、1 x 107 CFU/mL に相当します。
注:各ラボは、分光光度計を使用してOD600とCFU間の線形回帰を確立するために、実験を開始する前に独自のBCG成長曲線を作成する必要があります。分光光度計は光路距離が異なるため、同じサンプルで得られる測定値が異なる可能性があることに注意してください。 - 簡単な計算を行って、各宿主細胞培養に追加する細菌の数を確立します。宿主細胞あたりの細菌数は、感染の多重度(MOI)です。BCG感染実験に用いられる最も一般的なMOIである宿主細胞あたり10個の細菌のMOIを使用します。
4. マイクロコロニー形成ユニットアッセイ
注: in vivo または in vitro 感染実験が完了した後、mCFUによって細菌の列挙を行うことができます。 in vivo 試験では、まずビーズビーターまたは別の組織ホモジナイザーでサンプルをホモジナイズする必要があります。BCGに感染したマクロファージ/樹状細胞/好中球の in vitro 培養では、非イオン性界面活性剤(例:非イオン性非変性界面活性剤の0.05%溶液)を使用してサンプルを溶解する必要があります。
- 96ウェルプレートを用いた段階希釈: 図1Aのスキームに従って、滅菌済み96ウェルプレートで溶解物の10倍希釈を行います。ライセートを列AとEに分配します。各プレートのサンプル数および/または反復数の最大数は 24 です。
- 残りのウェルに180μLのdH2Oを加えて、段階希釈を行います。
- 12チャンネルピペットを使用して、A列のライセートを再懸濁し、20 μLを列Bに移します(20 μLライセート + 180 μL dH2O)。よく均質化します。行 D の最後の希釈液に達するまで、行 B と C に対してこの手順を順番に繰り返します。
注:通常、3 つの希釈(100、101、102、103)を行うため、12 サンプルおよび/または反復の各セットに対して 4 列のプレート(A-D または E-H)を使用します。 - マイクロ液滴プレーティング: 図1Bによると、0.5〜10 μL(チップが薄いものが望ましい)のマルチチャンネルピペットを使用して、96ウェルプレートの各列から固体の中角プレートに5 μLを移します。
- 5 μLの液滴をゆっくりとピペッティングしながら、寒天に少し触れさせます。これにより、先端から寒天に向かって液滴を取り除き、先端内に液体が滞留する可能性を減らすことができます。
- 液滴を乾燥させ、寒天プレートを閉じ、細菌の増殖を観察しながら37°Cでインキュベートします。必要に応じて、寒天プレートを密封されたビニール袋に入れてインキュベートし、プレートが乾燥しないようにします。
- マイクロコロニーカウント:約6〜10日間のインキュベーション後、肉眼で見える個々のコロニーを確認します(図2)。
- 倒立光学顕微鏡または虫眼鏡の最低倍率対物レンズ(4倍以下)を使用してコロニーをカウントします。カウントは、コロニーの数が300未満で30を超える希釈液で実行する必要があります。または、カメラを使用して液滴の写真を撮り、コンピューター上で手動でコロニーをカウントするか、ImageJなどのソフトウェアを使用してコロニーカウントを自動化します。
- 細胞数をCFU/mLで表すには、次の式を使用します。
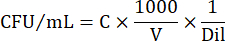
ここで、C = カウントしたコロニーの数、V = μL で播種した容量、Dil = コロニーをカウントした希釈液(100, 101, 102, 103)です。例えば、希釈液102で5μLの液滴中に30個のコロニーをカウントした場合、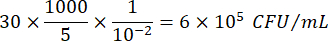
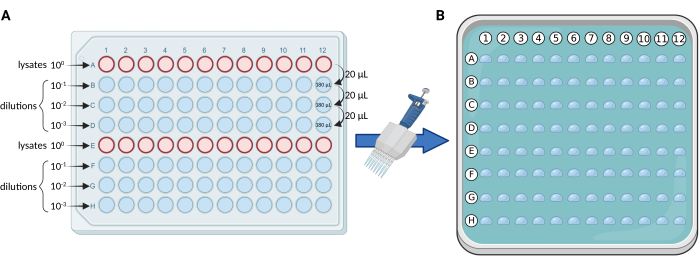
図 1.mCFUプロトコルの概略図 (A)96ウェルプレート中のBCG含有ライセートの10倍希釈。(B)固形培地を含有し、それぞれ5μLの液滴を96滴重ね合わせた正方形のシャーレ。液滴は、マルチチャンネルピペットを使用して96ウェルプレートから直接ピペットで取り出されます。BioRender.com で作成。 この図の拡大版をご覧になるには、ここをクリックしてください。
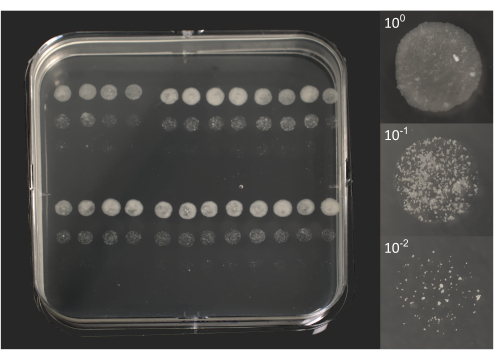
図 2.10日間のインキュベーション後のBCGのマイクロコロニー形成ユニット。左の写真は、図1Bに示したように、それぞれ5μLの液滴96個を重ね合わせた正方形のペトリ皿の写真です。右の図は、3つの液滴の個々の写真で、元のライセート(100)と2つの希釈液(101、102)に対応しています。写真は、18-55mmズームレンズ(プレート)または105mmマクロレンズ(液滴)を備えたDSRLカメラを使用して撮影されました。この図の拡大版をご覧になるには、ここをクリックしてください。
5. フィジーにおけるマイクロコロニー形成単位の計数 (ImageJ)
注:mCFU メソッドでは、大量のサンプルの CFU 定量が可能です。液滴の写真は、コロニーカウントを容易にするために事後分析のために記録されてもよい。いくつかの写真デバイスは、この目的のために十分な品質の画像を生成できます。これらには、デジタルカメラ、ウェブカメラ、カメラ付き顕微鏡と虫眼鏡、携帯電話が含まれます。ImageJなどの無料の画像解析ソフトウェアでは、これらの画像のコロニーを手動または自動でカウントすることができます。両方の方法を実証するために、科学的な画像解析のためのいくつかのツールをパッケージ化したImageJのディストリビューションであるフィジーを使用します30。フィジーは https://fiji.sc/ からダウンロードできます。
- 手動カウント方式
- フィジーでmCFUを含むイメージを開きます。[ Plugins] > [Analyze > Cell Counter] を選択します。
- [セル カウンター] メニューで [初期化 ] を選択し、カウンター (例: タイプ 1) を選択します。
- 各コロニーをクリックして続行します。クリックするたびに画像に表示され、カウンターが更新されます(図3)。誤ってクリックした操作を取り消すには、「 削除」を選択します。
- カウンタに表示された値を登録します。[ リセット ]ボタンをクリックしてカウントをリセットし、新しい画像を開いて追加のサンプルをカウントします。
注:このプラグインの詳細については、https://imagej.net/plugins/cell-counter を参照してください。
- 自動計数方式
- フィジーでmCFUを含むイメージを開きます。 [イメージ] > [タイプ] > [8 ビット] を選択します。これにより、画像が 8 ビットのグレースケール画像に変換されます。
- ツールバーの 楕円 ツールを選択し、コロニーのある領域の周囲に楕円を描きます(図4A)。楕円は、描画後に調整できます。
- [ Edit](編集)>[Clear Outside](外側をクリア)を選択して、外側の領域から干渉を取り除きます(図4B)。 [画像] を選択して>>しきい値を調整します。
- コロニーが赤く表示され、バックグラウンドノイズが最小になるまで、しきい値メニューのスライダーを動かします(図4C)。
- [適用] を選択し、しきい値ウィンドウを終了します。白黒画像が生成されます(図4D)。
- [ 解析]>[パーティクルを解析]を選択します。[パーティクルの解析]ウィンドウで、コロニー面積(1 から無限大まで、2 乗ピクセルで測定)と真円度(0 から 1 まで、1 は完全な円)の範囲を指定します。 図4E)。
- 表示ポップアップメニューで 「アウトライン 」を選択します。結果ウィンドウの各コロニーの詳細な測定値については、 Display Results をチェックします。 [結果のクリア] をオンにして、以前の測定値を消去します。[ Summarize ]ボックスをオンにすると、測定結果の要約結果が表示されます(図4E)。
- [ OK] を選択してアナライザーを開始します。新しいウィンドウが開き、検出およびカウントされたすべてのコロニーが概説表示されます。結果ウィンドウには各コロニーの詳細が表示され、要約された結果ウィンドウにはカウントされたコロニーの合計が表示されます(図4F)。
注:サイズと真円度の設定は、画像の解像度と倍率、およびコロニーのサイズと形状によって異なります。すべてのコロニーを検出する最適な設定が見つかるまで、このプロセスを数回繰り返します。粒子分析プラグインの詳細については、https://imagej.nih.gov/ij/docs/menus/analyze.html#ap を参照してください。
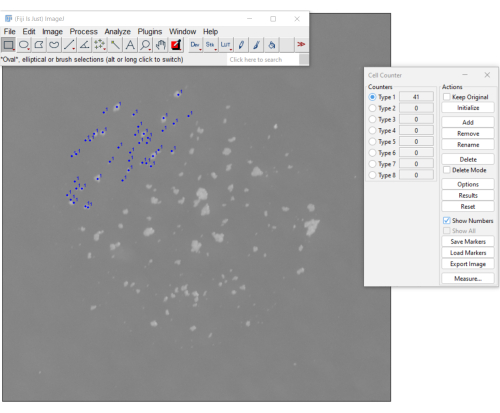
図 3.フィジーソフトウェアのセルカウンタープラグインを使用してmCFUをカウントするための手動の方法。 青い点は、ユーザーがすでにクリックしたコロニーを示します。右側のメニューには、これまでにカウントされたコロニーの数が表示されます(カウントは41です)。 この図の拡大版をご覧になるには、ここをクリックしてください。

図4.フィジーのソフトウェアを使用してmCFUをカウントする自動化された方法。 (A、B)コロニーのある関心領域は楕円選択ツールを使用して選択され、外側の領域は clear outside コマンドを使用して削除されます。(C、D)コロニーの白黒画像は、閾値ツールを使用して生成されます。(E、F)コロニーの数は、[粒子の分析 (Analyze Particles)] ツールを使用して定量化します。 この図の拡大版をご覧になるには、ここをクリックしてください。
結果
ここで説明するmCFUアッセイは、1つのペトリ皿から取り出すことができる情報量を少なくとも96倍に増やします。図5は、結核治療のための宿主特異的薬剤としてのサキナビル(SQV)31,32の再利用における2つの薬物送達方法の比較を示している。このアッセイでは、結核菌の4つの異なる株を使用して、初代ヒトマクロファー...
ディスカッション
結核は重要な公衆衛生上の問題であり、特に低・中所得国において重要性が高まっています。新型コロナウイルス感染症(COVID-19)のパンデミック(世界的大流行)において、結核の診断と治療のための医療現場が混乱したことで、新規症例の発生率に悪影響を及ぼしました1。さらに、この流行を制御するために、多剤耐性および広範囲の薬剤耐性M.tb株、およびM.tb?...
開示事項
DPとPJGBは、この調査は、潜在的な利益相反と解釈される可能性のある商業的または財政的関係がない状態で実施されたことを宣言します。
謝辞
この研究は、ポルトガル・カトリカ大学医学部の内部資金と、UIDP/04279/2020、UIDB/04279/2020、およびEXPL/SAU-INF/0742/2021の助成金に基づくFundação para a Ciência e a Tecnologia(FCT)からの外部資金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 96-well plates | VWR | 734-2781 | |
| DSLR 15-55 mm lens | Nikon | AF-P DX NIKKOR 18-55mm f/3.5-5.6G VR | |
| DSLR camera | Nikon | D3400 | |
| DSLR macro lens | Sigma | MACRO 105mm F2.8 EX DG OS HSM | |
| Fetal calf serum | Gibco | 10270106 | |
| Fiji Software | https://fiji.sc/ | Fiji is an open-source software supported by several laboratories, institutions, and individuals. All the required plugins are included. | |
| Igepal CA-630 | Sigma-Aldrich | 18896 | |
| L-glutamine | Gibco | 25030-081 | |
| Middlebrook 7H10 | BD | 262710 | |
| Middlebrook 7H9 | BD | 271310 | |
| Multichannel pipette (0.5 - 10 µl) | Gilson | FA10013 | |
| Multichannel pipette (20 - 200 µl) | Gilson | FA10011 | |
| Mycobacterium bovis BCG | American Type Culture Collection | ATCC35734 | strain TMC 1011 [BCG Pasteur] |
| OADC enrichment | BD | 211886 | |
| Phosphate buffered saline (PBS) | NZYTech | MB25201 | |
| RPMI 1640 medium | Gibco | 21875091 | |
| Sodium pyruvate | Gibco | 11360-070 | |
| Spectrophotometer UV-6300PC | VWR | 634-6041 | |
| Square Petri dish 120 x 120 mm | Corning | BP124-05 | |
| Tyloxapol | Sigma-Aldrich | T8761 | |
| Ultrasound bath Elma P 30 H | VWR | 142-0051 |
参考文献
- World Health Organization. . Global Tuberculosis Report 2022. , (2022).
- Bettencourt, P. J. G., Joosten, S. A., Lindestam Arlehamn, C. S., Behr, M. A., Locht, C., Neyrolles, O. 100 years of the Bacillus Calmette-Guérin vaccine. Vaccine. 39 (50), 7221-7222 (2021).
- Bettencourt, P. J. G. The 100th anniversary of bacille Calmette-Guérin (BCG) and the latest vaccines against COVID-19. The International Journal of Tuberculosis and Lung Disease. 25 (8), 611-613 (2021).
- Scriba, T. J., Netea, M. G., Ginsberg, A. M. Key recent advances in TB vaccine development and understanding of protective immune responses against Mycobacterium tuberculosis. Seminars in Immunology. 50, 101431 (2020).
- McShane, H., Williams, A. A review of preclinical animal models utilised for TB vaccine evaluation in the context of recent human efficacy data. Tuberculosis. 94 (2), 105-110 (2014).
- Voss, G., et al. Progress and challenges in TB vaccine development. F1000Research. 7, 199 (2018).
- Satti, I., McShane, H. Current approaches toward identifying a correlate of immune protection from tuberculosis. Expert Review of Vaccines. 18 (1), 43-59 (2019).
- Young, D. Animal models of tuberculosis. European Journal of Immunology. 39 (8), 2011-2014 (2009).
- Pedroza-Roldán, C., Flores-Valdez, M. A. Recent mouse models and vaccine candidates for preventing chronic/latent tuberculosis infection and its reactivation. Pathogens and disease. 75 (6), (2017).
- Gong, W., Liang, Y., Wu, X. Animal Models of Tuberculosis Vaccine Research: An Important Component in the Fight against Tuberculosis. BioMed Research International. 2020, 1-21 (2020).
- Bettencourt, P., et al. Identification of antigens presented by MHC for vaccines against tuberculosis. NPJ vaccines. 5 (1), 2 (2020).
- Moorlag, S. J. C. F. M., Arts, R. J. W., van Crevel, R., Netea, M. G. Non-specific effects of BCG vaccine on viral infections. Clinical Microbiology and Infection. 25 (12), 1473-1478 (2019).
- Wilkie, M., et al. Functional in-vitro evaluation of the non-specific effects of BCG vaccination in a randomised controlled clinical study. Scientific Reports. 12 (1), 7808 (2022).
- Netea, M. G., et al. Trained immunity: A program of innate immune memory in health and disease. Science. 352 (6284), aaf1098 (2016).
- Bettencourt, P., Pires, D., Carmo, N., Anes, E. Application of Confocal Microscopy for Quantification of Intracellular Mycobacteria in Macrophages. Microscopy: Science, Technology, Applications and Education. 1, 614-621 (2010).
- Bettencourt, P., Carmo, N., Pires, D., Timóteo, P., Anes, E. Mycobacterial infection of macrophages: the effect of the multiplicity of infection. Antimicrobial research: Novel bioknowledge and educational programs. , 651-664 (2017).
- Pires, D., Bettencourt, P., Carmo, N., Niederweis, M., Anes, E. Role of Mycobacterium tuberculosis outer-membrane porins in bacterial survival within macrophages. Drug Discovery Today. 15 (23-24), 1112-1113 (2010).
- Pires, D., et al. Mycobacterium tuberculosis Modulates miR-106b-5p to Control Cathepsin S Expression Resulting in Higher Pathogen Survival and Poor T-Cell Activation. Frontiers in immunology. 8 (DEC), 1819 (2017).
- Pires, D., et al. Role of Cathepsins in Mycobacterium tuberculosis Survival in Human Macrophages. Scientific reports. 6 (August), 32247 (2016).
- Bettencourt, P., et al. Actin-binding protein regulation by microRNAs as a novel microbial strategy to modulate phagocytosis by host cells: the case of N-Wasp and miR-142-3p. Frontiers in cellular and infection microbiology. 3 (June), 19 (2013).
- Bhuyan, S., et al. Microliter spotting and micro-colony observation: A rapid and simple approach for counting bacterial colony forming units. Journal of Microbiological Methods. 207, 106707 (2023).
- Jackson, S., McShane, H. Challenges in Developing a Controlled Human Tuberculosis Challenge Model. Current topics in microbiology and immunology. , 1-27 (2022).
- Darrah, P. A., et al. Prevention of tuberculosis in macaques after intravenous BCG immunization. Nature. 577 (7788), 95-102 (2020).
- Madura Larsen, J., et al. BCG stimulated dendritic cells induce an interleukin-10 producing T-cell population with no T helper 1 or T helper 2 bias in vitro. Immunology. 121 (2), 276-282 (2007).
- Bickett, T. E., et al. Characterizing the BCG-Induced Macrophage and Neutrophil Mechanisms for Defense Against Mycobacterium tuberculosis. Frontiers in immunology. 11, 1202 (2020).
- Pires, D., et al. Interference of Mycobacterium tuberculosis with the endocytic pathways on macrophages and dendritic cells from healthy donors: role of cathepsins. Drug Discovery Today. 15 (23-24), 1112-1112 (2010).
- Betts, G., et al. Optimising Immunogenicity with Viral Vectors: Mixing MVA and HAdV-5 Expressing the Mycobacterial Antigen Ag85A in a Single Injection. PLoS ONE. 7 (12), e50447 (2012).
- Tanner, R., et al. The influence of haemoglobin and iron on in vitro mycobacterial growth inhibition assays. Scientific reports. 7 (1), 43478 (2017).
- McNeill, E., et al. Regulation of mycobacterial infection by macrophage Gch1 and tetrahydrobiopterin. Nature communications. 9 (1), 5409 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Pereira, M., Vale, N. Saquinavir: From HIV to COVID-19 and Cancer Treatment. Biomolecules. 12 (7), 944 (2022).
- Pires, D., et al. Repurposing Saquinavir for Host-Directed Therapy to Control Mycobacterium Tuberculosis Infection. Frontiers in immunology. 12, 647728 (2021).
- Pires, D., et al. Liposomal Delivery of Saquinavir to Macrophages Overcomes Cathepsin Blockade by Mycobacterium tuberculosis and Helps Control the Phagosomal Replicative Niches. International journal of molecular sciences. 24 (2), (2023).
- Maartens, G., Wilkinson, R. J. Tuberculosis. The Lancet. 370 (9604), 2030-2043 (2007).
- Matarazzo, L., Bettencourt, P. J. G. mRNA vaccines: a new opportunity for malaria, tuberculosis and HIV. Frontiers in Immunology. 14, 1172691 (2023).
- Young, D., Dye, C. The Development and Impact of Tuberculosis Vaccines. Cell. 124 (4), 683-687 (2006).
- Kommareddi, S., Abramowsky, C. R., Swinehart, G. L., Hrabak, L. Nontuberculous mycobacterial infections: Comparison of the fluorescent auramine-o and Ziehl-Neelsen techniques in tissue diagnosis. Human Pathology. 15 (11), 1085-1089 (1984).
- Sabiiti, W., et al. A Tuberculosis Molecular Bacterial Load Assay (TB-MBLA). Journal of visualized experiments: JoVE. (158), e60460 (2020).
- Somoskövi, A., et al. Comparison of Recoveries of Mycobacterium tuberculosis Using the Automated BACTEC MGIT 960 System, the BACTEC 460 TB System, and Löwenstein-Jensen Medium. Journal of Clinical Microbiology. 38 (6), 2395-2397 (2000).
- Tanner, R., et al. The in vitro direct mycobacterial growth inhibition assay (MGIA) for the early evaluation of TB vaccine candidates and assessment of protective immunity: a protocol for non-human primate cells. F1000Research. 10, 257 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved