このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウスにおける結紮誘発性インプラント周囲炎の実験モデル
要約
本稿は、マウスにおける結紮誘発性インプラント周囲炎の実験モデルに関する報告である。動物の術前および術後の管理、抜歯、インプラント埋入、結紮誘発性インプラント周囲炎など、すべての外科的ステップについて説明します。
要約
歯科インプラントは高い成功率と生存率を持っています。しかし、インプラント周囲炎(PI)などの合併症は、治療が非常に困難です。PIは、歯科インプラント周辺の組織に炎症があり、支持骨が徐々に失われることを特徴としています。健康と機能の観点から歯科インプラントの寿命を最適化するには、インプラント周囲炎の病態生理学を理解することが重要です。この点で、研究にマウスモデルを使用することは、臨床状況を再現する上で明らかな利点があることが証明されています。この研究は、マウスの結紮誘発性インプラント周囲炎の実験モデルを記述し、観察された骨および組織の変化を考慮して、この疾患を誘発する有効性があるかどうかを判断することを目的としていました。実験的なインプラント周囲炎誘導術は、抜歯、インプラント埋入、結紮誘導PIのステップを含みます。3週齢のC57BL/6J雄マウス18匹のサンプルを、結紮(N=9)と非結紮(N=9)の2つのグループに分けた。臨床的、X線写真的、および組織学的要因の評価が行われました。結紮箕班群は、非結紮紮群よりも有意に高い骨量減少、軟部組織浮腫の増加、および頂端上皮移動を示した。この前臨床モデルは、マウスのインプラント周囲炎をうまく誘発できると結論付けられました。
概要
歯科インプラントは、欠損した歯を補うための望ましい選択肢としてますます普及しています1。米国の成人人口における歯科インプラントの有病率は、2026年までに最大23%増加すると予測されています2。Grand View Researchの市場分析レポート(2022年)によると、歯科インプラントの世界市場規模は2022年に約46億米ドルに達すると予測されています。さらに、2030年まで年間10%前後の安定した成長率を示すと予想されています3。残念ながら、歯科インプラントの使用は、インプラント周囲炎などの合併症につながる可能性があります。インプラント周囲炎は、インプラント周囲粘膜の炎症とそれに続く支持骨の進行性の喪失を特徴とするバイオフィルム誘発性状態として定義されています4。
システマティックレビューでは、インプラント周囲炎の平均有病率は、患者レベルで19.53%(95%信頼区間[CI]、12.87〜26.19%)、インプラントレベルで12.53%(95%CI 11.67〜13.39%)であったことが明らかになった5。インプラント周囲炎は、インプラントの失敗の増加、ひいては多額の治療費の増加により、公衆衛生が拡大していることを表しています6。
インプラント周囲炎の病因を理解することは、その発症と進行を防ぎ、審美性と機能の観点から歯科インプラントの寿命を最大化するための体系的なアプローチを開発するために重要です7,8。この意味で、マウスが遺伝子の95%以上を人間と共有していること9,10、利用可能なオンライン遺伝子データベースの数、および臨床シナリオを再現する能力11を考えると、歯科研究でマウスモデルを使用することは有利であることが証明されています。記載されたすべての利点は、炎症性組織評価および疾患マッピング13のための遺伝子組み換えの利用可能性(例えば、ノックアウトおよび過剰発現)を超えて、異なる疾患における遺伝的メカニズムの解剖12、アクセス可能な調節および管理、およびヒトパネルとして広く入手可能な抗体を可能にする。有利ではあるが、マウスのインプラント周囲炎を扱った論文はほとんどない。これは、ミニインプラントの入手や取り付けの難しさなど、方法論的な課題によるものです。
マウスにインプラント周囲炎を発症するために、結紮誘発性インプラント周囲炎、細菌誘発性インプラント周囲炎14、リポ多糖(LPS)誘発性インプラント周囲炎15、またはLPS+結紮誘発性インプラント周囲炎の組み合わせ16など、多くのプロトコルが記載されている。ここでは、歯周炎17,18,19、そして最近ではインプラント周囲炎20,21を誘発するために最も広く受け入れられている方法であるため、結紮モデルに焦点を当てます。粘膜下位置でインプラントの周囲に配置された結紮糸は、プラークの蓄積を刺激し、その結果、組織の炎症を引き起こします。したがって、このアプローチの開発は、インプラント周囲疾患の前臨床研究のための実行可能な費用便益技術の適応に基づいています。この研究は、マウスの結紮誘発性インプラント周囲炎の実験モデルを説明し、観察された骨および組織の変化を考慮して、この疾患を誘発するのに有効性があるかどうかを判断することを目的としています。
この記事の全体的な目標は、結紮によってマウスのインプラント周囲炎を誘発するために適用されるプロトコルを報告し、インプラント周辺の組織評価と骨量減少を通じてその有効性を観察することです。
Access restricted. Please log in or start a trial to view this content.
プロトコル
動物を対象とする手順は、カリフォルニア大学ロサンゼルス校の学長動物研究委員会(ARCプロトコル番号2002-125)および動物研究:生体内実験の報告(ARRIVE)22によって承認されています。この方法では、3週齢のC57BL/6J雄マウス18匹を使用し、抜歯、インプラント埋入、インプラント周囲炎誘導を行った。すべての歯科治療は、10×の顕微鏡倍率で実施され、訓練を受け、校正されたオペレーターによって実施されました(図1A)。
1. 抽出前のステップ
- 手術室で、すべてのバイオセーフティーと保護基準に準拠した処置を行ってください。
- 70%イソプロピルアルコール溶液を使用して、3重摩擦ですべての表面の無菌化を行います。
- 3週齢のC57BL/6J雄マウスに3%イソフルランを麻酔します。十分な麻酔深度が得られるように、タッチ時に足が引っ込められても反応がないかどうかを確認します。
- 口腔内の処置の妨げにならないように、ノーズコーンを使用してイソフルラン麻酔を維持します。
- 動物を安定させ、口の開きを維持するための補助オペレーターがいます(図1B)。
- 抽出を開始する前に、眼の刺激を防ぐために眼科用潤滑剤を塗布します。
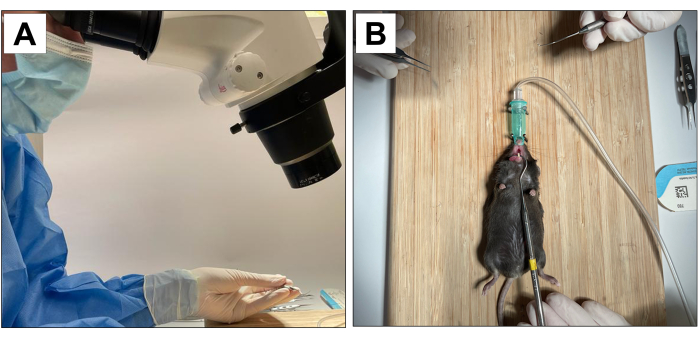
図1:手術の適応: (A)顕微鏡倍率。(B)口を開くための吸入麻酔システムと安定化。 この図の拡大版をご覧になるには、ここをクリックしてください。
2.抜歯
- 抜歯の場合は、第1大臼歯と第2大臼歯の間に#5デンタルエクスプローラーを導入し、歯がソケット内で移動するまで器具を近心遠位方向に動かすことにより、挙上および脱臼の手順を開始します(図2A)。
- 次に、第一大臼歯の近心部位に#5デンタルエクスプローラーを導入します。これを行うには、歯がソケット内で移動するまで、器具を近距離遠位方向に動かします。
- 挙上後、先端鉗子と縫合糸結束鉗子を使用して第1大臼 歯を除去します。
- 次に、第2大臼歯と第3大臼歯の間にデンタルエクスプローラーを導入し、第2大臼歯を持ち上げて脱臼させます(図2B)。
- 次に、先端鉗子および/または縫合糸結束鉗子を使用して、器具を使用して歯を取り外し、歯を保持して口から取り出します。(図2C)。
- 抜歯後、先端が滅菌された綿(図2D)を1分間使用して、完全な止血を確実に達成します(図2E、F)。
- 抜歯後すぐに、すべての動物に鎮痛剤(カルプロフェン/リマジル5 mg / kg)を24時間ごとに投与します。皮下注射で薬を投与します。
- さらに、通常の食事を柔らかい食事に置き換えてください。抗生物質(アモキシル0.25 mg / mL)を飲料水に組み込んで経口投与します。.抜歯後4週間これを行います。
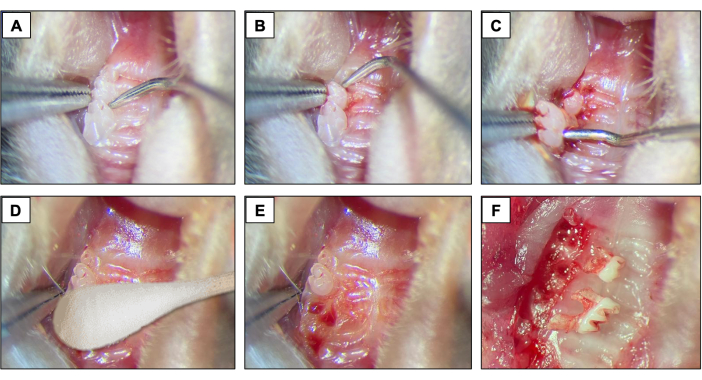
図2:初期抜歯シーケンス: (A、 B)第1大臼歯と第2大臼歯のある上顎領域と、挙上と脱臼のための歯科用エクスプローラーの使用。(C)脱臼と歯の抜歯のための先端鉗子とエクスプローラーの使用。(D)止血。(E、 F)抜歯後の歯槽の外観。 この図の拡大版をご覧になるには、ここをクリックしてください。
3. インプラント埋入
- 15cブレードを使用して、以前に存在した歯に対応する領域の角質化された組織を通って近距離遠位切開を作成します。右上顎大臼歯を空間基準として使用します(図3A)。
- #5デンタルエクスプローラーを使用して頬側と口蓋の全層フラップを上げ、フラップが完全に上昇するようにします(図3B)。
- ピンバイス(ハンドドリル)に取り付けられた直径0.3mmの超硬マイクロハンドドリルを使用して骨切り術を行い、時計回りに回転させて作動させます。治癒した抜歯ソケットに約1mmの深さで骨切り部位を作成します(図3C)。
- 6AL4Vチタンロッド(図3D)から製造された滑らかな機械加工面(長さ1.0mm、直径0.5mm)を備えたカスタム設計のネジ型インプラントを、時計回りのねじ込み動作を使用して第1および第2上顎左大臼歯の領域をセルフタッピングすることにより、動物ごとに1つずつ配置します(図3E-I)。
- インプラント埋入直後に鎮痛剤(カルプロフェン/リマジル5mg/kgを24時間ごとに)皮下注射で投与します。
- インプラントを4週間治癒させ、その間に抗生物質を投与し、前述のように給餌します。
- 治癒期間の終わりに、粘膜の傷が完全に閉じられ、薄いピンク色の外観になっていることを確認してください。
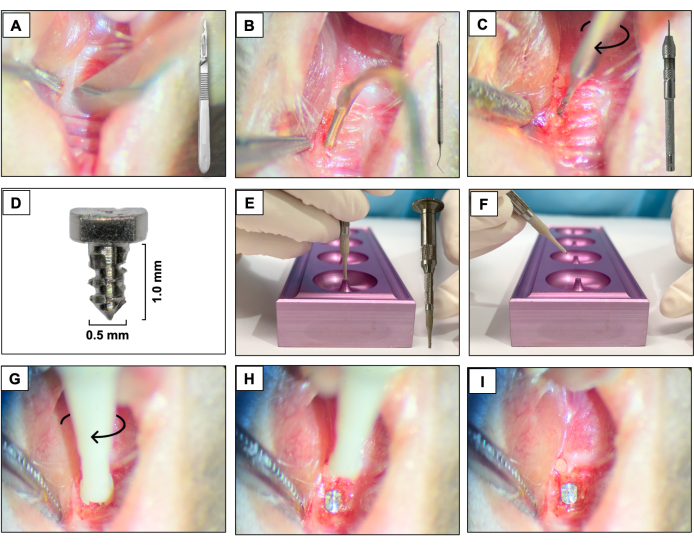
図3:インプラント埋入シーケンス: (A)ハンドルに取り付けられた15cブレードを使用した切開。(B)#5デンタルエクスプローラーを使用した全層フラップ。(C)ピンバイスに取り付けた0.3mm超硬マイクロハンドドリルを使用した骨切り術。(D)チタン製歯科インプラント。(E、F)インプラントサポートとインプラントホルダー。(G-I)時計回りのねじ込み動作によるインプラント埋入。 この図の拡大版をご覧になるには、ここをクリックしてください。
4.インプラント周囲炎の誘発
- インプラントの表面の輪郭を描き、二重の結び目で固定することにより、インプラントヘッドのすぐ先端にある各フィクスチャーの周りにシルク結紮糸(6-0)を配置します。結紮糸を2週間保管し、インプラント周囲炎の発生を可能にします。
- 合字を 2 日ごとにチェックして、合字がまだ存在することを確認します。ない場合は、新しい合字を配置します。
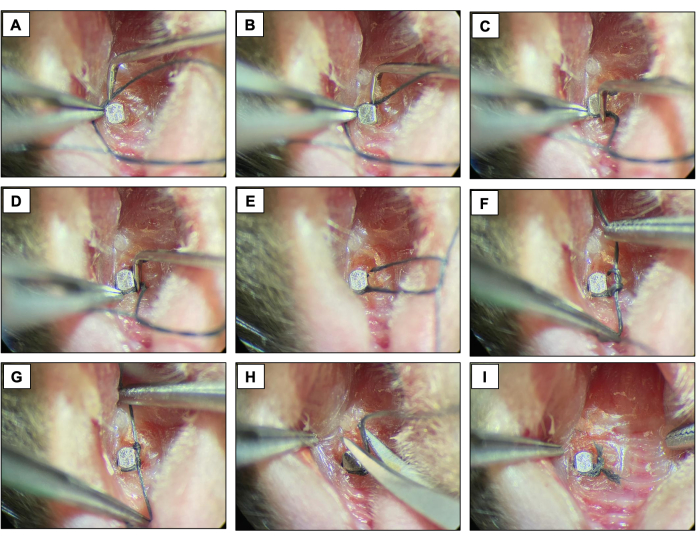
図4:結紮誘発性インプラント周囲炎のシーケンス。 (A-D)インプラントヘッドの周囲に配置されたシルク結紮糸(6.0)。(E-G)結び目を閉じます。(H)合字カット。(I)最終外観。鎮静下で生きた動物から得られた臨床画像。 この図の拡大版をご覧になるには、ここをクリックしてください。
5.犠牲
- インプラント周囲炎誘発期間(2週間)後、高濃度の吸入イソフルランですべての動物を犠牲にした後、ロッドを頭蓋骨の基部に押し込み、後肢をすばやく引っ張って頸椎を頭蓋骨から分離させる頸椎脱臼の二次的な方法を行います。
- 手術用ハサミなどの鋭利な器具を使用して上顎を分離し、動物の顎全体を体の他の部分から分離します。
- 光学顕微鏡を使用して上顎を撮影し、10%ホルマリンで24時間固定した後、70%エタノールで保存します。
6. マイクロコンピュータ断層撮影(μCT)
- マイクロコンピュータ断層撮影(マイクロCT)スキャンを使用して、前述のように上顎をスキャンします18,19。
- スキャナーとコンピューターの電源を入れ、スキャンソフトウェアを開き、放射線サインをクリックして、15分待って予熱します。
- ドアアイコンをクリックして機器のドアを開きます。
- クォーターサイズの回転テーブルを使用してください。上顎骨を15mlの円錐形のチューブに置きます。チューブを回転テーブルベースに固定します。回転テーブルを機器のネジに置きます。
- ドアアイコンをクリックして機器のドアを閉じます。
- X線源をオンにします。
- グラブ画像アイコンをクリックし、ボーンがフィールド上にあることを確認します。
- 解像度10μmピクセルサイズ、X線エネルギー55KVpおよび181μA、AIフィルター0.5mm、回転ステップ0.4、平均フレーム10を調整します。これらの設定により、推定スキャン時間は 24 分になります。
- 取得を開始します。
- 再構築するには、再構築ソフトウェアを開きます。20%のビーム硬化を使用します。5%のリングアーティファクトを使用します。0〜0.13のダイナミックレンジを使用します。ラベル ON の選択を解除し ます。「 プレビュー」をクリックします。対象地域に表示される適切なビューを選択し、TIFF として保存します。
- データを表示および分析するためのソフトウェアを使用して取得した画像の向きを設定します。インプラントヘッドの長軸を矢状軸と冠状軸と平行にし、軸軸と垂直にします。
- 矢状画像を 1 つの画像として保存し、線形骨解析を行います。
- 経軸画像を体積骨解析用のデータセットとして保存します。
- 解析データソフトウェアを使用して線形骨解析を実行します。インプラントヘッドと歯槽骨の間の距離を、近心部位、遠位部位、頬側部位、口蓋部位を含む矢状面および冠状面でミリメートル単位で測定します。
- データ解析ソフトウェアを使用して体積骨解析を実行します。骨量減少に対応するすべてのスライドに関心のある領域を描画することにより、インプラント周辺の骨量減少を追跡します。
7. 統計解析
- 線形および体積マイクロトモグラフィーの骨量減少を測定し、各値を対照群の平均で割ることにより、これらの値を正規化します。すべてのグループの平均を平均±平均の標準誤差(SEM)として提示します。
- 二元配置分散分析(ANOVA)とそれに続く95%信頼区間のテューキー検定を使用して有意性を比較します。(プリズム5)。有意水準をp≤0.01**、p≤0.001****のように適用します。
Access restricted. Please log in or start a trial to view this content.
結果
この方法では、3週齢のC57BL/6J雄マウス18匹を使用し、抜歯、インプラント埋入、インプラント周囲炎誘導を行った。80%の検出力、15%の標準偏差(σ)および95%信頼区間(α=0.05)を達成した線形骨量減少を考慮すると、統計的に有意なグループごとに9匹の動物がいました。実験中、マウスにはソフトダイエットを随 時 与えました。9匹のマウスに結紮を投与し(結紮誘発性インプラント周囲炎?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
このプロトコルは、マウスの結紮モデルを利用したインプラント周囲炎誘導の外科的処置に関する記述的なレポートを提示します。マウスを扱うことには、費用対効果が高いこと、多くの背景23、他の側面24,25を考えると、広範な遺伝子アレイが利用できるなどの利点があります。何年にもわたって、いくつかの研究は、インプラ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は何も開示していません。
謝辞
この研究は、NIH/NIDCR DE031431の支援を受けた。UCLAのトランスレーショナルパソロジーコアラボラトリーには、脱灰組織切片の準備を支援していただき、感謝いたします。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| #5 dental explorer | Hu-Friedy, Chicago, IL | 392-0911 | Dental luxation |
| 15c blade and surgical scalpel | Henry Schein Inc., Melville, NY | 1126186 | Tissue incision |
| 6-0 silk ligatures | Fisher Scientific, Hampton, NH | NC9201232 | Ligature |
| Amoxicillin 50μg/mL | Zoetis, San Diego, CA | TS/DRUGS/57/2003 | Oral suspension |
| Bacon Soft Diet | Bio Serve®, Frenchtown, NJ | 14-726-701 | - |
| C57BL/6J male mice | The Jackson Laboratories, Bar Harbor, ME, USA | 000664 | Age: 3-week-old |
| CTAn software | V.1.16 Bruker, Billerica, MA | - | Volumetric analysis |
| Dolphin software | Navantis, Toronto, CA | - | Linear bone analysis |
| Implant carrier & Tip | D. P. Machining Inc., La Verne, CA | Unique product | Implant holder |
| Implant support | D. P. Machining Inc., La Verne, CA | Unique product | Implant capture |
| Isoflurane | Vet One, Boise, ID | NDC13985-528-60 | Inhalational anesthetic |
| Micro-CT scan 1172 | SkyScan, Kontich, Belgium | - | μCT scans |
| Nrecon Software | Bruker Corporation, Billerica, MA | - | Images reconstruction |
| Ø 0.3mm - L 2.5mm Micro Drills | Sphinx, Hoffman Estates, IL | ART. 50699 | Osteotomy |
| Ø 0.5mm - L 1.0mm Titanium implants | D. P. Machining Inc., La Verne, CA | Unique product | - |
| Ophthalmic lubricant | Apexa, Ontario, CA | NDC13985-600-03 | Artificial tears |
| Pin Vise | General Tools, Secaucus, NJ | 90 | Osteotomy |
| Rimadyl 50mg/ml | Zoetis, San Diego, CA | 4019449 | Anti-inflammatory |
| Sterile cotton tipped | Dynarex, Glendale, AZ | 4304-1 | Hemostasis |
| Tip forceps | Fine Science Tools, Foster City, CA | 11071-10 | Dental Extraction |
| Tying forceps | Fine Science Tools, Foster City, CA | 18025-10 | Ligature placement |
参考文献
- Ho, K., et al. A cross-sectional survey of patient's perception and knowledge of dental implants in japan. Int J Implant Dent. 8 (1), 14(2022).
- Elani, H. W., Starr, J. R., Da Silva, J. D., Gallucci, G. O. Trends in dental implant use in the u.S., 1999-2016, and projections to 2026. J Dent Res. 97 (13), 1424-1430 (2018).
- Grand view research. , Available from: grandviewresearch.com/industry-analysis/dental-implants-market (2022).
- Renvert, S., Persson, G. R., Pirih, F. Q., Camargo, P. M. Peri-implant health, peri-implant mucositis, and peri-implantitis: Case definitions and diagnostic considerations. J Clin Periodontol. 45, Suppl 20 S278-S285 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 449(2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases-the efp s3 level clinical practice guideline. J Clin Periodontol. 50, Suppl 26 4-76 (2023).
- Graziani, F., Figuero, E., Herrera, D. Systematic review of quality of reporting, outcome measurements and methods to study efficacy of preventive and therapeutic approaches to peri-implant diseases. J Clin Periodontol. 39, Suppl 12 224-244 (2012).
- Schwarz, F., Derks, J., Monje, A., Wang, H. L. Peri-implantitis. J Periodontol. 89, Suppl 1 S267-S290 (2018).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Mo Med. 110 (3), 207-211 (2013).
- Mouse Genome Sequencing, C. Et al. Initial sequencing and comparative analysis of the mouse genome. Nature. 420 (6915), 520-562 (2002).
- Pirih, F. Q., et al. Ligature-induced peri-implantitis in mice. J Periodontal Res. 50 (4), 519-524 (2015).
- Rau, C. D., et al. High-density genotypes of inbred mouse strains: Improved power and precision of association mapping. G3. 5 (10), Bethesda. 2021-2026 (2015).
- Schwarz, F., Sculean, A., Engebretson, S. P., Becker, J., Sager, M. Animal models for peri-implant mucositis and peri-implantitis. Periodontol 2000. 68 (1), 168-181 (2015).
- Varon-Shahar, E., et al. Peri-implant alveolar bone resorption in an innovative peri-implantitis murine model: Effect of implant surface and onset of infection. Clin Implant Dent Relat Res. 21 (4), 723-733 (2019).
- Pirih, F. Q., et al. A murine model of lipopolysaccharide-induced peri-implant mucositis and peri-implantitis. J Oral Implantol. 41 (5), e158-e164 (2015).
- Schwarz, F., et al. Influence of antiresorptive/antiangiogenic therapy on the extension of experimentally induced peri-implantitis lesions. Clin Oral Investig. 27 (6), 3009-3019 (2023).
- Wong, R. L., et al. Comparing the healing potential of late-stage periodontitis and peri-implantitis. J Oral Implantol. 43 (6), 437-445 (2017).
- Wong, R. L., et al. Early intervention of peri-implantitis and periodontitis using a mouse model. J Periodontol. 89 (6), 669-679 (2018).
- Hiyari, S., et al. Ligature-induced peri-implantitis and periodontitis in mice. J Clin Periodontol. 45 (1), 89-99 (2018).
- Nguyen Vo, T. N., et al. Ligature induced peri-implantitis: Tissue destruction and inflammatory progression in a murine model. Clin Oral Implants Res. 28 (2), 129-136 (2017).
- Yuan, S., et al. Comparative transcriptome analysis of gingival immune-mediated inflammation in peri-implantitis and periodontitis within the same host environment. J Inflamm Res. 15, 3119-3133 (2022).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 world workshop on the classification of periodontal and peri-implant diseases and conditions. J Periodontol. 89, Suppl 1 S313-S318 (2018).
- Hiyari, S., et al. Genomewide association study identifies cxcl family members as partial mediators of lps-induced periodontitis. J Bone Miner Res. 33 (8), 1450-1463 (2018).
- Kantarci, A., Hasturk, H., Van Dyke, T. E. Animal models for periodontal regeneration and peri-implant responses. Periodontol 2000. 68 (1), 66-82 (2015).
- Struillou, X., Boutigny, H., Soueidan, A., Layrolle, P. Experimental animal models in periodontology: A review. Open Dent J. 4, 37-47 (2010).
- Erata, E., et al. Cnksr2 loss in mice leads to increased neural activity and behavioral phenotypes of epilepsy-aphasia syndrome. J Neurosci. 41 (46), 9633-9649 (2021).
- Fakih, D., Guerrero-Moreno, A., Baudouin, C., Reaux-Le Goazigo, A., Parsadaniantz, S. M. Capsazepine decreases corneal pain syndrome in severe dry eye disease. J Neuroinflammation. 18 (1), 111(2021).
- Douam, F., Ploss, A. The use of humanized mice for studies of viral pathogenesis and immunity. Curr Opin Virol. 29, 62-71 (2018).
- Lin, P., et al. Application of ligature-induced periodontitis in mice to explore the molecular mechanism of periodontal disease. Int J Mol Sci. 22 (16), (2021).
- Marchesan, J., et al. An experimental murine model to study periodontitis. Nat Protoc. 13 (10), 2247-2267 (2018).
- Silva, D. N. A., et al. Probiotic lactobacillus rhamnosus em1107 prevents hyperglycemia, alveolar bone loss, and inflammation in a rat model of diabetes and periodontitis. J Periodontol. 94 (3), 376-388 (2023).
- Kim, Y. G., et al. 6-shogaol, an active ingredient of ginger, inhibits osteoclastogenesis and alveolar bone resorption in ligature-induced periodontitis in mice. J Periodontol. 91 (6), 809-818 (2020).
- Fine, N., et al. Periodontal inflammation primes the systemic innate immune response. J Dent Res. 100 (3), 318-325 (2021).
- Yu, X., et al. Role of toll-like receptor 2 in inflammation and alveolar bone loss in experimental peri-implantitis versus periodontitis. J Periodontal Res. 53 (1), 98-106 (2018).
- Reinedahl, D., Chrcanovic, B., Albrektsson, T., Tengvall, P., Wennerberg, A. Ligature-induced experimental peri-implantitis-a systematic review. J Clin Med. 7 (12), (2018).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved