Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Farelerde Ligatür ile İndüklenen Peri-İmplantitisin Deneysel Modeli
Bu Makalede
Özet
Bu, farelerde ligatür kaynaklı peri-implantitisin deneysel bir modeli hakkında bir rapordur. Hayvanların ameliyat öncesi ve sonrası yönetiminden, ekstraksiyonlardan, implant yerleştirmeden ve ligatüre bağlı peri-implantitisten tüm cerrahi adımları açıklıyoruz.
Özet
Diş implantları yüksek başarı ve hayatta kalma oranına sahiptir. Bununla birlikte, peri-implantitis (PI) gibi komplikasyonların tedavisi oldukça zordur. PI, diş implantlarının etrafındaki dokularda ilerleyici destekleyici kemik kaybı ile iltihaplanma ile karakterizedir. Dental implantların sağlık ve işlevsellik açısından uzun ömürlülüğünü optimize etmek için peri-implantitis patofizyolojisini anlamak çok önemlidir. Bu bağlamda, araştırmalarda fare modellerinin kullanılması, klinik koşulların yeniden yaratılmasında açık faydalar sağlamıştır. Bu çalışma, farelerde ligatür kaynaklı peri-implantitisin deneysel bir modelini tanımlamayı ve gözlenen kemik ve doku değişiklikleri göz önüne alındığında bu hastalığı indüklemede etkinlik olup olmadığını belirlemeyi amaçladı. Deneysel peri-implantitis indüksiyonu aşağıdaki adımları kavrar: diş çekimi, implant yerleştirme ve ligatür indüklü PI. On sekiz adet 3 haftalık C57BL / 6J erkek fareden oluşan bir örneklem, ligatür (N = 9) ve kontrol ligatür olmayan (N = 9) olmak üzere iki gruba ayrıldı. Klinik, radyografik ve histolojik faktörlerin değerlendirilmesi yapıldı. Ligatür grubu, ligatür olmayan gruba göre anlamlı olarak daha yüksek kemik kaybı, artmış yumuşak doku ödemi ve apikal epitelyal migrasyon gösterdi. Bu klinik öncesi modelin farelerde peri-implantitisi başarılı bir şekilde indükleyebileceği sonucuna varıldı.
Giriş
Diş implantları, eksik dişlerin yerine konması için arzu edilen bir seçenek olarak giderek daha yaygın hale gelmektedir1. ABD'deki yetişkin nüfusta diş implantlarının yaygınlığının 2026 yılına kadar %23'e kadar artacağı tahmin edilmektedir2. Grand View Research (2022) tarafından hazırlanan bir pazar analizi raporuna göre, diş implantlarının küresel pazar büyüklüğünün 2022'de yaklaşık 4,6 milyar ABD dolarına ulaşacağı tahmin ediliyor. Ayrıca, 2030 yılına kadar yıllık %10 civarında istikrarlı bir büyüme oranı sergilemesi beklenmektedir3. Ne yazık ki, diş implantlarının kullanımı peri-implantitis gibi komplikasyonlara yol açabilir. Peri-implantitis, peri-implant mukozada inflamasyon ve ardından destekleyici kemiğin ilerleyici kaybı ile karakterize biyofilm kaynaklı bir durum olarak tanımlanmıştır4.
Sistematik bir inceleme, peri-implantitisin ortalama prevalansının hasta seviyesinde% 19.53 (% 95 Güven aralığı [CI], 12.87 ila% 26.19) ve implant seviyesinde% 12.53 (% 95 CI 11.67 ila% 13.39)olduğunu buldu 5. Peri-implantitis, implant başarısızlığındaki artış ve sonuç olarak önemli tedavi maliyetleri nedeniyle büyüyen bir halk sağlığını temsil eder6.
Peri-implantitisin patogenezini anlamak, başlangıcını ve ilerlemesini önlemek ve dental implantların estetik ve fonksiyon açısından ömrünü en üst düzeye çıkarmak için sistematik bir yaklaşım geliştirmek için çok önemlidir 7,8. Bu anlamda, farelerin genlerinin %95'inden fazlasını insanlarla paylaştığı göz önüne alındığında, diş araştırmalarında fare modellerinin kullanılmasınınavantajlı olduğu kanıtlanmıştır 9,10, mevcut çevrimiçi genetik veri tabanlarının sayısı ve klinik senaryoları yeniden üretme yeteneği11. Açıklanan tüm avantajlar, farklı hastalıklarda genetik mekanizmaların diseksiyonunaizin verir 12, erişilebilir konaklama ve yönetim ve insan panelleri olarak yaygın olarak bulunan antikorlar, enflamatuar doku değerlendirmesi ve hastalık haritalaması için genetik modifikasyon mevcudiyetinin (örneğin, nakavt ve aşırı ekspresyon)ötesinde 13. Avantajlı olmasına rağmen, farelerde peri-implantitisi ele alan az sayıda yayın vardır. Bunun nedeni, diğerlerinin yanı sıra, mini implantların elde edilmesinin veya kurulmasının zorluğu da dahil olmak üzere metodolojik zorluklardır.
Farelerde peri-implantitis geliştirmek için, ligatür kaynaklı peri-implantitis, bakteri kaynaklı peri-implantitis14, Lipopolisakkarit (LPS) kaynaklı peri-implantitis15 veya LPS + ligatür kaynaklı peri-implantitis16 kombinasyonu gibi birçok protokol tanımlanmıştır. Burada, periodontitis17,18,19 ve daha yakın zamanda peri-implantitis 20,21'i indüklemek için en yaygın kabul gören yöntem olduğu için ligatür modeline odaklanacağız. İmplantların etrafına submukozal pozisyonda yerleştirilen bağ, plak birikimini ve dolayısıyla doku iltihabını uyarır. Bu nedenle, bu yaklaşımın geliştirilmesi, peri-implant hastalıklar üzerinde klinik öncesi araştırmalar için uygulanabilir bir maliyet-fayda tekniğinin göstergesine dayanmaktadır. Bu çalışma, farelerde ligatür kaynaklı peri-implantitisin deneysel bir modelini tanımlamayı ve gözlenen kemik ve doku değişiklikleri göz önüne alındığında bu hastalığı indüklemede etkinlik olup olmadığını belirlemeyi amaçlamaktadır.
Bu makalenin genel amacı, farelerde peri-implantitisi ligatür ile indüklemek için uygulanan protokolü bildirmek ve doku değerlendirmesi ve implant çevresindeki kemik kaybı yoluyla etkinliğini gözlemlemektir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Hayvan denekleri içeren prosedürler, Los Angeles'taki California Üniversitesi Şansölyesi'nin Hayvan Araştırma Komitesi (ARC protokol numarası 2002-125) ve Hayvan Araştırmaları: Raporlama In Vivo Deneyleri (ARRIVE)22 tarafından onaylanmıştır. Bu yöntem için on sekiz adet 3 haftalık C57BL/6J erkek fare kullanıldı ve diş çekimleri, implant yerleştirilmesi ve peri-implantitis indüksiyonu yapıldı. Tüm dental prosedürler ×10 mikroskobik büyütme altında gerçekleştirildi ve eğitimli ve kalibre edilmiş operatörler tarafından gerçekleştirildi (Şekil 1A).
1. Ekstraksiyon öncesi adımlar
- İşlemi tüm biyogüvenlik ve koruma standartlarına uygun bir ameliyathanede gerçekleştirin.
- % 70 izopropil alkol çözeltisi kullanarak üçlü sürtünme ile tüm yüzeylerin asepsisini gerçekleştirin.
- 3 haftalık C57BL / 6J erkek fareleri% 3 izofluran ile uyuşturun. Yeterli anestezik derinliğin elde edildiğinden emin olmak için dokunulduğunda pençenin geri çekilmesine yanıt verilmediğini kontrol edin.
- Ağızdaki prosedürlere müdahale etmekten kaçınmak için, izofluran anestezisini korumak için bir nosekon kullanın.
- Hayvanı stabilize etmek ve ağız açıklığını korumak için bir yardımcı operatör bulundurun (Şekil 1B).
- Oftalmik kayganlaştırıcı uygulayın, ekstraksiyona başlamadan önce gözlerde tahrişi önlemek için.
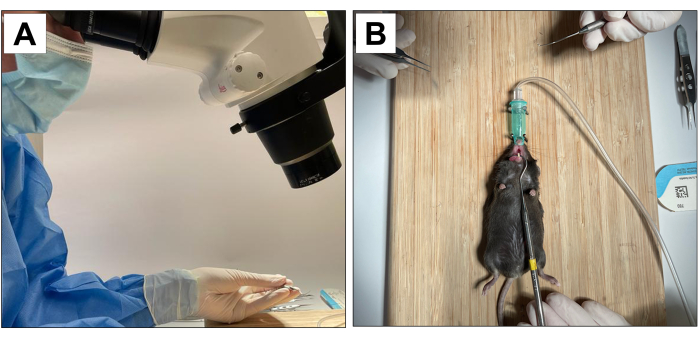
Şekil 1: Operatif uyarlamalar: (A) Mikroskobik büyütme. (B) Uyarlanmış inhalasyon anestezi sistemi ve ağız açıklığı için stabilizasyon. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Diş çekimi
- Diş çekimleri için, diş yuvada hareket edene kadar aleti mesio-distal yönde hareket ettirerek yükseltme ve luksasyon prosedürlerini başlatmak için birinci ve ikinci azı dişi arasına bir #5 diş kaşifi yerleştirin (Şekil 2A).
- Daha sonra, ilk azı dişinin mesiyal bölgesinde #5 diş kaşifini tanıtın. Bunu, diş sokette hareket edene kadar aleti mesio-distal yönde hareket ettirerek yapın.
- Elevasyondan sonra, 1. azı dişini çıkarmak için uç forsepslerini ve dikiş bağlama forsepslerini kullanın.
- Ardından, 2. azı dişini yükseltmek ve lüksleştirmek için diş kaşifini 2. ve 3. azı dişi arasına yerleştirin (Şekil 2B).
- Daha sonra, dişi tutmak ve ağızdan çıkarmak için aletleri kullanarak dişi çıkarmak için uç forseps ve/veya dikiş bağlama forsepslerini kullanın. (Şekil 2C).
- Diş çekimlerinden sonra, 1 dakika boyunca steril bir pamuk (Şekil 2D) kullanarak (Şekil 2E,F) tam hemostaz elde edildiğinden emin olun.
- Ekstraksiyondan hemen sonra, tüm hayvanlara her 24 saatte bir ağrı kesici ilaç (Carprofen/Rimadyl 5 mg/kg) verin. İlacı deri altı enjeksiyon yoluyla uygulayın.
- Ek olarak, normal yiyecekleri yumuşak bir diyetle değiştirin. Antibiyotiği (Amoxil 0.25 mg / mL) ilacı içme suyuna dahil ederek ağızdan uygulayın. Bunu ekstraksiyonlardan sonra dört hafta boyunca yapın.
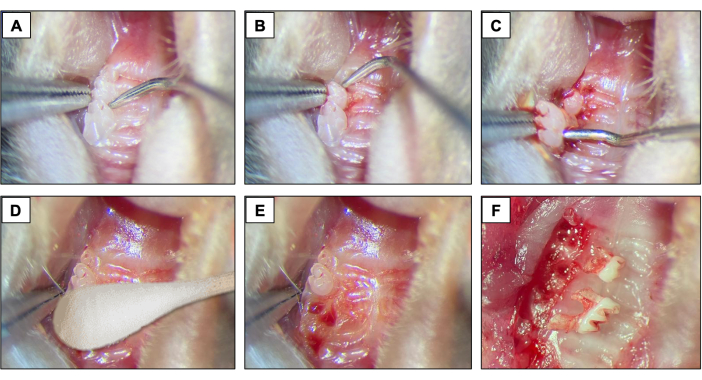
Şekil 2: İlk çekim sırası: (A, B) 1. ve 2. azı dişleri ile maksiller bölge ve elevasyon ve luksasyon için dental kaşif kullanımı. (C) Luksasyon ve diş çekimi için uç forseps ve kaşif kullanımı. (D) Hemostaz. (E, F) Ekstraksiyon sonrası alveolar görünüm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. İmplant yerleştirilmesi
- 15c'lik bir bıçak kullanarak, daha önce mevcut dişlere karşılık gelen alanda keratinize doku boyunca mesio-distal bir kesi oluşturun. Sağ maksiller azı dişlerini uzamsal referans olarak kullanın (Şekil 3A).
- Bukkal ve damak tam kalınlıktaki flepleri #5 dental kaşif kullanarak kaldırın ve tam flep yükselmesi sağlayın (Şekil 3B).
- Osteotomiyi bir Pin Mengene'ye (el matkabı) bağlı 0.3 mm çapında bir karbür mikro el matkabı kullanarak gerçekleştirin ve saat yönünde döndürerek etkinleştirin. İyileşmiş ekstraksiyon soketlerinin yaklaşık 1 mm derinliğinde osteotomi bölgeleri oluşturun (Şekil 3C).
- Hayvan başına bir tane olmak üzere 6AL4V titanyum çubuklardan (Şekil 3D) imal edilmiş pürüzsüz işlenmiş bir yüzeye (1,0 mm uzunluğunda ve 0,5 mm çapında) sahip özel olarak tasarlanmış vida şeklindeki implantları, saat yönünde vidalama hareketi kullanarak birinci ve ikinci maksiller sol azı dişleri bölgesine kendi kendine dokunarak yerleştirin (Şekil 3E-I).
- İmplant yerleştirildikten hemen sonra, deri altı enjeksiyon yoluyla ağrı kesici ilaçlar (Carprofen / Rimadyl 5 mg / kg) uygulayın.
- İmplantların dört hafta boyunca iyileşmesine izin verin, bu süre zarfında antibiyotik uygulayın ve daha önce tarif edildiği gibi besleyin.
- İyileşme süresinin sonunda mukozal yaranın tamamen kapandığından ve açık pembe bir görünüme sahip olduğundan emin olun.
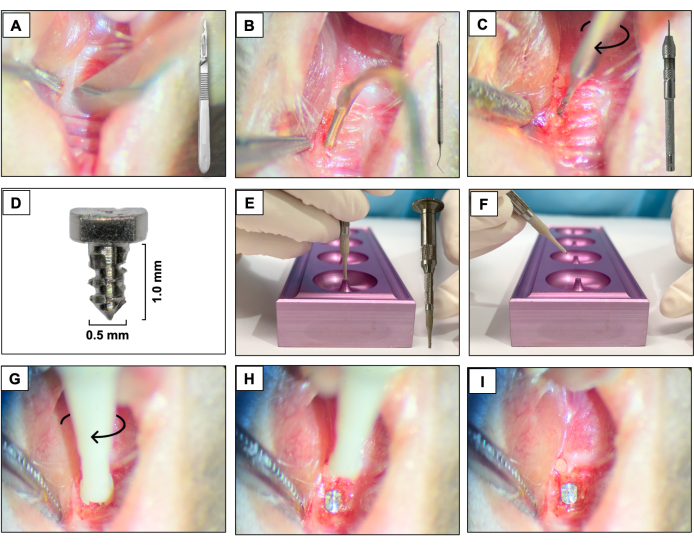
Şekil 3: İmplant yerleştirme sırası: (A) Sapa bağlı 15c bıçak kullanılarak kesi. (B) #5 dental explorer kullanan tam kalınlıkta flepler. (C) Bir Pim Mengenesine bağlı 0.3 mm karbür mikro el matkabı kullanılarak osteotomi. (D) Titanyum diş implantı. (E, F) İmplant desteği ve implant tutucu. (G- I) Saat yönünde vidalama hareketi kullanılarak implant yerleştirilmesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Peri-implantitis indüksiyonu
- İmplantın yüzeyini şekillendirerek ve çift düğümle sabitleyerek implant kafasına hemen apikal olan her bir fikstürün etrafına bir ipek bağ (6-0) yerleştirin. Peri-implantitis gelişimine izin vermek için ligatürü iki hafta boyunca tutun.
- Hala mevcut olduklarından emin olmak için bitişik harfleri iki günde bir kontrol edin. Eksikse, yeni bir bitişik harf yerleştirin.
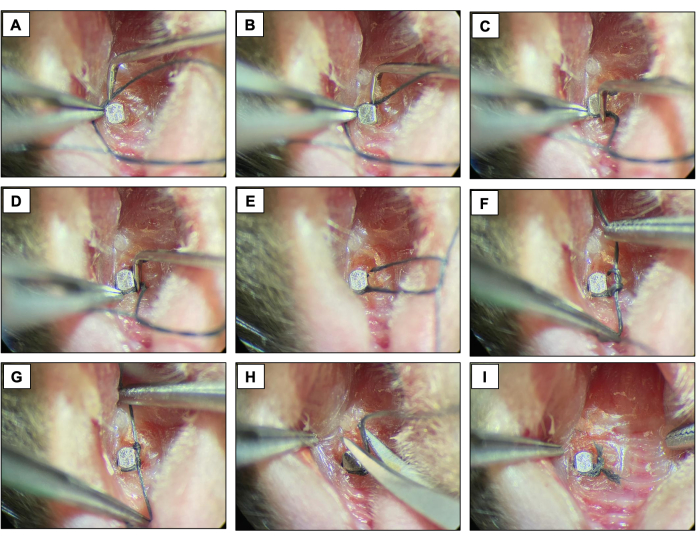
Şekil 4: Ligatür kaynaklı peri-implantitis dizisi. (A-D) İmplant başının etrafına yerleştirilen ipek bağ (6.0). (EG) Düğüm kapatma. (H) Ligatür kesimi. (I) Son görünüm. Sedasyon altında canlı hayvanlardan elde edilen klinik görüntüler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. Fedakarlık
- Peri-implantitis indüksiyon döneminden (iki hafta) sonra, yüksek konsantrasyonda inhale izofluran içeren tüm hayvanları feda edin, ardından kafatasının tabanına bastırılan bir çubukla ikincil bir servikal çıkık yöntemi uygulayın ve arka bacakları hızla çekerek servikal omurların kafatasından ayrılmasına neden olun.
- Hayvanın tüm çenesini vücudun geri kalanından ayıracak cerrahi makas gibi keskin aletler kullanarak maksillayı ayırın.
- Optik mikroskop kullanarak maksillanın fotoğrafını çekin, 24 saat boyunca% 10 formalin içinde sabitleyin, ardından% 70 etanol içinde saklayın.
6. Mikro bilgisayarlı tomografi (μCT)
- Mikro bilgisayarlı tomografi (mikro-BT) taraması kullanarak maksillaları daha önce tarif edildiği gibi18,19 tarayın.
- Tarayıcıyı ve bilgisayarı açın, ardından tarama yazılımını açın, radyasyon işaretine tıklayın ve ön ısıtmak için 15 dakika bekleyin.
- Kapı simgesine tıklayarak ekipman kapısını açın.
- Çeyrek boyutlu bir döner tabla kullanın. Maksillayı 15 ml'lik konik bir tüpe yerleştirin. Boruyu döner tabla tabanına sabitleyin. Döner tablayı ekipman vidasına yerleştirin.
- Kapı simgesine tıklayarak ekipman kapısını kapatın.
- X-Ray kaynağını açın.
- Görüntü yakala simgesine tıklayın ve kemiğin sahada olduğundan emin olun.
- 10 μm piksel boyutu, 55 KVp ve 181 μA X-ışını enerjisi, AI 0,5 mm filtre, 0,4 döndürme adımı, ortalama kare 10 ayarlayın. Bu ayarlar, tahmini 24 dakikalık bir tarama süresi oluşturacaktır.
- Satın alma işlemini başlatın.
- Yeniden yapılandırma için yeniden yapılandırma yazılımını açın. % 20 ışın sertleştirme kullanın. %5'lik halka artefaktı kullanın. 0-0,13 dinamik aralığını kullanın. AÇIK etiketinin seçimini kaldırın. Önizleme'ye tıklayın. İlgilenilen bölge için görülen uygun görünümü seçin ve TIFF olarak kaydedin.
- Verileri görüntülemek ve analiz etmek için yazılım kullanarak elde edilen görüntüleri yönlendirin. İmplant başının uzun eksenini sagital ve koronal eksenlere paralel ve eksenel eksene dik yapın.
- Doğrusal kemik analizi için sagital görüntüyü tek bir görüntü olarak kaydedin.
- Hacimsel kemik analizi için transaksiyel görüntüyü bir veri kümesi olarak kaydedin.
- Analiz veri yazılımını kullanarak doğrusal kemik analizi gerçekleştirin. Mesial, distal, bukkal ve damak bölgeleri dahil olmak üzere sagital ve koronal düzlemlerde implant başı ile alveolar kemik arasındaki mesafeleri milimetre cinsinden ölçün.
- Veri analiz yazılımını kullanarak hacimsel kemik analizi gerçekleştirin. Kemik kaybına karşılık gelen tüm slaytlarda ilgilenilen bölgeyi çizerek implantların etrafındaki kemik kaybını takip edin.
7. İstatistiksel analiz
- Doğrusal ve hacimsel mikrotomografik kemik kaybını ölçün ve her bir değeri kontrol grubunun ortalamasına bölerek bu değerleri normalleştirin. Tüm gruplar için ortalamanın (SEM) ortalama ± standart hatası olarak bir ortalama sunun.
- İki yönlü bir varyans analizi (ANOVA) ve ardından %95 güven aralığı ile bir Tukey testi kullanarak anlamlılığı karşılaştırın. (Prizma 5). Anlamlılık düzeylerini aşağıdaki gibi uygulayın: p≤0.01**, p≤0.001****.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Bu yöntem için on sekiz adet 3 haftalık C57BL/6J erkek fare kullanıldı ve diş çekimleri, implant yerleştirilmesi ve peri-implantitis indüksiyonu yapıldı. %80 güç, %15 standart sapma (σ) ve %95 güven aralığı (α =0.05) elde eden lineer kemik kaybı göz önüne alındığında, grup başına istatistiksel olarak anlamlı olan dokuz hayvan vardı. Deney sırasında fareler yumuşak bir diyet ad libitum ile beslendi. Dokuz fareye ligatür (ligatüre bağlı periimplantitis-deney grubu) ve dokuz fa...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu protokol, farelerde bir ligatür modeli kullanılarak peri-implantitis indüksiyonu için cerrahi prosedürler hakkında tanımlayıcı bir rapor sunar. Farelerle çalışmanın, uygun maliyetli olması, diğer yönlerin yanı sıra birçok arka plan23 göz önüne alındığında kapsamlı bir genetik dizinin mevcudiyeti gibi avantajları vardır24,25. Yıllar geçtikçe, peri-implantitis 26,27,28
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Bu çalışma NIH/NIDCR DE031431 tarafından desteklenmiştir. UCLA'daki Translasyonel Patoloji Çekirdek Laboratuvarı'na dekalsifiye histolojik bölümlerin hazırlanmasına yardımcı olduğu için teşekkür ederiz.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| #5 dental explorer | Hu-Friedy, Chicago, IL | 392-0911 | Dental luxation |
| 15c blade and surgical scalpel | Henry Schein Inc., Melville, NY | 1126186 | Tissue incision |
| 6-0 silk ligatures | Fisher Scientific, Hampton, NH | NC9201232 | Ligature |
| Amoxicillin 50μg/mL | Zoetis, San Diego, CA | TS/DRUGS/57/2003 | Oral suspension |
| Bacon Soft Diet | Bio Serve®, Frenchtown, NJ | 14-726-701 | - |
| C57BL/6J male mice | The Jackson Laboratories, Bar Harbor, ME, USA | 000664 | Age: 3-week-old |
| CTAn software | V.1.16 Bruker, Billerica, MA | - | Volumetric analysis |
| Dolphin software | Navantis, Toronto, CA | - | Linear bone analysis |
| Implant carrier & Tip | D. P. Machining Inc., La Verne, CA | Unique product | Implant holder |
| Implant support | D. P. Machining Inc., La Verne, CA | Unique product | Implant capture |
| Isoflurane | Vet One, Boise, ID | NDC13985-528-60 | Inhalational anesthetic |
| Micro-CT scan 1172 | SkyScan, Kontich, Belgium | - | μCT scans |
| Nrecon Software | Bruker Corporation, Billerica, MA | - | Images reconstruction |
| Ø 0.3mm - L 2.5mm Micro Drills | Sphinx, Hoffman Estates, IL | ART. 50699 | Osteotomy |
| Ø 0.5mm - L 1.0mm Titanium implants | D. P. Machining Inc., La Verne, CA | Unique product | - |
| Ophthalmic lubricant | Apexa, Ontario, CA | NDC13985-600-03 | Artificial tears |
| Pin Vise | General Tools, Secaucus, NJ | 90 | Osteotomy |
| Rimadyl 50mg/ml | Zoetis, San Diego, CA | 4019449 | Anti-inflammatory |
| Sterile cotton tipped | Dynarex, Glendale, AZ | 4304-1 | Hemostasis |
| Tip forceps | Fine Science Tools, Foster City, CA | 11071-10 | Dental Extraction |
| Tying forceps | Fine Science Tools, Foster City, CA | 18025-10 | Ligature placement |
Referanslar
- Ho, K., et al. A cross-sectional survey of patient's perception and knowledge of dental implants in japan. Int J Implant Dent. 8 (1), 14(2022).
- Elani, H. W., Starr, J. R., Da Silva, J. D., Gallucci, G. O. Trends in dental implant use in the u.S., 1999-2016, and projections to 2026. J Dent Res. 97 (13), 1424-1430 (2018).
- Grand view research. , Available from: grandviewresearch.com/industry-analysis/dental-implants-market (2022).
- Renvert, S., Persson, G. R., Pirih, F. Q., Camargo, P. M. Peri-implant health, peri-implant mucositis, and peri-implantitis: Case definitions and diagnostic considerations. J Clin Periodontol. 45, Suppl 20 S278-S285 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 449(2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases-the efp s3 level clinical practice guideline. J Clin Periodontol. 50, Suppl 26 4-76 (2023).
- Graziani, F., Figuero, E., Herrera, D. Systematic review of quality of reporting, outcome measurements and methods to study efficacy of preventive and therapeutic approaches to peri-implant diseases. J Clin Periodontol. 39, Suppl 12 224-244 (2012).
- Schwarz, F., Derks, J., Monje, A., Wang, H. L. Peri-implantitis. J Periodontol. 89, Suppl 1 S267-S290 (2018).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Mo Med. 110 (3), 207-211 (2013).
- Mouse Genome Sequencing, C. Et al. Initial sequencing and comparative analysis of the mouse genome. Nature. 420 (6915), 520-562 (2002).
- Pirih, F. Q., et al. Ligature-induced peri-implantitis in mice. J Periodontal Res. 50 (4), 519-524 (2015).
- Rau, C. D., et al. High-density genotypes of inbred mouse strains: Improved power and precision of association mapping. G3. 5 (10), Bethesda. 2021-2026 (2015).
- Schwarz, F., Sculean, A., Engebretson, S. P., Becker, J., Sager, M. Animal models for peri-implant mucositis and peri-implantitis. Periodontol 2000. 68 (1), 168-181 (2015).
- Varon-Shahar, E., et al. Peri-implant alveolar bone resorption in an innovative peri-implantitis murine model: Effect of implant surface and onset of infection. Clin Implant Dent Relat Res. 21 (4), 723-733 (2019).
- Pirih, F. Q., et al. A murine model of lipopolysaccharide-induced peri-implant mucositis and peri-implantitis. J Oral Implantol. 41 (5), e158-e164 (2015).
- Schwarz, F., et al. Influence of antiresorptive/antiangiogenic therapy on the extension of experimentally induced peri-implantitis lesions. Clin Oral Investig. 27 (6), 3009-3019 (2023).
- Wong, R. L., et al. Comparing the healing potential of late-stage periodontitis and peri-implantitis. J Oral Implantol. 43 (6), 437-445 (2017).
- Wong, R. L., et al. Early intervention of peri-implantitis and periodontitis using a mouse model. J Periodontol. 89 (6), 669-679 (2018).
- Hiyari, S., et al. Ligature-induced peri-implantitis and periodontitis in mice. J Clin Periodontol. 45 (1), 89-99 (2018).
- Nguyen Vo, T. N., et al. Ligature induced peri-implantitis: Tissue destruction and inflammatory progression in a murine model. Clin Oral Implants Res. 28 (2), 129-136 (2017).
- Yuan, S., et al. Comparative transcriptome analysis of gingival immune-mediated inflammation in peri-implantitis and periodontitis within the same host environment. J Inflamm Res. 15, 3119-3133 (2022).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 world workshop on the classification of periodontal and peri-implant diseases and conditions. J Periodontol. 89, Suppl 1 S313-S318 (2018).
- Hiyari, S., et al. Genomewide association study identifies cxcl family members as partial mediators of lps-induced periodontitis. J Bone Miner Res. 33 (8), 1450-1463 (2018).
- Kantarci, A., Hasturk, H., Van Dyke, T. E. Animal models for periodontal regeneration and peri-implant responses. Periodontol 2000. 68 (1), 66-82 (2015).
- Struillou, X., Boutigny, H., Soueidan, A., Layrolle, P. Experimental animal models in periodontology: A review. Open Dent J. 4, 37-47 (2010).
- Erata, E., et al. Cnksr2 loss in mice leads to increased neural activity and behavioral phenotypes of epilepsy-aphasia syndrome. J Neurosci. 41 (46), 9633-9649 (2021).
- Fakih, D., Guerrero-Moreno, A., Baudouin, C., Reaux-Le Goazigo, A., Parsadaniantz, S. M. Capsazepine decreases corneal pain syndrome in severe dry eye disease. J Neuroinflammation. 18 (1), 111(2021).
- Douam, F., Ploss, A. The use of humanized mice for studies of viral pathogenesis and immunity. Curr Opin Virol. 29, 62-71 (2018).
- Lin, P., et al. Application of ligature-induced periodontitis in mice to explore the molecular mechanism of periodontal disease. Int J Mol Sci. 22 (16), (2021).
- Marchesan, J., et al. An experimental murine model to study periodontitis. Nat Protoc. 13 (10), 2247-2267 (2018).
- Silva, D. N. A., et al. Probiotic lactobacillus rhamnosus em1107 prevents hyperglycemia, alveolar bone loss, and inflammation in a rat model of diabetes and periodontitis. J Periodontol. 94 (3), 376-388 (2023).
- Kim, Y. G., et al. 6-shogaol, an active ingredient of ginger, inhibits osteoclastogenesis and alveolar bone resorption in ligature-induced periodontitis in mice. J Periodontol. 91 (6), 809-818 (2020).
- Fine, N., et al. Periodontal inflammation primes the systemic innate immune response. J Dent Res. 100 (3), 318-325 (2021).
- Yu, X., et al. Role of toll-like receptor 2 in inflammation and alveolar bone loss in experimental peri-implantitis versus periodontitis. J Periodontal Res. 53 (1), 98-106 (2018).
- Reinedahl, D., Chrcanovic, B., Albrektsson, T., Tengvall, P., Wennerberg, A. Ligature-induced experimental peri-implantitis-a systematic review. J Clin Med. 7 (12), (2018).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır