このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
チックの全マウントの抗体染色のための方法
要約
このビデオでは、全体のマウント免疫組織化学、抗原の空間的および時間的発現パターンは、若いニワトリ胚における可視化することができる方法を示しています。このメソッドは当初、ジェーンドッドとトムJessellによって導入されました。
要約
ニワトリ胚は、初期胚発生の研究に貴重なツールです。その透明性、アクセス性と操作の容易さ、それを脳、神経管や体節の開発に抗体発現を研究するための理想的なツールとなっています。このビデオでは、HRP標識二次抗体を用いたホールマウントの抗体染色で別の手順を示し、まず、胚は卵から解剖し、パラホルムアルデヒドで固定されています。第二に、内因性ペルオキシダーゼの不活化であり、胚は、その後一次抗体にさらされています。数回の洗浄後、胚は、HRPにコンジュゲートした二次抗体とインキュベートされる。ペルオキシダーゼ活性は、ジアミノベンジジン基質との反応を用いて明らかにされる。最後に、胚を固定して、写真とセクショニングのために処理されます。蛍光抗体の使用に比べてこの方法の利点は、胚は、このような断面で抗原部位の調査を可能にする、ワックスのセクショニングのために処理できることです。このメソッドは当初、ジェーンドッドとトムJessellによって導入された
プロトコル
I.の概要図:
このビデオでは、ニワトリ胚での全体のマウント免疫組織化学での別の手順を示しています。最初に、胚はPFAで固定されています[IHC1]。次に、内因性ペルオキシダーゼ活性をクエンチされる[IHC2]。胚は、その後一次抗体[IHC3]でインキュベートする。数回の洗浄後、胚を二次抗体で[IHC4]をインキュベートされ、色の反応は、DAB [IHC5]と抗体染色を用いて明らかにされるオレンジ色の[IHC6]が表示されます。
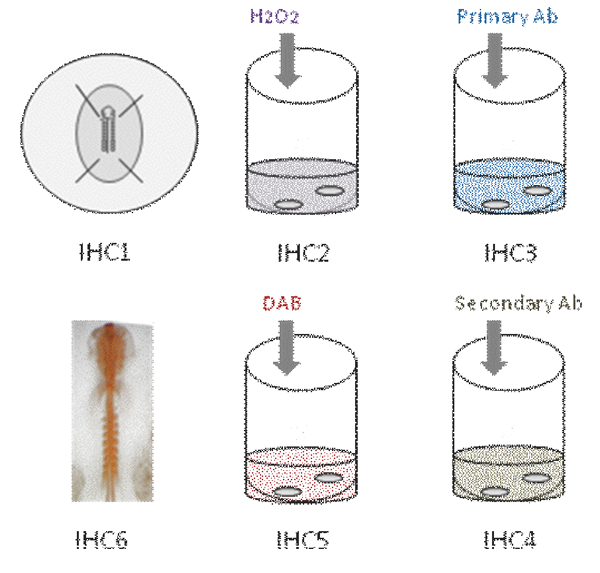
パート1:胚を修正
- ニワトリ胚での全体のマウント免疫組織化学を実行するには、最初にピンセットで殻をタップし、シェルの部分を削除して、卵を開きます。
- 鉗子と厚いアルブミンを削除して、胚が上向きに向くように粗い鉗子で卵黄嚢を傾けます。
- 細かいハサミを使用して、胚の周りに卵黄嚢の正方形をカット。スプーンで卵黄から胚を取り出し、そしてPBSを含む皿の場所。
- 解剖顕微鏡下で、慎重に膜と卵黄およびPBSを含む新鮮な皿に胚移植を削除します。
- 鉗子や昆虫ピンで胚を突き止める、およびPBSを吸引除去する。 PBS中4%PFAでこれを交換し、胚は、室温で1時間を修正することができます。
パート2:抗体のステップの準備胚
- 潜在的な微生物の汚染を最小限に抑えるために、すべて以下の手順でのddH 2 Oを使用してください。
- 胚を固定された後、固定液を吸引除去し、化学廃棄物として適切に処分する。 PBSで皿を埋める。
- 次に、顕微解剖ナイフを用いて、胚体外膜を除去するために胚の周りの角をカット。ピンセットで虫ピンを取り外します。
- ピンが削除された後、PBT(PBS pH7.4の、0.5%トリトンX)とを含むシンチレーションバイアルへ胚を転送するために平滑末端パスツールピペットを使用してください。
- 、PBTで10分間ずつ3回の胚を洗浄してください。
- シンチレーションバイアルからPBTを削除し、PBTxは潜在的な内因性ペルオキシダーゼを不活性化するために0.3%H 2 O 2を含むと交換してください。
- nutator上で室温で2時間インキュベートする。
- その後、PBT、10分ごとに3回、30分ごとに3回で胚を洗浄してください。
パート3:抗体のインキュベーション
- 抗体で胚を染色するために、ブロッキング緩衝液または1%BSA / 1%NGS / PBT(二次抗体がヤギで飼育されているため、我々はNGSを使用)で1時間胚を洗浄することにより開始します。 RTで1時間nutatorでインキュベートする。
- 4℃で2日間nutator上でCは、この溶液中でブロッキング緩衝液、及びインキュベート胚で一次抗体1:1に希釈する。一次抗体の希釈率は、一次抗体の選択に依存する。ここで、我々は、上澄みとして提供されている発達研究ハイブリドーマバンクからの抗体を使用してください。我々は、ブロッキング緩衝液で1:1に希釈する。
- 次に、PBTで3 1時間の洗浄に続いてPBT 3位10分間の洗浄を、実行してください。
- 洗浄後、ブロッキング緩衝液で二次抗体を1:2500に希釈する(この場合ペルオキシダーゼ共役ヤギ抗マウスIgG(H + L)、そしてこの溶液中でインキュベート胚の4でO / N ° nutatorでC。
- PBTの3 1時間の洗浄に続いてPBT 3位10分間の洗浄を、実行します。
パート3:色反応
- ステンド胚の呈色反応を開発するには、まずトリス緩衝液(100mMのトリスHCl、pH7.4)中2 20分間の洗浄を行います。
- 一方、ヒュームフードの下で500μg/mlのトリス緩衝液中で(3,3' - ジアミノベンジジン四塩酸塩)DAB基質を溶解し、氷の上に、暗闇の中で解決策を保つ。
- バイアルを含む胚から最後のTrisバッファー洗浄を削除し、ステップ3.2から5ミリリットルDAB溶液を交換してください。約20分のためのnutatorで暗所に保管してください。 DABを除染するために10%漂白剤溶液の入ったバケツにエッペンドルフ先端処分する。
- 一方、0.3%の株式氷上のdH 2 O中のH 2 O 2を準備。
- DABで胚を含むバイアルに50μlのストックH 2 O 2を追加。暗所で保管してください。 1〜2分後、顕微鏡下で反応を監視する。
パート4:写真撮影および組織学のための胚の処理
- 呈色反応が完了すると、漂白剤をバケツにDAB処分する。 5 mlの水道水に交換してください。
- PBSで2 10分間の洗浄を行います。
- 写真とワックスのセクショニングのために処理するには、10分ごとに(25%、50%、75%、100%)エタノール系列で脱水。
- 0.5でエタノールを交換してください - 1ミリリットルシダーウッドオイルを(これは、胚を半透明になります)。杉の木の油で写真撮影のためのプロセス。
- 以下の写真は、バイアルに胚を戻すと、100%エタノールで杉の木のオイルを交換してください。エタノールの手順を繰り返します。
- メールを交換してください100%エタノールに5%ファストグリーンFCFとthanol、と(このステップは、組織学のための胚を閲覧できるようになります)3分間インキュベートする。組織学のための100%エタノールとプロセスとファストグリーンFCFのソリューションを交換してください。
代表的な結果:
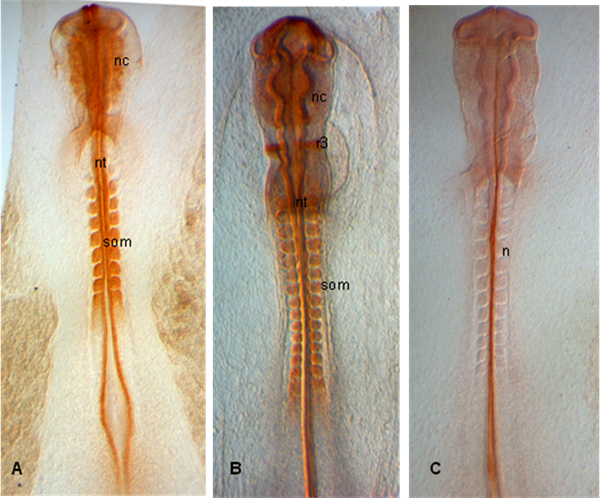
以下に示す例では、胚が段階HH 10()、12(B)と11(C)で解剖され、胚は、新興神経crestasにPAX 7の発現を見せるだけでなく、体節と神経管(A、B)の; (C)においては、脊索は15.3B9(はA - 1)(発達研究ハイブリドーマバンクから提供された抗体)で標識されている。
ディスカッション
このビデオでは、若いニワトリ胚のホールマウントの抗体染色を行うことで様々なステップを示しています。このプロトコルは、本質的に空間的および時間的ひよこ2,3における新規抗体の特徴だけでなく、侮辱4次胚の奇形を決定するために、既知の抗原マーカーの使用のために使用されます。
謝辞
(J.ドッド、TM JessellとA.川上)によって開発されたモノクローナル抗体は(15.3B9、PAX7)生物科学科、アイオワ大学でNICHDと維持の後援の下に開発された発達研究ハイブリドーマバンクから入手した、アイオワ州。 DPは、薬物乱用の国民の協会からルースキルシュシュタイン賞1F32 DA021977 - 01A1の受信者です。この作品は、RHFへマーガレットM. Alkek財団によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments | |
| Eggs | Charles River Laboratories | Premium Fertile | Fertilized, HH4 (16 hr) | |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Marsh Automatic Incubator | Other | Lyon | RX | |
| Curved Forceps (1) | Tool | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Tool | Fine Science Tools | 11002-13 | |
| Fine scissors | Tool | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Microdissecting knife | Tool | Fine Science Tools | 10056-12 | Use to cut embryo from surrounding membranes following fixation |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Reagent | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| 16% PFA | Reagent | Electron Microscopy Sciences | 15710 | |
| 30% H2O2 | Reagent | Sigma-Aldrich | H1009 | |
| BSA | Reagent | Sigma-Aldrich | A3803 | |
| NGS | Reagent | Jackson ImmunoResearch | 005-000-121 | |
| Primary Antibodies | Reagent | Developmental Studies Hybridoma Bank | 4G11, 15.3B9, PAX7 | For these antibodies, investgators used mouse donnors |
| Peroxidase conjugated-Goat Anti-Mouse IgG (H+L) | Reagent | Jackson ImmunoResearch | 115-035-003 | |
| 3,3’-diaminobenzidine tetrahydrochloride | Reagent | Pierce, Thermo Scientific | 34001 | Store at -20; Allow bottle to warm to RT before use. |
| Cedar wood oil | Reagent | Sigma-Aldrich | W522503 | |
| Fast green FCF | Reagent | Sigma-Aldrich | F7252 | |
| Minuten pins 0.2mm diam | Fine Science Tools | 26002-20 |
参考文献
- Yamada, T., Placzek, M., Tanaka, H., Dodd, J., Jessell, T. M. Control of cell pattern in the developing nervous system: Polarizing activity of the floor plate and notochord. Cell. 64, 635-647 (1991).
- Streit, A., Stern, C. D., Thery, C., Ireland, G. W., Aparicio, S., Sharpe, M. J., Gherardi, E. A role for HGF/SF in neural induction and its expression in Hensen's node during gastrulation. Development. 121, 813-824 (1995).
- Basch, M., Bronner-Fraser, M., Garcia-Castro, M. Specification of neural crest occurs during gastrulation and requires Pax7. Nature. 441, 218-222 (2006).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development. 122, 3263-3273 (1996).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved