É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Método para coloração Whole Mount anticorpos em Pintainho
Neste Artigo
Resumo
Este vídeo demonstra toda montagem imuno-histoquímica, um método pelo qual o padrão de expressão espacial e temporal de um antígeno pode ser visualizada em embriões de galinha jovens. Este método foi originalmente introduzido por Jane Dodd e Tom Jessell.
Resumo
O embrião de galinha é uma ferramenta valiosa no estudo do desenvolvimento embrionário precoce. Sua transparência, acessibilidade e facilidade de manipulação, torná-lo uma ferramenta ideal para estudar a expressão de anticorpos no desenvolvimento do cérebro do tubo, neural e somito. Este vídeo demonstra as diferentes etapas no todo-mount coloração anticorpos, por meio HRP conjugados anticorpos secundários; Primeiro, o embrião é dissecada do ovo e fixados em paraformaldeído. Peroxidase, segundo endógena é inativada; O embrião é, então, expostas ao anticorpo primário. Depois de várias lavagens, o embrião é incubada com anticorpo secundário conjugado com HRP. Atividade da peroxidase é revelada através de reação com o substrato diaminobenzidina. Finalmente, o embrião é fixo e processados para a fotografia e corte. A vantagem deste método sobre o uso de anticorpos fluorescentes é que os embriões podem ser processados para o seccionamento de cera, possibilitando o estudo de locais de antígeno em seção transversal. Este método foi originalmente introduzido por Jane Dodd e Jessell Tom
Protocolo
I. Visão geral esquemática:
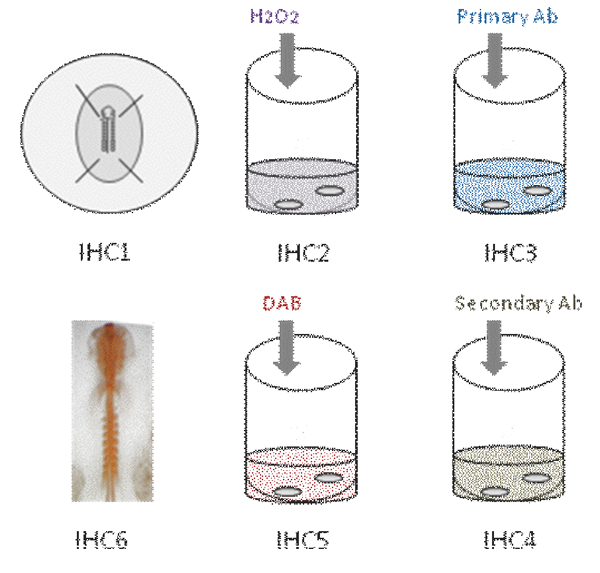
Este vídeo demonstra as diferentes etapas imunohistoquímica montar todo em embrião de galinha. Primeiro, o embrião é fixado em PFA [IHC1]. Então, a atividade da peroxidase endógena se apaga [IHC2]. O embrião é, então, incubadas em anticorpo primário [IHC3]. Depois de várias lavagens, o embrião é incubado em anticorpo secundário [IHC4]; Reação de cor é revelada usando DAB [IHC5] e coloração de anticorpos parece laranja [IHC6].
Parte 1: Corrigindo os embriões
- Para executar imunohistoquímica montagem toda em embriões de galinha, primeiro abra um ovo tocando no shell com uma pinça e retirar pedaços da casca.
- Remova a albumina espessa com uma pinça, e incline o saco vitelino com uma pinça grossa para que o embrião voltado para cima.
- Com uma tesoura fina, corte um quadrado de saco vitelino em torno do embrião. Remover o embrião da gema com uma colher e coloque em um prato contendo PBS.
- Sob um microscópio de dissecação, remova cuidadosamente as membranas e gema ea transferência do embrião para um prato de doce contendo PBS.
- Pin o embrião para baixo com uma pinça e pinos de insetos, e aspire a PBS. Substituir isto por PFA 4% em PBS, e permitir que o embrião se fixar 1h em temperatura ambiente.
Parte 2: embriões Preparando-se para a etapa de anticorpos
- Para minimizar a contaminação microbiana potencial, use DDH 2 O em todos os passos seguintes.
- Depois que o embrião é fixo, aspire a solução fixadora e descartar adequadamente os resíduos químicos. Encha o prato com PBS.
- em seguida, usando uma faca de microdissecção, corte um quadrado em torno do embrião para remover membranas extra-embrionário. Remova os pinos de inseto com uma pinça.
- Depois dos pinos terem sido removidos, usar um blunt end Pasteur pipeta para transferir o embrião para um frasco de cintilação contendo com PBT (PBS pH 7,4, 0,5% Triton X).
- Lave o embrião com PBT, 3 vezes por 10 minutos cada.
- Remover PBT do frasco de cintilação, e substituir com PBTx contendo 0,3% de H 2 O 2, a fim de inativar peroxidase endógena potencial.
- Incubar por 2 horas em temperatura ambiente em nutator.
- Lavar embrião com PBT, 3 vezes por 10 minutos cada, em seguida, 3 vezes por 30 minutos cada.
Parte 3: a incubação de anticorpos
- Para manchar o embrião com anticorpo, comece por lavar o embrião de uma hora em tampão de bloqueio ou 1% BSA / NGS 1% / PBT (usamos NGS porque o anticorpo secundário é gerado em cabra). Incubar no nutator durante uma hora a RT.
- Diluir o anticorpo primário 1:1 em tampão de bloqueio, e embrião incubar nesta solução por 2 dias a 4 ° C em nutator. Fator de diluição primária de anticorpos depende da escolha do anticorpo primário. Aqui, usamos um anticorpo do Desenvolvimento Estudos Hibridoma Bank, que é fornecido como sobrenadante. Nós diluir 1:1 em tampão de bloqueio.
- Em seguida, realizar 3 lavagens de 10 minutos em PBT, seguido por 3 lavagens de 1 hora em PBT.
- Após a lavagem, diluir o anticorpo secundário 1:2.500 em tampão de bloqueio (neste caso cabra conjugado peroxidase-anti-rato IgG (H + L), e embrião incubar nesta solução S / N, 4 ° C em nutator.
- Realizar 3 lavagens de 10 minutos em PBT, seguido por 3 lavagens de 1 hora em PBT.
Parte 3: Reação de cor
- Para desenvolver a reação de cor do embrião manchada, primeiro realizar duas lavagens de 20 minutos em tampão Tris (100mM Tris HCl, pH 7,4).
- Enquanto isso, dissolver substrato DAB (3,3 tetrahidrocloreto 'diaminobenzidina) em tampão Tris em 500μg/ml sob capela; manter solução no escuro, sobre o gelo.
- Remover o tampão de lavagem última Tris do embrião frasco contendo solução e substituir com DAB 5ml a partir do passo 3.2. Manter no escuro sobre nutator por 20 mn. Dispor de Eppendorf ponta em balde contendo uma solução de lixívia a 10%, a fim de descontaminar DAB.
- Enquanto isso, prepare um estoque de 0,3% H 2 O 2 em dH 2 O no gelo.
- Adicionar 50μl de ações H 2 O 2 para o frasco contendo embriões em DAB. Manter-se na escuridão. Depois de 1-2 minutos, monitor reação sob microscópio.
Parte 4: processamento de embriões para a fotografia e histologia
- Quando a reação de cor é completa, dispor de DAB em balde de lixívia. Substitua a água da torneira com 5 ml.
- Executar duas lavagens de 10 minutos em PBS.
- Ao processo para a fotografia e secção de cera, desidratar em série etanólica (25%, 50%, 75% e 100%) por 10 minutos cada.
- Substituir o etanol, com 0,5 - 1 ml de óleo de cedro madeira (isto fará com que o embrião translúcido). Processo para a fotografia em cedro óleo de madeira.
- Após a fotografia, o retorno do embrião para o frasco e substituir o óleo de madeira de cedro com etanol 100%. Repita o passo etanol.
- Substituir ethanol com 5% FCF verde rápido em etanol 100% e incubar por 3 minutos (este passo fará embriões visível para histologia). Substituir rápido FCF solução verde com 100% de etanol e processo para histologia.
Resultados representativos:
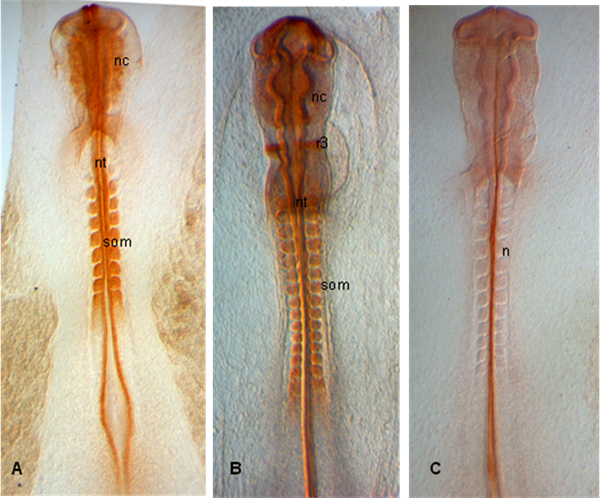
Nos exemplos abaixo, os embriões são dissecados em estágios HH 10 (A), 12 (B) e 11 (C); embriões mostram expressão de PAX 7 em emergentes crestas neural bem como em somitos e tubo neural (A, B); Em (C), notocorda é rotulado com 15.3B9 (Não-1) (anticorpos fornecidos pelo Banco de Desenvolvimento de Estudos Hibridoma).
Discussão
Este vídeo demonstra as diferentes etapas na realização de todo-mount coloração de anticorpos em embriões de galinha jovens. Este protocolo é essencialmente utilizado para a caracterização espacial e temporal de anticorpos romance em pinto 2,3, bem como para o uso de marcadores antigênicos conhecidos para determinar malformações embrionárias seguintes insulto 4.
Agradecimentos
Os anticorpos monoclonais (15.3B9, Pax7), desenvolvido por (J. Dodd, TM Jessell e A. Kawakami) foram obtidos do Banco de Desenvolvimento Hibridoma Estudos desenvolvidos sob os auspícios do NICHD e mantido pela Universidade de Iowa, Departamento de Ciências Biológicas , Iowa. DP é destinatário de Ruth Award Kirschstein DA021977 1F32-01A1 do Instituto Nacional sobre Abuso de Drogas. Este trabalho foi financiado pela M. Margaret Alkek Fundação RHF.
Materiais
| Name | Company | Catalog Number | Comments | |
| Eggs | Charles River Laboratories | Premium Fertile | Fertilized, HH4 (16 hr) | |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Marsh Automatic Incubator | Other | Lyon | RX | |
| Curved Forceps (1) | Tool | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Tool | Fine Science Tools | 11002-13 | |
| Fine scissors | Tool | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Microdissecting knife | Tool | Fine Science Tools | 10056-12 | Use to cut embryo from surrounding membranes following fixation |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Reagent | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| 16% PFA | Reagent | Electron Microscopy Sciences | 15710 | |
| 30% H2O2 | Reagent | Sigma-Aldrich | H1009 | |
| BSA | Reagent | Sigma-Aldrich | A3803 | |
| NGS | Reagent | Jackson ImmunoResearch | 005-000-121 | |
| Primary Antibodies | Reagent | Developmental Studies Hybridoma Bank | 4G11, 15.3B9, PAX7 | For these antibodies, investgators used mouse donnors |
| Peroxidase conjugated-Goat Anti-Mouse IgG (H+L) | Reagent | Jackson ImmunoResearch | 115-035-003 | |
| 3,3’-diaminobenzidine tetrahydrochloride | Reagent | Pierce, Thermo Scientific | 34001 | Store at -20; Allow bottle to warm to RT before use. |
| Cedar wood oil | Reagent | Sigma-Aldrich | W522503 | |
| Fast green FCF | Reagent | Sigma-Aldrich | F7252 | |
| Minuten pins 0.2mm diam | Fine Science Tools | 26002-20 |
Referências
- Yamada, T., Placzek, M., Tanaka, H., Dodd, J., Jessell, T. M. Control of cell pattern in the developing nervous system: Polarizing activity of the floor plate and notochord. Cell. 64, 635-647 (1991).
- Streit, A., Stern, C. D., Thery, C., Ireland, G. W., Aparicio, S., Sharpe, M. J., Gherardi, E. A role for HGF/SF in neural induction and its expression in Hensen's node during gastrulation. Development. 121, 813-824 (1995).
- Basch, M., Bronner-Fraser, M., Garcia-Castro, M. Specification of neural crest occurs during gastrulation and requires Pax7. Nature. 441, 218-222 (2006).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development. 122, 3263-3273 (1996).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados